REV ARGENT COLOPROCT | 2020 | VOL. 31, N° 4: 111-118
DOI: 10.46768/racp.v31i04.64
ARTÍCULO ORIGINAL
Estudio Prospectivo Acerca de la Precisión Diagnóstica del Test Inmunológico de Sangre Oculta en Materia Fecal en una Única Ronda para la Realización de Pesquisa del Cáncer Colorrectal en Pacientes de Riesgo Promedio en la Argentina
Lisandro Pereyra1,2, Galvarini Recabarren Martin2,3, Omodeo Mariana1,2; Gómez Estanislao1,2; Luna Pablo1,2; Roel Mariela1; González Raquel1; Mella José1,2; Panigadi Nicolas1,2; Fischer Carolina; Bun Maximiliano2,3; Gualdrini Ubaldo4; Daniel Cimmino1,2, Pedreira Silvia1,2.
1 Servicio de Gastroenterología, Hospital Alemán, CABA, Argentina.
2 Servicio de Endoscopía Digestiva, Hospital Alemán, CABA, Argentina.
3 Servicio de Cirugía General, Hospital Alemán, CABA, Argentina.
4 Servicio de Cirugía Coloproctológica, Hospital de Gastroenterología Dr. Carlos Bonorino
Udaondo, CABA, Argentina.
Los autores declaran ausencia de conflictos de interés.
Galvarini Recabarren, Martín
Correspondencia: mgalvarini@hospitalaleman.com
Recibido: agosto de 2020
Aceptado: noviembre de 2020
RESUMEN
Introducción: El cáncer colorrectal (CCR) es la segunda causa de muerte por cáncer en Argentina. Debido a su alta prevalencia es fundamental normatizar un programa de pesquisa para la prevención y detección temprana. La precisión del test de sangre oculta en materia fecal inmunológico (SOMFi) para pesquisa de CCR en población de riesgo promedio ha demostrado ser adecuada según la bibliografía internacional, no habiendo, sin embargo, información a nivel local. El objetivo es evaluar en nuestro medio la precisión diagnóstica del test de SOMFi en una única ronda para la pesquisa de CCR en pacientes de riesgo promedio.
Diseño: Prospectivo de precisión diagnóstica.
Material y Método: Se incluyeron pacientes con riesgo promedio que consultaron para realizar una videocolonoscopía (VCC) por pesquisa de CCR en el Hospital Alemán de Buenos Aires, entre el 1 de junio del 2015 y 31 diciembre de 2017. Se excluyeron todos los pacientes con riesgo incrementado para CCR. Todos los pacientes realizaron el test de SOMFi y posteriormente la VCC. Los endoscopistas estaban ciegos para el resultado del test al momento de realizar la VCC. Se evaluó la precisión diagnóstica del test SOMFi para detectar lesiones neoplásicas avanzadas (LNA) calculando la sensibilidad (S), especificidad (E), valor predictivo positivo (VVP) y negativo (VVN), coeficiente de probabilidad positivo (CP+) y negativo (CP-). Se evaluó también la precisión para la detección de adenomas de bajo riesgo, pólipos aserrados y CCR.
Resultados: Se incluyeron un total de 300 pacientes; 273 (91%) entregaron la muestra de materia fecal para realizar el test de SOMFi y completaron la VCC. La edad media de los pacientes fue de 56.9 (40-85) años y 54% fueron hombres. Del total de pacientes que realizaron ambos estudios (273), 53 pacientes (19%) presentaron al menos un adenoma de bajo riesgo, en 18 pacientes (6,59%)observamos al menos un adenoma aserrado sésil y en 21 pacientes (7,7%) al menos una lesión neoplásica avanzada (LNA). Solo 4 pacientes (1.5%) presentaron CCR.
En cuanto a la precisión diagnóstica del test de SOMFi en una única ronda para detectar LNA observamos una S de 30%, E de 84%, VPP de 13% y un VPN de 94%. Para adenomas de bajo riesgo observamos una S de 13%, E de 84%, VPP de 17%, VPN de 79%. Para adenomas aserrados sésiles observamos una S de 16.7%, E de 87%, VPP de 11% y de VPN 91%. La precisión para el CCR fue la siguiente, S de 75%, E de 83%, VPP 6%, VPN 99%. No se observaron complicaciones post procedimientos.
Conclusiones: La precisión diagnóstica del test de SOMFi en nuestro medio es comparable a los resultados internacionales. Sin embargo, la baja precisión observada en una única ronda realza la necesidad de realizarlo de forma anual o bianual para poder optimizar su precisión y lograr programas de pesquisa efectivos.
Palabras clave: Pesquisa; Cáncer Colorrectal; Pólipo de Colon; Sangre Oculta en Materia Fecal
ABSTRACT
Background: Colorectal cancer (CRC) is the second leading cause of cancer death in Argentina. Due to its high prevalence, it is essential to standardize a screening program for prevention and early detection. According to international literature, the accuracy of the immunochemical fecal occult blood test (FIT) for CRC screening in an average-risk population has proven to be adequate, but there is no information at the local level.
Objective: To evaluate the diagnostic accuracy of the FIT test in a single round for CRC screening in average-risk patients in our setting.
Design: Diagnostic accuracy prospective study.
Material and Methods: Average-risk patients who consulted for a CRC screening video colonoscopy (VCC) at the Hospital Alemán of Buenos Aires, between June 1, 2015 and December 31, 2017 were included. All patients with increased risk for CRC were excluded. All patients performed FIT and subsequently VCC. The endoscopists were blind to FIT result at the time of VCC. The diagnostic accuracy of FIT to detect advanced neoplastic lesions (ANL) was evaluated by calculating sensitivity (S), specificity (Sp), positive predictive value (PPV), negative (NPV), positive likelihood ratio (LR+) and negative likelihood ratio (LR-). The accuracy for the detection of low-risk adenomas, serrated polyps and CRC was also evaluated.
Results: A total of 300 patients were included; 273 (91%) submitted the stool sample to perform FIT and completed VCC. The mean age of patients was 56.9 (40-85) years and 54% were men. Of the total number of patients who carried out both studies (273), 53 (19%) patients had at least one low-risk adenoma, 18 (6.59%) patients had at least one sessile serrated adenoma and 21 (7.7%) patients had at least one ANL. Only 4 (1.5%) patients presented CRC. The diagnostic accuracy of FIT in a single round to detect ANL was: S 30%, Sp 84%, PPV 13%, NPV 94%; for low-risk adenomas: S 13%, Sp 84%, PPV 17%, NPV 79%; for sessile serrated adenomas: S 16.7%, Sp 87%, PPV 11%, NPV 91% and for CRC: S 75%, Sp 83%, PPV 6%, NPV 99%. No post-procedure complications were observed.
Conclusions: The diagnostic accuracy of FIT in our setting is comparable to international results. However, the low precision observed in a single round highlights the need to do it annually or biannually in order to optimize its accuracy and achieve effective screening programs.
Keywords: Screening; Colorectal Cancer, Colon Polyp; Fecal Occult Blood Test
INTRODUCCIÓN
El CCR representa el tercer cáncer más frecuentemente diagnosticado en hombres y el segundo en mujeres a nivel mundial, con más de 1.2 millones de nuevos casos y 608.700 muertes según estadísticas de la Organización Mundial de la Salud pertenecientes al año 2008.1 La Argentina no es la excepción y es considerado un país con alta prevalencia de CCR, representando la segunda causa de muerte por cáncer.2
Cuando el CCR es diagnosticado, en más del 60% de los casos ya se encuentra avanzado regionalmente o a distancia. Este es el principal factor que influye en la supervivencia global. Contrariamente, cuando el diagnóstico se efectúa en etapas tempranas (estadio 1 y 2), situación que ocurre solo en el 37% de los casos, la supervivencia global puede superar el 90%.3 Sumado a esto, el 95% de los CCR se desarrollan sobre una lesión precursora, el pólipo adenomatoso. El lento crecimiento de estas lesiones permite la detección temprana y resección oportuna a través de programas de pesquisa, disminuyendo de esta forma su incidencia y mortalidad.
Idealmente, un procedimiento de pesquisa debería ser una prueba simple y de bajo costo que pudiera aplicarse fácilmente a toda la población en riesgo. Hay muchos factores que influyen en la elección de una prueba de pesquisa: evidencia de la eficacia, magnitud del efecto (reducción de la incidencia o la mortalidad), seguridad, conveniencia, comodidad, disponibilidad y costo-efectividad.3,4
En la actualidad, existen diferentes métodos para la realización de pesquisa de CCR (colonoscopía, radiología por enema, SOMF, rectosigmoidoscopía, colonoscopía virtual y cápsula endoscópica). La colonoscopía se ha convertido en los últimos años en el “patrón oro” y en el método preferido para realizar pesquisa del CCR, ya que permite diagnosticar y tratar las lesiones precursoras y ya se ha demostrado en múltiples estudios la disminución de la mortalidad con este método.5 La utilización de la colonoscopia como método primario de pesquisa puede considerarse en sistemas de salud donde los recursos endoscópicos son suficientes para garantizar la accesibilidad y las garantías de calidad correspondientes. Sin embargo, sus limitaciones tales como necesidad de preparación, la sedación, los riesgos (perforación, sangrado, dolor abdominal que se producen en aproximadamente 2.8 de cada 1000 estudios) los costos elevados y los recursos necesarios (cantidad de endoscopios y endoscopistas entrenados) dificultan la utilización este método en programas de pesquisa de CCR.
La SOMF se basa en la detección de pérdidas inapreciables de sangre en las heces ante la presencia de lesiones avanzadas o CCR en forma intermitente, que pueden detectarse antes de que estas pérdidas sean clínicamente visibles. Fundamentalmente existen dos opciones para realizar el test de SOMF, los métodos basados en la prueba de guayaco (SOMFg) y las pruebas inmunoquímicas (SOMFi).6,7
Las pruebas inmunoquímicas (SOMFi) son más precisas que las pruebas de guayaco (SOMFg) debido a que reaccionan solo con la hemoglobina humana y no detectan hemoglobina de origen animal, por lo cual no requieren dieta previa y, por ende, incrementa considerablemente su aceptación. Es más precisa para detectar lesiones colónicas, ya que reacciona con hemoglobina entera y el sangrado digestivo alto puede no ser detectado por el hecho de que la hemoglobina se digiere durante su paso por el tubo digestivo. Otra ventaja de las pruebas inmunoquímicas es que requieren menos muestras de heces (una o dos, frente a tres del guayaco) y puede hacerse un análisis automatizado. Si bien la prueba de SOMFi es más costosa, tiene potencial de ahorro por el menor número de colonoscopias innecesarias motivadas por los falsos positivos del test.8-13 Hoy en día la realización de cualquiera de los métodos de SOMF es considerada por las guías internacionales como una opción válida de pesquisa de CCR, ya que hay pruebas contundentes de que disminuye la mortalidad por dicha neoplasia.14, 15 Consideramos de suma importancia conocer las características de la población a ser pesquisada y validar la precisión del método disponible en nuestro medio previo a comenzar un programa poblacional de pesquisa de CCR.
Por último, sabemos que, si bien el método de SOMFi es efectivo, su adherencia y tasa de repetición anual es muy baja. Sobre todo en nuestro medio, en donde carecemos de un programa actualizado de pesquisa que garantice el seguimiento de los pacientes; así es que encontramos muchos pacientes que se realizan la toma una única vez.
Por lo antes mencionado, conocer la precisión del test de SOMFi en pacientes que se realizan este método en una única ronda es de suma importancia.
Estas son las razones por las que nos propusimos como objetivo determinar la precisión diagnóstica del test SOMFi para detección de LNA realizando en una única ronda y comparándolo con la VCC. Como objetivo secundario procuramos conocer la prevalencia de lesiones neoplásicas de colon en la población con riesgo promedio de CCR en nuestro medio.
MATERIAL Y MÉTODO
Se realizó un estudio observacional, prospectivo de precisión diagnóstica. Se incluyeron pacientes voluntarios sanos que consultaron para realizar una VCC de pesquisa de CCR en el servicio de endoscopía digestiva del Hospital Alemán, situado en la Ciudad Autónoma de Buenos Aires, entre el 1 de junio del 2014 y 31 diciembre de 2017.
Se incluyeron pacientes de edad mayor o igual a 50 años y menor e igual a 75 años, que consintieron a participar voluntariamente del estudio y que eran asintomáticos desde el punto de vista digestivo y sin factores de riesgo para CCR.
Para el correcto análisis de los resultados, se excluyeron a las personas con riesgo incrementado para CCR (historia familiar de cáncer esporádico o síndromes heredo familiares como poliposis o síndrome de Lynch y antecedentes de enfermedad inflamatoria intestinal) a estos individuos se los invitó a realizar estrategia de pesquisa individual de acuerdo al grupo de riesgo.
También excluimos pacientes con enfermedades graves y/o crónicas asociadas, en estos casos, de acuerdo a criterio médico, se analizó el riesgo-beneficio de la inclusión en la pesquisa.
Excluimos a los pacientes con antecedente de hemorragia digestiva reciente (últimos 2 meses) o que hubieran sido estudiados mediante radiología de colon por enema en los últimos 5 años o colonoscopía en los últimos 10.
Por último, excluimos a pacientes que tuvieran imposibilidad de realizarse una colonoscopía, falta de consentimiento o presunción por parte del entrevistador de evidente falta de disposición por parte de este a efectuar o continuar el estudio.
Los pacientes tuvieron la libertad de abandonar el estudio cuando así lo manifestaran. Se consideró la posibilidad de interrupción precoz en caso de enfermedad intercurrente, intervenciones quirúrgicas u otras causas que desvirtuasen el protocolo establecido.
Los pacientes fueron entrevistados por profesionales médicos especialistas en gastroenterología o coloproctología, que registraron todos sus antecedentes personales y familiares. A todos los pacientes se les explicó la finalidad del estudio, evaluándose si cumplían con los requisitos de ingreso. Los pacientes firmaron un consentimiento informado donde constasen los alcances del proyecto y las eventuales consecuencias relacionadas a los hallazgos o complicaciones de los métodos de estudio o terapéuticas instituidas.
El día de la entrevista se les entregó a los pacientes un kit del test inmunológico (Inmunocromatográfico) de sangre oculta en materia fecal (MONTEBIO FOB®). Esta prueba, es rápida para detectar cualitativamente niveles bajos de sangre oculta en heces. La prueba utiliza un ensayo de sándwich doble de anticuerpo para detectar selectivamente sangre oculta en heces en concentraciones de 50 ng/mL o mayores o 6 μg/g heces. La exactitud de la prueba no se ve afectada por la dieta. Al paciente se le solicitó que realizara una única toma de muestra de materia fecal previa al comienzo de la preparación colónica para el estudio endoscópico. Se exigió que no transcurriera más de una semana entre la toma de la muestra y la entrega de la misma, que sería el mismo día que concurriese a realizar la VCC. A todos los pacientes se les entregaron indicaciones para realizar la preparación colónica. El tipo de preparación se individualizó para cada paciente según el criterio del médico.
El test inmunológico fue recibido y procesado por un médico del servicio de endoscopía el mismo día que el paciente concurrió a realizar la VCC. La interpretación del resultado por parte del médico se basó en las recomendaciones del fabricante del kit. Este profesional no participó del estudio endoscópico y no reveló información acerca de los resultados del test a los médicos operadores de la VCC. Los resultados del test inmunológico de sangre oculta en materia fecal fueron comunicados en forma escrita a todas las personas participantes en el estudio.
Todos los pacientes fueron sometidos a una VCC. El procedimiento endoscópico fue el habitual, realizado por endoscopistas entrenados en pesquisa de cáncer colorrectal, quienes estaban ciegos al resultado del test SOMFi. Se utilizó videoendoscopios de alta resolución, complementándose en los casos necesarios con cromoendoscopía si el operador lo consideró necesario. Se consignó la morfología de las lesiones encontradas (clasificación de París), el tamaño, la técnica empleada para la resección (biopsia con pinza, polipectomía o mucosectomía), intubación cecal y calidad de la preparación utilizando una escala validada. Todas las lesiones extirpadas fueron enviadas para estudio anatomopatológico. El servicio de endoscopía cuenta con parámetros de calidad en pesquisa de cáncer colorrectal actualmente aceptados: tasa de detección de adenomas > 20%, tasa de intubación cecal > 95% de las colonoscopías, tasa de perforación colónica < 1/1000, tasa de sangrado post-polipectomía < 1/200.
Se excluyeron pacientes con mala preparación (Boston < 6).
El examen histológico se realizó por patólogos expertos en gastroenterología, quienes estaban ciegos al resultado del test inmunológico de sangre oculta en materia fecal. Se clasificó a las lesiones colorrectales según la clasificación de Viena para neoplasias epiteliales gastrointestinales.
Relevamiento y análisis de la información
El relevamiento de la información se llevó a cabo por médicos pertenecientes a los Servicios de Gastroenterología y Endoscopía Digestiva del Hospital Alemán. Se utilizó una planilla electrónica de datos diseñada especialmente para el proyecto (Excel de Microsoft® para Windows®). En esta planilla se registraron los datos clínicos obtenidos en la evaluación previa a la colonoscopía y los datos del seguimiento pertenecientes a los hallazgos endoscópicos e histopatológicos.
Los datos se presentaron como valores medios ± desvío standard, rangos y/o porcentajes según correspondan a variables continuas o categóricas.
Se registró la presencia de lesión neoplásica avanzada (LNA), definida por el tamaño > 1 cm, displasia de alto grado y/o > 25% de componente velloso, también se registró la presencia de adenoma de bajo riesgo, adenomas aserrados sésiles y CCR (Figura 1).
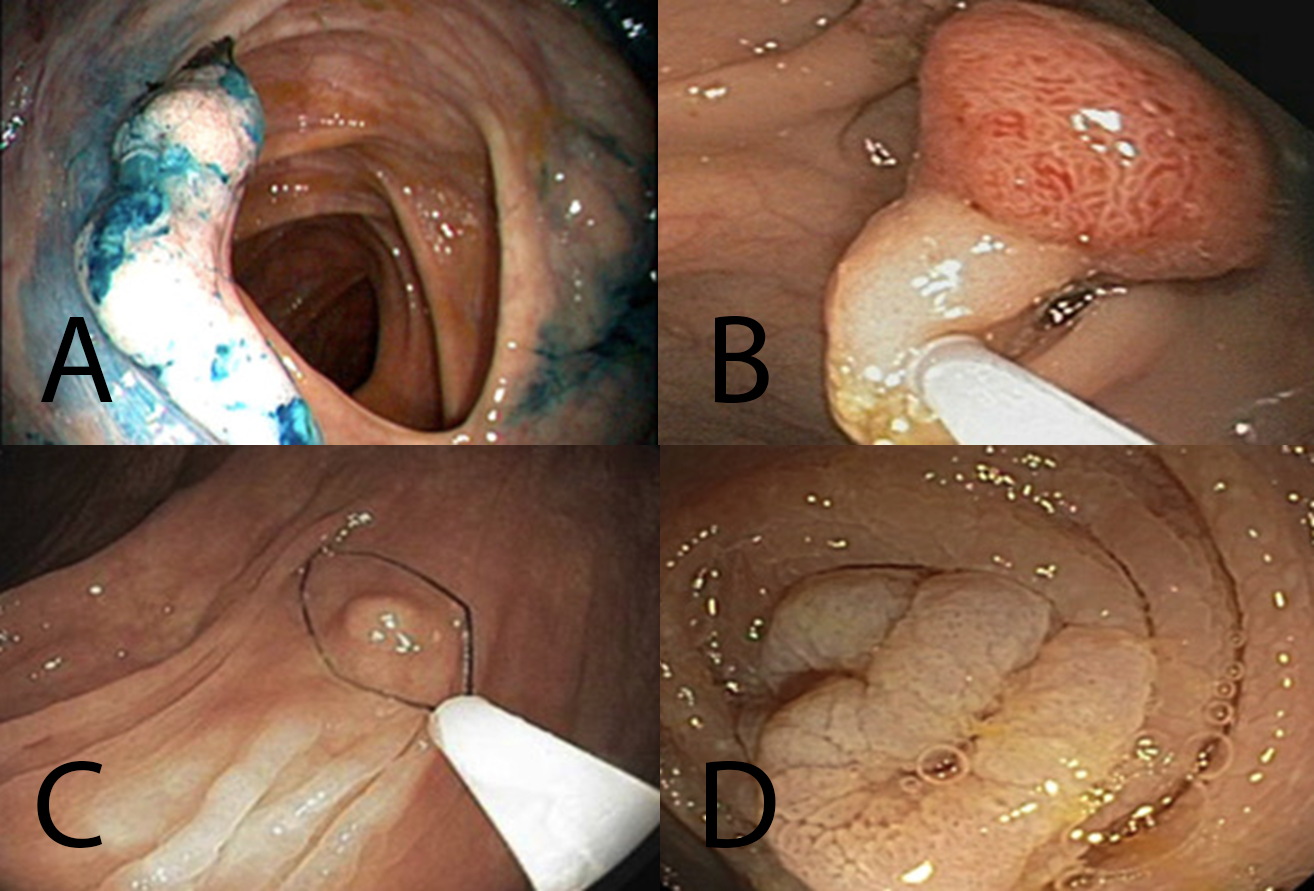
Figura 1: Lesiones colónicas encontradas durante la colonoscopía. A. Cáncer colorrectal. B. Lesión neoplásica avanzada. C. Adenoma de bajo riesgo. D. Adenoma aserrado sésil.
También se calculó la tasa de positividad del test en la población del estudio, así como el número necesario de población a pesquisar con SOMFi para encontrar un adenoma avanzado y el número necesario a realizar VCC para detectar una lesión neoplásica avanzada.
Se evaluó la precisión diagnóstica del test inmunológico para detectar lesiones neoplásicas avanzadas calculando la sensibilidad, especificidad, valor predictivo positivo y negativo, coeficiente de probabilidad positivo y negativo.
Como objetivo secundario nos propusimos conocer la prevalencia de lesiones neoplásicas según la clasificación de las guías presentadas por el programa nacional de prevención y detección temprana del cáncer colorrectal,5 que las divide en riesgo bajo: 1 0 2 adenomas ≤ 10 mm de tipo tubular y con displasia de bajo grado, riesgo intermedio: 3 a 10 adenomas ≥ 10 mm de tipo velloso o con displasia de alto grado y alto riesgo: más de 10 adenomas o uno ≥ a 20 mm o uno o varios pólipos aserrados ≥ 10 mm con displasia.
El análisis estadístico fue llevado a cabo utilizando el paquete estadístico SPSS versión 20.0 para Windows (SPSS, Inc., Chicago, IL, USA).
RESULTADOS
Un total de 300 pacientes fueron entrevistados e invitados a participar; 273 (91%) entregaron la muestra de materia fecal para realizar el test de SOMFi y completaron la VCC.
La edad media de los pacientes fue de 56.9 (40-85) años, de estos el 54% fueron hombres. Las características generales de la población estudiada se resumen en la Tabla 1.
TABLA 1: CARACTERÍSTICAS GENERALES DE LA POBLACIÓN
| Características N% |
Edad (años, rango) |
57,9 (30-85) |
Masculino |
147 (53,8) |
Peso (Kg) |
75,8 |
Altura (m) |
1,68 |
Índice de masa corporal: Kg/m2 (rango) |
26,6 (16,3-42,9) |
Sobrepeso: IMC 25 - 29,9 |
16 (5,8) |
Obesidad: IMC >30 |
53 (19,4) |
Tabaquismo actual |
35 (12,8) |
Ex tabaquista |
102 (37,4) |
Ejercicio frecuente* |
113 (41,4) |
Dieta rica en frutas y verduras (fibras) † |
236 (86,4) |
Dieta consumo habitual de carnes rojas ‡ |
147 (53,8) |
Antecedentes familiares de 1° grado con pólipos colorrectales |
18 (6,6) |
Antecedentes familiares de 1° grado con cáncer colorrectal |
25 (9,1) |
Antecedentes familiares de 2° grado con cáncer colorrectal |
20 (7,3) |
Diabetes mellitus |
22 (8) |
Antecedentes de patología hemorroidal |
120 (43,9) |
Consumo de Aspirina |
49 (17,9) |
Consumo de AINES |
41 (15) |
Consumo de Anticoagulantes orales (warfarina, acenocumarol, rivaroxaban) |
3 (1,1) |
Las cifras entre paréntesis son porcentajes, excepto cuando se indica lo contrario.
IMC: Índice de masa corporal. AINES: Antiinflamatorios no esteroides.
* Ejercicio aeróbico ≥3 veces por semana.
† Consumo de frutas y vegetales que aporten fibras >3 veces por semana.
‡ Consumo de carnes rojas ≥3 veces por semana.
En cuanto al análisis de la precisión del método, observamos que para detectar LNA tuvimos una sensibilidad del 30% (IC 95% 13-53), especificidad de 84% (IC 95% 83-86), VPP 13% (IC 95% 6-23), VPN 94% (IC 95% 92-96), CPP 1.9 (IC 95% 0.8-3.9), CPN 0.8 (IC 95% 0.5-1). Tanto para adenoma de bajo riesgo como para adenomas aserrados sésiles observamos una menor precisión del método, observando en adenomas de bajo riesgo una sensibilidad de 13% (IC 95% 6-24), especificidad de 84% (IC 95% 82-87), VPP 17% (IC 95% 8-32), VPN 79% (IC 95% 77-81), CP+ 0.8 (IC 95% 0.3-1.8), CP- 1.03 (IC 95% 0.8-1.1) y en adenomas aserrados sésiles obtuvimos una sensibilidad de 16.7% (IC 95% 4-39), especificidad del 87% (IC 95% 85-89), VPP 11% (IC 95% 3-26), VPN 91% (IC 95% 90-94), CP+ 1.25 (IC 95% 0.3-3.6), CP- 0.9 (IC 95% 0.7-1.1).
En el CCR, observamos una sensibilidad de 75% (IC 95% 22-98), especificidad de 83% (IC 95% 82-84), VPP 6% (IC 95% 2-8), VPN 99% (IC 95% 98-100), CP+ 4.4 (IC 95% 1.2-6), CP- 0.3 (IC 95% 0.01-0.9) (Tabla 3).
TABLA 3: PRECISIÓN DIAGNÓSTICA DEL TEST DE SOMFI EN UNA ÚNICA RONDA
Lesión neoplásica de colon |
Sensibilidad ( 95% IC) |
Especificidad (95% IC) |
VPP
(95% IC) |
VPN
(95% IC) |
CPP
(95% IC) |
CPN
(95% IC) |
Adenoma de bajo riesgo |
13 %
(6-24) |
84%
(82-87) |
17%
(8-32%) |
79%
(77-81) |
0,8
(0,3-1,8) |
1,03
(0,8-1,4) |
Adenoma aserrado |
16,7%
(4-39) |
87%
(85-89) |
87%
(85-89) |
91%
(90-94) |
1,25
(0,3-3,6) |
0,9
(0,7-1,1) |
LNA |
30%
(13-53) |
84%
(83-86) |
13%
(6-23) |
94%
(92-96) |
1,9
(0,8-3,9) |
0,8
(0,5-1) |
CRR |
75%
(22-98) |
83%
(82-84) |
6%
(2-8) |
99% (98-100) |
4,4
(1,2-6) |
0,3
(0,01 – 0,9) |
IC: Intervalo de confianza. VPP: Valor predictivo positivo. VPN: Valor predictivo negativo. CPP: Coeficiente de probabilidad positivo. CPN: Coeficiente de probabilidad negativo. LNA: Lesión neoplásica avanzada. CCR: Cáncer colorrectal
Cuando analizamos la prevalencia de lesiones neoplásicas, vimos que al menos un adenoma de bajo riesgo fue diagnosticado en 53 (19%) pacientes, al menos un adenoma serrato sésil en 18 (6.6%) pacientes, al menos una LNA en 21 (7.7%) pacientes y 4 (1.5%) pacientes presentaron CCR (Tabla 2).
TABLA 2: HALLAZGOS ENDOSCÓPICOS EN LOS PACIENTES INCLUIDOS EN EL ESTUDIO
Hallazgos N (%) |
VCC normal sin pólipos |
21 (43,7) |
Pólipos hiperplásicos |
8 (16,6) |
LNA |
7 (14,6) |
Adenoma de bajo riesgo |
8 (16,6) |
Adenomas aserrados |
3 ( 6,25) |
CCR |
3 (6,25) |
VCC: Videocolonoscopía.
En cuanto al objetivo secundario de nuestro trabajo, observamos la siguiente positividad del test de SOMFi en relación a la clasificación de lesiones en bajo, moderado y alto riesgo de progresión a CCR: 4/31 (12%), 10/48 (21%) y 2/14 (15%) de pacientes con adenomas hiperplásicos pequeños (<10 mm) en recto o sigma, 1 o 2 adenomas tubulares pequeño (<10 mm) y de 3 a 10 adenomas tubulares fueron positivos respectivamente. También encontramos el test de SOMFi positivo en 8/20 (40%) de pacientes con uno o más adenomas tubulares mayor a 10 mm. Los pacientes con uno o más adenomas vellosos tuvieron SOMFi positivos en 5/9 (55%), mientras que tuvieron el test positivo 8/22 (36%) de pacientes con LNA. Con respecto a los adenomas aserrados sésiles<10 mm, el test de SOMFi fue positivo solo en 3/15 (20%) de los pacientes.
Ningún test de SOMFi fue positivo en pacientes con pólipos ≥ 10 mm, que fuesen adenomas aserrados tradicionales o que tengan síndrome de poliposis aserrada (Tabla 4).
No se registraron complicaciones tanto en el procedimiento como en el seguimiento de los pacientes.
TABLA 4: HALLAZGO ENDOSCÓPICOS EN PACIENTES CON SOMFI POSITIVO
Lesión colorrectal |
Sensibilidad
(95% IC) |
Especificidad
(95% IC) |
Precisión diagnóstica |
p |
Pólipo hiperplásico en recto o sigma <10 mm |
0 %
(0-10) |
95%
(95-97) |
71% |
0,6 |
1 o 2 adenomas tubulares <10 mm |
33%
(18-79) |
75%
(73-79) |
69% |
0,2 |
3 a 10 adenomas tubulares |
9%
(1-20) |
90%
(89-93) |
79% |
0,9 |
1 o más adenomas tubulares ≥ 10 mm |
28%
(15-43) |
90%
(88-94) |
80% |
0,005 |
1 o más adenomas vellosos |
16%
(5-28) |
96%
(93-98) |
83% |
0,001 |
Adenoma aserrado sésil |
14%
(4-31) |
87%
(85-90) |
80% |
0,012 |
Lesión neoplásica avanzada |
29%
(15-45) |
89%
(86-92) |
80% |
0,012 |
Cáncer colorrectal |
75%
(22-98) |
83%
(82-84) |
85% |
0,001 |
SOMFi: Sangre oculta en materia fecal inmunológico.
DISCUSIÓN
En nuestro estudio encontramos que la utilización del test de SOMFi para pesquisa de CCR en la población de riesgo promedio es similar a la reportada internacionalmente, sin embargo realizada en una única ronda presenta una precisión baja para detectar LNA y una precisión intermedia para detectar el CCR. La repetición anual o bianual del test puede incrementar su precisión diagnóstica.
Cuando analizamos la bibliografía, observamos que tres estudios japoneses, en donde evaluaron la eficacia del test de SOMFi, coincidieron en el hallazgo de una reducción significativa en la mortalidad por CCR, que va desde un 23% hasta un 81%, dependiendo del tiempo de seguimiento desde el último examen.16-18
Muchos estudios han demostrado una alta sensibilidad y especificidad de este método para detección de LNA y CCR, como Freitas y col., que en un estudio prospectivo observaron una sensibilidad del 63% y una especificidad del 87% para adenomas avanzados y de más del 88% de sensibilidad y especificidad para CCR.19
Sin embargo, la mayoría de los trabajos reportados en la bibliografía son con la toma de muestra del test de SOMFi de forma anual o bianual, lo cual aumenta la precisión del método. En nuestro trabajo realizamos el test en una única ronda para conocer la precisión bajo estas circunstancias, ya que actualmente no contamos en nuestro país con un programa actualizado de pesquisa que garantice el correcto seguimiento de los pacientes y muchas de las personas que se someten al test bajo el contexto de pesquisa de CCR no vuelven a repetirlo.
En nuestra serie observamos una sensibilidad del 30% y una especificidad del 84% para LNA, mientras que para el CCR una sensibilidad y una especificidad del 75% y 83% respectivamente. Nuestros resultados son comparables a los de Morikawa T y col.,20 quienes observaron en su estudio, el cual fue realizado con pacientes de riesgo promedio para CCR y en una única ronda del test de SMOFi, una sensibilidad del 65% para CCR y del 27% para LNA, con una adherencia al seguimiento del 30%. Si bien los resultados observados en ambos estudios realzan la necesidad de realizar este test en forma anual, la similitud de los resultados de ambos estudios permite validar el método localmente.
Para nuestro conocimiento, este es el primer trabajo prospectivo en comparación con gold strandard (videocolonoscopía) realizado en Argentina que evalúe la precisión del SMOFi para detectar LNA en pacientes de riesgo promedio. Por este motivo los resultados de este estudio son fundamentales para la implementación de estrategias locales de prevención de CCR.
Si bien en nuestro estudio observamos como con una única ronda del test SOMFi detectamos el 75% de los CCR, también demostramos una baja precisión para detectar LNA y adenomas de bajo riesgo. Esto demuestra que lesiones precursoras del CCR pueden ser pasadas por alto por el test en una única ronda y solo en la repetición anual se podrían detectar estas lesiones cuando ya tuvieran un mayor tamaño, aumentando la probabilidad de sangrado. Sin embargo, el desafío es lograr una adherencia aceptable a la repetición del test de SOMFi, ya que de no ser así seremos incapaces de detectar estas neoplasias en forma temprana.
Por último, encontramos que la población de pacientes con riesgo promedio para CCR en nuestro medio tiene una prevalencia de lesiones neoplásicas (adenomas de bajo riesgo, LNA, adenomas aserrados y CCR) comparable a lo reportado en estudios internacionales. Esto nos permite conocer el verdadero riesgo de CCR de este grupo en nuestra población y poder extrapolar resultados de distintas intervenciones reportados en otros estudios.
CONCLUSIONES
La precisión diagnóstica del test de SOMFi en una única ronda en nuestro medio es comparable a los resultados internacionales. Sin embargo, la baja precisión pone a la luz la necesidad de realizarlo de forma anual o bianual para lograr una mejora en su precisión y así poder aplicarlo a un programa de pesquisa de CCR. La información que aporta este estudio podría ser de gran utilidad para planificar futuros programas de pesquisa de CCR en nuestra población.
BIBLIOGRAFÍA
- Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin 2011;61:69-90.
- Ministerio de Salud de la Nación. Guía de recomendaciones para la prevención y detección precoz del cáncer colorrectal 2010. www.sage.org.ar/nueva/docs/guias_consensos_arg/CCR-Consenso-Argentino-2010.pdf
- Pereyra L, Gómez EJ, Mella JM, Cimmino DG, Boerr LA. Colorectal cancer screening with colonoscopy, Medicina 2013;73:567-72.
- Winawer SJ, Fletcher RH, Miller L, Godlee MH, Stolar CD, Mulrow SH, et al. Colorectal cancer screening: clinical guidelines and rationale. Gastroenterology 1997;112:594-542.
- Ministerio de Salud de la Nación. Instituto Nacional del Cáncer. Cáncer colorrectal en la Argentina: Organización, cobertura, y calidad de las acciones de prevención y control (2011).www.msal.gov.ar/inc/images/stories/downloads/publicaciones/equipo-medico/cancer_colorrectal.pdf
- Allison JE, Tekawa IS, Ransom LJ, Adrain AL. A comparison of fecal occult-blood tests for colorectal cancer screening. N Engl J Med 1996;334:155-59.
- Castiglione G, Zappa M, Grazzini G, Mazzotta A, Biagini M, Salvadori, , et al. Immunochemical vs guaiac faecal occult blood tests in a population-based screening programme for colorectal cancer, Br J Cancer 1996:74:141-44.
- Rozen P, Knaani J, Samuel Z. Comparative screening with a sensitive guaiac and specific immunochemical occult blood test in an endoscopic study. Cancer 2000;89:46-52.
- Zappa M.; Castiglione, G.; Paci, E.; Grazzini, G.; Rubeca, T.; Turco, P.; et al. Measuring interval cancers in population-based screening using different assays of fecal occult blood testing: the District of Florence experience. Int J Cancer 2001;92:151-54.
- Ko CW, Dominitz JA, Nguyen TD. Fecal occult blood testing in a general medical clinic: comparison between guaiac-based and immunochemical-based tests. Am J Med 2003;115:111-14.
- Wong BC, Wong WM, Cheung K L, Tong TS, Rozen P, Young GP, et al. A sensitive guaiac faecal occult blood test is less useful than an immunochemical test for colorectal cancer screening in a Chinese population. Aliment Pharmacol Ther 2003;18:941-46.
- Hughes K, Leggett B, Del MC, Croese J, Fairley S, Masson J, et al. Guaiac versus immunochemical tests: faecal occult blood test screening for colorectal cancer in a rural community. Aust N Z J Public Health 2005;29:358-64.
- Allison JE, Sakoda LC, Levin TR, Tucker JP, Tekawa IS, Cuff T, et al. J Natl Cancer Inst 2007;99:1462-70.
- Organización Mundial de Gastroenterología/Guías Prácticas de la Alianza Internacional para Cáncer Digestivo: Tamizaje del cáncer colorrectal; http://www.worldgastroenterology.org/assets/downloads/es/pdf/guidelines/cancer_colorectal_tamizaje_screening_y_vigilancia.pdf.
- U.S. Preventive Services Task Force. Screening for colorectal cancer: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med 2008; 149:627.
- Nakajima M, Saito H, Soma Y, Sobue T, Tanaka M, Munakata A. Prevention of advanced colorectal cancer by screening using the immunochemical faecal occult blood test: a case-control study. Br J Cancer 2003;89:23-8.
- Saito H, Soma Y, Koeda J, Wada T, Kawaguchi H, Sobue T, Aisawa T, et al. Reduction in risk of mortality from colorectal cancer by fecal occult blood screening with immunochemical hemagglutination test. A case-control study. Int J Cancer 1995; 61: 465-69.
- Saito H, Soma Y, Nakajima, M, Koeda J, Kawaguchi H, Kakizaki R, et al. A case-control study evaluating occult blood screening for colorectal cancer with hemoccult test and an immunochemical hemagglutination test. Oncol Rep 2000;7:815-19.
- Freitas BRV, Nagasako CK, Pavan CR, SLS Lorena, Guerrazzi F, Rodrigues Coy CS, et al. Immunochemical fecal ocult blood test for detection of advanced colonic adenomas and colorectal cancer: Comparison with colonoscopy results. Gastroenterol Res Pract 2013. Article ID 384561 | https://doi.org/10.1155/2013/384561.
- Morikawa T, Kato J, Yamaji Y, Wada R, Mitsushima T, Shiratori Y. A comparison of the immunochemical fecal occult blood test and total colonoscopy in the asymptomatic population. Gastroenterology 2005;129:422-28.
COMENTARIO
No resulta redundante repetir lo esbozado en este artículo sobre la prevalencia del cáncer colorrectal en la Argentina, este ocupa el tercer lugar entre las causas de neoplasia y el segundo en mortalidad, su prevalencia ha aumentado significativamente en la última década y desafortunadamente el 60% de los diagnósticos se realiza en estadios avanzados, determinando una sobrevida global del 60%. Sin embargo, ante la detección precoz, esta asciende a una 90%.
A pesar de que esta neoplasia se ha asociado a factores alimentarios y tipo de vida, el cambio en dichos hábitos muchas veces no es posible, imposibilitando la prevención primaria. Dadas estas circunstancias, una prevención secundaria mediante un diagnóstico precoz se impone.
La historia natural del carcinoma colorrectal lo transforma en uno de los más prevenibles, ya que tiene una lesión precursora, el pólipo adenomatoso, de lento crecimiento, cuya detección y resección mediante colonoscopía, permite una reducción eficaz de su incidencia, cumpliendo de esta forma con los requisitos descriptos por la OMS en la década del ‘70 para la implementación de un sistema de pesquisa.
Las diferencias en equipamiento y financiación en nuestro país, sumadas a la ausencia de un sistema nacional de registro dificultan la implementación de los programas de pesquisa propuestos.
Si bien la videocolonoscopía es el gold estándar para la detección de estas lesiones, se deduce que es imposible de aplicar a toda la población. Es por ello la importancia de este artículo, para concientizar al lector de la relevancia de los test inmunológicos, y la forma de aplicación con el fin de alcanzar una mayor precisión. Cabe destacar que es condición fundamental para un programa de cribado que ante un resultado positivo de la prueba exista la disponibilidad del estudio endoscópico para certificar el diagnóstico y emplear un tratamiento, situación que no es simple de solventar en todo el territorio nacional.
Se destaca que la comparación se realiza con el gold estándar de diagnóstico, la videocolonoscopía, y que se remarcan los estándares de calidad de la misma.
Por otra parte, es relevante que se tomen estadísticas de nuestra población para así adecuar los programas de pesquisa, ya que como fuera descripto previamente, según los factores ambientales y de nutrición la incidencia varía. Siendo difícil homologar con estudios japoneses cuyo estilo de vida y programa de pesquisa comienza una década antes que el nuestro.
El test inmunológico ha demostrado una mayor precisión, lo cual se asocia a una reducción de la mortalidad en los países que lo han implementado para su programa de pesquisa en una reducción de hasta el 60% de mortalidad.
Federico Carballo
Hospital Ignacio Pirovano. CABA, Argentina.
