REPORTE DE CASO
Melanoma del ano
Presentación de un caso y revisión bibliográfica
Ana Clara Ortega1; Ignacio Pitaco2; Eduardo Gómez3; Ángel M. Minetti4
Sanatorio de la Trinidad. Quilmes, Provincia de Buenos Aires
1: Médica cursista del Curso Universitario de Especialista en Coloproctología, Facultad de Medicina, Universidad de Buenos Aires. 2: Miembro del Servicio de Cirugía General y del Sector de Coloproctología. 3: Jefe del Servicio de Cirugía General. 4: Profesor Adjunto de Cirugía, Facultad de Medicina, Universidad de Buenos Aires; encargado del Sector de Coloproctología.
Los autores declaran ausencia de conflictos de interés.
Ana Clara Ortega: anaclaraortega@gmail.com
Recibido: marzo de 2022. Aceptado: agosto de 2022
Ana Clara Ortega: 0000-0002-4733-3844
Ignacio Pitaco: 0000-0002-8450-0488
Eduardo Gómez: 0000-0002-9639-976X
Ángel M. Minetti: 0000-0003-1235-6904
RESUMEN
El melanoma del ano es una neoplasia maligna de baja incidencia, con un pronóstico poco favorable y clínica inespecífica. Su diagnóstico temprano es fundamental en la sobrevida del paciente. Se presenta un caso de melanoma del margen anal con metástasis inguinal unilateral. Se realizó biopsia excisional mediante resección local con margen de seguridad amplio y linfadenectomía inguinal diferida, sin tratamiento adyuvante. A los 18 meses de seguimiento no evidencia recidiva local y/o a distancia.
Palabras clave: Melanoma del ano, melanoma mucoso, cáncer del ano.
SUMMARY
Anal melanoma is a malignant neoplasm of low incidence, with an unfavorable prognosis and non-specific symptoms. Its early diagnosis is essential for patient survival. A case of melanoma of the anal margin with unilateral inguinal metastasis is presented. Wide local resection and delayed inguinal lymphadenectomy, without adjuvant treatment, was performed At 18-month follow-up, there was no evidence of local and/or distant recurrence.
Key words: Anal melanoma, Mucosal melanoma, Anal cancer
INTRODUCCIÓN
Las neoplasias del conducto anal y la piel perianal son entidades poco frecuentes, comprendiendo 2 a 4% de los procesos malignos anorrectales.1-3 El melanoma del ano constituye entre el 1 a 3% de todos los melanomas. Afecta a personas entre los 60 y 80 años con una prevalencia del sexo femenino. Su prevalencia es tan baja que no permite el desarrollo de estudios prospectivos randomizados que sirvan para el desarrollo de guías, lo cual impide tener un protocolo de manejo óptimo. Su forma de presentación poco específica, la demora en el diagnóstico y la escasa respuesta a los tratamientos multimodales hacen que estos tumores tengan un mal pronóstico. Los mejores resultados se obtienen en los casos iniciales tratados mediante cirugía.
CASO CLÍNICO
Paciente masculino de 73 años, tez blanca, consulta por proctorragia, con secreción mucosanguinolenta, asociado a un tumor perianal de 10 meses de evolución, que duplicó su tamaño en los últimos 5 meses. Carece de antecedentes personales ni heredo familiares de relevancia.
Examen físico: tumor de 6x5 cm, con crecimiento hacia la piel perianal del hemiano izquierdo y límite interno en la línea mucocutánea; de base ancha, liso, duro elástico, color marrón azulado y parcialmente móvil. Tacto rectal y anoscopía muestran el canal anal libre (Fig. 1). En región inguinal izquierda: adenopatía de 1,5 cm móvil indolora.
![]()
![]()

Figura 1. A. Tumor nodular que limita internamente con la línea mucocutánea y se extiende hacia la piel perianal del lado izquierdo. B. Se observa el margen interno de la lesión a ras de la línea mucocutánea (flecha).
Exámenes complementarios: Laboratorio normal.
Diagnóstico presuntivo: Melanoma vs. tumor del tejido conectivo o epidermoide.
Con el fin de mejorar los severos síntomas locales y confirmar el diagnostico histológico se propone la resección completa con márgenes de seguridad.
Cirugía: Anestesia raquídea. Posición de litotomía. Marcado de bordes con electrobisturí a 2 cm de la lesión del lado interno y 5 cm en el resto del contorno. Disección hasta el plano muscular del esfínter resecando en profundad algunas fibras del mismo y la grasa perianal en todo el resto. Exéresis de la pieza (Fig. 2) y cierre del defecto con deslizamiento de colgajo (Fig. 3).
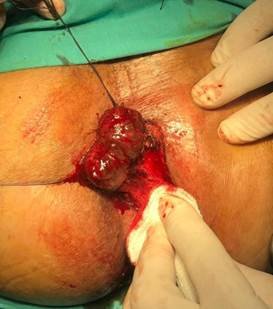
Figura 2. Incisión sobre la piel perianal.
![]()
![]()

Figura 3. A. Lecho quirúrgico luego de la resección. B. Aspecto final luego de la reconstrucción con colgajo.
Alta a las 48 horas. Al séptimo día dehiscencia parcial de la herida que cura por segunda intención.
Anatomía patológica: Melanoma mucoso, nodular, invasor, en fase de crecimiento vertical, con ulceración. Invade hasta la submucosa del conducto anal distal. Mide 4,8 x 2,5 cm. Espesor tumoral máximo (Breslow): 7 mm. Índice mitótico: 3 mitosis/mm2. No se identifican nódulos satélites macroscópicos, linfocitos infiltrantes tumorales, regresión tumoral, microsatelitosis ni neurotropismo. Se identifica invasión linfovascular (Fig. 4 A). Márgenes de resección libres de neoplasia: lateral más cercano se encuentra a 0,2 cm (hora 3) y profundo a 1,2 cm. Estadificación patológica (pTNM): no disponible para melanoma mucoso del conducto anal.
Inmunomarcación: CKAE1A3: negativo en células neoplásicas. S100: positivo citoplasmático en células neoplásicas. HMB45: positivo citoplasmático en células neoplásicas. Melan-A: positivo citoplasmático en células neoplásicas (Fig. 4 B).

Figura 4. Melanoma. A. Tinción con hematoxilina y eosina. B. Inmunomarcación Melan-A positivo.
Con el diagnóstico histológico definitivo se estadifica mediante tomografía con emisión de positrones, en la que se define una imagen nodular hipermetabólica en la región inguinal izquierda de 23,7 mm (SUV 4,4). Sin hallazgos patológicos en el resto del estudio (Fig. 5).
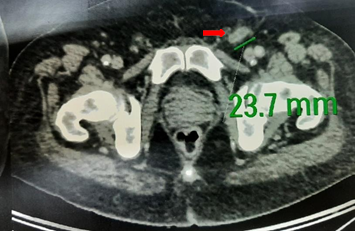
Figura 5. Imagen de tomografía con emisión de positrones, en la que se observa un ganglio captante en la ingle izquierda (flecha).
Reoperación: A los dos meses, linfadenectomía inguinal izquierda (Fig. 6).

Figura 6. Pieza de linfadenectomía abierta en la que se observa el ganglio metastásico.
Postoperatorio: Dehiscencia parcial de la herida con necrosis del margen y linforragia. Cura por segunda intención. Anatomía patológica: Linfadenectomía que evidencia mutación p.V600E en el Exón 15 del gen BRAF.
En ateneo multidisciplinario, se decide control clínico y tomografía corporal total cada 3 meses, junto con RMN de la pelvis.
Control alejado: Sin evidencia de recidiva local y/o a distancia a los 18 meses.
DISCUSIÓN
El melanoma anal ocupa el tercer lugar en frecuencia luego del de la piel y la retina, representando del 0,6 al 1,6% del total.2 Afecta a personas entre la sexta y octava década de la vida, con prevalencia 1,6 a 2,3 veces mayor en el sexo femenino.3,4 Su incidencia aumentó en los últimos años, sin embargo no se conoce la causa específica ya que no se relaciona con las zonas expuestas a las radiaciones como el melanoma cutáneo.3
La clínica poco concreta puede simular patología periorificial benigna lo cual demora el diagnóstico.3 Los síntomas son poco específicos, el más frecuente es el sangrado, la secreción mucosanguinolenta y la presencia de tumor anal; otros son prurito y dolor. En casos de afectación rectal presenta tenesmo y alteración del tránsito intestinal (constipación o diarrea).3,4
El tiempo de evolución entre el inicio de los síntomas y el diagnóstico se estima en aproximadamente 3 a 8 meses. El 67% de los pacientes presentan metástasis a distancia al momento del diagnóstico, lo cual se asocia a un pronóstico desfavorable y una sobrevida media global de entre 8 y 18,6 meses.4
En 2018, la Organización Mundial de la Salud clasificó al melanoma cutáneo, uveal y mucoso en nueve variantes histológicas: melanoma asociado a daño solar acumulativo y los no asociados dentro de los cuales se encuentra el mucoso. La forma nodular es la de peor pronóstico.5
Las lesiones pueden ser pigmentadas o no, en la región anorrectal las amelanocíticas comprenden entre el 10 y 87 %.4 El diagnóstico definitivo se obtiene por inmunohistoquímica, que resulta positiva para proteína S100, HMB 45 y Melan-A y negativa para CEA, Citokeratina y antígeno de la membrana epitelial.2,3,7
Los métodos para determinar el estadio en forma local, regional y sistémica son el tacto rectal, la anoscopía, rectosigmoideoscopía, videocolonoscopía y ecografía transrrectal. La tomografía corporal total, y/o la resonancia magnética nuclear junto a la tomografía por emisión de positrones son útiles para la evaluación sistémica.
A diferencia del melanoma de la piel, el mucoso no presenta estadificación TNM.9 Falch y cols.,4 en 2013 propusieron la siguiente estadificación para el melanoma ano-rectal: Estadio I, tumor localmente diseminado, sin infiltración de la capa muscular; Estadio II, tumor localmente diseminado, con infiltración de la capa muscular; Estadio III, tumor diseminado regionalmente y/o metástasis ganglionares; Estadio IV, tumor diseminado.
Las metástasis a distancia más frecuentes son en el hígado, pulmón y hueso.4,8 La infiltración submucosa se asocia con un 44% de metástasis ganglionar y menor sobrevida,4,9 aunque es controversial ya que hay bibliografía que no lo relaciona.12
El tratamiento consiste en cirugía a través de dos variantes: resección abdominoperineal (RAP) o resección local extendida (RL) con el agregado de linfadenectomía inguinal simultánea o diferida. La adyuvancia se realiza mediante radioterapia (RT), quimioterapia (QT) e inmunoterapia (IMT).
En una revisión sistemática realizada por Matsuda y cols.,10 donde se incluyeron 1.006 pacientes se concluyó que la RAP en relación con la RL permite un mejor control local de la enfermedad, pero sin beneficios en la sobrevida global (a 5 años RL 18% vs. RAP 19,9%) y libre de enfermedad. Razonablemente, la RL tuvo menor morbimortalidad y mejor calidad de vida. Además, se vio que cuando ocurre la recurrencia local tanto luego de la RAP como de la RL, la mayor parte de las veces se acompaña de metástasis a distancia. La recurrencia luego de la RL puede ser tratada con una RAP, o una nueva RL cuando es posible y no hay riesgos de incontinencia severa.14,10 Los resultados parecen mostrar la preferencia por la RL, sin embargo cabe aclarar que la decisión de efectuar una RAP o una cirugía conservadora del esfínter se halla vinculada a diversos factores tales como: localización del tumor (rectal, anal, o de piel), el tamaño y, especialmente para la RL, el hecho de poder conllevar alto riesgo de incontinencia.
La linfadenectomía como parte del tratamiento es otro tópico discutido. Un estudio retrospectivo de Pérez y cols.,12 del Memorial Sloan-Kettering Cancer Center, muestra la experiencia en melanoma anorrectal en 65 pacientes tratados con intención curativa, entre 1985 y 2010. En 25 (39%) pacientes se realizó RAP y en 40 (61%), RL. En 18 (26%) pacientes, se realizó diferentes formas de adyuvancia, QT, RT, e IMT.
En el grupo de RAP solo 7 de 65 pacientes tuvieron ganglios positivos en el mesorrecto, la presencia de los mismos no influyó en la sobrevida libre de enfermedad ni en la global. La localización del tumor (arriba o debajo de la línea del pecten) y la invasión en profundidad tampoco estuvieron relacionadas. No hubo asociación entre la localización del tumor por encima o por debajo de la línea pectínea y el patrón de diseminación linfática hacia meso o ingle.
En 32 de los 65 pacientes se hallaron ganglios inguinales positivos, en los cuales no varió la sobrevida global, aunque hubo una tendencia de menor sobrevida. La diseminación linfática mesorrectal o inguinal no estuvo asociada a un peor pronóstico. La biopsia del ganglio centinela, realizada solamente en 9 pacientes del grupo de RL, fue positiva en 7 aunque no tuvo influencia en la sobrevida global y libre de enfermedad.
El empleo del ganglio centinela para la definición de la linfadenectomía agregada no está establecido en esta localización.4,6 Un estudio retrospectivo presentado por Bleicher y cols.13 en una cohorte de 24 pacientes, mostró que no hubo diferencias significativas en la sobrevida entre pacientes que se sometieron a identificación de ganglio centinela y los que no. A los que se sometieron a biopsia del ganglio centinela y dieron positivo se les indicó terapia sistémica adyuvante.
Actualmente se desconoce el impacto de la terapia adyuvante en la sobrevida de estos pacientes. Cuando se habla de la terapia no quirúrgica no se encuentra actualmente un patrón de oro en el manejo, por cuanto aun no es clara la estrategia terapéutica. La diferentes terapias (RT, QT e IMT) no demostraron beneficios una sobre la otra. La sobrevida media fue de 18,8 meses, con 0% de sobrevida global a los 5 años. Excluyendo a los pacientes con enfermedad a distancia al momento del diagnóstico la sobrevida media global fue de 19,9 meses.
Un estudio retrospectivo llevado a cabo por Naqvi y cols.14 en 398 pacientes, la mayoría con enfermedad nodal o metastásica, compara cuatro grupos de terapias: solo cirugía, cirugía y RT, cirugía y QT/IMT, RT ± IMT/QT. La mayor sobrevida global la obtuvo el grupo que realizó cirugía y RT (32,3 meses). La sobrevida con cirugía sola fue de 22,9 meses y con RT ± IMT/QT 5,1 meses. En los pacientes con afección ganglionar, la cirugía sola tuvo una sobrevida de 3,9 meses, mientras que la cirugía con QT/IMT tuvo 10,8 meses, lo cual remarca la necesidad de acompañar la cirugía con una terapia sistémica en los casos más avanzados de la enfermedad.14
A pesar del tratamiento empleado, el melanoma anal tiene una letalidad muy alta, con una sobrevida a 5 años reportada de menos del 20%. Obtener un R0 en la cirugía permite una mejor sobrevida.11
Si bien hay pocos estudios que comparen las diferentes opciones terapéuticas, algo claro es que el estadio de la enfermedad al momento del diagnóstico y a la hora de decidir implementar una estrategia adecuada es crucial para la sobrevida.
El seguimiento posterior, los estudios indicados, la conducta frente a la recidiva, aún son interrogantes a evaluar.
En conclusión, el tratamiento del melanoma del ano tiene como objetivo primordial la resección, preferentemente local, cuando es posible y no existen riesgos de incontinencia, ya que tiene mejores resultados de calidad de vida y morbimortalidad y similares resultados alejados respecto a la resección abdominoperineal. Las terapias adyuvantes no han demostrado mejores efectos.
El paciente presentado, tratado con resección local y linfadenectomía inguinal sin otra terapia, se encuentra libre de enfermedad luego de´plpo 18 meses de seguimiento.
REFERENCIAS
1. Wietfeldt ED, Thiele J. Malignancies of the anal margin and perianal skin. Clin Colon Rectal Surg. 2009; 22:127-35.
2. Leonard D, Beddy D, Dozois EJ. Neoplasms of anal canal and perianal skin. Clin Colon Rectal Surg. 2011; 24:54-63.
3. Meguerditchian AN, Meterissian SH, Dunn KB. Anorectal melanoma: diagnosis and treatment. Dis Colon Rectum. 2011; 54:638-44.
4. Falch C, Stojadinovic A, Hann-von-Weyhern C, Protic M, Nissan A, Faries MB, et al. Anorectal malignant melanoma: extensive 45-year review and proposal for a novel staging classification. Am Coll Surg. 2013; 217:324-35
5. Elder DE, Bastian BC, Cree IA, Massi D, Scolyer RA. The 2018 World Health Organization classification of cutaneous, mucosal, and uveal melanoma: detailed analysis of 9 distinct subtypes defined by their evolutionary pathway. Arch Pathol Lab Med. 2020; 144: 500-22.
6. Iddings DM, Fleisig AJ, Chen SL, Faries MB, Morton DL. Practice patterns and outcomes for anorectal melanoma in the United States; is more extensive surgical resection beneficial in all patients? Ann Surg Oncol. 2010; 17: 40-4.
7. Fuertes L, Santonja C, Kutzner H, Requena L. Inmunohistoquímica en dermatopatología: revisión de los anticuerpos utilizados con mayor frecuencia (parte I). Actas Dermosifiliogr. 2013; 104:99-127.
8. Efron J. Expert commentary on anal melanoma: a rare perianal tumor with a poor prognosis. Dis Colon Rectum. 2020; 63: 576-77.
9. Chang AE, Karnell LH, Menck HR. The National Cancer Data Base report on cutaneous and noncutaneous melanoma: a summary of 84,836 cases from the past decade. The American College of Surgeons Commission on Cancer and the American Cancer Society. Cancer. 1998; 83:1664-78.
10. Matsuda A, Miyashita M, Matsumoto S, Takahashi G, Matsutani T, Yamada T, et al. Abdominoperineal resection provides better local control but equivalent overall survival to local excision of anorectal malignant melanoma: a systematic review. Ann Surg. 2015; 261:670-77.
11. Fields AC, Goldberg J, Senturk J, Saadat LV, Jolissaint J, Shabat G, et al. Contemporary surgical management and outcomes for anal melanoma: A National Cancer Database Analysis. Ann Surg Oncol. 2018; 25:3883-88.
12. Pérez DR, Trakarnsanga A, Shia J, Nash GM, Temple LK, Paty PB, et al. Locoregional lymphadenectomy in the surgical management of anorectal melanoma. Ann Surg Oncol. 2013; 20:2339-44.
13. Bleicher RJ, Essner R, Foshag LJ, Wanek LA, Morton DL. Role of sentinel lymphadenectomy in thin invasive cutaneous melanomas. J Clin Oncol. 2003; 21:1326-31.
1. Naqvi J, Lee A, Lederman A, Kavi A, Osborn VW, Schreiber D. Patterns of care and survival outcomes in the treatment of anal melanoma. J Gastrointest Cancer. 2020; 51:211-16.
COMENTARIO
La relevancia de esta publicación radica en que alerta al lector de una patología muy poco frecuente, permitiendo su sospecha con el fin de arribar a un diagnóstico precoz, que como veremos será fundamental para su pronóstico.
Desde el primer caso descripto de melanoma anorrectal maligno realizado por Moore en 1857, múltiples han sido las publicaciones al respecto, sin embargo, estas han sido en su mayoría reportes de casos o series pequeñas, poblando la literatura internacional de una calidad de evidencia muy baja.
Más del 67% de los pacientes presentan metástasis al momento del diagnóstico, asociándose a una sobrevida entre 8 y 18 meses. Una de las más amplias series que incluyó 85000 pacientes con melanoma, evidenció que el melanoma mucocutáneo corresponde al 1,3% y sólo un 24% de estos se debe al tipo que nos ocupa en esta publicación. Se considera que aún en centros de referencia en patología oncológica no se llegan a tratar más de dos casos por año.1
Cabe destacar que la fisiopatología de esta neoplasia no se relaciona con la conocida en el melanoma cutáneo, ya que no se presenta en zonas corporales expuestas a los rayos ultravioletas y por ello no existe predilección de raza para la presentación de la misma.
Como fuera muy bien descripto en el artículo, el pronóstico del melanoma cutáneo depende de su diagnóstico precoz, y la dificultad del mismo radica en la inespecificidad de sus síntomas (sangrado, dolor, masa…) asociado a que más del 87% suelen ser amelanóticos. 1
Con respecto a la estadificación, no está disponible actualmente una clasificación según el sistema TNM. Lo recomendado se basa en la descripción de Ballantyne en 1970, que comprende 3 estadíos (I local, II regional, III diseminado). Falch y cols1 subdividieron a su vez, el estadio 1, según haya compromiso o no de la muscular, siendo relevante para una propuesta de tratamiento acorde al mismo.
Según los resultados publicados por Kelly y colaboradores2, los pacientes con presencia de adenopatías al momento del diagnóstico desarrollarán metástasis a distancia en un 90%. Los casos tratados con intención curativa han demostrado una tasa de diseminación posterior del 59% y 72%, a los 2 y 5 años, denotando la importancia de un seguimiento estrecho y prolongado, dado lo insidioso de esta enfermedad. Afortunadamente en el caso que se presenta luego de 1 año de seguimiento no hubo evidencia de enfermedad.
Con respecto al tratamiento quirúrgico es interesante citar el trabajo publicado en la revista europea de Cancer, titulado “Less is more” 3, una revisión sistemática y metaanálisis que incluye 27 estudios y concluye que el tratamiento más radical (Amputación abdominoperineal) no ofrecería una diferencia significativa en sobrevida. Recomendando la resección local amplia asociada a una estrecha vigilancia como esquema óptimo de tratamiento.
En lo que atañe al tratamiento multimodal, nuevas estrategias se han incorporado al arsenal terapéutico 4, sin embargo, al momento, ninguna de ellas ha logrado prolongar la sobrevida en las últimas tres décadas. Recomiendo la lectura del trabajo titulado “Anorectal mucosal Melanoma in the era of inmune check point inhibition: should we change our surgical management paradigm?” publicado en la Disease the colon and rectum de mayo de 2021.5
Para finalizar con el comentario, recomiendo la lectura de las guías del reino unido de melanoma mucoso ano-uro-genital 6, que si bien aclaran que por el nivel de evidencia los grados de recomendación no pueden ser altos, se convierten en la única guía disponible al momento para estandarizar el diagnóstico, tratamiento y seguimiento de los melanomas mucosos.
Conclusión: Dada la falta de evidencia de nivel I, la toma de decisiones debe ser acorde a un balance entre posibilidad de curación y la morbilidad asociada a tratamientos frente a una patología muy recidivante y con una alta mortalidad. Su diagnóstico precoz y su seguimiento estrecho son pilares fundamentales para mejorar su pronóstico.
Federico Carballo
Hospital Pirovano, Buenos Aires
Bibliografía consultada:
1. Anorectal Malignant Melanoma: Extensive 45-Year Review and Proposal for a Novel Staging Classification. Claudius. Falch, MD, Alexander Stojadinovic, MD, FACS, Claus Hann-von-Weyhern, MD, Mladjan Protic, MD, Aviram Nissan, MD, Mark B Faries, MD, FACS, Martin Daumer, Dr rer nat, Dipl Phys, Anton J Bilchik, MD, PhD, FACS, Avital Itzhak, MD, PhD, FACS, Bjo¨rn LD M Bru¨cher, MD, PhD, FRCS (ENGL), FACS. J Am Coll Surg. http://dx.doi.org/10.1016/j.jamcollsurg.2013.02.031
2. Kelly P, Zagars GK, Cormier JN, et al. Sphincter-sparing local excision and hypofractionated radiation therapy for anorectal melanoma: a 20-year experience. Cancer 2011;117:4747e4755
3. Less is more: A systematic review and meta-analysis of the outcomes of radical versus conservative primary resection in anorectal melanoma. Henry G Smith , Jessica Glen , Nancy Turnbull , Howard Peach , Ruth Board , Miranda Payne , Martin Gore , Karen Nugent , Myles J F Smith. Eur J Cancer
. 2020 Aug;135:113-120. doi: 10.1016/j.ejca.2020.04.041. Epub 2020 Jun 18.
4. Surgical treatment of anorectal melanoma: a systematic review and meta-analysis. Esther Jutten , Schelto Kruijff, Anne Brecht Francken , Martijn F. Lutke Holzik , Barbara L. van Leeuwen , Henderik. L. van Westreenen, L. van Westreenen and Kevin P. Wevers. BJS Open, 2021, zrab107 DOI: 10.1093/bjsopen/zrab107
5. Anorectal Mucosal Melanoma in the Era of Immune Checkpoint Inhibition: Should We Change Our Surgical Management Paradigm? Mohammad Adileh, M.D. , Jonathan B. Yuval, M.D., Shan Huang, M.D., Alexander N. Shoushtari, M.D., Felipe Quezada-Diaz, M.D. , Emmanouil P. Pappou, M.D., Ph.D. , Martin R. Weiser, M.D., Julio Garcia-Aguilar, M.D., Ph.D. , J. Joshua Smith, M.D., Ph.D. , Philip B. Paty, M.D., Garrett M. Nash, M.D., M.P.H. Dis Colon Rectum. 2021 May ; 64(5): 555–562. doi:10.1097/DCR.0000000000001872.
6. Ano-uro-genital mucosal melanoma UK national guidelines. Henry G. Smith, Izhar Bagwan , Ruth E. Board , Sharon Capper , Sarah E. Coupland, Jessica Glen, Susan Lalondrelle , Antonia Mayberry, Asif Munee , Karen Nugent , Pubudu Pathiraja , Miranda Payne , Howard Peach , Jonathan Smith , Sarah Westwell , Ewan Wilson , Simon Rodwell , Martin Gore , Nancy Turnbull, Myles J.F. Smith. European Journal of Cancer 135 (2020) 22e30