Artículo original
DOI: https://doi.org/10.46768/racp.v0i0.195
Perfusión de azul de metileno en piezas de colectomía ex-vivo para incrementar la cosecha ganglionar
Javier Chinelli,1 Adrián Medina,2 Florencia Sarries,3 Virginia Irigoyen,3 Emilia Moreira,3 Viviana Escobar,4 Valentina Porro,4 Elisa Laca,4 Gustavo Rodríguez,5
Clínica Quirúrgica 2, Hospital Maciel, Montevideo, Uruguay y Corporación Médica de Canelones (COMECA), Canelones, Uruguay.
1 Profesor Adjunto. Clínica Quirúrgica 2, Hospital Maciel. Cirujano General, Corporación Médica de Canelones (COMECA). 2 Asistente. Clínica Quirúrgica 2. 3 Residente. Clínica Quirúrgica 2. 4 Patólogo. Departamento de Anatomía Patológica, Hospital Maciel. 5 Profesor Titular. Clínica Quirúrgica 2, Hospital Maciel. Jefe del Servicio de Cirugía de COMECA.
Los autores declaran ausencia de conflictos de interés.
Javier Chinelli
Recibido: diciembre de 2021. Aprobado: febrero de 2022.
Javier Chinelli: 0000-0002-3387-7365
Adrián Medina: 0000-0002-4930-9995
Florencia Sarries: 0000-0002-4753-0805
Virginia Irigoyen: 0000-0003-0884-6628
Emilia Moreira: 0000-0002-9300-9981
Viviana Escobar: 0000-0003-2381-697X
Valentina Porro: 0000-0001-6803-6120
Elisa Laca: 0000-0001-6215-2059
Gustavo Rodríguez: 0000-0003-3465-8364
RESUMEN
Introducción: El pronóstico del cáncer del colon está relacionado con el número de ganglios linfáticos extirpados quirúrgicamente. El número de ganglios linfáticos extraídos varía según factores relacionados con el paciente, el tumor, el cirujano y el patólogo.
Objetivo: Evaluar la eficacia de la perfusión intraarterial ex-vivo de azul de metileno (AM) de especímenes después de una cirugía curativa de cáncer del colon, para mejorar el número de ganglios linfáticos recolectados.
Diseño: Estudio de cohortes, multicéntrico, comparativo. Se comparó un grupo de estudio prospectivo (AM) con un grupo de control retrospectivo.
Material y métodos: Se incluyeron 76 pacientes, 29 en el grupo de AM y 47 en el grupo control. Se evaluaron los datos demográficos, el estadio, el sitio del tumor, la longitud de la pieza y el tipo de resección. El recuento de ganglios linfáticos fue el resultado primario.
Resultados: La mediana del número de ganglios linfáticos extraídos fue de 18 y 13 en el grupo AM y control, respectivamente (p=0,033).
Conclusión: La perfusión de AM mejoró la mediana del número de ganglios linfáticos resecados, como se muestra en la literatura. Validamos la eficacia de esta técnica, que es simple, de bajo costo y fácil de realizar.
Palabras clave: Azul de metileno; Perfusión intraarterial ex-vivo; Colectomía; Cosecha de ganglios linfáticos
ABSTRACT
Introduction: Colon cancer prognosis is related to the number of surgically removed lymph-nodes. The number of harvested lymph-nodes varies according to patient, tumor, surgeon and pathologist-related factors.
Aim: To assess the efficacy of ex-vivo intra-arterial methylene-blue (MB) perfusion of specimens after curative colon cancer surgery, to improve the number of harvested lymph-nodes.
Design: Cohort, multi-centric, comparative study. A prospective study group (MB) was compared with a retrospective control group.
Material and Methods: Seventy-six patients were included, 29 in the study group (MB) and 47 in the control group. Demographics, tumor stage, tumor site, specimen length and type of resection were assessed. Lymph-node count was the primary outcome.
Results: Median number of harvested lymph-nodes was 18 and 13 in the MB and control group, respectively (p=0,033).
Conclusion: MB perfusion improved the median number of lymph-node count, as shown in the literature. We validated the efficacy of this technique, which is simple, low-cost and easy to perform.
Key words: Methylene-blue; Ex-vivo Intra-arterial Perfusion; Colectomy; Lymph-node Harvest
INTRODUCCIÓN
El pronóstico oncológico del cáncer del colon luego de una resección curativa está dado por varios factores. Probablemente uno de los más importantes sea el estado ganglionar de la pieza de resección. Otro de ellos, bien establecido por West et al.,1 es la integridad del mesocolon; sin embargo, no se informa de rutina en nuestro medio.
La afectación ganglionar tiene dos implicancias fundamentales: pronóstica y terapéutica. En el primer caso (estadio III según la clasificación TNM de la UICC)2 supone una sobrevida de un 60% a 5 años.3 Desde el punto de vista terapéutico, su positividad define la necesidad de tratamiento adyuvante.
Para una correcta estadificación debe obtenerse un número adecuado de ganglios linfáticos en la pieza de resección, pero no hay consenso absoluto en el número óptimo para cumplir con ese precepto. El National Quality Forum estableció en 2007 un número ≥12 como estándar de calidad para una colectomía oncológica.4
Si bien existen técnicas que pueden aumentar el número de ganglios linfáticos recolectados en una pieza quirúrgica, como el clearence de grasa, habitualmente suponen un mayor tiempo de estudio, costo adicional y riesgo de toxicidad.5 En 2008, Märkl et al.6 demostraron la utilidad de la inyección de azul de metileno (AM) intraarterial ex-vivo para la identificación de ganglios linfáticos en la pieza operatoria. En 2012, Frasson et al.7 también obtuvieron resultados favorables con la aplicación de esta técnica, que tiene la ventaja de ser de bajo costo y fácilmente reproducible.
Este estudio tiene 2 objetivos:
a) Evaluar la utilidad de la perfusión de AM en piezas de colectomía oncológica ex-vivo, para facilitar la cosecha ganglionar.
b) Evaluar la calidad de la resección, teniendo en cuenta 2 indicadores: el número ganglionar obtenido y la integridad del mesocolon.
MATERIAL Y MÉTODOS
Estudio experimental, multicéntrico, de carácter ambispectivo, con un brazo de estudio prospectivo y un grupo control retrospectivo. Los datos se obtuvieron del archivo de las historias clínicas en el grupo control, y se diseñó una base de datos de registro prospectivo para el grupo de estudio.
Participaron 2 centros asistenciales, la Clínica Quirúrgica 2 del Hospital Maciel y la Corporación Médica de Canelones.
Criterios de inclusión: pacientes operados por adenocarcinoma del colon (incluyendo los tumores de la unión rectosigmoidea) en forma electiva y con intención curativa. En este grupo se realizó la perfusión intraarterial ex-vivo de la pieza quirúrgica en fresco, antes de la fijación en formol. Fueron excluidos aquellos pacientes operados de urgencia, con intención paliativa y con tumores por debajo de la unión rectosigmoidea.
Técnica
Se canaliza en su origen la arteria del pedículo correspondiente al segmento del colon resecado con un catéter intravenoso 20G, inyectando 15 ml de una dilución de 2 ml de AM + 13 ml de solución salina fisiológica (Fig. 1). En el caso de que la pieza incluya más de un segmento colónico, se repite el procedimiento en el/los otros pedículo/s. Se considera satisfactorio si la serosa del órgano se tiñe en forma homogénea (Fig. 2). Una vez completado el procedimiento se realiza la fijación de la pieza en formol. El estudio anatomopatológico fue realizado por 3 patólogos siguiendo el protocolo del College of American Pathologists (2020).8
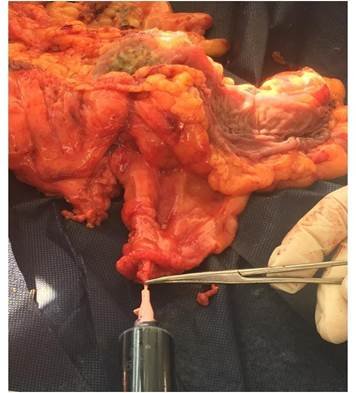
Figura 1. Técnica de inyección de azul de metileno.
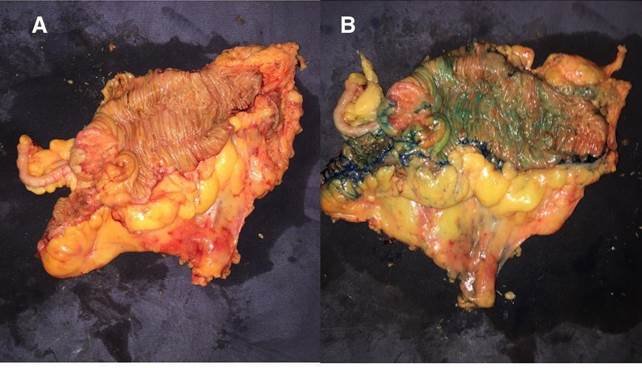
Figura 2. Pieza quirúrgica antes (A) y después (B) de la inyección del azul de metileno.
Se conformó un grupo control retrospectivo con pacientes operados en la Clínica Quirúrgica 2, que cumplían con los criterios de inclusión.
Se consignó para cada caso edad (en años), sexo, localización del tumor, longitud de la pieza (en cm), estadificación histopatológica del tumor (pT), en caso de cáncer sincrónico se consideró el grado de invasión parietal más avanzado, número de ganglios resecados y presencia o no de metástasis ganglionar (pN).
En el grupo de estudio (inyección de AM) se evaluó además la integridad de la resección mesocólica, estableciendo el plano de disección de acuerdo al esquema propuesto en el Medical Research Council trial (CLASSIC):9
- Plano mesocólico: sin defectos de las hojas peritoneales del mesocolon.
- Plano intra-mesocólico: pequeños defectos que no alcanzan la muscular propia.
- Plano de la muscular propia: defectos completos que alcanzan la capa muscular del colon.
El proyecto de investigación fue aprobado por el Comité de Ética del Hospital Maciel.
Análisis estadístico
Para las variables cuantitativas se contrastó la normalidad mediante test de Kolomogrov Smirnov y en los casos de distribución normal se expresan en media y desvío estándar, de lo contrario se expresan en mediana y rango intercuartilo. Las variables cualitativas se expresan en frecuencia absoluta y frecuencia relativa porcentual.
Para las variables cuantitativas se utilizó el test U de Mann-Whitney y para las variables cualitativas el test de Chi cuadrado o razón de máxima verosimilitud según correspondiera. Se consideró significativo un valor p < 0,05. Para el análisis estadístico se utilizó el programa SPSS IBM inc. V 22.0.
RESULTADOS
Se incluyeron 76 pacientes, 29 en el grupo de estudio (AM) y 47 en el grupo control. El abordaje fue laparoscópico en 64/76 (84%) pacientes. Los 12 pacientes operados por abordaje abierto pertenecían al grupo control.
La inyección del AM siguiendo la técnica descrita fue posible y satisfactoria en todos los casos (Fig. 3). Los datos se recogieron en forma prospectiva a lo largo de 15 meses.

Figura 3. Ganglios teñidos con azul de metileno.
Los resultados demográficos, la localización tumoral, la longitud de la pieza resecada, estadio T (pT), el número de ganglios resecados y el estado ganglionar (metastásico o no) se resumen en la Tabla 1.
Tabla 1. Datos demográficos, localización tumoral, tipo de resección y estudio anatomopatológico
|
Variable |
Azul de metileno n = 29 |
Control n = 47 |
p |
|
|
Edad (años) |
61 (RIC 20) |
70 (RIC 14) |
0,289 |
|
|
Sexo masculino, n (%) |
12 (41,4) |
30 (63,8) |
0,056 |
|
|
Centro asistencial, n (%) |
|
|
< 0,0001 |
|
|
H. Maciel |
15 (51,7) |
47 (100) |
|
|
|
Comeca |
14 (48,3) |
0 |
|
|
|
Localización tumoral en el colon, n (%) |
|
|
< 0,0001 |
|
|
Ascendente |
11 (37,9) |
32 (68,1) |
0,01 |
|
|
Transverso |
4 (13,8) |
0 |
0,009 |
|
|
Descendente |
2 (6,9) |
2 (4,3) |
0,616 |
|
|
Sigmoides |
4 (13,8) |
11 (23,4) |
0,306 |
|
|
Unión rectosigmoidea |
8 (27,6) |
0 |
|
|
|
Procedimiento |
|
|
0,092 |
|
|
Colectomía derecha |
14 |
32 |
0,069 |
|
|
Colectomía izquierda |
5 |
2 |
0,058 |
|
|
Sigmoidectomía |
9 |
11 |
0,514 |
|
|
pT, n (%) |
|
|
0,009 |
|
|
0 |
4 (13,8) |
4 (8,5) |
0,486 |
|
|
1 |
0 |
6 (12,8) |
0,045 |
|
|
2 |
0 |
4 (8,5) |
0,106 |
|
|
3 |
21 (72,4) |
25 (53,2) |
0,095 |
|
|
4 |
4 (9,8) |
8 (17) |
0,708 |
|
|
pN+, n (%) |
16 (55,2) |
19 (40,4) |
0,160 |
|
|
Longitud pieza (cm) |
31.5 (RIC 18,5) |
30.0 (RIC 15,5) |
0,788 |
|
|
N° ganglios |
18 (RIC 10) |
13 (RIC 9) |
0,033 |
|
RIC: rango intercuartilo.
Para los pacientes en el grupo AM, el plano de resección fue mesocólico en 27 (93,1%), intra-mesocólico en 1 (3,4%), y de la muscular propia en 1 (3,4%).
En la Tabla 2 se presentan las medianas de cosecha ganglionar en cada grupo según el tipo de procedimiento realizado.
Tabla 2. Cosecha ganglionar según el tipo de procedimiento realizado
|
|
Azul de metileno |
Control |
p |
|
Ganglios resecados, mediana (RIC) Colectomía derecha Colectomía izquierda Sigmoidectomia |
20,5 (10) 15 (9) 15 (11) |
14 (11) 12 (14) 13 (12) |
0,042 1,0 0,412 |
RIC: rango intercuartilo.
DISCUSIÓN
Los resultados obtenidos sugieren que la perfusión con azul de metileno incrementa el recuento ganglionar, obteniendo diferencias estadísticamente significativas, y son consistentes con los señalados en la literatura.6,7 También se observó una reducción en el porcentaje de resecciones cuya cosecha ganglionar fue inferior a 12 (38% vs 7%).
Las 2 instituciones que participaron de la investigación aportaron pacientes al grupo de estudio (AM) en la misma proporción y estos fueron operados en su totalidad por el mismo equipo quirúrgico. Analizando la homogeneidad y comparabilidad de los dos grupos, no se encontraron diferencias estadísticamente significativas en las variables demográficas, tipo de procedimiento, ni longitud de la pieza resecada, aunque sí existieron en la proporción de lesiones precoces (pT0 y pT1) y en la localización tumoral en el colon ascendente.
Al día de hoy el número de ganglios a resecar en una colectomía oncológica sigue siendo objeto de debate, a pesar del mínimo de 12 propuesto inicialmente por el Working Party Report en el Congreso Mundial de Gastroenterología en Sydney (1990)10 y adoptado posteriormente por el American Joint Committee on Cancer (AJCC), el College of American Pathologists (CAP) y la National Comprehensive Cancer Network (NCC).11 Esto se debe a que cuanto mayor es la cosecha ganglionar, particularmente en los tumores T3, también lo es la posibilidad de hallar adenopatías metastásicas.12, 13 Por otra parte, aun cuando no se encuentren metástasis la sobrevida también aumenta conforme lo hace la cosecha ganglionar, lo que se explicaría por una mayor respuesta inmune al tumor.14 En nuestro caso, observamos una tendencia a una mayor positividad ganglionar ante el mayor número de ganglios resecados (grupo AM), aunque sin significación estadística (p = 0,16), probablemente debido a la falta de potencia del estudio.
Aun así, hay series que reportan un número medio de ganglios resecados inferior a 12, así como un porcentaje llamativamente bajo de casos en los que se obtuvo dicho recuento.15 En la literatura nacional, Viola y cols.16 reportan una media de 17 ganglios resecados en colectomías oncológicas laparoscópicas electivas, en tanto que Chinelli y cols.17 obtienen una media de 22.
Además del cirujano y el patólogo, existen otros factores del paciente y el tumor determinantes de la cosecha ganglionar. De esta forma, el número obtenido deberá interpretarse en su contexto y no simplemente como un punto arbitrario que marca el límite entre lo suficiente e insuficiente, tal como señalan Misa y cols.18 en una revisión reciente del tema.
La experiencia del equipo actuante (cirujanos y patólogos) y el trabajo multidisciplinario se señalan en la literatura como un factor de peso en la calidad oncológica de la cirugía.19, 20 En nuestro estudio, tanto en el grupo AM como en el grupo control, las cirugías fueron llevadas a cabo por cirujanos que habían completado su curva de aprendizaje en resección colónica laparoscópica y el estudio anatomopatológico fue realizado por patólogos que forman parte del equipo multidisciplinario.
La edad es uno de los factores que más inciden, existiendo una relación inversamente proporcional con el número de ganglios resecados.21 Como se mencionó inicialmente, en nuestro estudio no existieron diferencias con significación estadística en la distribución por edad entre los grupos.
Con respecto a las variables propias del tumor identificadas, (tamaño, diferenciación, localización, infiltración linfocitaria),22 destacaremos por su importancia la localización tumoral y por ende el tipo de resección efectuada. La colectomía derecha se asocia a un mayor número de ganglios obtenidos,23 en parte por una mayor extensión de la resección visceral en comparación con las resecciones segmentarias del lado izquierdo y también por el mayor número de ganglios presente a lo largo del eje mesentérico superior. Uno de los sesgos que puede suponer comparar la totalidad de los pacientes de cada grupo reside en la variedad de procedimientos (colectomía derecha, colectomía izquierda y resección rectosigmoidea), aun cuando la distribución de los mismos fue homogénea (p = 0,092). Por ello también se comparó la mediana de cosecha ganglionar según la táctica quirúrgica y se observó que fue superior para el grupo AM en las 3 categorías, alcanzando significación estadística solamente en el caso de la colectomía derecha (Tabla 2).
Finalmente, en un
alto porcentaje de los casos (93%) se obtuvo un plano de disección mesocólico. Esto es de suma importancia teniendo en cuenta los
hallazgos de West et al.1 que
encuentran un beneficio adicional del 15% en la sobrevida de los pacientes
cuando se remueve todo el mesocolon intacto, que asciende al 27 % en los
estadios III.
Nuestra investigación presenta algunas fortalezas y debilidades que deben señalarse. Ya se ha hecho mención a la consistencia en la conformación y experiencia de los equipos quirúrgicos y de patólogos, así como a la utilización de una técnica quirúrgica uniforme y estandarizada. Por otra parte, existe un sesgo ya que el grupo de estudio no es ciego y tanto cirujanos como patólogos podrían extremar los esfuerzos para optimizar la calidad oncológica de la cirugía y examinar con mayor detenimiento las piezas de resección.
CONCLUSIONES
La técnica de inyección intra-arterial ex-vivo de azul de metileno en las piezas de colectomía es simple, de bajo costo, insume poco tiempo, es fácilmente reproducible y aumenta el rendimiento de la búsqueda ganglionar durante el estudio anatomopatológico.
REFERENCIAS
1. West NP, Morris EJ, Rotimi O, Cairns A, Finan PJ, Quirke P. Pathology grading of colon cancer surgical resection and its association with survival: a retrospective observational study. Lancet Oncol 2008; 9:857-65.
2. Amin MB, Edge SB, Greene FL. AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer. 2017.
3. O’Connell JB, Maggard MA, Ko CY. Colon cancer survival rates with the new American Joint Committee on Cancer sixth edition staging. J Natl Cancer Inst 2004; 96:1420-25.
4. National voluntary consensus standards for quality of cancer care. Washington, DC: National Quality Forum. 2007.
5. Vogel C, Kirtil T, Oellig F. Lymph node preparation in resected colorectal carcinoma specimens employing the acetone clearing method. Pathol Res Pract 2008; 204:11-5.
6. Märkl B, Kerwel TG, Jähnig HG, Oruzio D, Arnholdt H, Schöler C, et al. Methylene blue-assisted lymph node dissection in colon specimens: a prospective, randomized study. Am J Clin Pathol 2008; 130:913-19.
7. Frasson M, Faus C, Garcia-Granero A, Puga R, Flor-Lorente B, Cervantes A, et al. Pathological evaluation of mesocolic resection quality and ex vivo methylene blue injection: What is the impact on lymph node harvest after colon resection for cancer? Dis Colon Rectum 2012; 55:197-204.
8. College of American Pathologists. Protocol for the examination of patients with primary carcinoma of the colon and rectum. Washington, DC: CAP. 2020. https://documents.cap.org/protocols/ColoRectal_4.2.0.0.REL_CAPCP.pdf
9. Quirke P, Sebag-Montefiore D, Steele R, Khanna S, Monson J, Holliday A, et al, for the NCRI colorectal cancer study group. Local recurrence after rectal cancer resection is strongly related to the plane of surgical dissection and is further reduced by preoperative short course radiotherapy. Preliminary results of the MRC CR07 trial. J Clin Oncol 2006; 24 (suppl): A3512.
10. Fielding LP, Arsenault PA, Chapuis PH, Dent O, Gathright B, Hardcastle JD, et al. Clinicopathological staging for colorectal cancer: an international documentation system (IDS) and an international comprehensive anatomical terminology (ICAT). J Gastroenterol Hepatol 1991; 6: 325-44.
11. Xue L, Williamson A, Gaines S, Andolfi C, Paul-Olson T, Neerukonda A, et al. An update on colorectal cancer. Curt Probl Surg 2018; 55:76-116.
12. Pheby DF, Levine DF, Pitcher RW, Shepherd NA. Lymph node harvests directly influence the staging of colorectal cancer: evidence from a regional audit. J Clin Pathol 2004; 57:43-7.
13. Tornroos A, Garvin S, Olsson H. The number of identified lymph node metastases increases continuously with increased total lymph node recovery in pT3 colon cancer. Acta Oncol 2009; 48:1152-56.
14. Bui L, Rempel E, Reeson D, Simunovic M. Lymph node counts, rates of positive lymph nodes, and patient survival for colon cancer surgery in Ontario, Canada: a population-based study. J Surg Oncol 2006; 93: 439-45.
15. Baxter NN, Virnig DJ, Rothenberger DA, Morris AM, Jessurun J, Virnig BA. Lymph node evaluation in colorectal cancer patients: a population-based study. J Natl Cancer Inst 2005; 97:219-25.
16. Viola Malet M, Laurini M, Zeballos J, Muniz N, Rodríguez-Goñi P, Castelli F y cols. Cirugía correctal videoasistida en Uruguay, luego de 106 casos. An Facultad Med (Univ Repub Urug) 2015; 2:43-52.
17. Chinelli Ramos J, Costa JM, Rodríguez Temesio G. Desarrollo de la resección colo-rectal mínimamente invasiva en un servicio de cirugía universitario. An Facultad Med (Univ Repub Urug) 2019; 6: 45-56.
18. Misa R, Almada MN, Brito N, Martínez J, Pouy A, Haro C. Cosecha ganglionar en cáncer de colon. Rev Med Urug 2020; 36:177-85.
19. Morris EJ, Maughan NJ, Forman D, Quirke P. Identifying stage III colorectal cancer patients: the influence of the patient, surgeon, and pathologist. J Clin Oncol 2007; 25:2573-79.
20. García-Granero E, Faiz O, Muñoz E, Flor B, Navarro S, Faus C, et al. Macroscopic assessment of mesorectal excision in rectal cancer: a useful tool for improving quality control in a multidisciplinary team. Cancer 2009; 115:3400-11.
21. Martínez-Ramos D, Escrig-Sos J, Miralles-Tena J, Rivadulla-Serrano I, Salvador-Sanchís J. ¿Existe un número mínimo de ganglios linfáticos que se debe analizar en la cirugía del cáncer colorrectal? Cir Esp 2008; 83:108-17.
22. van Erning F, Crolla R, Rutten H, Beerepoot L, van Krieken J, Lemmens V. No change in lymph node positivity rate despite increased lymph node yield and improved survival in colon cancer. Eur J Cancer 2014; 50:3221-29.
23. Betge J, Harbaum L, Pollheimer M, Lindtner R, Kornprat P, Ebert M, et al. Lymph node retrieval in colorectal cancer: determining factors and prognostic significance. Int J Colorectal Dis 2017; 32:991-9
COMENTARIO
Los autores presentan un estudio sumamente atractivo y con un muy buen diseño. Es un desafío constante cómo realizar nuestras propias auditorías y cómo mejorar la calidad de las piezas de resección. Los autores describen detalladamente una valiosa forma para hacerlo, sencilla y de bajo costo.
Si bien el número del conteo ganglionar está en revisión y depende, como bien dicen los autores, de múltiples factores, estandarizar y aunar la mayor cantidad de los mismos repercute en beneficios para el paciente. La experiencia del equipo quirúrgico, el trabajo multidisciplinario con equipos entrenados, las auditorías constantes y formales hacen que sin duda mejoren los resultados.
Felicito a los autores y los estimulo a continuar por esta senda.
Sergio Schlain
HIGA San Roque de Gonnet, La Plata, Buenos Aires, Argentina.