Análisis de los factores asociados con el síndrome de resección anterior en los pacientes operados por tumores del recto. ¿Puede el cirujano prevenir su aparición?
Adrián Mattacheo,1,2 Laura Magrini,1 Mariano Rivera,1 Joaquín Tognelli,2 Darío Venditti,2 Norberto Lucilli,1 Luis Pedro2
1- Servicio de Cirugía, Hospital J. M. Ramos Mejía y 2- Cirugía
Coloproctológica, Sanatorio Sagrado Corazón, OSECAC. CABA, Argentina.
Adrian Mattacheo
amattacheo@gmail.com
Adrián Mattacheo: 0000-0002-9622-9031
Laura Magrini: 0000-0003-3374-4877
Mariano Rivera: 0000-0001-8191-029X
Joaquín Tognelli: 0000-0001-9432-6287
Darío Venditti: 0000-0002-8516-3065
Norberto Lucilli: 0000-0002-6910-3433
Luis Pedro: 0000-0002-7239-6492
Los autores declaran ausencia de conflictos de interés.
Recibido: agosto de 2021. Aceptado: septiembre de 2021.
RESUMEN
Introducción: Los pacientes con resección anterior baja por cáncer del recto suelen manifestar trastornos funcionales relacionados con la evacuación intestinal, los que en conjunto se definen como síndrome de resección anterior baja (LARS, por su sigla en inglés). Los síntomas consisten en aumento de la frecuencia, urgencia y fraccionamiento evacuatorio, e incontinencia fecal. Se han demostrado algunos factores predisponentes para su aparición.
Objetivo: Determinar la prevalencia del LARS y su relación con factores de riesgo.
Diseño: Observacional, retrospectivo y transversal.
Material y métodos: Pacientes con adenocarcinoma o lesión sospechosa en el recto sometidos a resección anterior baja con anastomosis primaria extraperitoneal y restablecimiento del tránsito intestinal, entre junio de 2012 y marzo de 2021, operados por integrantes del mismo equipo. Se realizó clasificación de severidad del LARS mediante el Score de LARS (rango 0-42), entre noviembre de 2020 y abril de 2021.
Resultados: Sesenta y nueve pacientes cumplían con los criterios de inclusión. Con una mediana de tiempo desde la cirugía al cuestionario de 31 (rango 3-97) meses, el 40,6 % (28/69) de los pacientes obtuvieron un score de LARS ≥ 30 (LARS mayor). El riesgo de LARS mayor estuvo significativamente incrementado en el sexo femenino (OR 3,4; IC 95 % 1,08- 11,8), la radioterapia previa (OR 3,8; IC 95 % 1,4-10) y la resección total del mesorrecto (OR 4,1; IC 95 % 1,06-15,9). No se encontró asociación con la edad, el uso de reservorio, la anastomosis coloanal manual, ni el uso de una ostomía transitoria.
Conclusiones: La prevalencia de un score de LARS mayor en nuestro servicio es similar a la reportada en la literatura. La radioterapia y la escisión total del mesorrecto son variables que se asocian a un score de LARS mayor, pero se fundamentan en resultados oncológicos más que funcionales. Las medidas potencialmente preventivas, como el tipo de anastomosis, no parecen ser determinantes.
Palabras clave: Cáncer del recto; Síndrome de resección anterior; Score de LARS
ABSTRACT
Introduction: Patients with low anterior resection for rectal cancer often suffer functional disorders related to bowel movements defined as low anterior resection syndrome (LARS). Symptoms include increased frequency, urgency, clustering and fecal incontinence. Some predisposing factors for its appearance have been demonstrated.
Objective: To determine LARS prevalence, and factors related with its appearance and severity.
Design: Retrospective, cross-sectional, observational study.
Material and methods: Patients submitted to low anterior resection with extraperitoneal primary anastomosis for confirmed/suspected rectal adenocarcinoma not considered for endoscopic resection, operated on by members of the same surgical staff in two institutions, between June 2012 and March 2021. A questionnaire on bowel function was administered to patients between November 2020 and April 2021. LARS score (range 0-42) and related variables were also analyzed.
Results: Sixty-nine patients met the inclusion criteria. With a median time from surgery to questionnaire of 31 (range 3-97) months, 40.6% (28/69) patients obtained a LARS score ≥ 30 (major LARS). The risk of major LARS was significantly increased in females (OR 3.4; 95% CI 1.08-11.8), and patients that underwent neoadjuvant radiotherapy (OR 3.8; 95% CI 1.4-10) and total mesorectal excision (OR 4.1; 95% CI 1.06-15.9). No association was found with age, the use of reservoir, hand-sewn coloanal anastomosis, or temporary ostomy.
Conclusions: The prevalence of major LARS in our service is similar to that reported in the literature. Radiotherapy and total mesorectal excision are variables associated with a higher LARS score, but are based on oncological rather than functional results. Potentially preventive measures, such as the type of anastomosis, do not seem to be decisive.
INTRODUCCIÓN
El cáncer del recto es una enfermedad frecuente en nuestro medio. Los diferentes esquemas terapéuticos, que incluyen la quimiorradioterapia así como la cirugía, han permitido ampliar los horizontes de la preservación esfinteriana.1
Idealmente, los pacientes operados por cáncer del recto mantendrán la continuidad intestinal. A pesar de esto, aquellos en quienes se realiza una resección anterior baja (RAB) con anastomosis y restablecimiento del tránsito, conllevan dificultades funcionales relacionadas con la evacuación intestinal. Las manifestaciones más frecuentemente relatadas por los pacientes se vinculan con la frecuencia, urgencia y fraccionamiento evacuatorios, así como con la incontinencia fecal. Generalmente, estos síntomas, son de mayor intensidad inmediatamente después de la cirugía y disminuye transcurrido el primer año.2 Para evaluarlos, el LARS score (por su sigla en inglés de Low Anterior Resection Syndrome), se ha consagrado en los últimos años como una herramienta válida para la categorización de estos pacientes.3 De acuerdo con esta puntuación, los individuos que sufren un LARS mayor tienen un deterioro significativo en la calidad de vida, en comparación con quienes tienen un LARS menor o ningún LARS.
Por otra parte, se han descrito factores relacionados con la aparición de los síntomas, en especial la radioterapia pelviana, la altura del tumor, la escisión total o parcial del mesorrecto, el tipo de anastomosis y el uso de una ostomía de protección.2,4-6
No encontramos en las bases de datos disponibles, publicaciones nacionales que analicen en nuestra población la ocurrencia de este síndrome y los factores de riesgo que predisponen a su aparición. En tal sentido, el objetivo de la presente investigación es determinar la prevalencia del LARS en una muestra tratada por el mismo equipo profesional en diferentes instituciones y analizar los factores predisponentes para su desarrollo y severidad, buscando interpretar los mecanismos prevenibles de su aparición.
MATERIAL Y MÉTODOS
Se realizó un estudio observacional, retrospectivo y transversal de los pacientes sometidos a una resección anterior baja (RAB), en el periodo comprendido entre junio de 2012 y marzo de 2021, tratados por un integrante del mismo equipo, en el Hospital J. M. Ramos Mejía y en el Sanatorio Sagrado Corazón de la Ciudad Autónoma de Buenos Aires. Se incluyó a todos los pacientes con diagnóstico de adenocarcinoma, independientemente de su distancia al margen anal, con resección parcial o total del mesorrecto, o aquellos con lesiones sospechosas (adenomas con displasia o carcinoma in situ no resecables endoscópicamente o por abordaje transanal), en los que se realizó una anastomosis primaria extraperitoneal, con o sin ostoma de protección, que tuvieron restablecimiento del tránsito intestinal y manifestaron consentimiento para participar de la investigación.
Fueron excluidos los pacientes con resecciones locales transanales, con amputación del recto, sin confección de anastomosis, sin cierre de la ostomía considerada a priori transitoria, o aquellos en quienes esta debió rehacerse. Se excluyó además los que tuvieron resecciones mayores del colon (colectomías derechas, proctocolectomías totales o colectomías izquierdas extendidas hasta el ángulo esplénico).
Se consideró como RAB a la exéresis parcial o total del recto y del tejido graso celuloadiposo mesorrectal acompañante. Se consideró como total a la resección completa del tejido mesorrectal (TME por su sigla en inglés de Total Mesorrectal Excision), interpretada tras la revisión de los estudios preoperatorios, el protocolo quirúrgico y la fotografía de la pieza resecada. Los casos en los que no se confirmó la totalidad del volumen mesorrectal fueron categorizados como resección parcial (PME: Partial Mesorectal Excision). Se descartaron los casos en los que no hubo disección por debajo de la reflexión peritoneal.
Los datos fueron obtenidos de una base de datos de recolección prospectiva, así como de la búsqueda en archivos e historias clínicas.
Se consideró como complicación anastomótica a las fugas clínicas evidentes (salida de pus o materia fecal por el drenaje, abscesos pelvianos, fístulas rectovaginales o peritonitis), o las estenosis que requirieron dilatación.
Se realizó rutinariamente ileostomía de protección en las escisiones mesorrectales totales y en algunas parciales, de acuerdo con la decisión del cirujano. En algunos casos (edad avanzada, comorbilidades) se optó por una colostomía transversa.
Se consideró como neo-reservorio a las anastomosis lateroterminales (L-T), a las coloplastias y a los pouch colónicos.
Score de LARS
Los pacientes fueron secuencialmente encuestados entre noviembre de 2020 y abril de 2021, de forma presencial o mediante encuesta telefónica. Para la clasificación se utilizó el score de LARS traducido y validado al español.7Este consiste en 5 preguntas de opción múltiple relacionadas con el hábito evacuatorio (Tabla 1). Se clasificó como No LARS cuando el puntaje total obtenido fue de 0-20 puntos, LARS menor cuando fue entre 21 y 29 y LARS mayor entre 30 y 42.
TABLA 1: SCORE DE LARS
Puntos |
|
1. ¿Existen momentos en los que no puede controlar los gases (pedos) por el ano? |
|
No, nunca. |
0 |
Sí, menos de una vez por semana. |
4 |
Sí, más de una vez por semana. |
7 |
2. ¿Tiene alguna vez pérdida accidental de deposiciones (materia fecal) líquidas? |
|
No, nunca. |
0 |
Sí, menos de una vez por semana. |
3 |
Sí, más de una vez por semana. |
3 |
3. ¿Con qué frecuencia va al baño a evacuar (defecar, hacer caca)? |
|
Más de 7 veces por día (24 horas). |
4 |
4 a 7 veces por día (24 horas). |
2 |
1 a 3 veces por día (24 horas). |
0 |
Menos de una vez por día (24 horas). |
5 |
4. ¿Tiene que volver al baño a evacuar (defecar, hacer caca) antes de transcurrida una hora de la última deposición? |
|
No, nunca. |
0 |
Sí, menos de una vez por semana. |
9 |
Sí, más de una vez por semana. |
11 |
5. ¿Siente una necesidad tan urgente de defecar (hacer caca) que debe apurarse para llegar al baño? |
|
No, nunca. |
0 |
Sí, menos de una vez por semana. |
11 |
Sí, más de una vez por semana. |
16 |
0-20 no LARS; 21-29 LARS menor; 30-42 LARS mayor |
|
Análisis estadístico
Para la comparación de las características de los pacientes, se utilizó el test X2 para las variables categóricas, o el de Fisher cuando los eventos fueron menores de 5. Para las variables continuas se utilizó el T test, o el test de Wilcoxon cuando los datos no tuvieron distribución normal. Se realizó regresión logística para estimar el odds ratio para el LARS mayor ajustado por el impacto del sexo, uso de radioterapia, técnica de resección (TME vs. PME), fuga anastomótica y uso de neo-reservorio. Se consideró un valor estadístico significativo a una p<0,05. Para el modelo final, se incorporaron todas las variables con valor <0,1 en el test de Wald. Todos los análisis se realizaron con Stata 14.1 (StataCorp 4905® Lakeway Dr College Station, TX 77845 USA).
RESULTADOS
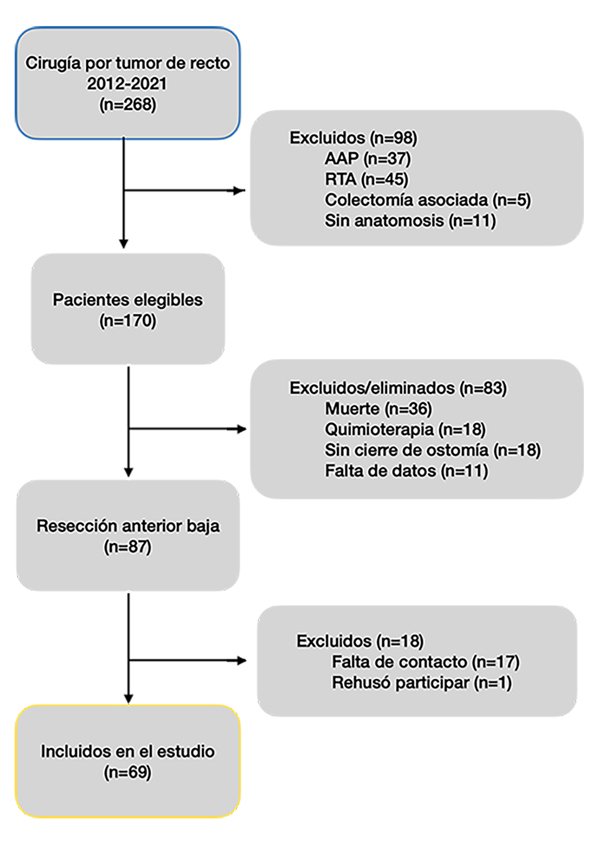
En el período estudiado, fueron operados 268 pacientes con diagnóstico de tumor del recto (adenocarcinoma o lesión sospechosa). De estos, 69 reunieron los criterios de inclusión y aceptaron participar del estudio (Fig. 1).
La mediana de seguimiento post-restablecimiento del tránsito fue de 31 (rango 3-97) meses. Los datos demográficos, tumorales y terapéuticos de los individuos incluidos pueden verse en la Tabla 2.
Para analizar la representatividad de la muestra, se compararon las principales variables entre los pacientes incluidos y excluidos. No hubo diferencias entre ambos grupos (Tabla 3).

Figura 1: Flujograma de los pacientes. Quimioterapia: incluye pacientes en tratamiento adyuvante de consolidación o paliativo. Sin cierre: complicaciones anastomóticas, decisión del paciente, comorbilidad y otra
TABLA 2: CARACTERÍSTICAS DE LOS PACIENTES
Características |
Pacientes |
Sexo, n (%) |
|
Hombres |
46 (66,6) |
Mujeres |
23 (33,3) |
Edad, mediana (rango) |
58 (18-89) |
IMC, mediana (rango) |
27,3 (17,8-39,6) |
ASA, n (%) |
|
1-2 |
41 (59) |
3-4 |
28 (41) |
Tiempo desde la reconstrucción del tránsito, meses, mediana (rango) |
31 (3-97) |
Estadio del tumor, n (%) |
|
0 |
14 (20,3)* |
I |
16 (23,2) |
II |
12 (17,4) |
III |
23 (33,3) |
IV |
4 (5,8) |
Altura tumoral, mediana (rango) |
8,6 (2,2-15) |
Radioterapia, n (%) |
31 (48) |
Tipo de anastomosis, n (%) |
|
Termino-terminal |
59 (85) |
Reservorio |
10 (15) |
Lateral |
8 (?) |
Coloplastia |
2 (?) |
Resección mesorrectal, n (%) |
|
TME |
43 (63,2) |
PME |
25 (36,8) |
* Respuesta patológica completa o adenoma con displasia.
TABLA 3: COMPARACIÓN ENTRE LOS PACIENTES EXCLUIDOS E INCLUIDOS
Incluidos (n=69) |
Excluidos (n=101) |
p |
|
Sexo n (%) |
|||
M 23 (33,3 ) |
M 42 (42 ) |
0,29 |
|
H 46 (66,6 ) |
H 59 (58 ) |
||
IMC mediana (rango) |
27,3 (17,8-39,6) |
27,1 (19,1-52,1) |
0,515 |
Altura de la lesión mediana (rango) |
8,6 (2,2-15) |
8,3 (3-15) |
0,742 |
TME n (%) |
43 (63,2 ) |
63 (62) |
0,475 |
Radioterapia n (%) |
31 (48) |
73 (72) |
0,128 |
Anastomosis con reservorio n (%) |
10 (15 ) |
17 (17) |
0,286 |
Ostomía n (%) |
61 (88 ) |
96 (95) |
0,356 |
Score de LARS
La prevalencia del LARS mayor en los pacientes encuestados fue del 40,6 % (28/69) (Tabla 4). En nuestra muestra, el sexo femenino estuvo relacionado con la presencia de LARS mayor (OR 3,4; IC 95 % 1,08-11,8). Entre los otros factores de riesgo, aquellos pacientes que recibieron radioterapia sufrieron una propensión mayor a desarrollar un LARS mayor (OR 3,8; IC 95 % 1,4-10). Los que tuvieron una TME también conllevan mayor riesgo de desarrollar el grado más severo del LARS, en comparación con quienes recibieron resecciones parciales (OR 4,1; IC 95 % 1,06-15,9). La altura del tumor debió excluirse por colinealidad con la variable PME/TME. En el análisis bivariado, las complicaciones de las anastomosis, así como haber transcurrido un año desde la última cirugía, tuvieron diferencia estadística, que se perdió al ajustar por las otras variables (OR 6,3;IC 95 % 0,7-58 y OR 0,2; IC 95 % 0,06-1,2, respectivamente). El riesgo de desarrollar un LARS mayor no estuvo asociado con la edad, con la confección de un reservorio (coloplastia o anastomosis L-T, ya que no se confeccionó ningún pouch colónico en la serie), con una anastomosis coloanal manual, ni con el uso de una ostomía transitoria (Tabla 5).
TABLA 4: PREVALENCIA DEL LARS EN LA SERIE
No LARS |
LARS menor |
LARS mayor |
22 (31,9 %) |
19 (27,5 %) |
28 (40,6 %) |
TABLA 5: FACTORES DE RIESGO PARA LARS MAYOR
Factor de riesgo |
LARS mayor* |
p Cruda |
p ajustada |
Sexo |
0,048 |
0,048 |
|
M |
1,00 (ref) |
||
F |
3,4 (1,08-11,8) |
||
Técnica de resección |
0,018 |
0,04 |
|
TME |
1,00 (ref) |
||
PME |
4,1 (1,06-15-9) |
||
Radioterapia |
0,037 |
0,008 |
|
No |
1,00 (ref) |
||
Sí |
3,8 (1,4-10) |
||
Complicación anastomosis |
0,021 |
0,201 |
|
No |
1,00 (ref) |
||
Sí |
2,4 (0,6-9,7) |
||
Reservorio |
0,888 |
||
No |
1,00 (ref) |
||
Sí |
1,1 (0,2-4,3) |
||
Ostomía |
0,105 |
||
No |
1,00 (ref) |
||
Sí |
5,9 (0,6-51,2) |
||
Anastomosis coloanal |
0,102 |
||
No |
1,00 (ref) |
||
Sí |
6,3 (0,7-58) |
||
Tiempo desde la cirugía |
0,035 |
0,088 |
|
< 1 año |
1,00 (ref) |
||
> 1 año |
0,2 (0,06-1,2) |
* Los datos se expresan como OR (IC 95 %).
DISCUSIÓN
La cirugía del cáncer del recto ha ampliado sus horizontes en las últimas décadas. Nuevos esquemas de tratamiento acercaron a los pacientes a un incremento en las tasas de preservación esfinteriana, e inclusive a la preservación del órgano.
Sin embargo, independientemente de los resultados oncológicos, los pacientes sometidos a cirugía radical con anastomosis bajas desarrollan molestos síntomas evacuatorios, a menudo incapacitantes. La urgencia, la incontinencia y, sobre todo, la fragmentación, alteran la calidad de vida de estos pacientes, aunque estos síntomas mejoran con el paso del tiempo, especialmente transcurrido el primer año.3
A modo de objetivar el trastorno, diferentes modalidades de encuesta fueron validadas en los últimos años, destacando el score desarrollado por el Memorial Sloan Kettering Cancer Center (MSKCC score),8 y el LARS score. Este último, publicado por Emmersten y Laurberg,9 evalúa las diferentes esferas de la evacuación (continencia, frecuencia y urgencia) mediante 5 preguntas, otorgando un mayor puntaje a los pacientes que desarrollan más frecuentemente estos síntomas. Validado en múltiples poblaciones e idiomas,10 debido a su facilidad y aplicabilidad y a su correlato con las encuestas de calidad de vida, ha ganado cada vez más adhesiones.
La prevalencia del 40 % de LARS mayor en nuestra casuística es similar a la de diferentes publicaciones. Reportes de Dinamarca y otros países europeos, mostraron una tasa de entre el 41 y el 52 % de LARS mayor.4,11 Para tratarlo, los diferentes esquemas no han ganado consenso en la práctica, debido a su falta de efectividad o a la inaccesibilidad debida a los costos. La irrigación transanal, el biofeedback y la neuromodulación sacra son los que cuentan con mayor evidencia de resultados.12-18
En virtud de la dificultad para tratar los intensos síntomas en estos individuos, se vislumbra prometedor determinar condiciones que puedan prevenir su aparición.
Un único estudio preliminar prospectivo y aleatorio, de 2017, que utilizó el biofeedback previo al cierre de las ostomías a modo de prevenir los síntomas funcionales, no encontró beneficios en comparación con los individuos que no realizaron el tratamiento. Han transcurrido 4 años y los resultados definitivos no fueron publicados.14
Por otra parte, dentro de los factores que tienen un peso relevante en la generación del LARS mayor, se reconocen la asociación del uso de radioterapia pelviana y la extensión de la resección en el recto.5 La radioterapia actúa interfiriendo con la inervación de la unidad rectoanal, que depende principalmente del plexo nervioso hipogástrico, conduciendo a una alteración de las señales que llevan a un satisfactorio proceso evacuatorio, así como a la alteración de la compliance del muñón rectal remanente.19 Aun mediante una técnica quirúrgica meticulosa que preserve la indemnidad de los nervios autonómicos, la resección completa del recto (TME vs. PME), íntimamente relacionada con la altura del tumor, conduce a la anulación de la función de reservorio propia del órgano. Todo esto, sumado a la excitabilidad colónica producida por la denervación quirúrgica, contribuiría a la fragmentación o clustering, el síntoma de mayor peso según el relato de los pacientes. Nuestros resultados mostraron que tanto la radioterapia, como la TME, son los dos factores que más contribuyen a la aparición del grado más severo de este síndrome, aún ajustados por el resto de las variables.
A la hora de la toma de decisiones por el equipo multidisciplinario, reducir la tasa de recurrencia local constituye la meta máxima en la elección del tratamiento radiante en los casos de cáncer del recto localmente avanzado. Del mismo modo, el cirujano colorrectal decidirá la TME intentando asegurar los márgenes de resección y la calidad de la pieza operatoria. En síntesis, no serán los resultados funcionales los que pesarán determinantemente en la toma de decisiones.
Entre los factores prevenibles accesibles a la hora de tratar a estos pacientes, está el tipo de anastomosis. Desde la revisión Cochrane, de 2008,20 la recomendación en favor de los reservorios colónicos, mediante pouch en J idealmente, o una anastomosis lateral de no poder confeccionarlo, ha encabezado las opciones. Sin embargo, estudios prospectivos y aleatorios recientes no mostraron diferencias en términos de complicaciones anastomóticas ni resultados funcionales (utilizando el FISI y el score MSKCC), en la comparación del pouch colónico en J con las anastomosis laterales y termino-terminales.21-23 Confeccionar un pouch colónico no siempre es factible, especialmente en las anastomosis bajas en las que la longitud del colon y su adecuada perfusión resultan determinantes. Si bien no realizamos bolsa colónica en J en ningún caso, la comparación entre anastomosis terminales y laterales con reservorio o coloplastia, no tuvo diferencias en la aparición del LARS mayor. La evidencia disponible de los trabajos mencionados nos permite estimar que la confección de una anastomosis directa terminoterminal es segura y no empeora las tasas de complicaciones, ni de resultados funcionales.
Aunque su importancia decae transcurrido un año del cierre,24 el uso de una ostomía de protección y el tiempo transcurrido hasta el cierre de la misma, se correlacionaron con la aparición de un LARS mayor, de acuerdo con un reciente metaanálisis.6 Si bien resultaría improbable que un cirujano tome la decisión de realizar una ileostomía o colostomía transitorias basado en los eventuales resultados funcionales, nuestro modelo falló en encontrar esta asociación. Lo mismo sucedió con las anastomosis coloanales manuales.
Las filtraciones anastomóticas también se han postulado como un factor contribuyente al LARS mayor. El estudio de Hain et al.25 encontraron que las filtraciones sintomáticas, estuvieron relacionadas de forma independiente con la aparición de un LARS mayor. De igual forma que nuestros resultados, el resto de las publicaciones no alcanzó a demostrar esta diferencia.
La mayoría de las investigaciones excluyen del análisis a los pacientes con menos de un año de la reconstrucción del tránsito, por tener mayor proporción de LARS mayor. En nuestra serie, con gran variabilidad en el tiempo transcurrido (mediana de 31 meses, rango 3-97), la diferencia perdió poder en el análisis multivariado, aunque es probable que un n mayor hubiera podido alcanzarla (error tipo II).
Llamativamente, el género femenino tuvo un peso significativo en nuestro modelo. Este resultado es similar al trabajo de Breghendal et al.4 En la mayoría de los otros estudios, no hay diferencia entre los sexos.2 Un reporte de la prevalencia de LARS en la población general, sí mostró una preeminencia por el sexo femenino.26 Se requerirá de nuevas investigaciones para confirmar este hallazgo en nuestra población.
Limitaciones
Este trabajo tiene importantes limitaciones. En primer lugar, se trata de un estudio retrospectivo y con número muestral pequeño, lo que puede explicar algunas diferencias no encontradas al procesar el análisis estadístico. Si bien la comparación de las características entre los pacientes incluidos y excluidos mostró que nuestra muestra es representativa, la pérdida de casos susceptibles para el análisis también fue importante. Otra limitación fue no llevar asociado un análisis de la calidad de vida.
CONCLUSIONES
Los resultados de nuestro estudio muestran una prevalencia de LARS mayor del 40,6 %, en concordancia con lo referido por las publicaciones internacionales. Entre los factores predisponentes, destaca la relación con la radioterapia y la escisión total del mesorrecto, variables de peso en la determinación del síndrome. De las pocas medidas modificables por el cirujano, excluidas las decisiones basadas en criterios oncológicos, la selección del tipo de anastomosis no parece ser determinante. Por lo tanto, de acuerdo con la evidencia disponible en este estudio, una vez decidida la resección del recto no parece haber conductas que puedan prevenir la aparición del LARS mayor.
REFERENCIAS