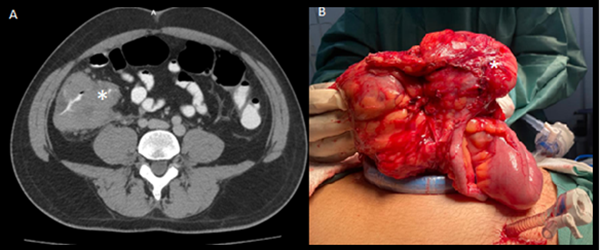
Figura 1: A) Tomografía del abdomen con doble contraste que muestra una masa en el ciego (*). B) Imagen intraoperatoria posterior a la liberación del colon derecho por laparoscopía, previa a la resección quirúrgica.
Linfoma no Hodgkin primario del colon. Reporte de dos casos y revisión de la literatura
David Figueroa-Bohórquez,1 Nairo Senejoa,2 Roberto Rodríguez,3 Carlos Martínez,4 Sergio Ardila,5 Julián Barreto,6 Adalberto Gómez,7 César Caro8
Hospital Central de la Policía. Bogotá D.C, Colombia.
David Mauricio Figueroa-Bohórquez: 0000-0003-2858-0118
Nairo Javier Senejoa Nuñez: 0000-0002-9785-8534
Roberto José Rodríguez Flórez: 0000-0002-7994-1107
Carlos Edmundo Martínez Jaramillo: 0000-0002-4982-8955
Sergio Felipe Ardila Robles: 0000-0002-6076-7698
Julián Barreto: 0000-0001-6557-9146
Adalberto Gómez Rueda: 0000-0002-3887-1026
Cesar Caro: 0000-0001-6218-4392
David Mauricio Figueroa Bohórquez
damfigueroabo@unal.edu.co
Los autores declaran ausencia de conflictos de interés.
RESUMEN
Introducción: El linfoma primario de colon representa menos del 1% de todas las neoplasias colorrectales y el colon derecho es el segmento más frecuentemente afectado. La variante B difusa de células grandes es el tipo histológico más común.
Objetivo: Describir dos pacientes con linfoma primario de colon y realizar una revisión de la bibliografía disponible, enfatizando el abordaje diagnóstico y las indicaciones de manejo quirúrgico.
Pacientes y método: Se presentan dos pacientes de 38 y 62 años con linfoma primario de colon. Uno de ellos requirió manejo quirúrgico de emergencia, mientras que el otro presentó clínica durante varias semanas, lo que permitió el seguimiento en la consulta externa. Ambos fueron manejados con resección quirúrgica y quimioterapia posoperatoria.
Discusión: El 70 % de los linfomas primarios de colon ocurren en el colon derecho, la presentación en el colon descendente y recto se asocia con un peor pronóstico. La inmunosupresión y la enfermedad inflamatoria intestinal se consideran los factores de riesgo más importantes en el desarrollo de linfomas de colon primarios. Los síntomas de presentación más frecuentes son dolor, masa abdominal, pérdida de peso y hemorragia digestiva. En pacientes con lesiones resecables, el mejor abordaje terapéutico es la combinación de resección quirúrgica y quimioterapia posoperatoria.
Conclusiones: El linfoma primario de colon es una entidad poco frecuente que requiere un abordaje multidisciplinario. En pacientes que no debutan con urgencia quirúrgica, la tomografía abdominal y la PET-TC aportan información valiosa para definir la viabilidad y extensión de la resección quirúrgica, que debe complementarse con quimioterapia posoperatoria.
Palabras clave: Linfoma; Extranodal; Colon; Cirugía; Quimioterapia
SUMMARY
Introduction: Primary colon lymphoma accounts for less than 1% of all colorectal neoplasms and the right colon is the segment most frequently affected. Diffuse large B cell is the most common histological variant.
Objective: To describe two patients with primary colon lymphoma and to review the available bibliography, emphasizing the diagnostic approach and indications for surgical management.
Patients and methods: Two patients, 38 and 62 years old, with primary colon lymphoma are presented. One of them required emergency surgical management, while the other presented symptoms for several weeks, which allowed follow-up in the outpatient clinic. Both were managed with surgical resection and postoperative chemotherapy.
Discussion: Seventy percent of primary colon lymphomas occur in the right colon, presentation in the descending colon and rectum is associated with a worse prognosis. Immunosuppression and inflammatory bowel disease are considered the most important risk factors in their development. The most common presenting symptoms are pain, abdominal mass, weight loss, and gastrointestinal bleeding. In patients with resectable lesions, the best treatment approach is the combination of surgical resection and postoperative chemotherapy.
Conclusions: Primary colon lymphoma is a rare entity that requires a multidisciplinary approach. In patients who do not present with surgical urgency, abdominal tomography and PET-CT provide valuable information to define the feasibility and extent of surgical resection, which should be complemented with postoperative chemotherapy.
INTRODUCCIÓN
Los linfomas son una entidad maligna que se origina a partir de células hematológicas del linaje linfoide. Pueden tener un comportamiento indolente o agresivo, manifestándose con linfadenopatías o tumores sólidos que pueden comprometer cualquier órgano del cuerpo.1 El 90 % corresponden a linfomas no Hodgkin, que pueden tener manifestaciones extranodales en un tercio de los casos y comprometer el tracto gastrointestinal en un 5-15 %.2 El estómago es el órgano que más frecuentemente está comprometido por esta patología, aportando cerca del 50 % de los casos, seguido por el intestino delgado y esófago.3
Los linfomas corresponden al 0,2-0,8 % de todas las neoplasias colorrectales, son más comunes en el colon derecho y el tipo histológico más frecuente es el linfoma difuso de células B grandes (DLBCL, por su sigla en inglés).2,3
El objetivo de este estudio es describir los casos de dos pacientes con linfoma del colon derecho tratados quirúrgicamente, así como hacer una revisión de la bibliografía, haciendo énfasis en el abordaje diagnóstico y en las indicaciones de manejo quirúrgico de los linfomas primarios del colon (LPC).
PRESENTACIÓN DE CASOS
CASO 1
Hombre de 38 años sin antecedentes médicos de importancia, quien consulta al servicio de urgencias por dolor abdominal en fosa ilíaca derecha asociado a astenia y adinamia. Refiere cambios en el hábito intestinal de un mes de evolución asociados a melenas ocasionales, sin pérdida de peso. En el examen inicial se encuentra taquicárdico, pálido y con dolor leve a la palpación en hemiabdomen derecho, sin signos de irritación peritoneal. En los exámenes de ingreso se encuentra con anemia severa y sangre fresca en heces. No hay signos de respuesta inflamatoria sistémica. Se realiza estabilización hemodinámica y se brinda soporte transfusional.
Se le realizó una tomografía contrastada del abdomen y pelvis, en la que se encuentra un engrosamiento irregular de las paredes del ciego, colon ascendente e íleon terminal, sin cambios estructurales de la grasa pericecal, con adenopatías por compromiso secundario. Con estos hallazgos se decidió realizar una colonoscopía, que reporta una masa de forma polipoidea en el ciego que cubre casi el 96 % de la luz e impide ver la válvula ileocecal y el orificio apendicular. La mucosa del colon ascendente, transverso y descendente es normal.
Dada la inminencia de obstrucción y el sangrado digestivo bajo asociado, se decidió llevar al paciente a hemicolectomía derecha por laparoscopía, con anastomosis ileotransversa extracorpórea. No había líquido libre en cavidad ni lesiones hepáticas metastásicas. Evolucionó de forma satisfactoria y se dio egreso. El resultado de patología confirmó que se trata de un DLBCL (Fig. 1).

Figura 1: A) Tomografía del abdomen con doble contraste que muestra una masa en el ciego (*). B) Imagen intraoperatoria posterior a la liberación del colon derecho por laparoscopía, previa a la resección quirúrgica.
CASO 2
Paciente masculino de 62 años de edad, sin antecedentes de importancia. Consulta por un cuadro clínico de 6 meses de evolución que consiste en pérdida de 8 kg de peso asociado a dolor posprandial leve, a nivel epigástrico, que se irradia a la región dorsolumbar. Tres meses después del inicio de los síntomas, se asocia hematoquecia, distensión abdominal y progresión de la intensidad del dolor, por lo que inicia manejo con opioides. Reportó una colonoscopía que muestra una masa de 6 cm con áreas necróticas y estigmas de sangrado en la unión del colon ascendente y el ciego, por encima de la válvula ileocecal, con reporte de patología que informó material necroinflamatorio agudo con sobreinfección bacteriana, sin observar lesión tumoral. Al examen físico, sin hallazgos de anormalidad. Se realiza una nueva colonoscopía que muestra tumor en tercio medio del colon ascendente de aspecto mamelonado de 60 × 60 × 60 mm que compromete el 100 % de la circunferencia y obstruye la luz en un 75 % con un patrón glandular Vn de Kudo. El reporte de patología mostró una mucosa colónica con infiltración de la lámina propia por una neoplasia constituida por células grandes, de cromatina grumosa, algunas de núcleos con convolución, hallazgos sugestivos de infiltración de linfoma de célula grande. En la tomografía abdominal se identifica una lesión sólida expansiva en el tercio medio del colon ascendente, con compromiso transmural de aspecto neoplásico, de 47 mm de diámetro mayor, con múltiples adenomegalias en el mesocolon, además de un conglomerado ganglionar de 50 mm en estrecha relación con la segunda y tercera porción del duodeno. La tomografía del tórax no mostró lesiones y en la endoscopía de vías digestivas altas fue evidente una compresión extrínseca leve en la segunda porción del duodeno. Se lleva a hemicolectomía derecha ampliada por laparoscopía, con hallazgos de un tumor de 12 × 12 × 12 cm en el tercio proximal del colon ascendente que macroscópicamente infiltra la serosa, asociado a un conglomerado ganglionar de 50 × 50 × 50 mm en el nacimiento de los vasos íleo-ceco-apendículo-cólicos adherido a la segunda y tercera porción del duodeno, que dificulta su disección por laparoscopía, por lo que se convierte a laparotomía. Evoluciona de forma satisfactoria y se da egreso. El reporte de patología mostró DLBCL, de origen centrogerminal por inmunohistoquímica, con un conglomerado ganglionar y 39/50 ganglios linfáticos pericolónicos comprometidos por el tumor (Fig. 2).

Figura 2: A) Tomografía del abdomen con doble contraste que muestra una masa en el colon ascendente (*) asociada a adenomegalias regionales (flecha). B) Imagen del espécimen quirúrgico con masa en el colon ascendente y meso engrosado. Vasos cólicos derechos marcados con sedas.
DISCUSIÓN
El LPC no Hodgkin es una entidad infrecuente y que suele tener una presentación variable, desde indolente hasta presentarse en estadios avanzados de la enfermedad requiriendo un manejo quirúrgico de urgencia.4 El 50 % de la enfermedad colorrectal se localiza en el ciego y el 20 % en el colon ascendente. Su presentación en el colon descendente y recto se asocia a un peor pronóstico con una supervivencia en promedio 68 meses menor que cuando el compromiso es del colon derecho.4 La inmunosupresión y la enfermedad inflamatoria intestinal se consideran los factores de riesgo más importantes en el desarrollo del linfoma colorrectal.5 La edad promedio de presentación es de 55 años y ser mayor de 60 años es un factor de mal pronóstico.2,4
Los síntomas más frecuentes de presentación, según las series de casos descritas, son dolor abdominal (71,4 %), masa abdominal (54 %), pérdida de peso (43 %), sangrado digestivo (27 %), cambios del hábito intestinal (14,3 %), obstrucción intestinal (9,6 %) y anemia (7,6 %).4,5
En el primer caso descrito, el paciente cursó con sintomatología de rápida instauración, con inminencia de obstrucción intestinal y sangrado digestivo bajo con requerimiento de soporte transfusional, que indicaron el manejo quirúrgico. En el segundo caso, la sintomatología fue de lenta progresión, cursando con pérdida de peso, dolor abdominal y sangrado digestivo bajo no masivo.
Para el diagnóstico de LPC, es necesario descartar un linfoma sistémico con afectación del colon, ya que su tratamiento y pronóstico son diferentes. En 1961 el Dr. Dawson propuso unos criterios que se deben cumplir en su totalidad para que pueda diagnosticarse un LPC (Tabla 1).5,6 En la actualidad, estos criterios son cada vez menos usados dado el progreso en estudios diagnósticos que facilitan el estudio de los linfomas de alto grado.
Tabla 1: Criterios de Dawson para el diagnóstico del linfoma primario del colon.6
1. Ausencia de linfadenopatías periféricas. |
| 2. Ausencia de adenopatías mediastinales en la radiografía del tórax. |
| 3. Frotis de sangre periférica normal. |
| 4. Compromiso único del tracto gastrointestinal y los ganglios regionales. |
| 5. Ausencia de compromiso hepático y esplénico, excepto por el compromiso por extensión local de un tumor gastrointestinal. |
En 1971, en Ann Arbor, Michigan, se crea un sistema de estadificación para el linfoma Hodgkin, que posteriormente se utilizó también para el linfoma no Hodgkin.7 En 1977, se modifica la clasificación de Ann Arbor, creando una estadificación específica para linfomas no Hodgkin del tracto gastrointestinal (Tabla 2).8
Tabla 2: Estadificación modificada del linfoma no Hodgkin primario gastrointestinal.8
ESTADIO I: Tumor confinado al tracto gastrointestinal. |
| ESTADIO II-1: Tumor afecta ganglios regionales. |
| ESTADIO II-2: Afectación incluye más allá de los ganglios regionales. |
| ESTADIO III: Tumor con afectación de otros órganos del abdomen (hígado, bazo), o más allá del abdomen (tórax, médula ósea). |
El estudio inicial de un paciente con sospecha de linfoma del tracto gastrointestinal debe estar acompañado de pruebas para VIH y demás enfermedades de transmisión sexual.5En los casos que debutan sin urgencia quirúrgica, se recomienda la realización de biopsias con suficiente contenido histológico, siendo ideal la biopsia Trucut. Con el fin de aumentar el rendimiento diagnóstico, se recomienda dividir la muestra en dos, una parte en formol para análisis histopatológico y de inmunohistoquímica y la otra en solución salina para la realización de citometría de flujo,.9
Estudios imagenológicos
En el abordaje diagnóstico por imagen, la tomografía del abdomen contrastada se considera la de mayor utilidad, debido a su detalle anatómico, bajos requerimientos técnicos y corto tiempo de adquisición, así como por su capacidad de identificación de adenopatías locorregionales, estimación del tamaño y extensión de la lesión.10 Aunque no hay hallazgos patognomónicos, se han descrito varios patrones de presentación. En una serie de 15 casos, se agruparon en 3 estos patrones: masa focal, infiltrante focal e infiltrante difuso.11 Sin embargo, ninguno de los 3 es característico o excluyente, observándose más frecuentemente un engrosamiento circunferencial y concéntrico de las paredes del colon. Esto concuerda con lo presentado en el primer caso, el cual muestra extensión al ciego y la válvula ileocecal, sin compromiso desmoplásico de la grasa, con disminución de la amplitud de la luz intestinal sin condicionar obstrucción. Estas lesiones presentan también, en menor medida, comportamiento de masa exofítica, nodularidad de la mucosa o engrosamiento de pliegues, lo que genera ocasionalmente estenosis focales, dilataciones aneurismáticas, ulceración, formación de fístulas e intususcepción. En caso de presentarse extensión extracolónica o importante compromiso ganglionar, se puede observar el efecto de masa sobre estructuras vecinas, como en el segundo caso a nivel duodenal.12
La diferenciación con el adenocarcinoma del colon puede ser compleja, sin embargo, la existencia de márgenes bien definidos en la lesión, la ausencia de compromiso de estructuras adyacentes y la perforación sin reacción desmoplásica, ayudan a su distinción. Pese a que ambos podrían causar estenosis segmentaria, la obstrucción intestinal es menos frecuente en el linfoma, por la ausencia de reacción desmoplásica adyacente y la infiltración predominantemente submucosa que condiciona debilidad de la pared muscular interna.13
El rendimiento de la resonancia magnética es limitado, particularmente en el compromiso del colon ascendente o ciego, aunque cobra mediana importancia en las lesiones del recto. No obstante, no existen hallazgos que lo diferencien de otras lesiones tumorales de esta localización.14
El papel del PET/CT en el diagnóstico es incierto, siendo frecuente encontrar focos de hipercaptación a nivel del ciego en patología inflamatoria benigna como colitis amebiana, enfermedad intestinal inflamatoria, entre otros. Se ha propuesto que valores de SUV máx. (valores de captación estándar máxima, por su sigla en inglés) mayores que 11 g/ml podrían discriminar entre lesiones benignas y malignas sin que exista un parámetro que diferencie el comportamiento metabólico entre las lesiones neoplásicas de tipo linfoide del más prevalente adenocarcinoma del colon, por lo que debe interpretarse siempre en conjunto con los hallazgos anatómicos15. El PET/CT cobra gran importancia en pacientes que ya cuenten con el diagnóstico de LPC, para lograr realizar una adecuada estadificación tumoral. Sin embargo, es necesario tener en cuenta la pobre captación de 18DFG de los linfomas tipo B de bajo grado y de los linfomas marginales.16
Estudios endoscópicos
La colonoscopía tiene un rol muy importante en las neoplasias del colon, pues además de describir la lesión y dar idea sobre la extensión, permite la toma de biopsias para clasificación histológica, sin embargo, son pocos sus reportes en LPC y no existe un consenso para su clasificación endoscópica.
De manera general, de acuerdo a los hallazgos endoscópicos de la mucosa colónica, se pueden distinguir cinco patrones de criptas según la clasificación de Kudo: tipo I y II que son no neoplásicos, tipo IIIS, IIIL y IV que corresponden a neoplasias intramucosas y tipo V, con criptas distorsionadas (VI) o superficie amorfa (VN), que sugieren carcinoma.17
Un estudio de LPC en Korea, analizó las colonoscopías de 78 pacientes.18 Según los hallazgos endoscópicos, tan solo se sospechó esta patología en el 15,4 % de los estudios. El 80,7 % de los pacientes se diagnosticó con alguna variante de linfoma de células B y el 19,3 % con linfoma de células T. Según sus hallazgos endoscópicos, los autores clasificaron las lesiones en 5 categorías: masa polipoide (46,2 %), masa polipoide ulcerada (23,1 %), masa úlceroinfiltrativa (11,5 %), masa ulcerativa (12,8 %), masa infiltrativa (6,4 %). En los linfomas de células T, el tipo endoscópico más frecuente (80 %) fueron las lesiones infiltrativas o úlceroinfiltrativas, mientras que los linfomas B en el 54 % se manifestaron como masas polipoideas, según lo descrito en la literatura, principalmente prevalente en los subtipos MALT de células del manto y en la poliposis linfomatosa 19.
El rol de la ultrasonografía endoscópica está por establecerse en esta patología. Se conoce su buen rendimiento para definir la extensión de la lesión y el compromiso ganglionar locoregional. Los principales hallazgos suelen ser engrosamiento de la segunda y tercera capa de la pared intestinal, asociado con nódulos hipoecogénicos 19.
Hallazgos de patología
El DLBCL representa el tipo más común de linfoma no Hodgkin y se puede dividir en variantes morfológicas, variantes de células de origen y subtipos clínicos biológicamente distintos. A su vez, puede ser el resultado de la transformación de un linfoma de bajo grado preexistente. En el tracto gastrointestinal, puede representar hasta dos tercios de los casos de linfomas. Macroscópicamente, se observan lesiones ulceradas, elevadas o infiltrantes que en algunas en ocasiones pueden llevar a la perforación.20
Además de formar masas tumorales, las células neoplásicas linfoides infiltran en patrón intersticial, lo que altera la arquitectura histológica usual, con la separación y pérdida de estructuras especializadas normales como las glándulas y criptas intestinales, llegando a veces hasta el epitelio donde generan ulceración. Citológicamente, el DLBCL presenta células linfoides con tamaño grande a intermedio, con características morfológicas de centroblastos, inmunoblastos o intermedias entre ambos.21
El inmunofenotipo del DLBCL está dado por la expresión de CD45 y marcadores celulares Pan-B como CD20, CD22, CD79a y PAX5. Los demás marcadores presentan una reactividad heterogénea con variabilidad en su expresión. Por ejemplo, el CD10 se expresa entre 25 y 50 %, BCL6 entre 50 y 90 %, BCL2 cerca del 50 % y MUM1 entre 35 y 65 %. La expresión de Ki-67 es muy variable y oscila entre 30 % y 95 %.22
Existen algoritmos para la discriminación inmunohistoquímica entre células B del centro germinal (GCB), como en el segundo caso clínico; y células B del centro activado no germinal (non-GCB), como en el primero. Uno de los más usados es el algoritmo de Hans, que usa los marcadores CD10, BCL6 y MUM1 para esta aproximación, tomando la expresión como positiva si se presenta en más del 30 % de las células tumorales. Con CD10+ o CD10-/BCL6+/MUM1- indican un fenotipo GCB y con CD10-/BCL6- o CD10-/BCL6+/MUM1+ indican un fenotipo non-GCB.23
El DLBCL intestinal es genéticamente heterogéneo, algunos con presencia de translocación t 14,18 que involucra los genes IGH y BCL2. Otras alteraciones que pueden encontrarse son t (8,14), que involucran los genes IGH y C-MYC t 11,18, que involucran los genes API2 y MALT1 y anomalías del BCL6 (Fig. 3).20

Figura 3: Linfoma B de célula grande, de centro no germinal.
Tratamiento
Es necesario diferenciar dos escenarios de presentación clínica, urgente y no urgente. En el primero, como el del primer caso presentado, los pacientes asisten con clínica de obstrucción intestinal, sangrado que causa anemia o abdomen agudo. En estos el manejo quirúrgico será la opción de inicial, buscando la resección completa de la lesión con anastomosis intestinal, en los escenarios que se considere factible, siendo la derivación intestinal, una opción válida.24 El abordaje recomendado es el abierto, a menos que se cuente con la experiencia suficiente para realizar un abordaje laparoscópico o video asistido, que según reportes recientes es técnicamente posible y no se diferencia en morbimortalidad con la cirugía abierta, pero tiene una recuperación más rápida y menor estancia hospitalaria.24
El tratamiento de los linfomas del colon en el escenario no urgente, especialmente el rol del manejo quirúrgico, genera gran controversia entre los expertos.25 Son varios los estudios que han sugerido el beneficio del manejo quirúrgico en comparación con el manejo médico, con mayor evidencia en los estadios tempranos de la enfermedad, en el linfoma difuso de células B y en los tumores del colon derecho.18,26 El grado de complicaciones reportado con el manejo quirúrgico o la quimioterapia oscila para ambos entre el 20 y 23 %.26 En cuanto a las complicaciones postoperatorias, la mayoría se catalogan en los grados I-III de la clasificación Clavien-Dindo, con bajas tasas de mortalidad posoperatoria temprana y 16 % de reingresos hospitalarios a los 30 días.5 El análisis de la base de datos “University HealthSystem Consortium Clinical Database/Resource Manager (UHC CDB/RM)” demostró en forma estadísticamente significativa una menor tasa de complicaciones en las cirugías del colon derecho comparadas con las del colon izquierdo (26,8 vs. 28,3 %, p < 0,05).27
Con el manejo exclusivo de quimioterapia se han descrito complicaciones principalmente en los tumores formadores de masa del colon derecho, reportándose perforación intestinal hasta en el 6 %, así como sepsis asociada a quimioterapia que llega a ser la causa de mortalidad de hasta el 20 % de los pacientes que fallecen por esta patología.5
Los mejores resultados de supervivencia a largo plazo se han encontrado con la combinación del manejo quirúrgico seguido por la quimioterapia. El principal factor de riesgo para recaída y mortalidad es la presencia de compromiso ganglionar en el momento del diagnóstico, con supervivencia a 5 años de hasta 88-93 %.28 En un estudio retrospectivo realizado en Taiwán con 29 pacientes, se logró comparar el uso de quimioterapia con el manejo quirúrgico seguido por quimioterapia, encontrando una estadísticamente significativa mayor supervivencia global a 3 y 5 años con la terapia combinada.29
Si bien el rol del manejo quirúrgico en los LPC espera ser completamente aclarado, dependiendo principalmente de la histología, estadificación y localización tumoral, el manejo quirúrgico inicial es aceptado por gran número de expertos. Esto se debe a que proporciona información pronóstica importante (incluyendo histología, extensión y estadio del tumor), ofrece una posibilidad de cura con o sin terapia adyuvante y previene complicaciones como hemorragia, obstrucción o perforación.2 El manejo quirúrgico como monoterapia se podría considerar en escenarios tempranos de las variables indolentes de los linfomas, como son las variantes MALT y los foliculares de bajo grado; sin embargo, para las variantes agresivas, es necesario completar el tratamiento con quimioterapia adyuvante.5,29,30
Para los tumores agresivos y de rápida proliferación que se escapen del manejo quirúrgico, se recomienda el manejo con quimioterapia primaria.29 El régimen R CHOP ha sido el preferido para el manejo de los linfomas B de grado moderado y alto por los beneficios que tiene respecto a los esquemas de quimioterapia sin anticuerpos monoclonales en cuanto a mayores tasas de respuesta y de supervivencia libre de enfermedad y global, inclusive para población mayor.24,29,30
CONCLUSIONES
El LPC es una entidad rara, que requiere un abordaje multidisciplinario. Se presentan dos casos clínicos de DLBCL, uno centro germinal, con manifestaciones de lenta instauración, que permitió una resección quirúrgica programada y el otro de centro no germinal, con un tiempo más corto de sintomatología, que requirió cirugía de urgencia.
En los pacientes en quienes se sospeche esta patología y no debuten con abdomen agudo, el estudio inicial debe incluir una tomografía contrastada del abdomen, seguida por una colonoscopía con toma de biopsias.
Una vez confirmado el diagnóstico, excepto en el linfoma de bajo grado, se recomienda una PET-CT para estadificación tumoral y posteriormente una terapia combinada con cirugía y quimioterapia postoperatoria, si las condiciones del paciente lo permiten.
REFERENCIAS
COMENTARIO
El estudio presentado resulta de interés dada la infrecuente presentación del linfoma colónico primario. Los autores describen la presentación clínica, el abordaje diagnóstico y la resolución quirúrgica de dos casos sin mayor información acerca de la evolución oncológica de los mismos. Un punto a destacar, como marcan los autores, es el valor de la inmunohistoquímica en el diagnóstico diferencial con otras neoplasias colorrectales, en muchos casos indistinguibles en su presentación clínica. Este estudio define el tratamiento adyuvante posterior y el pronóstico de los pacientes. La revisión de la literatura es completa y se presenta de forma prolija y actualizada abarcando los diferentes aspectos de una patología infrecuente.
Maximiliano Bun
Hospital Alemán. CABA, Argentina.