10. Complicaciones Intraoperatorias y Postoperatorias de la Resección Total de Mesorrecto Transanal (taTME)
REV ARGENT COLOPROCT | 2019 | VOL. 30, N° 3: 58-64
RELATO ANUAL
CAPÍTULO 10
Complicaciones Intraoperatorias y Postoperatorias de la Resección Total de Mesorrecto Transanal (taTME)
La taTME surge con la intención de sortear algunas de las dificultades descriptas de la cirugía miniinvasiva del recto. Como fue mencionado en capítulos anteriores, estas dificultades se hacen especialmente evidentes en pacientes portadores de tumores voluminosos de recto medio e inferior, con pelvis estrecha e índice de masa corporal elevado. Sin embargo, como suele ocurrir con el surgimiento de una nueva técnica quirúrgica, la taTME ha sido asociada a complicaciones específicamente relacionadas con este tipo de abordaje, las cuales generan, aún hoy, cierta preocupación en la comunidad quirúrgica1,2.
Una nueva técnica quirúrgica requiere, en primera instancia, un conocimiento detallado de la anatomía. En el caso de la taTME, este concepto cobra mayor importancia ya que ‒si bien los cirujanos colorrectales están familiarizados con ella‒ el cirujano debe abordarla desde un ángulo completamente distinto (de abajo hacia arriba), lo cual puede llevar a malas interpretaciones de esta. Recientemente, sobre un total de 1594 pacientes, el International TaTME Registry informó una morbilidad global del 30,4% y un índice de reoperación del 8%. Las complicaciones intraoperatorias alcanzaron un 30,6%, debido principalmente a problemas técnicos durante el tiempo transanal (18,0%). Trescientos treinta pacientes presentaron lesiones de órganos (1,8%) incluyendo la uretra, el recto, la vagina, la vejiga y los nervios hipogástricos, y 67 (4,2%) presentaron hemorragias pelvianas3. La tabla 1 sintetiza los hallazgos de dichas complicaciones.
Tabla 1: Complicaciones intraoperatorias asociadas a la taTME según el International taTME Registry
| Total de pacientes = 1594 n (%) | |
| Problemas técnicos durante el tiempo perineal | 330 (18,0) |
| Plano de disección incorrecto | 91 (5,7) |
| Sangrado pelviano (> 100 mL) | 67 (4,2) |
| Lesiones de órgano durante el tiempo perineal, total | 28 (1,8) |
| Lesión de uretra | 12 (0,8) |
| Perforación rectal | 7 (0,4) |
| Perforación vaginal | 5 (0,3) |
| Perforación vesical | 2 (0,1) |
| Lesión de nervio hipogástrico | 2 (0,1) |
Adaptado de Penna y col.3
La mayoría de estas complicaciones pueden ser evitadas mediante la estandarización del procedimiento y un acabado conocimiento de la anatomía. El objetivo de este capítulo es describir las complicaciones más frecuentes relacionadas con este procedimiento, y destacar los principales reparos que deben tenerse en cuenta para evitarlas.
DIFICULTADES EN LA CONFECCIÓN DE LA JARETA DISTAL
La jareta rectal marca el límite de sección distal del recto y aísla la luz y su contenido de la cavidad pelviana. Una oclusión incompleta de esta aumenta el riesgo de infecciones pelvianas por escurrimiento de materia fecal, informadas en un 2,3% de los pacientes, según una reciente revisión sistemática4. Para ello resulta crítica una adecuada toma de tejido de pared rectal en cada punto de ella y, en segundo lugar, una vez finalizada, se debe anudar correctamente a fin de evitar la apertura del sitio de oclusión favoreciendo la salida de contenido fecal (fig. 1).
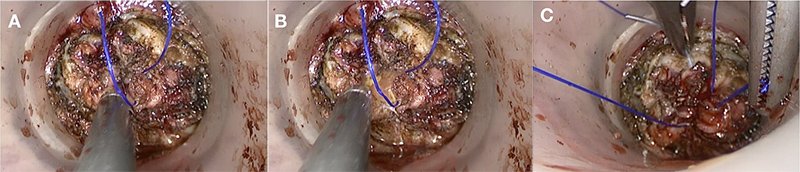
Figura 1: Apertura parcial de la jareta (A) con salida de materia fecal (B). Cierre del defecto con nuevo punto de sutura a través de la plataforma endoscópica (C).
Esto, a su vez, puede influir negativamente en los resultados oncológicos, como ha sido observado en pacientes con perforación rectal5. La jareta debe realizarse a aproximadamente 1 cm por debajo del tumor, para luego efectuar la rectotomía 1 cm por debajo de ella. Uno de los errores más frecuentes es realizar una jareta innecesariamente baja, la cual deja un muñón rectal innecesariamente corto, dificultando la posterior realización de la anastomosis. Los detalles técnicos de su confección ya han sido descriptos en el capítulo acerca de la técnica quirúrgica, haciendo hincapié en que una confección adecuada de la jareta es aquella que muestra el nudo en el centro y los pliegues radiados hacia afuera en forma simétrica. Cuando los puntos no son equidistantes, se puede apreciar lo que se ha descripto como el signo de “pétalo de rosa”, donde uno de los pliegues es mayor que los restantes6. Esto representa potencialmente un sitio de debilidad, donde en ocasiones, luego de realizar la rectotomía, la mucosa rectal puede evertirse, como hemos experimentado en uno de los pacientes de nuestra serie (fig. 2).
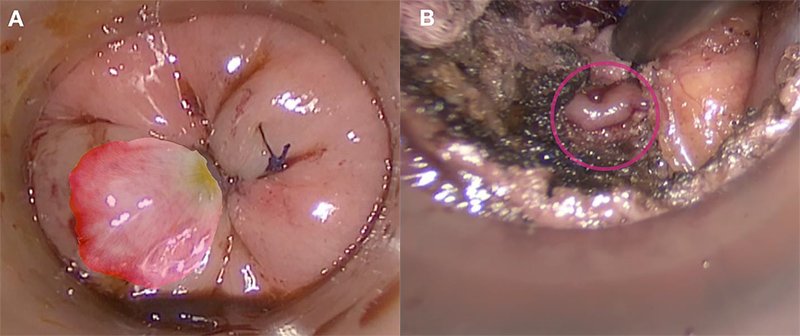
Figura 2: Imagen de jareta con tomas asimétricas. En la figura A se ve el signo del pétalo de rosa y en la B se observa cómo por este sitio de debilidad se evierte la mucosa.
La confección de la jareta puede realizarse con plataforma endoscópica transanal o sin ella, generalmente dependiendo de la altura del tumor. En tumores muy bajos es más conveniente realizarla manualmente asistido por un dispositivo de tracción como el LoneStar® (CooperSurgical, Inc., Trumbull, Estados Unidos) y una valva de Sims o anoscopio tipo Fansler. Incluso en estos casos, como también se mencionó en el capítulo acerca de aspectos técnicos, puede requerirse un tiempo de disección interesfinteriano previo a la colocación de la plataforma.
Finalmente, la realización de los nudos para obturar la jareta no debe subestimarse. Lo recomendable es utilizar suturas fuertes irreabsorbibles de monofilamento para que se deslice con facilidad entre las capas del recto. Realizar dos nudos en una misma dirección para que ajuste y un contranudo para fijarlo. Un gesto muchas veces útil es hacer varios nudos para que se forme una hebra del mismo hilo y que esta nos sirva de sitio de tracción cuando comencemos con la disección del mesorrecto.
DIFICULTADES EN EL RECONOCIMIENTO DE LOS PLANOS DE DISECCIÓN
Como mencionamos anteriormente, la anatomía quirúrgica de una taTME de “abajo hacia arriba” es completamente diferente de aquella de la TME por vía anterior “de arriba hacia abajo”. Con la taTME, la mayoría de las complicaciones intraoperatorias ocurren, precisamente, por la falta de familiaridad que tienen los cirujanos con las estructuras anatómicas pelvianas, lo que los lleva a tomar planos de disección incorrectos. En este apartado resaltaremos algunos aspectos críticos de la disección.
Anillo anorrectal
En tumores muy bajos en los que la sección del recto exige hacerlo de manera cercana al anillo anorrectal, el ingreso en el plano correcto puede volverse dificultoso. Cuando se realiza la rectotomía proximal a la línea dentada, suele identificarse con relativa facilidad una delgada capa de mesorrecto y, en un plano más profundo, la fascia endopelviana como una lámina fibrosa que recubre los músculos elevadores. Por el contrario, si el ingreso se da por debajo de la línea dentada o sobre ella, se debe reconocer adecuadamente el espacio interesfinteriano para no ingresar por fuera de la fascia endopelviana. Continuar por este plano llevaría indefectiblemente a una disección por fuera del plano, derivando en posibles lesiones vasculares y/o nerviosas de la pared lateral de la pelvis, relativamente infrecuentes durante la disección por vía abdominal4,7.
Recto inferior y fascia propia del mesorrecto
La sección de las fibras musculares del recto (rectotomía) debe realizarse en forma circunferencial y completa antes de continuar con la disección del mesorrecto. Esto permite la movilidad completa del recto, que es empujado por la propia presión que genera el ingreso de CO2 en el interior de la cavidad pelviana, facilitando el reconocimiento del plano areolar avascular descripto por Heald. A diferencia de lo que ocurre con la disección por vía abdominal, el mesorrecto distal es mucho más delgado, por lo que el cirujano puede verse tentado a continuar por el tejido areolar que cubre la capa muscular. Por eso, para evitar una disección muy profunda, es importante reconocer la fascia que recubre los músculos pelvianos como un tejido fibroso y grisáceo. Si observamos una coloración rosada intensa de dichos músculos o si estos se contraen fácilmente al usar el electrobisturí, debemos sospechar que estamos en el plano incorrecto. El plano correcto también es un plano avascular pero, a diferencia de un empuje suave y una “neumodisección” como ocurre en un plano demasiado profundo, este sí requiere una disección activa.
DIFICULTADES EN EL PLANO POSTERIOR
Este plano tiende a ser casi perpendicular al eje del canal anal debido al ángulo anorrectal, llegando en algunos casos a 90 grados. Debido a esta angulación pronunciada, el ingreso erróneo en el mesorrecto puede ocurrir con más frecuencia en la disección posterior. Antes de ingresar en el plano posterior, el cirujano debe seccionar un ligamento grueso, el ligamento hiatal. Esta estructura es una continuación del rafe anococcígeo y puede identificarse traccionando el recto hacia arriba8. Una disección muy profunda puede conducirnos al plano que se encuentra por debajo de la fascia presacra. En dicho sector se encuentra el plexo venoso presacro que drena hacia las venas ilíacas internas y venas profundas dentro del sacro a través de los forámenes sacros9. Las lesiones vasculares en el plexo presacro pueden ser catastróficas, muy difíciles de cohibir desde el abordaje perineal, y requiren, en la mayoría de los casos, una conversión10,11. Es importante que, a medida que la disección se acerca al recto medio, el cirujano anticipe la curvatura del sacro en el sentido vertical para evitar dichas lesiones. Quizás en este punto, la disección sería más segura por la vía abdominal12.
DIFICULTADES EN EL PLANO LATERAL
La desviación del plano lateral expone al riesgo de sangrado (por lesiones de vasos tributarios de la arteria y vena ilíacas internas), así como también al riesgo de lesión de los plexos nerviosos autonómicos pelvianos (fig. 3). En dicho sector también se encuentran los nervios erigentes parasimpáticos, fundamentales en el hombre para la función eréctil, así como la inervación simpática de la raíz S3, importante en función del esfínter anal interno13.
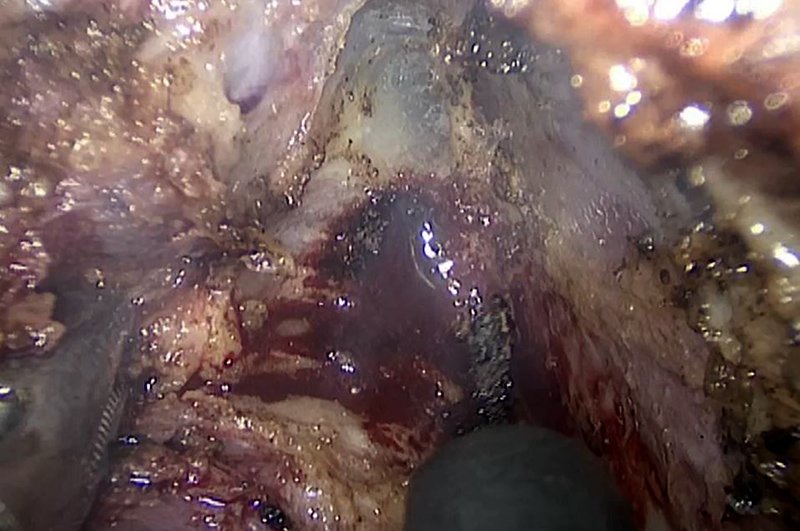
Figura 3: Disección lateral izquierda fuera de plano que motiva sangrado arterial de las venas rectales medias.
En un plano profundo hacia hora 10 y 2 se encuentran los uréteres. Sin embargo, los casos de lesiones de uréter son muy infrecuentes durante la taTME y solo han sido informados en el tiempo abdominal11. Como mencionamos anteriormente, el tejido areolar del plano extrafascial es disecado fácilmente, incluso por el mismo C02. Por este motivo, suele verse que la grasa de dicho espacio tiende a quedar suelta, rodeada del tejido areolar y no adherida al mesorrecto a nivel medial o la pared pelviana en los laterales14. Del mismo modo, tal como ocurre cuando exponemos directamente los músculos pelvianos, la aparición de este tejido adiposo suelto debe advertir al cirujano acerca de un plano de disección demasiado profundo.
DIFICULTADES EN EL PLANO ANTERIOR (LESIÓN DE LA URETRA)
La lesión de la uretra masculina es una complicación alarmantemente relacionada con la taTME, informada por excepción en la TME por vía abdominal. Precisamente, la mala interpretación del plano anterior es la que predispone a dicha complicación tan particular (fig. 4). El plano anterior es horizontal con respecto al ángulo de visión. Cuando el cirujano cambia dicho ángulo de abordaje hacia un plano más anterior es cuando puede producirse la movilización de la próstata en el hombre o la apertura de la vagina en la mujer.
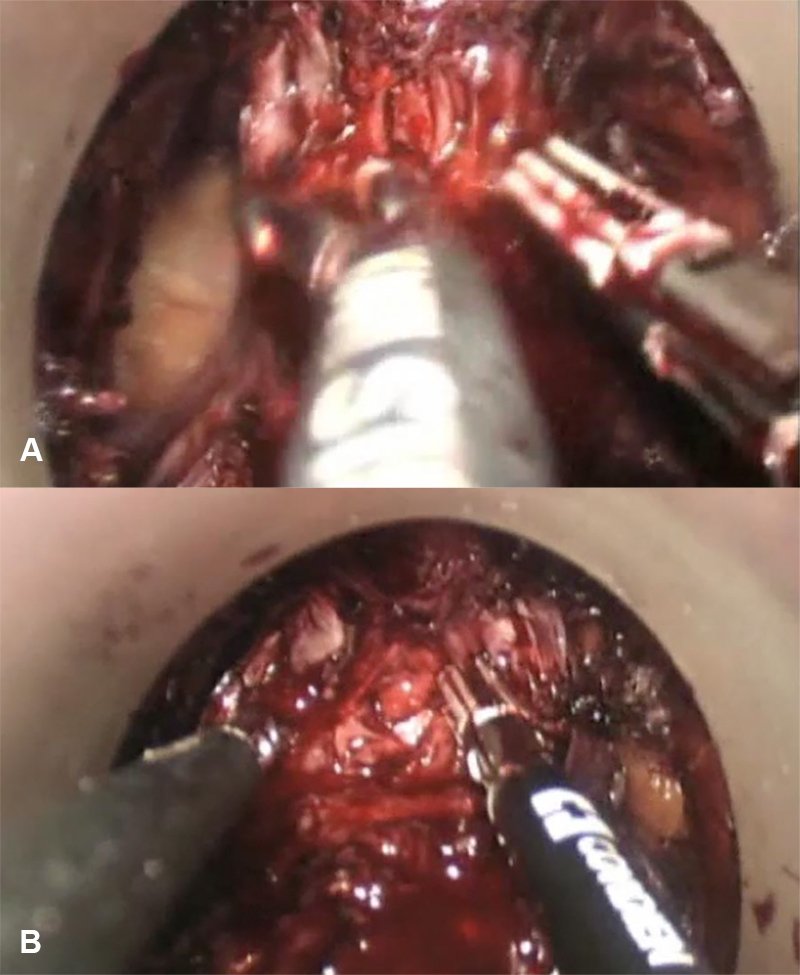
Figura 4: Transección parcial de la uretra durante disección en el plano anterior. La solución de continuidad es reconocida (A) y se puede observar la sonda Foley en su interior (B). Cortesía Dra. Itzel Vela.
La primera publicación sobre lesiones uretrales asociadas a taTME fue realizada por Rouanet y col., quienes refirieron una incidencia de 6,7% sobre 30 pacientes de sexo masculino15. Posteriormente, otros grupos también han descripto esta complicación en un rango que fue del 1 al 5% de sus pacientes16-18. Por su parte, en la última publicación del International TaTME Registry, la incidencia de lesiones uretrales fue del 0,8%, sobre un total de 1594 pacientes3, aunque se especula que un subregistro de esta complicación puede llevar a subestimarla. Una reciente encuesta internacional demostró que, de un total de 34 lesiones uretrales, solo 18 de ellas se habían informado en el registro internacional, y a su vez solo 5 habían sido incluidas en series publicadas19. Más allá de que la mayoría de estas lesiones se reconocen intraoperatoriamente (94,1% según Sylla y col.), muchos de los pacientes son finalmente convertidos a cirugía abierta o a una amputación abdominoperineal o cirugía de Hartmann, y otros sufren las consecuencias alejadas de ella, como estenosis o fístulas19.
Como mencionamos anteriormente, el mecanismo por el que se produce la lesión uretral es por la movilización innecesaria de la próstata. Esta glándula no puede movilizarse fácilmente desde un abordaje abdominal pero sí desde la vía transanal. Ciertos reparos deben tenerse en cuenta con el fin de evitar dicha maniobra. Inmediatamente luego de realizar la rectotomía en anterior, debemos reconocer las fibras musculares prerrectales de Luschka y el músculo rectouretral. Este complejo muscular parte desde las fibras longitudinales del canal anal medial con respecto al elevador del ano y el haz puborrectal. Luego continúa por el plano perirrectal (es decir, no forma parte de la capa muscular del recto), hasta insertarse en la fascia endopelviana y la fascia preprostática20,21. Durante la taTME, estas fibras se ven como un telón que cubre la próstata y el recto, haciendo más difícil la distinción de ambos órganos (fig. 5).
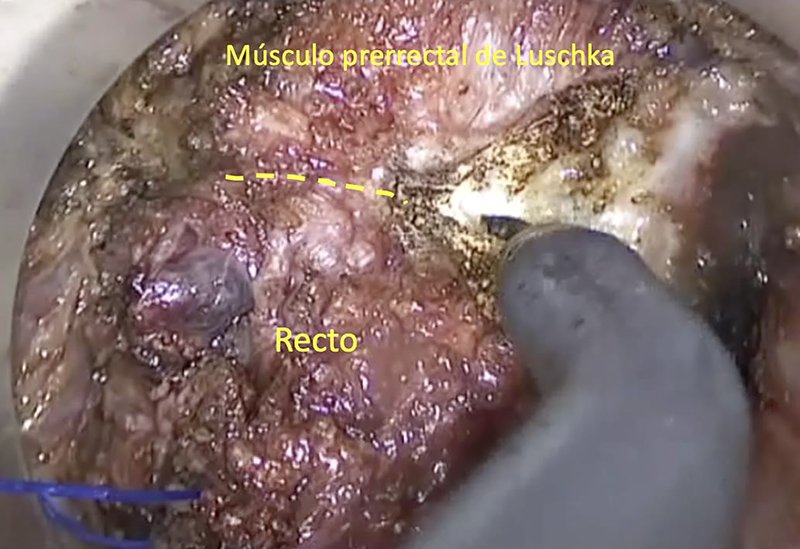
Figura 5: Sección de las fibras musculares prerrectales de Luschka que cubren el recto y la próstata como un telón. Una vez seccionado, se reconoce la fascia de Denonvilliers.
El error es considerar esto parte del recto y, en vez de seccionarlo, dirigir la disección hacia un plano más anterior. En segundo lugar, es importante reconocer el paquete vasculonervioso de Walsh (PVNW), que se encuentra en hora 2 y 10, entre la próstata y el recto1. Esta estructura define el plano anterolateral de disección, por lo que debemos conservarlas pasando por debajo de ellas. Una vez identificado el PVNW a ambos lados, las fibras de Luschka y del músculo rectouretral pueden seccionarse de manera segura (fig. 6). En tercer lugar, debemos reconocer la glándula prostática como una estructura esférica lisa, dura y amarillenta pálida. Si no es fácilmente reconocible, como suele ocurrir en pacientes irradiados, lo mejor es quitar el dispositivo transanal y asegurarse haciendo un examen digital. Por último, y en caso de haber avanzado por el plano incorrecto, debemos ser capaces de identificar la forma cilíndrica de la uretra, incluso por palpación considerando que todos estos pacientes tienen una sonda vesical colocada.
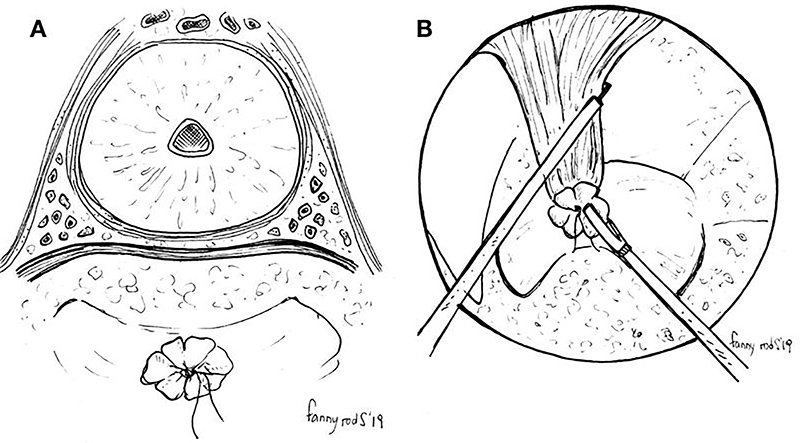
Figura 6: Esquema en el que se observa el plano que separa la cara anterior del recto de la próstata. A ambos lados pueden observarse los paquetes vasculonerviosos de Walsh (PVNW), discurriendo por encima de la fascia de Denonvilliers y marcando el límite anterolateral de disección (A). Una vez identificado el PVNW a ambos lados, las fibras de Luschka y del músculo rectouretral pueden seccionarse de manera segura (B).
La selección de los casos también ayuda a prevenir complicaciones. Debemos reconocer a aquellos pacientes con mayor riesgo de lesiones uretrales por hiperplasia prostática benigna, tumores grandes de la cara anterior que amenazan el margen de resección circunferencial, radioterapia previa (sobre todo por cáncer de próstata), prostatectomía radical y biopsias prostáticas transrectales previas22,23. Ante este tipo de situación, y sin la experiencia adecuada, es aconsejable emplear una opción alternativa al abordaje transanal.
En los últimos años han surgido nuevas tecnologías aplicadas a facilitar el reconocimiento de la uretra durante el intraoperatorio. Entre ellas, el uso de estímulos vibratorios a través de la sonda vesical para facilitar su palpación, ecografías intraoperatorias con irrigación retrógrada por la sonda y otras más novedosas, como el uso de biofluorescencia (verde de indocianina) y colorantes orgánicos (azul de metileno), han sido informadas en los últimos años24,27.
EMBOLIZACIÓN DE CO2
La embolización de burbujas de CO2 es una complicación poco frecuente pero potencialmente fatal en los pacientes operados por cirugía mínimamente invasiva28. El factor desencadenante para dicha complicación es la lesión venosa, sobre todo cuando esta pasa inadvertida y la insuflación no se detiene. El CO2 ingresa en el torrente sanguíneo a través de la vena lesionada por diferencias de presión y llega a las cavidades cardíacas derechas. Durante la taTME, todo esto puede verse favorecido por un campo quirúrgico pequeño y rígido (por la pared pelviana), sumado a una menor presión venosa periférica por la posición de Trendelenburg y a la utilización de unidades de insuflación más potentes en lugar de insuflación estándar2,29. Al día de hoy existen datos limitados sobre su incidencia, los factores de riesgo y el manejo de esta complicación. Basada en un reciente estudio, la incidencia del embolismo de CO2 es de 0,4%, sobre un total de 6375 casos registrados en dos bases de datos internacionales29. Todos los embolismos se produjeron en presencia de insuflación transanal, ya sea sola (10 casos, 40%) o durante la insuflación abdominal simultánea (15 casos, 60%). En 24 de estos pacientes se utilizó el sistema AirSeal® (SurgiQuest Inc., Milford, Connecticut, Estados Unidos) y en 21 había una hemorragia activa en el lecho pelviano en el momento de la embolia. A pesar de que el uso de estos dispositivos especiales de insuflación puede generar preocupación, su relación directa con el embolismo no ha sido demostrada, e incluso los primeros informes se refieren pacientes en los que se usaron sistemas estándar15. Para disminuir el gradiente de presión se sugiere ajustar la presión de insuflación pelviana a un valor de 10-12 mm Hg en lugar de 15 mm Hg2.
La embolización de CO2 puede generar cambios hemodinámicos en el paciente, así como también acidosis metabólica aguda. La herramienta más precisa para su diagnóstico es el ecocardiograma transesofágico, que muestra la presencia de aire en las cavidades derechas. El manejo de estos pacientes sugiere detener el ingreso de gas, cohibir el sangrado y aumentar la concentración de O2 a través de la ventilación mecánica30; incluso se informó el aspirado del gas mediante una vía central31. Como ha sido observado, el gas sigue el flujo sanguíneo, independientemente de su flotabilidad. De acuerdo con estos principios, colocar el corazón debajo del sitio quirúrgico para aumentar la presión venosa central no resulta profiláctico32. En nuestro país, Mattacheo y cols. publicaron recientemente su experiencia en taTME sobre una serie de 8 pacientes operados, sin haber experimentado esta seria complicación33.
COMPLICACIONES DE LA ANASTOMOSIS
Como en toda anastomosis colorrectal, su falla se asocia a la dehiscencia, los abscesos pelvianos, las fístulas crónicas asociadas a senos y las estenosis. La dehiscencia fue específicamente evaluada en el registro internacional, donde ‒sobre un total de 1594 pacientes ingresados‒ 250 (15,7%) presentaron complicaciones relacionadas con la anastomosis. Estas incluyeron 156 (9,8%) pacientes con dehiscencia, 74 (4,6%) con abscesos pelvianos, 12 (0,8%) con fístulas, 15 (0,9%) con senos crónicos, mientras que 58 pacientes (3,6%) presentaron estenosis como complicación alejada. Casi la mitad de estos pacientes debieron ser reoperados. El sexo masculino, el tabaquismo, los tumores mayores de 2,5 cm, la diabetes, las anastomosis manuales, el sangrado intraoperatorio mayor de 50 mL y un tiempo perineal superior a 1,5 horas demostraron estar asociados en forma independiente a complicaciones de la anastomosis3.
Dos revisiones sistemáticas que incluyeron 510 y 794 pacientes, respectivamente, han informado tasas de dehiscencia anastomótica temprana de 5,7% y 6,1%, respectivamente4,34, valores similares a los observados en el registro internacional (7,8% de dehiscencias antes de los 30 días posoperatorios)3. A pesar de que se ha hipotetizado que en la taTME, al no existir el entrecruzamiento de las suturas mecánicas observadas con la técnica de doble sutura, la dehiscencia sería menor que en el abordaje abdominal, esto aún no ha podido ser demostrado35-38. En este sentido, en una reciente publicación que compara la taTME con la TME laparoscópica, la tasa de dehiscencia anastomótica ha sido similar entre los grupos (5,4% vs. 8,87%, p=0,09, respectivamente). Sin embargo, a pesar de no haber encontrado diferencias significativas en términos de morbilidad posoperatoria global (25% vs. 27%; p=0,35), la taTME se asoció a una menor tasa de complicaciones mayores (6,36% vs. 12,13%; p=0,04)39. La tabla 2 muestra un resumen de estos resultados.
Tabla 2: Complicaciones posoperatorias: taTME vs. TME laparoscópica
| taTME (n = 331) | TME lap (n = 381) | p-valor | OR/DM (IC 95%) | |
| Tiempo operatorio (min.) * | 333 | 381 | 0,52 | -4,52 (-22,51-13,47) |
| Morbilidad global § | 25 (83) | 27 (103) | 0,35 | 0,89 (0,7-11,4) |
| Complicaciones mayores (CD ≥ III) § | 6,36 (17) | 12,1 (33) | 0,04 | 0,55 (0,37-0,97) |
| Dehiscencia anastomótica § | 5,43 (18) | 8,9 (34) | 0,09 | 0,62 (0,36-1,08) |
| Conversión § | 0 | 0 | – | – |
* Mediana (rango intercuartílico); § proporción (n). OR: Odds ratio; DM: diferencia de medias; IC 95%: intervalo de confianza de 95%. Adaptado de Rubinkiewicz y col.39
BIBLIOGRAFÍA
- Atallah S, Albert M. The neurovascular bundle of Walsh and other anatomic considerations crucial in preventing urethral injury in males undergoing transanal total mesorectal excision. Tech Coloproctol. 2016; 20(6):411-2.
- Harnsberger CR, Alavi K, Davids JS, Sturrock PR, Zayaruzny M, Maykel JA. CO embolism can complicate transanal total mesorectal excision. Tech Coloproctol. 2018; 2(11):881-5.
- Penna M, Hompes R, Arnold S, Wynn G, Austin R, Warusavitarne J, et al. Incidence and Risk Factors for Anastomotic Failure in 1594 Patients Treated by Transanal Total Mesorectal Excision [Internet]. Ann Surg. 2019; 269: 700-11. Available from: http://dx.doi.org/10.1097/sla.0000000000002653
- Deijen CL, Tsai A, Koedam TWA, Veltcamp Helbach M, Sietses C, Lacy AM, et al. Clinical outcomes and case volume effect of transanal total mesorectal excision for rectal cancer: a systematic review. Tech Coloproctol. 2016; 20(12):811-24.
- Bülow S, Christensen IJ, Iversen LH, Harling H, Danish Colorectal Cancer Group. Intra-operative perforation is an important predictor of local recurrence and impaired survival after abdominoperineal resection for rectal cancer. Colorectal Dis. 2011; 13(11):1256-64.
- Stevenson ARL. Zen and the Art of the Purse-String [Internet]. Transanal Minimally Invasive Surgery (TAMIS) and Transanal Total Mesorectal Excision (taTME). 2019. p. 271-6. Available from: http://dx.doi.org/10.1007/978-3-030-11572-2_26
- Mege D, Hain E, Lakkis Z, Maggiori L, Prost à la Denise J, Panis Y. Is trans-anal total mesorectal excision really safe and better than laparoscopic total mesorectal excision with a perineal approach first in patients with low rectal cancer? A learning curve with case-matched study in 68 patients. Colorectal Dis. 2018; 20(6):O143-51.
- Chen C-C, Lai Y-L, Jiang J-K, Chu C-H, Huang I-P, Chen W-S, et al. Transanal Total Mesorectal Excision Versus Laparoscopic Surgery for Rectal Cancer Receiving Neoadjuvant Chemoradiation: A Matched Case-Control Study. Ann Surg Oncol. 2016; 23(4):1169-76.
- Casal Núñez JE, Vigorita V, Ruano Poblador A, Gay Fernández AM, Toscano Novella MÁ, Cáceres Alvarado N, et al. Presacral venous bleeding during mobilization in rectal cancer. World J Gastroenterol. 2017 7; 23(9):1712-9.
- Sparreboom CL, Komen N, Rizopoulos D, van Westreenen HL, Doornebosch PG, Dekker JWT, et al. Transanal total mesorectal excision: how are we doing so far? Colorectal Dis [Internet]. 2019 Mar 7. Available from: http://dx.doi.org/10.1111/codi.14601
- Penna M, Hompes R, Arnold S, Wynn G, Austin R, Warusavitarne J, et al. Transanal Total Mesorectal Excision: International Registry Results of the First 720 Cases. Ann Surg. 2017; 266(1):111-7.
- Atallah S. Transanal total mesorectal excision: full steam ahead. Tech Coloproctol. 2015; 19(2):57-61.
- Kneist W, Rink AD, Kauff DW, Konerding MA, Lang H. Topography of the extrinsic internal anal sphincter nerve supply during laparoscopic-assisted TAMIS TME: five key zones of risk from the surgeons’ view. Int J Colorectal Dis. 2015; 30(1):71-8.
- Bell SW. Critical Anatomical Landmarks in Transanal Total Mesorectal Excision (taTME) [Internet]. Transanal Minimally Invasive Surgery (TAMIS) and Transanal Total Mesorectal Excision (taTME). 2019. p. 299-309. Available from: http://dx.doi.org/10.1007/978-3-030-11572-2_29
- Rouanet P, Mourregot A, Azar CC, Carrere S, Gutowski M, Quenet F, et al. Transanal endoscopic proctectomy: an innovative procedure for difficult resection of rectal tumors in men with narrow pelvis. Dis Colon Rectum. 2013; 56(4):408-15.
- Burke JP, Martín-Pérez B, Khan A, Nassif G, de Beche-Adams T, Larach SW, et al. Transanal total mesorectal excision for rectal cancer: early outcomes in 50 consecutive patients. Colorectal Dis. 2016; 18(6):570-7.
- Kang L, Chen W-H, Luo S-L, Luo Y-X, Liu Z-H, Huang M-J, et al. Transanal total mesorectal excision for rectal cancer: a preliminary report. Surg Endosc. 2016; 30(6):2552-62.
- Perdawood SK, Thinggaard BS, Bjoern MX. Effect of transanal total mesorectal excision for rectal cancer: comparison of short-term outcomes with laparoscopic and open surgeries [Internet]. Surg Endosc. 2018; 32: 2312-21. Available from: http://dx.doi.org/10.1007/s00464-017-5926-x
- Carmichael H, Sylla P. Urethral Injury: The New Challenge for taTME [Internet]. Transanal Minimally Invasive Surgery (TAMIS) and Transanal Total Mesorectal Excision (taTME). 2019. p. 311-9. Available from: http://dx.doi.org/10.1007/978-3-030-11572-2_30
- Nakajima Y, Muro S, Nasu H, Harada M, Yamaguchi K, Akita K. Morphology of the region anterior to the anal canal in males: visualization of the anterior bundle of the longitudinal muscle by transanal ultrasonography. Surg Radiol Anat. 2017; 39(9):967-73.
- Brooks JD, Eggener SE, Chao W-M. Anatomy of the rectourethralis muscle. Eur Urol. 2002; 41(1):94-100.
- Atallah S, Albert M, Monson JRT. Critical concepts and important anatomic landmarks encountered during transanal total mesorectal excision (taTME): toward the mastery of a new operation for rectal cancer surgery. Tech Coloproctol. 2016; 20(7):483-94.
- Marecik SJ, Pai A, Sheikh T, Park JJ, Prasad LM. Transanal Total Mesorectal Excision: Save the Nerves and Urethra. Dis Colon Rectum. 2016; 59(7):e410-4.
- Atallah S, Mabardy A, Volpato AP, Chin T, Sneider J, Monson JRT. Surgery beyond the visible light spectrum: theoretical and applied methods for localization of the male urethra during transanal total mesorectal excision. Tech Coloproctol. 2017; 21(6):413-24.
- Okada T, Kawada K, Nakamura T, Okamura R, Hida K, Takai A, et al. A cadaveric demonstration of visualization of the urethra using a lighted stent during transanal intersphincteric resection [Internet]. International Cancer Conference Journal. 2018; 7: 77-80. Available from: http://dx.doi.org/10.1007/s13691-018-0319-0
- Mabardy A, Lee L, Valpato AP, Atallah S. Transanal total mesorectal excision with intersphincteric resection and use of fluorescent angiography and a lighted urethral stent for distal rectal cancer [Internet]. Tech Coloproctol. 2017; 21: 581-2. Available from: http://dx.doi.org/10.1007/s10151-017-1629-5
- Barnes TG, Volpi D, Cunningham C, Vojnovic B, Hompes R. Improved urethral fluorescence during low rectal surgery: a new dye and a new method. Tech Coloproctol. 2018; 22(2):115-9.
- Blaser A, Rosset P. Fatal carbon dioxide embolism as an unreported complication of retroperitoneoscopy [Internet]. Surg Endosc. 1999; 13: 713-4. Available from: http://dx.doi.org/10.1007/s004649901079
- Dickson EA, Penna M, Cunningham C, Ratcliffe FM, Chantler J, Crabtree NA, et al. Carbon Dioxide Embolism Associated With Transanal Total Mesorectal Excision Surgery: A Report From the International Registries. Dis Colon Rectum. 2019; 62(7):794-801.
- Mirski MA, Lele AV, Fitzsimmons L, Toung TJK. Diagnosis and Treatment of Vascular Air Embolism [Internet]. Anesthesiology. 2007; 106: 164-77. Available from: http://dx.doi.org/10.1097/00000542-200701000-00026
- Bedford RF, Marshall WK, Butler A, Welsh JE. Cardiac Catheters for Diagnosis and Treatment of Venous Air Embolism. A Prospective Study in Man [Internet]. Survey of Anesthesiology. 1982; 26: 219-20. Available from: http://dx.doi.org/10.1097/00132586-198226040-00028
- Lanier WL, Warner MA. Assessing Acceptable Risk in New Surgical Procedures, with Special Reference to Gas Emboli in Transanal Total Mesorectal Surgery. Dis Colon Rectum. 2019; 62(7):777-80.
- Mattacheo A, Tognelli J, Magrini L, López L, Oliva Pérez R, Sao Juliao G, et al. Implementación segura de la escisión total mesorrectal transanal (TaTME) en la práctica clínica. Rev Argent Coloproctol. 2019; 30(1):11-8.
- Simillis C, Hompes R, Penna M, Rasheed S, Tekkis PP. A systematic review of transanal total mesorectal excision: is this the future of rectal cancer surgery? Colorectal Dis. 2016; 18(1):19-36.
- Jayne D, Pigazzi A, Marshall H, Croft J, Corrigan N, Copeland J, et al. Effect of Robotic-Assisted vs Conventional Laparoscopic Surgery on Risk of Conversion to Open Laparotomy among Patients Undergoing Resection for Rectal Cancer: The ROLARR Randomized Clinical Trial. JAMA. 2017; 318(16):1569-80.
- Stevenson ARL, Solomon MJ, Lumley JW, Hewett P, Clouston AD, Gebski VJ, et al. Effect of Laparoscopic-Assisted Resection vs Open Resection on Pathological Outcomes in Rectal Cancer: The ALaCaRT Randomized Clinical Trial. JAMA. 2015; 314(13):1356-63.
- Fleshman J, Branda M, Sargent DJ, Boller AM, George V, Abbas M, et al. Effect of Laparoscopic-Assisted Resection vs Open Resection of Stage II or III Rectal Cancer on Pathologic Outcomes: The ACOSOG Z6051 Randomized Clinical Trial. JAMA. 2015; 314(13):1346-55.
- van der Pas MH, Haglind E, Cuesta MA, Fürst A, Lacy AM, Hop WC, et al. Laparoscopic versus open surgery for rectal cancer (COLOR II): short-term outcomes of a randomised, phase 3 trial. Lancet Oncol. 2013; 14(3):210-8.
- Rubinkiewicz M, Nowakowski M, Wierdak M, Mizera M, Dembiński M, Pisarska M, et al. Transanal total mesorectal excision for low rectal cancer: a case-matched study comparing TaTME versus standard laparoscopic TME. Cancer Manag Res. 2018; 10:5239-45.
