8. Proctectomía transanal: origen y racionalidad
REV ARGENT COLOPROCT | 2019 | VOL. 30, N° 3: 45-50
RELATO ANUAL
CAPÍTULO 8
Proctectomía Transanal: Origen y Racionalidad
Desde hace casi 40 años, la resección total del mesorrecto (en inglés TME: Total Mesorrectal Excision) descripta por Heald en 1982 representa el estándar de cuidado para los tumores de recto medio e inferior con una recurrencia local actuarial a 5 años menor del 10%1,2. Estos resultados a su vez están directamente relacionados con la calidad de la pieza quirúrgica obtenida durante el procedimiento, la cual incluye una adecuada linfadenectomía, un mesorrecto íntegro y márgenes (distal y circunferencial) negativos3-5.
Históricamente, la TME ha sido realizada en forma convencional a través de una laparotomía cuyo sentido de disección fue históricamente descripto de proximal a distal o, como se menciona en la actualidad, de arriba hacia abajo. Hoy en día, este abordaje continúa siendo el procedimiento con el cual debe compararse toda nueva técnica quirúrgica que pretenda demostrar superioridad. A su vez, los tumores del recto extraperitoneal conllevan una dificultad adicional por alojarse en la parte más caudal de la pelvis, en relación con el aparato esfinteriano y con numerosas estructuras de la esfera urogenital. Esta situación anatómica ofrece generalmente un espacio reducido de maniobrabilidad y visión para el cirujano actuante, lo que en algunos casos puede afectar la disección, impactar negativamente en la calidad de la pieza obtenida, imposibilitar la confección de una anastomosis y, como resultado de ello, aumentar la tasa de amputaciones abdominoperineales. En 1977, Alan Parks desde el Hospital St. Marks de Londres describió la disección interesfintérica para las proctectomías por colitis ulcerosa, lo cual permitió conservar el piso pelviano6. Posteriormente describió la anastomosis coloanal manual por vía transanal en pacientes con tumores de recto distales como alternativa a una anastomosis dificultosa por vía anterior en la profundidad de la pelvis7. Paralelamente, Gerald Marks desarrollaba en el Hospital Universitario Thomas Jefferson de los Estados Unidos un abordaje transabdominal-transanal (TATA), cuya característica principal era iniciar la disección del recto inferior a través del ano entrando en el plano interesfinteriano (de abajo hacia arriba) hasta alcanzar la disección abdominal hecha desde arriba a la altura de las vesículas seminales o del cuello uterino (fig. 1). Para ese entonces, eso significó una nueva alternativa para lograr una mayor tasa de preservación esfinteriana por medio de una anastomosis coloanal manual8.
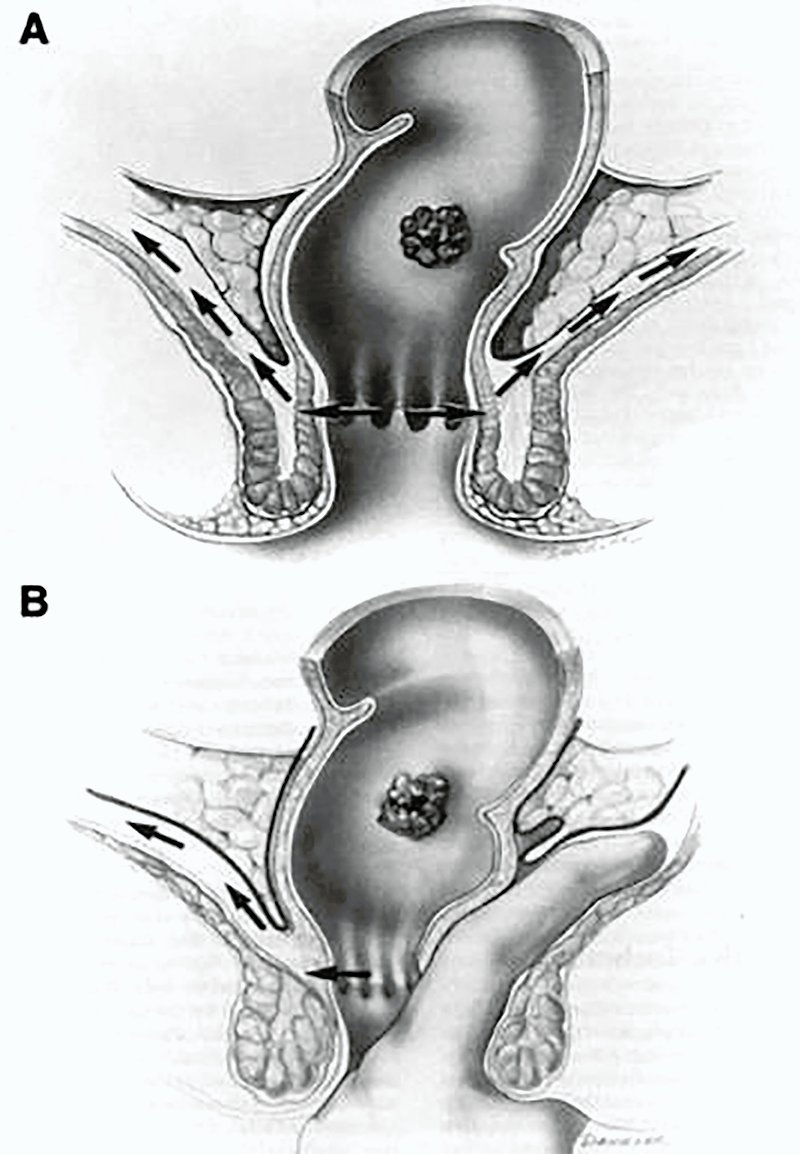
Figura 1: A) Plano de disección interesfinteriano del TATA. B) Creación del plano a través de la fascia propia del mesorrecto. TATA: TransAnal TransAbdominal9.
Sin embargo, la principal crítica que se le hacía al TATA era no solo la incomodidad de iniciar el procedimiento por vía transanal, continuarlo por vía transabdominal, para luego volver al periné y finalizarlo con la confección de la anastomosis coloanal, sino que a su vez la disección transanal del recto se realizaba con una limitada calidad del campo visual y por momentos con disección digital a ciegas. Esto hizo que su adopción fuera escasa dentro de la comunidad quirúrgica.
Casi en simultáneo, Gerhard Buess desarrollaba en Alemania la microcirugía endoscópica transanal (en inglés TEM: Transanal Endoscopic Microsurgery), a través de la cual optimizó la visualización del campo quirúrgico para la resección local de lesiones rectales endoluminales a través de un rectoscopio con visión endoscópica binocular y el desarrollo de instrumental especialmente diseñado para ese procedimiento10. Más de dos décadas después, y luego de la aparición de nuevas plataformas endoscópicas, se acuña el término TAMIS, mediante el cual se buscaba simplificar el procedimiento descripto por Buess asociando la utilización de un monopuerto transanal con instrumental laparoscópico convencional11. El desarrollo de estas técnicas comenzó a despertar la idea encarar la disección del mesorrecto de abajo hacia arriba a través de un abordaje transanal con la intención de sortear las dificultades en la disección del recto extraperitoneal de arriba hacia abajo en la parte más caudal de la pelvis que presentan tanto la cirugía abierta como la laparoscópica y robótica en el tratamiento del cáncer de recto.
Durante las últimas décadas, la cirugía laparoscópica y también la cirugía robótica han sido incorporadas por numerosos grupos quirúrgicos como método de abordaje del cáncer de recto, por ofrecer las ventajas de un procedimiento miniinvasivo en términos de recuperación posoperatoria temprana12. Sin embargo, sea cual fuere el abordaje miniinvasivo, ambas vías presentan un gran desafío al momento de realizar la disección pelviana del recto distal. Como se mencionó anteriormente, el reducido espacio del hiato pelviano, sumado a la escasa fuerza de tracción y ergonomía que ofrece el instrumental laparoscópico, hace muchas veces que se generen desgarros a nivel de la fascia mesorrectal, a la vez de impedir una adecuada exposición para la disección tanto a nivel del margen circunferencial como del distal. Respecto del control del margen distal, no solo se ha mencionado la dificultad de poder colocar una sutura lineal cortante en un espacio reducido como es el hiato pelviano, sino también se ha observado que la necesidad de seccionar el recto distal al tumor con más de un disparo de sutura ha sido asociada a un mayor riesgo de dehiscencia anastomótica13. A su vez, esta sección distal del recto se realiza generalmente sin control visual, lo cual puede llevar no solo a realizar anastomosis mas bajas de lo necesario, sino por el contrario a dividir el recto pasando en las cercanías o incluso a través del propio tumor. Estas dificultades en el adecuado control de los márgenes (circunferencial y distal) es sabido que impactan negativamente en los resultados oncológicos a largo plazo3,14. A su vez, la no identificación del plano correcto y, como consecuencia, la falta de reconocimiento de otras estructuras, llevan a generar lesiones que afectan los resultados funcionales de esta cirugía15.
A pesar de esto, la TME laparoscópica ofrece, en manos entrenadas, una alternativa segura con respecto a su abordaje convencional en términos de complicaciones posoperatorias y resultados oncológicos a largo plazo16,17. Sin embargo, aún hoy presenta un riesgo de conversión que ha sido observado hasta en un 34% de los casos18, especialmente cuando se tratan hombres, con un índice de masa corporal elevado y una pelvis estrecha. La pelvis estrecha no solo ha sido mencionada como uno de los factores más importantes de conversión16, sino también se asoció con una mala calidad de las piezas de resección19.
Frente a estas limitaciones, la cirugía robótica ha irrumpido como un nuevo abordaje miniinvasivo con la intención de mejorar los resultados perioperatorios de la cirugía laparoscópica del cáncer de recto, fundamentalmente en términos de conversión. Entre sus ventajas se destacan la visión tridimensional, la ergonomía del instrumental, su maniobrabilidad en espacios reducidos y, por último, la disminución del temblor muscular y la fatiga para el cirujano actuante. Sin embargo, a pesar del esfuerzo de numerosas series retrospectivas y metaanálisis que comparan el abordaje laparoscópico versus el robótico20,21, el único estudio prospectivo, multicéntrico y aleatorizado (ROLARR) concluyó que la cirugía robótica para el tratamiento del cáncer de recto no disminuye significativamente el riesgo de conversión del procedimiento, por lo que este abordaje no confiere ninguna ventaja por encima del abordaje laparoscópico22.
Simultáneamente al desarrollo de la cirugía robótica, dos estudios fueron específicamente diseñados para comparar la calidad de las piezas quirúrgicas de pacientes operados por cáncer de recto mediante cirugía laparoscópica y cirugía convencional (ALaCaRT y ACOSOG Z6051), a través de una variable compuesta basada en un margen circunferencial > 1 mm, margen distal > 1 mm y una resección mesorrectal completa o casi completa23,24. Estos estudios fallaron en determinar la no inferioridad del abordaje laparoscópico frente al convencional. A su vez, ambos estudios presentaron un índice de conversión de 9 y 11%, respectivamente. Basados en estos resultados, los intentos por optimizar la cirugía miniinvasiva del cáncer de recto llevados a cabo durante la última década parecían limitarse a dos: preservar el abordaje miniinvasivo y obtener piezas quirúrgicas con adecuados márgenes e integridad mesorrectal.
La resección total del mesorrecto transanal (taTME) surge con el propósito de sortear las dificultades del abordaje laparoscópico de arriba hacia abajo de los tumores de recto medio e inferior25 y es el resultado evolutivo de distintas técnicas quirúrgicas (fig. 2).
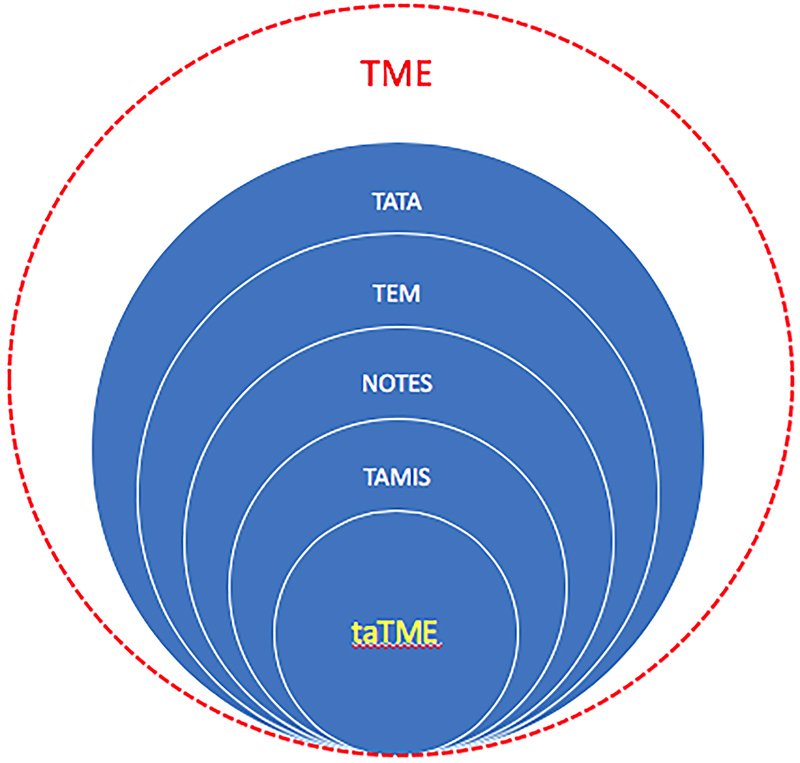
Figura 2: Esquema que representa la evolución de distintos conceptos quirúrgicos que dan origen a la taTME. TME: Total Mesorectal Excision2, TATA: TransAnal TransAbdominal9, TEM: Transanal Endoscopic Microsurgery10, NOTES: Natural Orifice Transluminal Endoscopic Surgery20, TAMIS: Transanal Minimally Invasive Surgery11, taTME: Transanal Total Mesorectal Excision25.
Este abordaje transanal de abajo hacia arriba define el margen distal bajo estricto control visual y propone realizar una disección adecuada sin las dificultades de tracción y exposición en la pelvis distal, aun tratándose de un mesorrecto voluminoso en un paciente obeso. A su vez, la creación de la neumopelvis con CO2 facilita la identificación del plano mesorrectal, el cual evitaría la lesión de los nervios pélvicos, los vasos presacros, la próstata y la vagina (fig. 3). Esta disección por vía transanal también evita lidiar con las estructuras anatómicas que se interponen en la pelvis en la disección de arriba hacia abajo. Sin embargo, resulta crítico que los cirujanos que se involucren en este procedimiento estén familiarizados con esta “nueva” anatomía a fin de evitar complicaciones como las lesiones uretrales raramente descriptas en el abordaje clásico26. La morbilidad y los resultados oncológicos de esta técnica serán analizados aparte, en otro capítulo.
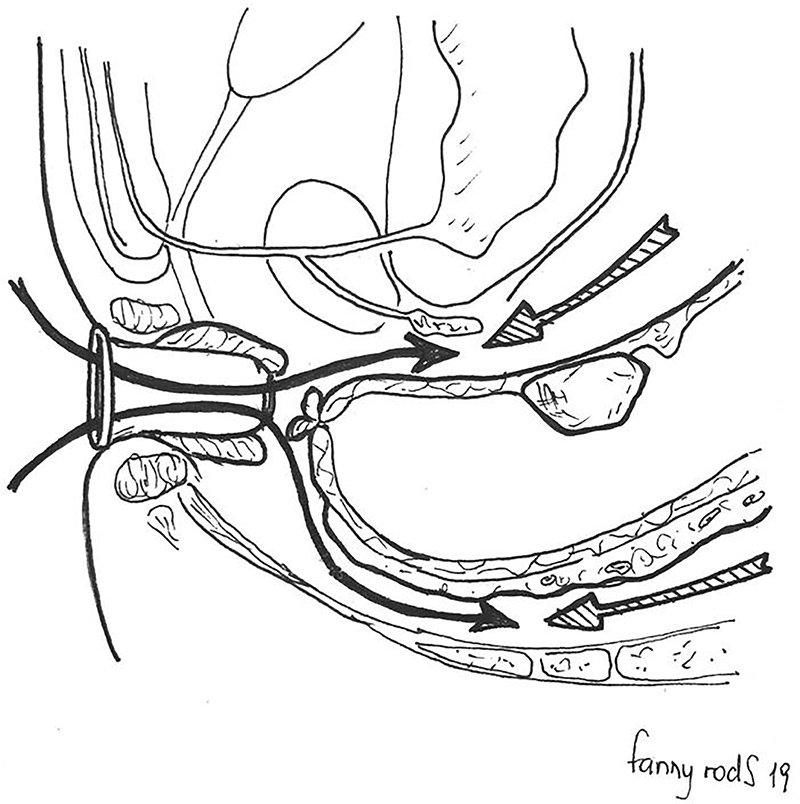
Figura 3: Esquema que grafica el sentido de la disección transanal “de abajo hacia arriba” una vez delimitado el margen distal del recto, y el punto de encuentro con la disección transabdominal.
Indicaciones
Aun cuando en la actualidad el abordaje transanal o transperineal ha sido descripto en situaciones menos frecuentes como reconstrucciones de tránsito, amputaciones abdominoperineales o incluso exenteraciones pelvianas27-29 (las cuales serán comentadas en otro capítulo), el cáncer de recto ha sido y continúa siendo la indicación más frecuente que llevó adelante el desarrollo de este abordaje. En menor medida, las enfermedades inflamatorias intestinales constituyen la segunda indicación en frecuencia. En este apartado se analizarán distintas variables inherentes a la indicación de este abordaje tanto en patología maligna como benigna.
Selección de pacientes
Si bien han sido esbozadas como opinión de expertos ciertas recomendaciones para la implementación segura de la taTME para el tratamiento del cáncer de recto30, hasta el momento no existen guías o recomendaciones oficiales que definan criterios de selección de casos para este abordaje. Tanto hombres como mujeres portadoras de cáncer de recto pueden ser sometidos a una taTME. Sin embargo, se ha destacado que donde se obtiene el mayor beneficio de este abordaje es, generalmente, en pacientes de sexo masculino, obesos, con un mesorrecto o tumores de recto medio/inferior voluminosos y/o con un volumen prostático elevado30. Asimismo, la imposibilidad de progresar la disección de arriba hacia abajo por vía anterior puede ser otra indicación de este abordaje, convirtiendo el procedimiento de un abordaje clásico a uno transanal.
De lo antedicho se desprende que los factores que pueden condicionar la selección de los pacientes para una taTME dependen de tres aspectos fundamentales: las características del paciente, del tumor y del propio procedimiento.
Características demográficas del paciente
La obesidad se ha destacado previamente como un factor de dificultad técnica que motiva porcentajes elevados de conversión en cirugía laparoscópica por cáncer de recto12,18. El aumento de la grasa visceral observada en esta se asocia generalmente a la presencia de mesos voluminosos que, a su vez, estrechan el hiato pelviano e impiden progresar la disección desde arriba hacia el piso pelviano (fig. 4). Esta situación (índice de masa corporal mayor de 30 kg/m2 con elevada grasa visceral) has sido señalada como una indicación propicia para un abordaje transanal31.
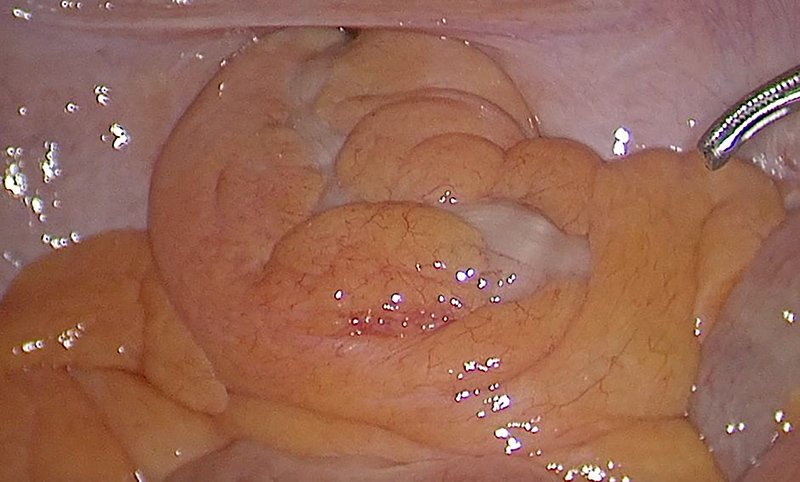
Figura 4: Imagen laparoscópica del recto ingresando en la pelvis, en un hombre con índice de masa corporal de 36 kg/m, portador de un tumor de recto inferior. Se destaca el volumen del mesorrecto que ocupa la totalidad del hiato pelviano.
Otro aspecto relacionado con las características del paciente tiene que ver con la estrechez pelviana, la cual también se ha mencionado como otra situación propicia para la implementación del abordaje transanal, debido a su asociación con un elevado índice de conversión en cirugía laparoscópica26. A su vez, diferentes estudios han documentado que ciertas variables de la pelvimetría pelviana, obtenidas por tomografía computarizada (TC) o resonancia magnética (RM), han sido asociadas no solo a elevadas tasas de conversión sino también a piezas de TME de baja calidad19,32,33.
Características del tumor
Entre los factores propios del tumor primario, las variables para tener en cuenta son la altura y estadificación tumoral, así como la indicación de radioterapia neoadyuvante. Respecto de esta última, la distorsión anatómica de los planos de disección generados por el tratamiento radiante ha sido considerada una indicación adecuada para este abordaje31. La altura tumoral establecida para este procedimiento ha sido 12 cm o menos, incluyendo tumores muy bajos31. Más recientemente se ha mencionado que la colocación de una jareta transanal en el recto medio/alto puede resultar sumamente dificultosa30. Por ello, la indicación más precisa para una taTME son los tumores de recto medio e inferior. Sin embargo, la altura tumoral como criterio de indicación de este procedimiento continúa siendo tema debatible. Los estudios europeos en curso prospectivos y aleatorizados COLOR III y GRECCAR 11, cuyo objetivo es comparar la taTME versus la TME laparoscópica, están reclutando pacientes con tumores de hasta 10 y 6 cm, respectivamente34,35. Esto ha sido señalado por otros autores con cierta preocupación, ya que la resección de tumores altos que no requerirían una TME genera la pérdida innecesaria de parte del reservorio rectal, con todas las alteraciones funcionales relacionadas con una anastomosis baja o coloanal36. En el otro extremo, para los tumores muy bajos, el último consenso de expertos resalta que una taTME con disección interesfinteriana puede ser realizada preservando parte de la función esfinteriana. Esto requiere un cirujano entrenado, ya que la continuidad del tránsito intestinal se establece mediante la confección de una anastomosis coloanal o pouch anal con sutura manual30.
La estadificación local del tumor primario es otro aspecto para tener en cuenta en caso de indicar este abordaje. Si bien el segundo Consenso de expertos llevado a cabo en París en 2014 definió a los tumores T4 como una contraindicación formal31, la tercera Reunión de Consenso celebrada en Suiza en 2016 no hizo mención de este punto30. Más aún, en el último análisis publicado por el registro internacional de taTME, sobre 1594 pacientes operados, 30 (2,1%) fueron lesiones T437. Esto permite inferir que, a medida que los distintos grupos quirúrgicos van adquiriendo experiencia con la adopción de esta técnica, casos más complejos van siendo seleccionados.
Características del procedimiento
Finalmente, el tipo de procedimiento que deba realizarse también desempeña un papel en la selección del caso. Como fue mencionado en el apartado anterior, la eventualidad de realizar una disección interesfinteriana estará marcada por la localización del tumor. Rullier y cols. establecieron una clasificación para guiar al cirujano actuante en el manejo de los tumores de recto inferior, de acuerdo con la relación de estos con el anillo anorrectal38. Más recientemente, Knol y Chadi propusieron una versión modificada que establece ciertas pautas técnicas para iniciar el abordaje transanal39. Estos detalles serán ampliados en el capítulo de correspondiente a técnica quirúrgica de la taTME.
Por último, cabe mencionar que el abordaje transanal también ha sido incorporado a la práctica clínica por cirujanos que se dedican al manejo de las enfermedades inflamatorias intestinales (colitis ulcerosa y enfermedad de Crohn), aunque en menor medida si se lo compara con la patología maligna. Este se ve reflejado en los datos del registro internacional en el cual solo el 3,4% de los pacientes ingresados fueron operados por enfermedades benignas37.
La indicación más frecuente es la proctectomía transanal junto a la confección de un reservorio ileal. La racionalidad para su indicación se apoya en que este abordaje identifica claramente el sitio para realizar la rectotomía, impidiendo que quede mucosa rectal retenida (o cuff) en la futura anastomosis ileoanal que condicione nuevos episodios de inflamación en dicho nivel (cuffitis). A su vez, la sección transanal del recto evita uno de los pasos más dificultosos de la cirugía rectal laparoscópica: el cierre y la sección del recto con suturas mecánica lineales a la altura del anillo anorrectal. Como se ha destacado más arriba en este capítulo, tal maniobra requiere generalmente más de un disparo de sutura mecánica, lo cual ha sido asociado a una mayor tasa de dehiscencia anastomótica13. Dicho esto, la anastomosis con doble sutura mecánica es reemplazada por una anastomosis de una única sutura mecánica circular, evitando de este modo la superposición de dos líneas de sutura, así como el remanente de la sutura lineal que queda por fuera de la anastomosis circular, lo cual ha sido identificado como otro factor de riesgo de fuga anastomótica40. Diferentes estudios con resultados promisorios de la proctectomía transanal con anastomosis ileoanal por colitis ulcerosa comparada con el abordaje miniinvasivo transabdominal fueron recientemente informados41.
BIBLIOGRAFÍA
- Peeters KCMJ, Koen C M, Marijnen CAM, Nagtegaal ID, Kranenbarg EK, Putter H, et al. The TME Trial After a Median Follow-up of 6 Years [Internet]. Ann Surg. 2007; 246: 693-701. Available from: http://dx.doi.org/10.1097/01.sla.0000257358.56863.ce.
- Heald RJ, Ryall RDH. Recurrence and survival after total mesorectal excision for rectal cancer [Internet]. The Lancet. 1986; 327: 1479-82. Available from: http://dx.doi.org/10.1016/s0140-6736(86)91510-2.
- Quirke P, Steele R, Monson J, Grieve R, Khanna S, Couture J, et al. Effect of the plane of surgery achieved on local recurrence in patients with operable rectal cancer: a prospective study using data from the MRC CR07 and NCIC-CTG CO16 randomised clinical trial [Internet]. The Lancet. 2009; 373: 821-8. Available from: http://dx.doi.org/10.1016/s0140-6736(09)60485-2.
- Martling A, Singnomklao T, Holm T, Rutqvist LE, Cedermark B. Prognostic significance of both surgical and pathological assessment of curative resection for rectal cancer [Internet]. Brit J Surg. 2004; 91: 1040-5. Available from: http://dx.doi.org/10.1002/bjs.4557.
- Nikberg M, Kindler C, Chabok A, Letocha H, Shetye J, Smedh K. Circumferential resection margin as a prognostic marker in the modern multidisciplinary management of rectal cancer. Dis Colon Rectum. 2015; 58(3):275-82.
- Lyttle JA, Parks AG. Intersphincteric excision of the rectum [Internet]. Vol. 64, Brit J Surg. 1977; 64: 413-6. Available from: http://dx.doi.org/10.1002/bjs.1800640611.
- Parks AG, Percy JP. Resection and sutured colo-anal anastomosis for rectal carcinoma [Internet]. Brit J Surg. 1982; 69: 301-4. Available from: http://dx.doi.org/10.1002/bjs.1800690602.
- Marks G, Mohiuddin M, Rakinic J. New hope and promise for sphincter preservation in the management of cancer of the rectum. Semin Oncol. 1991; 18(4):38898.
- Marks J, Nassif G, Schoonyoung H, DeNittis A, Zeger E, Mohiuddin M, et al. Sphincter-sparing surgery for adenocarcinoma of the distal 3 cm of the true rectum: results after neoadjuvant therapy and minimally invasive radical surgery or local excision [Internet]. Surg Endosc. 2013; 27: 4469-77. Available from: http://dx.doi.org/10.1007/s00464-013-3092-3.
- Website [Internet]. [cited 2019 May 5]. Available from: Bueß G, Theiß R, Günther M, Hutterer F, Pichlmaier H. Endoscopic Surgery in the Rectum [Internet]. Endoscopy. 1985; 17: 31-5. Available from: http://dx.doi.org/10.1055/s-2007-1018451.
- Atallah S, Albert M, Larach S. Transanal minimally invasive surgery: a giant leap forward. Surg Endosc. 2010; 24(9):2200–5.
- Pas MH van der, van der Pas MH, Haglind E, Cuesta MA, Fürst A, Lacy AM, et al. Laparoscopic versus open surgery for rectal cancer (COLOR II): short-term outcomes of a randomised, phase 3 trial [Internet]. Lancet Oncol. 2013; 14: 210-8. Available from: http://dx.doi.org/10.1016/s1470-2045(13)70016-0.
- Ito M, Sugito M, Kobayashi A, Nishizawa Y, Tsunoda Y, Saito N. Relationship between multiple numbers of stapler firings during rectal division and anastomotic leakage after laparoscopic rectal resection [Internet]. Int J Colorectal Dis. 2008; 23: 703-7. Available from: http://dx.doi.org/10.1007/s00384-008-0470-8.
- Bosch SL, Nagtegaal ID. The Importance of the Pathologist’s Role in Assessment of the Quality of the Mesorectum [Internet]. Current Colorectal Cancer Reports. 2012; 8: 90-8. Available from:http://dx.doi.org/10.1007/s11888-012-0124-7.
- Breukink SO, van der Zaag-Loonen HJ, Bouma EMC, J P E, Hoff C, Wiggers T, et al. Prospective Evaluation of Quality of Life and Sexual Functioning After Laparoscopic Total Mesorectal Excision [Internet]. Dis Colon Rectum. 2007; 50: 147-55. Available from: http://dx.doi.org/10.1007/s10350-006-0791-z.
- Website [Internet]. [cited 2019 May 5]. Available from: Pas MH van der, van der Pas MH, Haglind E, Cuesta MA, Fürst A, Lacy AM, et al. Laparoscopic versus open surgery for rectal cancer (COLOR II): short-term outcomes of a randomised, phase 3 trial [Internet]. The Lancet Oncology. 2013; 14: 210-8. Available from: http://dx.doi.org/10.1016/s1470-2045(13)70016-0.
- Kang S-B, Park JW, Jeong S-Y, Nam BH, Choi HS, Kim D-W, et al. Open versus laparoscopic surgery for mid or low rectal cancer after neoadjuvant chemoradiotherapy (COREAN trial): short-term outcomes of an open-label randomised controlled trial. Lancet Oncol. 2010 J; 11(7):637-45.
- Guillou PJ, Quirke P, Thorpe H, Walker J, Jayne DG, Smith AMH, et al. Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer (MRC CLASICC trial): multicentre, randomised controlled trial [Internet]. The Lancet. 2005; 365: 1718-26. Available from: http://dx.doi.org/10.1016/s0140-6736(05)66545-2.
- Targarona EM, Balagué C, Pernas JC, Martínez C, Berindoague R, Gich I, et al. Can We Predict Immediate Outcome After Laparoscopic Rectal Surgery? Multivariate Analysis of Clinical, Anatomic, and Pathologic Features After 3-Dimensional Reconstruction of the Pelvic Anatomy [Internet]. Ann Surg. 2008; 247: 642-9. Available from: http://dx.doi.org/10.1097/sla.0b013e3181612c6a.
- Memon S, Heriot AG, Murphy DG, Bressel M, Craig Lynch A. Robotic versus Laparoscopic Proctectomy for Rectal Cancer: A Meta-analysis [Internet]. Ann Surg Oncol. 2012; 19: 2095-101. Available from: http://dx.doi.org/10.1245/s10434-012-2270-1.
- Colombo P-E, Bertrand MM, Alline M, Boulay E, Mourregot A, Carrère S, et al. Robotic Versus Laparoscopic Total Mesorectal Excision (TME) for Sphincter-Saving Surgery: Is There Any Difference in the Transanal TME Rectal Approach? : A Single-Center Series of 120 Consecutive Patients. Ann Surg Oncol. 2016; 23(5):1594-600.
- Jayne D, Pigazzi A, Marshall H, Croft J, Corrigan N, Copeland J, et al. Effect of Robotic-Assisted vs Conventional Laparoscopic Surgery on Risk of Conversion to Open Laparotomy Among Patients Undergoing Resection for Rectal Cancer: The ROLARR Randomized Clinical Trial. JAMA. 2017; 318(16):1569-80.
- Stevenson ARL, Solomon MJ, Lumley JW, Hewett P, Clouston AD, Gebski VJ, et al. Effect of Laparoscopic-Assisted Resection vs Open Resection on Pathological Outcomes in Rectal Cancer [Internet]. JAMA. 2015; 314: 1356. Available from: http://dx.doi.org/10.1001/jama.2015.12009.
- Fleshman J, Branda M, Sargent DJ, Boller AM, George V, Abbas M, et al. Effect of Laparoscopic-Assisted Resection vs Open Resection of Stage II or III Rectal Cancer on Pathologic Outcomes [Internet]. JAMA. 2015; 314: 1346. Available from: http://dx.doi.org/10.1001/jama.2015.10529.
- Sylla P, Rattner DW, Delgado S, Lacy AM. NOTES transanal rectal cancer resection using transanal endoscopic microsurgery and laparoscopic assistance. Surg Endosc. 2010; 24(5):1205-10.
- Rouanet P, Mourregot A, Azar CC, Carrère S, Gutowski M, Quenet F, et al. Transanal endoscopic proctectomy: an innovative procedure for difficult resection of rectal tumors in men with narrow pelvis. Dis Colon Rectum. 2013; 56(4):408-15.
- Uematsu D, Akiyama G, Sugihara T, Magishi A, Ono K, Yamaguchi T, et al. Transanal Total Pelvic Exenteration With Sphincter-Preserving Surgery [Internet]. Dis Colon Rectum. 2018; 61: 641. Available from: http://dx.doi.org/10.1097/dcr.0000000000001031.
- Hasegawa S, Okada T, Hida K, Kawada K, Sakai Y. Transperineal minimally invasive approach for extralevator abdominoperineal excision. Surg Endosc. 2016; 30(10):4620-1.
- Bravo R, Fernández-Hevia M, Jiménez-Toscano M, Flores LF, de Lacy B, Quaresima S, et al. Transanal Hartmann reversal: a new technique. Surg Endosc. 2016; 30(6):2628-31.
- Adamina M, Buchs NC, Penna M, Hompes R, St.Gallen Colorectal Consensus Expert Group. St.Gallen consensus on safe implementation of transanal total mesorectal excision. Surg Endosc. 2018; 32(3):1091-103.
- Motson RW, Whiteford MH, Hompes R, Albert M, Miles WFA, the Expert Group. Current status of trans-anal total mesorectal excision (TaTME) following the Second International Consensus Conference [Internet]. Colorectal D. 2016; 18: 13-8. Available from: http://dx.doi.org/10.1111/codi.13131.
- Ferko A, Malý O, Örhalmi J, Dolejš J. CT/MRI pelvimetry as a useful tool when selecting patients with rectal cancer for transanal total mesorectal excision [Internet]. Surg Endosc. 2016; 30: 1164-71. Available from: http://dx.doi.org/10.1007/s00464-015-4324-5.
- Killeen T, Banerjee S, Vijay V, Al-Dabbagh Z, Francis D, Warren S. Magnetic resonance (MR) pelvimetry as a predictor of difficulty in laparoscopic operations for rectal cancer [Internet]. Surg Endosc. 2010; 24: 2974-9. Available from: http://dx.doi.org/10.1007/s00464-010-1075-1.
- Deijen CL, Velthuis S, Tsai A, Mavroveli S, de Lange-de Klerk ESM, Sietses C, et al. COLOR III: a multicentre randomised clinical trial comparing transanal TME versus laparoscopic TME for mid and low rectal cancer. Surg Endosc. 2016; 30(8):3210-5.
- Lelong B, de Chaisemartin C, Meillat H, Cournier S, Boher JM, Genre D, et al. A multicentre randomised controlled trial to evaluate the efficacy, morbidity and functional outcome of endoscopic transanal proctectomy versus laparoscopic proctectomy for low-lying rectal cancer (ETAP-GRECCAR 11 TRIAL): rationale and design. BMC Cancer. 2017; 17(1):253.
- Bendl R, Bergamaschi R. Transanal TME: a bum rap? Colorectal Dis. 2016; 18(1):7-8.
- Penna M, Hompes R, Arnold S, Wynn G, Austin R, Warusavitarne J, et al. Incidence and Risk Factors for Anastomotic Failure in 1594 Patients Treated by Transanal Total Mesorectal Excision [Internet]. Ann Surg. 2019; 269: 700-11. Available from: http://dx.doi.org/10.1097/sla.0000000000002653.
- Rullier E, Denost Q, Vendrely V, Rullier A, Laurent C. Low rectal cancer: classification and standardization of surgery. Dis Colon Rectum. 2013; 56(5):560-7.
- Knol J, Chadi SA. Transanal total mesorectal excision: technical aspects of approaching the mesorectal plane from below. Minim Invasive Ther Allied Technol. 2016; 25(5):257-70.
- Roumen RM, Rahusen FT, Wijnen MH, Croiset van Uchelen FA. “Dog ear” formation after double-stapled low anterior resection as a risk factor for anastomotic disruption. Dis Colon Rectum. 2000; 43(4):522-5.
- van Overstraeten A de B, Mark-Christensen A, Wasmann KA, Bastiaenen VP, Buskens CJ, Wolthuis AM, et al. Transanal Versus Transabdominal Minimally Invasive (Completion) Proctectomy with Ileal Pouch-anal Anastomosis in Ulcerative Colitis [Internet]. Ann Surg. 2017; 266: 878-83. Available from: http://dx.doi.org/10.1097/sla.0000000000002395.
