7. Resección Endoscópica Transanal versus Resección Mucosa Endoscópica y Disección Endoscópica Submucosa
REV ARGENT COLOPROCT | 2019 | VOL. 30, N° 3: 40-44
RELATO ANUAL
CAPÍTULO 7
Resección Endoscópica Transanal versus Resección Mucosa Endoscópica y Disección Endoscópica Submucosa
La detección temprana y posterior resección de lesiones neoplásicas del recto resultan clave para reducir el riesgo de progresión a un cáncer. Diferentes alternativas terapéuticas han sido descriptas para el tratamiento de estas lesiones: resección local transanal convencional (TAE), resección mucosa endoscópica (RME), disección submucosa endoscópica (DSE, y en inglés ESD), las cuales se han estudiado en relación con la cirugía endoscópica transanal (TEM).
En capítulos anteriores se ha discutido el papel y los resultados de la TAE en comparación con la TEM. En este capítulo discutiremos y analizaremos los resultados de las RME y la ESD en comparación con la TEM.
TEM VS. RESECCIÓN MUCOSA ENDOSCÓPICA
Como fue mencionado, la RME es la técnica de preferencia para la resección de adenomas colorrectales de pequeño tamaño. Sin embargo, su utilización en adenomas grandes es algo controvertida. La optimización de las imágenes, así como los instrumentos endoscópicos, ha llevado a la resección de pólipos grandes mediante la técnica de “piecemeal” (por partes) utilizando un ansa endoscópica, previa infiltración de la submucosa. Entre las ventajas de la RME se encuentran la baja tasa de complicaciones, el bajo costo y ser un procedimiento que generalmente no requiere anestesia general. En cambio, las desventajas radican en su mayor tasa de recurrencia, la necesidad de realizar más de un procedimiento, así como la imposibilidad de estudiar el espécimen de resección de manera completa y determinar adecuadamente el grado de invasión submucosa en el caso de un carcinoma invasor inesperado. La principal ventaja de la cirugía por TEM radica en la posibilidad de obtener un espécimen completo con baja tasa de fragmentación gracias a su adecuada visualización que permite una correcta disección (fig. 1).
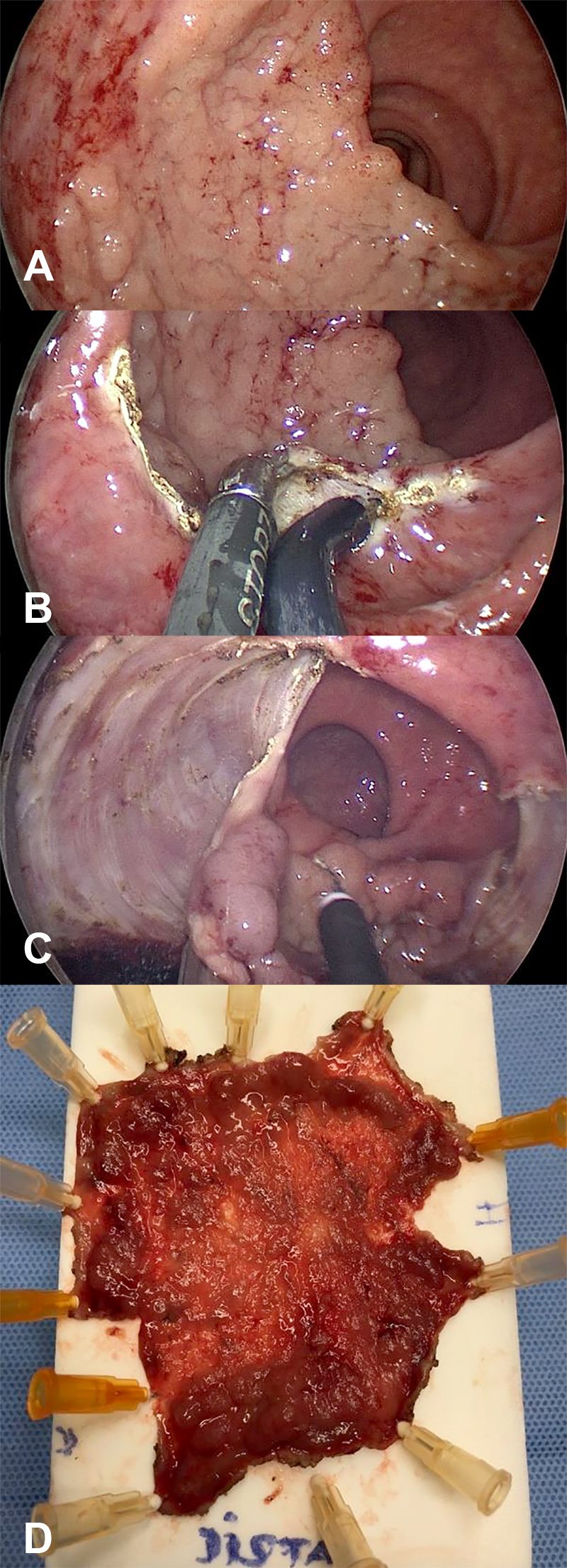
Figura 1: A) Adenoma velloso extendido lateralmente y que abarca más de la mitad de la circunferencia. B) Inicio de la resección endoscópica submucosa por TEM. C)Pared muscular denudada. D) Resección completa de la pieza extendida para su estudio posterior.
En 2011, Barendse y col. llevaron a cabo un metaanálisis sobre los trabajos disponibles en la literatura que comparaban RME y TEM para el tratamiento de adenomas rectales. Los autores examinaron los trabajos aleatorizados y series de casos disponibles con el objetivo de analizar variables de eficacia, recurrencia, tiempo operatorio, estadía hospitalaria, complicaciones y costo-efectividad. El principal problema con el que se encontraron fue que la mayoría de los trabajos de RME se referían a series de casos en los cuales se analizaron adenomas colorrectales sin distinción de localización ya sea colónica o rectal. Además, los estudios incluidos variaron considerablemente en los siguientes aspectos: si se incluyeron o no los cánceres rectales (TEM); pacientes seleccionados o consecutivos; resección de todo el espesor de la pared o no (TEM); aplicación de suturas (TEM); aplicación de argón plasma (RME); uso de adrenalina para el levantamiento de la submucosa (RME); criterios de alta hospitalaria; descripción clara de las complicaciones y tiempo de recurrencia. Teniendo en cuenta estos sesgos y factores confundidores, en total se analizaron 20 estudios de RME y 48 estudios de TEM. La tasa de recurrencia temprana fue del 11,2% para la RME vs. 5,4% para TEM (p = 0,04). Las tasas de recurrencia tardía fueron del 1,5% para la RME frente al 3,0% para TEM (p = 0,29). La morbilidad posoperatoria fue del 3,8% para RME vs. 13,0 para TEM (P <0,001)1.
En orden de brindar más información, Barendse y col. llevaron a cabo un estudio aleatorizado que involucró a 18 centros europeos y comparó los resultados de RME vs. TEM para la resección de adenomas rectales grandes2. En este estudio, varios pacientes con adenomas rectales ≥ 3 cm fueron aleatorizados 1:1 para RME o TEM y se les realizó una rectoscopia de control a los 3, 6, 12 y 24 meses. La tasa de adenoma residual a los 3 meses (luego de una intervención) fue de 19% para RME vs. 5% para TEM (p =0,008). De estos, la mayoría pudo ser tratada mediante una nueva resección endoscópica, hecho que se ve reflejado por una tasa de recurrencia alejada similar de 11% para TEM y 15% para RME. La tasa de complicaciones tampoco evidenció diferencias significativas (RME: 18% vs.TEM: 26%). Desde el punto de vista funcional, los pacientes fueron evaluados mediante manometría anorrectal a los 6 y 12 meses posteriores al procedimiento y a través del Score de Wexner para incontinencia fecal. No se observaron alteraciones manométricas en ambos grupos y, si bien los pacientes del grupo TEM tuvieron un score (puntaje) inferior, su continencia mejoró luego de la resección del adenoma. Sin embargo, un dato relevante es la alta incidencia de cánceres inesperados en los especímenes resecados que fue del 13%. Si bien la mayoría de ellos fueron lesiones T1 de “bajo riesgo”, la tasa de resección R0 fue del 53% para RME vs. 92% para TEM (p=0,04). Más aún, solo 5 de 12 pacientes (40%) con cáncer invasor en el grupo TEM requirieron una cirugía adicional, mientras que 12 de 15 (80%) sí lo requirieron en el grupo de RME.
En conclusión, mientras que la RME es un procedimiento seguro y costo-efectivo, se requirieron un mayor número de procedimientos para alcanzar los mismos resultados que la TEM. Por otro lado, la alta incidencia de cánceres no esperados abre un interrogante acerca de su seguridad oncológica a la hora de tratar adenomas rectales grandes. De esta manera, la TEM se posiciona como una mejor alternativa para el manejo de dicha patología.
TEM vs. Disección Mucosa Endoscópica
La ESD fue concebida en Japón con el objetivo de evitar la fragmentación de los especímenes y disminuir la recurrencia luego de su resección mediante RME, permitiendo una mayor tasa de resección en bloque de lesiones colorrectales más grandes. A pesar de su tiempo operatorio más prolongado y mayor índice de complicaciones, la ESD se asocia a una tasa de resección en bloque más alta en comparación con la RME convencional o por piezas3,4. La ESD aún no está completamente establecida como método terapéutico estándar para las lesiones colorrectales en todo el mundo. Sin embargo, en las últimas décadas, el desarrollo de nuevas técnicas endoscópicas ha permitido a la ESD realizar resecciones en bloque de lesiones superficiales con resultados similares a la TEM.
Desarrollada y estandarizada en Japón para la resección del cáncer gástrico temprano, la aplicación de la ESD se ha extendido al tracto digestivo distal y sobre todo al recto, donde sus resultados son comparables a los de la TEM5-9. La ESD se basa en la elevación del plano submucoso, lo que permite la disección cuidadosa de la lesión, utilizando un “cuchillo” electroquirúrgico, con bajo riesgo de lesión de la capa muscular. Para ello existen diferentes soluciones de inyección submucosa, cuchillos y capuchones endoscópicos en orden a facilitar la resección en bloque (fig. 2)10.
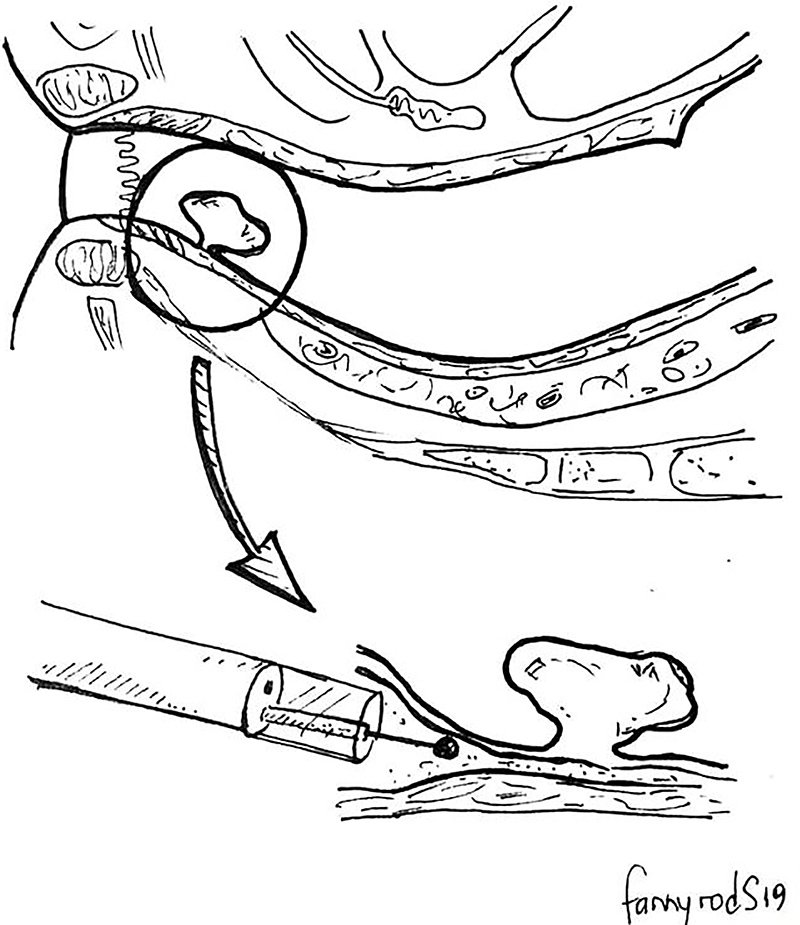
Figura 2: Esquema de una resección por ESD. La colocación de un capuchón en la punta del endoscopio proporciona una adecuada retracción de la capa submucosa y permite la visualización del plano submucoso-muscular propia.
La potencialidad maligna de los adenomas colorrectales ha sido bien establecida11. En Occidente, la incidencia de malignidad en pólipos colorrectales resecados varía del 2,6 al 9,7%, y en adenomas rectales mayores de 3 cm puede ser tan alta como el 25%12. La prevalencia de malignidad en pólipos rectales con biopsia previa de adenoma ha sido informada por varios autores. Así Guerrieri y col. observaron una prevalencia del 9%, aunque incluyendo los adenocarcinomas “in situ”, mientras que Ramírez y col. refirieron una prevalencia del 14%13,14. Más aún, un estudio reciente de Serra-Aracil y col. reveló, sobre un total de 227 pacientes con pólipos rectales con biopsia de adenoma resecados vía TEO/TEM, una incidencia de malignidad de 18,8% (27 pT1 (52%), 16 pT2 (30,7%), y 9 pT3 (17,3%)15,16. Basados en estos hallazgos, al igual que en otros, los autores proponen una resección de espesor total de la pared rectal, para que en caso de hallarse un adenocarcinoma invasor el patólogo pueda confirmar dicho hallazgo y así determinar si la resección local es o no un tratamiento suficiente. De lo contrario, una resección incompleta, podría condicionar una subestimación del verdadero estadio de esa lesión y ocultar la necesidad de una resección curativa (completion surgery) en casos de tumores invasivos más allá de la submucosa15.
Básicamente, las indicaciones para ESD son neoplasias colorrectales pasibles de una resección endoscópica en bloque donde la RME es difícil de aplicar. En este sentido, la estadificación preoperatoria es fundamental a fin de descartar lesiones invasoras. Así, la indicación más frecuente son lesiones > 2 cm con extensión lateral (Lateral Spreading Tumor), ya sea de tipo granular (LST-G) o de tipo no granular (LST-NG)17,18, en donde se sospecha la presencia de un carcinoma intramucoso o con poca invasión submucosa (sm1).
Resultados operatorios: Arezzoy col., en un reciente metaanálisis de un solo brazo de series de casos, analizaron y compararon los resultados del TEM vs. ESD. Utilizaron criterios de inclusión estrictos, limitando el análisis a las lesiones > 20 mm según pautas de la sociedad japonesa de colon y recto (JSCCR), sin sospecha de invasión submucosa por evaluación preoperatoria, y se excluyeron todas las series de TEM, donde se documentó malignidad en forma preoperatoria o donde no se realizó una resección de todo el espesor de la pared19. En este estudio, el índice de resecciones en bloque (especímenes sin fragmentación) fue de 87,8% (95% CI 84,3-90,6%) para la ESD y de 98,7% (95%CI 97,4–-99,3%) para la TEM; p<0,001. Se logró una resección R0 por ESD en el 74% (95%CI 70,4-78,4%) de los pacientes comparados con el 89% (95% CI 85,9-90,6%) por TEM; p< 0,001. Esto probablemente explique la necesidad de un mayor porcentaje de completion surgery luego de una ESD20. A su vez, el tiempo operatorio dela TEM fue significativamente inferior a la ESD (67 min versus 96 min, p= 0,003). Los autores concluyen que la TEM es el procedimiento de referencia (estándar de oro) para las resecciones locales de recto. Sin embargo, mencionan una gran heterogeneidad de resultados entre los diferentes trabajos. En este sentido cabe mencionar que la mayoría de los estudios de ESD analizados en dicho metaanálisis son anteriores a 2010 y no reflejan los resultados de los recientes desarrollos en ESD. En relación con esto, un reciente estudio comparativo de Jung y col. ha informado resultados superiores a los clásicamente descriptos21. Las tasas de resección en bloque de este estudio fueron semejantes para ESD como para TEM (95% versus 93,7%, p = 1) y las tasas de resección R0 fueron del 92,5% y 87,5%, respectivamente (p= 0,617). En este estudio, la ESD se asoció a un menor tiempo operatorio que TEM (71,5 ± 51,3 min vs. 105,6 ± 28,2 min, p = 0,016) y la estadía hospitalaria también fue significativamente más corta en el grupo de ESD (4,3 ± 1,2 días frente a 5,8 ± 1,8 días, p = 0,001). La tasa de recurrencia fue de 2,5% vs. 6,2% (p = 0,49) y no observaron diferencias significativas en lo que respecta a complicaciones posoperatorias.
Complicaciones. Cuando se analizan las complicaciones intraoperatorias y posoperatorias, suele postularse que la TEM, por ser un procedimiento más invasivo y que requiere anestesia, conlleva un mayor riesgo de complicaciones asociadas. Sin embargo, no existen trabajos aleatorizados y controlados que demuestren dicha observación. Más aún, Arezzo y col. en su metaanálisis no encontraron diferencias significativas en la tasa de complicaciones entre ambos procedimientos. La proporción de pacientes con complicaciones fue 8,0% (95% CI 5,4-11,8%) después de la ESD versus 8,4% (IC 95%: 5,2-13,4%) después de TEM (P = 0,874)20. Similares resultados fueron publicados por Jung y col. Recientemente21 as complicaciones más frecuentes observadas después de ESD son sangrado y perforación. Numerosos estudios unicéntricos y multicéntricos han informado una tasa de sangrado posterior a una ESD que varía del 0% al 11,9%17,18,21,22. La perforación es una complicación importante de la ESD; sin embargo, la mayoría de los casos de perforación se pueden tratar de forma conservadora mediante cierre con endoclips22. El tamaño de la lesión, la fibrosis submucosa y la experiencia de los operadores han sido señalados como factores de riesgo para la perforación durante la DSE21,23-26. Las complicaciones de la TEM se pueden dividir en intraoperatorias y posoperatorias Entre las complicaciones intraoperatorias, las más frecuentes son el sangrado y la perforación. La perforación hacia la cavidad peritoneal es una complicación frecuentemente referida con una incidencia que varía de 2-30%27,28. Entre los factores de riesgo para perforación se encuentran tumores más allá de 6 cm del margen anal. Sin embargo, la mayor parte de estas perforaciones pueden ser manejadas de manera conservadora mediante suturas endorrectales. En un reciente estudio de Restivo y col., más del 80% de las perforaciones se manejaron de manera conservadora. Debido a esto, la presencia de tumores altos debe alertar al cirujano de un riesgo mayor de perforación y no ser una contraindicación absoluta para realizar TEM o una resección de todo el espesor de la pared29. Entre las complicaciones posoperatorias más frecuentes luego de TEM se encuentran el sangrado, filtración de la sutura, fístulas, retención/infección urinaria y trastornos de la función anorrectal (incontinencia fecal), las cuales serán tratadas en otro capítulo19.
Recurrencia. Los principales factores asociados a la recurrencia son la resección R1 y la fragmentación del espécimen. Por lo tanto, cuanto mayor el índice de resecciones R0 y en bloque, menor el índice de recurrencia. Arezzo y col. en su metaanálisis comunicaron una tasa de recurrencia de 2,6% con un seguimiento de 6-12 meses para ESD,mientras que la serie TEM informó un período medio de seguimiento de 58,9 meses y una tasa de recurrencia del 5,2% sin diferencias significativas entre ambos grupos (P=0,06)19.
En definitiva, ambas técnicas (tanto ESD como TEM) son procedimientos mínimamente invasivos que pueden ser empleados para el tratamiento de adenomas rectales grandes e incluso carcinomas con invasión mínima de la submucosa. Una ventaja indiscutible de la ESD para las lesiones rectales es que no implica la necesidad de anestesia general o que se asocia a una estadía hospitalaria más corta. Sin embargo, la estadificación preoperatoria y por ende la distinción entre lesiones invasivas o no invasivas aún es subóptima, con una incidencia de cáncer inesperado no despreciable. Esto hace que una resección de todo el espesor de la pared vía TEM sea lo recomendable para una adecuada estadificación y eventual tratamiento definitivo.
BIBLIOGRAFÍA
- Barendse RM, van den Broek FJC, van Schooten J, Bemelman WA, Fockens P, de Graaf EJR, et al. Endoscopic mucosal resection vs transanal endoscopic microsurgery for the treatment of large rectal adenomas. Colorectal Dis. 2012;14(4):e191-6.
- Barendse RM, Musters GD, de Graaf EJR, van den Broek FJC, Consten ECJ, Doornebosch PG, et al. Randomised controlled trial of transanal endoscopic microsurgery versus endoscopic mucosal resection for large rectal adenomas (TREND Study). Gut. 2018;67(5):837-46.
- Hotta K, Fujii T, Saito Y, Matsuda T. Local recurrence after endoscopic resection of colorectal tumors. Int J Colorectal Dis. 2009;24(2):225-30.
- Tanaka S, Oka S, Chayama K. Colorectal endoscopic submucosal dissection: present status and future perspective, including its differentiation from endoscopic mucosal resection [Internet]. J Gastroenterol. 2008; 43:641-51. Available from: http://dx.doi.org/10.1007/s00535-008-2223-4
- Ono H, Kondo H, Gotoda T, Shirao K, Yamaguchi H, Saito D, et al. Endoscopic mucosal resection for treatment of early gastric cancer. Gut. 2001;48(2):225-9.
- Oyama T, Kikuchi Y. Aggressive endoscopic mucosal resection in the upper GI tract - Hook knife EMR method. Minim Invasive Ther Allied Technol. 2002;11(5-6):291-5.
- Yahagi N, Fujishiro M, Kakushima N, Kobayashi K, Hashimoto T, Oka M, et al. Endoscopic submucosal dissection for early gastric cancer using the tip of an electrosurgical snare (thin type) [Internet]. Dig Endosc. 2004; 16: 34-8. Available from: http://dx.doi.org/10.1111/j.1443-1661.2004.00313.x
- Yamamoto H, Yahagi N, Oyama T. Mucosectomy in the colon with endoscopic submucosal dissection. Endoscopy. 2005;37(8):764-8.
- Rösch T, Sarbia M, Schumacher B, Deinert K, Frimberger E, Toermer T, et al. Attempted endoscopic en bloc resection of mucosal and submucosal tumors using insulated-tip knives: a pilot series. Endoscopy. 2004;36(9):788-801.
- Burgess NG, Bourke MJ. Endoscopic resection of colorectal lesions: The narrowing divide between East and West. Dig Endosc. 2016;28(3):296-305.
- Leslie A, Carey FA, Pratt NR, Steele RJC. The colorectal adenoma-carcinoma sequence [Internet]. British Journal of Surgery. 2002; 89:845-60. Available from: http://dx.doi.org/10.1046/j.1365-2168.2002.02120.x
- Haboubi N, Scott M. Clinicopathological management of the patient with a malignant colorectal adenoma [Internet]. Colorectal Dis. 2000; 2: 2-7. Available from: http://dx.doi.org/10.1046/j.1463-1318.2000.00132.x
- Guerrieri M, Baldarelli M, de Sanctis A, Campagnacci R, Rimini M, Lezoche E. Treatment of rectal adenomas bytransanalendoscopicmicrosurgery: 15 years’ experience. SurgEndosc. 2010; 24(2):445-9.
- Ramírez JM, Aguilella V, Gracia JA, Ortego J, Escudero P, Valencia J, et al. Local full-thickness excision as first line treatment for sessile rectal adenomas: long-term results. Ann Surg. 2009;249(2):225-8.
- Serra-Aracil X, Caro-Tarrago A, Mora-López L, Casalots A, Rebasa P, Navarro-Soto S. Transanal Endoscopic Surgery With Total Wall Excision Is Required With Rectal Adenomas due to the High Frequency of Adenocarcinoma [Internet]. Dis Colon Rectum. 2014; 57:8239. Available from: http://dx.doi.org/10.1097/dcr.0000000000000139
- Hahnloser D, Wolff BG, Larson DW, Ping J, Nivatvongs S. Immediate Radical Resection After Local Excision of Rectal Cancer: An Oncologic Compromise? [Internet]. Dis Colon Rectum. 2005; 48:429-37. Available from: http://dx.doi.org/10.1007/s10350-004-0900-9
- Taku K, Sano Y, Fu K-I, Saito Y, Matsuda T, Uraoka T, et al. Iatrogenic perforation associated with therapeutic colonoscopy: a multicenter study in Japan. J Gastroenterol Hepatol. 2007;22(9):1409-14.
- Zhou P-H, Yao L-Q, Qin X-Y. Endoscopic submucosal dissection for colorectal epithelial neoplasm. Surg Endosc. 2009;23(7):1546-51.
- Arezzo A, Passera R, Saito Y, Sakamoto T, Kobayashi N, Sakamoto N, et al. Systematic review and meta-analysis of endoscopic submucosal dissection versus transanal endoscopic microsurgery for large noninvasive rectal lesions [Internet]. SurgEndosc. 2014; 28:427-38. Available from: http://dx.doi.org/10.1007/s00464-013-3238-3
- Jung Y, Lee J, Cho JY, Kim YD, Park CG, Kim MW, et al. Comparison of efficacy and safety between endoscopic submucosal dissection and transanal endoscopic microsurgery for the treatment of rectal tumor. Saudi J Gastroenterol. 2018;24(2):115-21.
- Kim ES, Cho KB, Park KS, Lee KI, Jang BK, Chung WJ, et al. Factors predictive of perforation during endoscopic submucosal dissection for the treatment of colorectal tumors. Endoscopy. 2011;43(7):573-8.
- Yamamoto K, Hayashi S, Saiki H, Indo N, Nakabori T, Yamamoto M, et al. Endoscopic submucosal dissection for large superficial colorectal tumors using the “clip-flap method.” Endoscopy. 2015;47(3):262-5.
- Hayashi N, Tanaka S, Nishiyama S, Terasaki M, Nakadoi K, Oka S, et al. Predictors of incomplete resection and perforation associated with endoscopic submucosal dissection for colorectal tumors. GastrointestEndosc. 2014;79(3):427-35.
- Lee E-J, Lee JB, Choi YS, Lee SH, Lee DH, Kim DS, et al. Clinical risk factors for perforation during endoscopic submucosal dissection (ESD) for large-sized, nonpedunculated colorectal tumors. Surg Endosc. 2012;26(6):1587-94.
- Saito Y, Uraoka T, Yamaguchi Y, Hotta K, Sakamoto N, Ikematsu H, et al. A prospective, multicenter study of 1111 colorectal endoscopic submucosal dissections (with video). GastrointestEndosc. 2010;72(6):1217-25.
- Hori K, Uraoka T, Harada K, Higashi R, Kawahara Y, Okada H, et al. Predictive factors for technically difficult endoscopic submucosal dissection in the colorectum. Endoscopy. 2014;46(10):862-70.
- Dafnis G, Påhlman L, Raab Y, Gustafsson U.-M, Graf W. Transanal endoscopic microsurgery: clinical and functional results [Internet]. Colorectal Dis. 2004; 6:336-42. Available from: http://dx.doi.org/10.1111/j.1463-1318.2004.00629.x
- Law WL, Delaney CP. Single Incision Laparoscopic and Transanal Colorectal Surgery. New York: Springer Science & Business Media; 2013. 117 p.
- Restivo A, Zorcolo L, D’Alia G, Cocco F, Cossu A, Scintu F, et al. Risk of complications and long-term functional alterations after local excision of rectal tumors with transanal endoscopic microsurgery (TEM) [Internet]. Int J Colorectal Dis. 2016; 31:257-66. Available from:http://dx.doi.org/10.1007/s00384-015-2371-y
