4. Indicaciones y Resultados Oncológicos de la Resección Local Transanal
REV ARGENT COLOPROCT | 2019 | VOL. 30, N° 3: 26-32
RELATO ANUAL
CAPÍTULO 4
Indicaciones y Resultados Oncológicos de la Resección Local Transanal
Como fue mencionado anteriormente, si bien existen otras indicaciones de cirugía transanal como la remoción de pequeños tumores carcinoides y GIST, la reparación de fístulas recto-vaginales, el drenaje de abscesos pelvianos y el tratamiento de estenosis de anastomosis colorrectales, en este capítulo nos referiremos exclusivamente a la cirugía transanal de lesiones neoplásicas colorrectales. En este sentido, las principales indicaciones de la cirugía endoscópica transanal son:
- Lesiones benignas de recto o colon distal (primarias o recurrentes) que no pueden ser removidas a través de una colonoscopia por su tamaño, extensión lateral, sospecha de malignidad o recurrencia.
- Tumores de recto tempranos.
- Tumores de recto sometidos a una terapia adyuvante (generalmente radioterapia posoperatoria) o neoadyuvante (quimioterapia o radioterapia preoperatoria o ambas técnicas).
LESIONES BENIGNAS (ADENOMAS)
Los adenomas de recto representan la indicación más frecuente de la cirugía endoscópica transanal, la cual a su vez puede ser complementaria de la resección endoscópica mucosa y/o la disección endoscópica submucosa (EMR y ESD; siglas en inglés de Endoscopic Mucosal Resection y Endoscopic Submucosal Dissection, respectivamente). Los resultados de ambas técnicas comparadas con la cirugía endoscópica transanal serán motivo de análisis en otro capítulo.
Distintas series de adenomas de recto resecados a través de este abordaje y con un adecuado tiempo de seguimiento han evidenciado un bajo índice de recurrencia (de un 4 a un 12%) y además mostraron ser una técnica más eficaz que la vía transanal convencional en términos de compromiso de márgenes y fragmentación de la pieza1-3. Entre los factores de riesgo de recurrencia se encuentran el tamaño inicial de la lesión, la resección previa por partes (más conocida por su denominación en inglés: piecemeal) y la detección de márgenes positivos en el estudio anatomopatológico4,5. Tejido adenomatoso residual ha sido detectado en hasta un 37% de los márgenes de las piezas resecadas por cirugía endoscópica transanal5. Se especula que la discrepancia entre este alto porcentaje de margen comprometido y una baja recurrencia se debe a que el daño térmico de la energía monopolar utilizada durante el procedimiento favorece la esterilización del margen residual que pudiera quedar en el lecho tumoral. Las resecciones R1 pueden aumentar el índice de recurrencia hasta un 29% con un seguimiento adecuado1.
El otro factor de riesgo de recurrencia es el tamaño de la lesión. En la serie de Allaix y col., sobre 293 adenomas de recto resecados por cirugía endoscópica transanal, el 21% de las lesiones mayores de 5 cm presentaron márgenes positivos, mientras que aquellas lesiones menores de 5 cm presentaron un compromiso de márgenes del 9%, estableciendo que el diámetro mayor de 5 cm fue un factor predictivo de recurrencia local5. Dado que la recurrencia local es un evento relativamente frecuente luego de resecar lesiones mayores de 5 cm, es recomendable un estricto seguimiento endoscópico de estos pacientes. A su vez, distintas series han revelado la seguridad y eficacia de la cirugía endoscópica transanal en el tratamiento de la recurrencia de estas lesiones, sin aumentar la morbilidad ni la incidencia de nueva recurrencia de estas lesiones4,6.
Los adenomas colorrectales se consideran lesiones premalignas, con riesgo potencial de desarrollar un adenocarcinoma7. Más específicamente, los adenomas de recto presentan una incidencia de transformación maligna que puede alcanzar hasta casi un 40%8.9. A su vez, el tamaño se considera un factor de riesgo de malignidad: aquellas lesiones mayores de 2-3 cm presentan un riesgo que puede alcanzar hasta un 50%10. Distintos autores han informado la incidencia de malignidad en series de pacientes portadores de lesiones adenomatosas de recto resecadas por cirugía endoscópica transanal. Guerrieri y col.2 y Ramírez y col.8 presentaron una incidencia del 9% y 14%, respectivamente; en tanto Serra-Aracil y col.11 refieren una incidencia mayor de cáncer invasor del 18,8% (52 pacientes sobre 277 tratados por adenomas de recto). Estos hallazgos, sumados a las limitaciones de la ecografía endorrectal y la resonancia magnética nuclear en la estadificación de estas lesiones tempranas, hacen que la decisión de resecarlas se incline por hacerlo involucrando el espesor completo de la pared rectal11.
Otra presentación poco frecuente, pero que impone un desafío técnico para este abordaje, son aquellas lesiones benignas que involucran toda la circunferencia de la luz rectal o más de tres cuartos de ella (fig. 1).
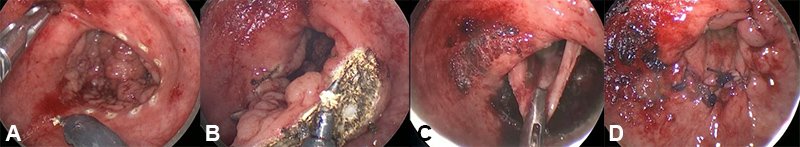
Figura 1: Imagen endoscópica de adenoma velloso circunferencial de recto medio en una mujer de 42 años tratada en el Hospital Italiano de Buenos Aires. A) Marcación de los márgenes. B) Resección de espesor total de la pared rectal. C) Aproximación de cabos para anastomosar. D) Cierre del defecto.
En estos casos, con la debida experiencia, la cirugía endoscópica transanal puede permitir remover este tipo de lesiones que, de otra manera, deberían ser resecadas mediante una resección anterior. Arezzo y col. informan la factibilidad de este tipo de procedimiento en una serie de 17 pacientes portadores de lesiones circunferenciales resecados por TEO (Transanal Endoscopic Operation), con una tasa de dehiscencia parcial de la anastomosis de 29,4% (5 pacientes tratados de forma conservadora con terapia de vacío endoluminal) y de estenosis anastomótica alejada de 23,5% (4 pacientes tratados con sesiones repetidas de dilatación endoscópica con balón).
TUMORES DE RECTO TEMPRANO
La resección local transanal como tratamiento de casos seleccionados de cáncer de recto ha sido considerada una alternativa válida frente a la cirugía radical. Esta última, a su vez, continúa siendo el estándar de cuidado de los tumores del recto extraperitoneal12. Sin embargo, la morbimortalidad asociada a este procedimiento (dehiscencia anastomótica, disfunción urinaria y sexual e incontinencia fecal)13 hacen de la resección local transanal un método sumamente atractivo no solo para pacientes de alto riesgo sino también para aquellos con lesiones tempranas cuyos predictores de recurrencia local son bajos, situación en la cual una cirugía radical puede no aportar beneficios en términos oncológicos.
Uno de los principales inconvenientes vinculados a la resección local transanal de los tumores de recto es que este procedimiento deja casi intacto el mesorrecto junto al componente linfoganglionar. Esto lleva a que el riesgo de recurrencia, luego de una resección local transanal, se encuentre relacionado con el compromiso metastásico de sus ganglios. Por ello resulta crítico identificar factores de riesgo de metástasis ganglionares durante la estadificación preoperatoria para seleccionar pacientes pasibles de ser tratados mediante este abordaje.
Uno de los factores de riesgo de compromiso ganglionar más conocido es el grado de penetración tumoral en la pared del órgano. El riesgo de compromiso ganglionar global descripto para los tumores pT1 ha sido de hasta un 13%. Sin embargo, cuando se discrimina el nivel de penetración por tercios de la submucosa, el riesgo varía ostensiblemente, siendo de entre 0 y 3% para el estadio pT1 sm1, de entre 8 y 11% para el estadio pT1 sm2 y de entre 10 y 23% para el estadio pT1 sm314,15. Estos hallazgos fueron confirmados por otro estudio multicéntrico sobre 253 pacientes portadores de lesiones pT1 resecados localmente por cirugía endoscópica transanal16. Más recientemente, otro estudio retrospectivo informó un riesgo de metástasis ganglionares del 21% para los tumores de recto pT2. De esto se desprende que las lesiones pT1 sm2 y sm3 presentan un comportamiento similar a las lesiones pT2. Otras características importantes asociadas al riesgo de compromiso ganglionar son el grado de diferenciación tumoral, la invasión linfovascular y la localización en el recto distal17.
ESTADIFICACIÓN LOCAL
La estadificación clínica y radiológica resulta crítica a la hora de decidir una conducta frente a lesiones tempranas potencialmente pasibles de una resección local transanal. En tal escenario, la ecografía endorrectal (EER) y la resonancia magnética nuclear (RMN) han sido ampliamente estudiadas y parecen tener un papel complementario (fig. 2).
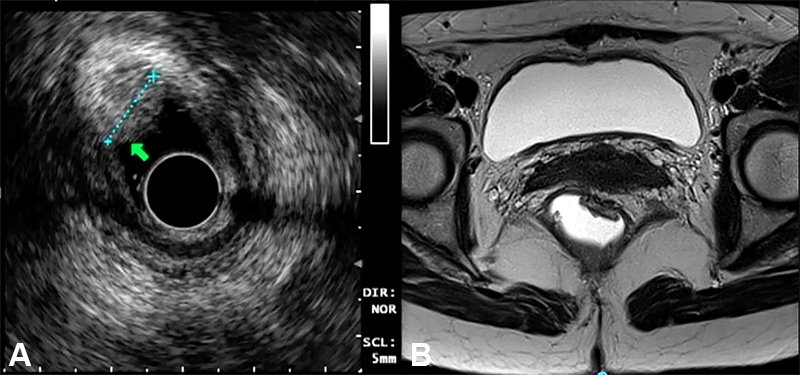
Figura 2: A) EER que muestra lesión T1 sin evidencia de invasión tumoral hacia la submucosa. B) Corte axial de RMN de lesión T1 que descarta invasión hacia el plano de la muscular propia del recto. EER: ecografía endorrectal, RMN: resonancia magnética nuclear.
Un reconocido metaanálisis referido por Bipat y col. sobre estadificación local en cáncer de recto observó que la especificidad para discriminar entre lesiones T1 y T2 era mayor con la EER versus la RMN. De esto se desprende que generalmente la RMN sobreestadifica entre lesiones T1 y T2 cuando se la compara con la EER18. A su vez, otro estudio prospectivo que evaluó el grado de penetración tumoral de la submucosa con EER tridimensional sobre 142 pacientes consecutivos portadores de posibles tumores de recto pT1 pudo discriminar entre un compromiso superficial y un compromiso masivo de la submucosa, con un grado de certeza del 95,2%19.
El otro aspecto por evaluar durante la estadificación local es la afectación ganglionar, la cual se sabe que es menos precisa que la evaluación de la penetración tumoral. Para esta variable, tanto la EER como la RMN han demostrado un bajo nivel de certeza, cuyo rango se encuentra entre el 70 y el 85%18. Otra serie retrospectiva del Memorial Sloan Kettering Cancer Center observó que el grado de certeza de la EER en la estadificación ganglionar era del 70%, con un 16% de falsos positivos y 14% de falsos negativos. Los autores de este estudio destacan que, generalmente, este método subestima el compromiso ganglionar, lo que constituye una de las causas que explica el alto índice de recurrencia local observado luego de la resección local transanal de estas lesiones20.
En definitiva, un aspecto clave de la estadificación preoperatoria es identificar aquellas lesiones tempranas de alto riesgo de recurrencia local antes de que sean sometidas a una resección local transanal. Contemplando las variables morfológicas e histológicas de estas lesiones, a aquellas pacientes portadoras de tumores de recto que, luego de una resección local transanal presentan lesiones planas mayores de 3 cm con compromiso mayoritario de la submucosa, muestran alto grado de diferenciación, invasión angiolinfática y budding, se les debe ofrecer algún tratamiento adicional ya que presentan alto riesgo de recurrencia local21-23 (Tabla 1).
Tabla 1: Variables que definen los tumores de bajo y alto riesgo de recurrencia local luego de una resección local transanal
| Bajo riesgo | Alto riesgo | |
| Morfología | Polipoideo | Sésil |
| Tamaño (cm) | < 3 | > 3 |
| Localización | Tercio medio/superior | Tercio distal |
| Compromiso | ||
| circunferencia (%) | < 30 | > 30 |
| Invasión linfovascular | No | Sí |
| Invasión submucosa | sm1 | sm2-3 |
| Diferenciación | ||
| tumoral | Buena o moderada | Poca |
| Budding | Ausente | Presente |
| Tumor mucinoso | Ausente | Presente |
| Células en anillo de sello | Ausente | Presente |
RESULTADOS DE LA RESECCIÓN LOCAL TRANSANAL COMO ÚNICO TRATAMIENTO
Distintas series, la mayoría de ellas retrospectivas, que han evaluado los resultados oncológicos a largo plazo de la resección local transanal del cáncer de recto comparada con la cirugía radical, han evidenciado magros resultados en términos de recurrencia local y supervivencia relacionada con el cáncer. En 2009, Nash y col. informaron los resultados de 145 resecciones radicales versus 137 resecciones locales por vía transanal en tumores T1, destacando que esta última presentaba una recurrencia local significativamente mayor (13,2 vs. 2,7%, p= 0,001) y una supervivencia a 5 años menor relacionada con el cáncer (87 vs. 96%, p= 0,03)24. Resultados similares se obtuvieron en series más recientes y revisiones sistemáticas25,26. Sin embargo, un solo estudio prospectivo comunicó resultados bastante alentadores. Cincuenta y nueve pacientes portadores de lesiones T1 resecadas localmente por vía transanal fueron seguidos por más de 7 años presentando una recurrencia local y a distancia de 8 y 5%, respectivamente, con una supervivencia actuarial a 10 años del 84%27. Resultados oncológicos similares fueron informados por nuestro grupo más de una década atrás28.
Esto sugiere que aquellas lesiones T1 con características histológicas y morfológicas favorables (tumores bien diferenciados, con escasa penetración submucosa y sin invasión linfovascular) podrían ser los mejores candidatos para este tipo de abordaje. De lo contrario, sin una adecuada selección, la resección local puede alcanzar niveles de recurrencia local de entre un 10 y 20%29.
CIRUGÍA RADICAL POSRESECCIÓN LOCAL (COMPLETION SURGERY Y SALVAGE SURGERY)
La cirugía radical ofrecida a pacientes que presentan una lesión de alto riesgo de recurrencia local luego de una resección local transanal (en inglés, Completion Surgery) ha demostrado ser segura y mantener los resultados oncológicos alejados que hubiera ofrecido la cirugía radical primaria para esos mismos tumores. En un estudio prospectivo sobre pacientes portadores de tumores T1 operados por cirugía endoscópica transanal, el índice de recurrencia local de las lesiones de bajo riesgo fue de 6% y de 39% para las de alto riesgo. Sin embargo, el riesgo de recurrencia del segundo grupo disminuyó significativamente a un 6% luego de ofrecerles cirugía radical tras la resección local. A su vez, no hubo diferencia significativa en la supervivencia libre de enfermedad actuarial a 10 años30. Otra serie más reciente no encontró diferencias cuando comparó un grupo de pacientes a quienes se les había realizado cirugía radical luego de una cirugía endoscópica transanal con los que tuvieron cirugía radical de inicio. Los índices de recurrencia local para estos dos grupos fueron de 0 y 8%, respectivamente. Si bien el tiempo de seguimiento fue escaso, tampoco encontraron diferencias significativas en términos de metástasis a distancia31.
Desde el punto de vista técnico, cabe destacar que ‒si bien la cirugía radical luego de una resección local mantiene resultados oncológicos aceptables‒ la calidad de la pieza de la resección total del mesorrecto puede verse afectada. La localización distal de la lesión y un intervalo luego de la resección local mayor de 7 semanas han sido asociados con la obtención de una pieza quirúrgica de baja calidad32. Smart y col. manifiestan que, según su experiencia, la inflamación residual que queda a nivel del mesorrecto después de una resección local, puede dificultar la cirugía radical ulterior debido a cierta fijación del mesorrecto al ambiente perirrectal33. En línea con esto, Morino y col. destacan que la resección local por cirugía endoscópica transanal previa a una cirugía radical fue un predictor independiente de amputación abdominoperineal34.
Así como la cirugía radical propuesta ante una lesión de alto riesgo resecada localmente ha demostrado no afectar los resultados oncológicos a largo plazo, la cirugía radical de rescate que se realiza una vez instaurada la recidiva local (en inglés Salvage Surgery) parece ofrecer pobres resultados oncológicos. Doornebosch y col. observaron una supervivencia libre de enfermedad del 58% después de haber rescatado quirúrgicamente a 18 pacientes que presentaron una recidiva local luego de resección local por cirugía endoscópica transanal35. Más recientemente, una revisión sistemática de los resultados sobre 165 cirugías de rescate evidenció que, si bien el índice de nueva recurrencia local era bajo (3%), la recurrencia global de la enfermedad fue de un 13% y la supervivencia a 5 años de alrededor del 50%36. También se han informado magros resultados de la cirugía de rescate luego de la resección local por TEM posterior a un tratamiento neoadyuvante37.
TUMORES DE RECTO SOMETIDOS A TERAPIA ADYUVANTE
Considerando todos los factores de riesgo antes mencionados, alrededor del 75% de los tumores tempranos de recto (T1 y T2) presentan un riesgo intermedio de recurrencia local cuando son tratados únicamente mediante una resección local transanal16. Por lo tanto, en presencia de algunos de estos factores, una alternativa a la cirugía radical (Completion Surgery) puede ser la administración de radioterapia (RT) o quimiorradioterapia (QRT).
Un estudio retrospectivo que evaluó los resultados oncológicos de tumores T1 y T2 tratados con resección local sola versus resección local + RT adyuvante mostró que el índice de recurrencia local del primer grupo fue de 11% y 67% para las lesiones T1 y T2, respectivamente, mientras que, para el grupo que recibió RT adyuvante, la tasa de recurrencia local fue 0 para las lesiones T1 y 15% para las lesiones T2; en consecuencia, recomendó el uso de RT adyuvante ante lesiones de alto riesgo de recurrencia local38. Otro estudio que intentó evaluar el beneficio de agregar una terapia adyuvante luego de la resección local de lesiones tempranas evidenció que, en lesiones de alto riesgo que recibieron QRT adyuvante, la tasa de recurrencia local global a 5 años fue de 16% y la supervivencia libre de enfermedad de 86%, valores similares a los informados con cirugía radical39.
Las distintas estrategias terapéuticas, técnicas quirúrgicas, tipos y dosis de las terapias adyuvantes hacen dificultosa la interpretación de los resultados ofrecidos en el resto de las series.
TUMORES DE RECTO SOMETIDOS A TERAPIA NEOADYUVANTE
Si bien las terapias adyuvantes permiten dirigir el tratamiento a aquellas lesiones con riesgo elevado de recurrencia una vez resecadas localmente, los beneficios observados en términos de menor toxicidad y recurrencia local asociados a la administración de QRT previa a la cirugía radical han llevado a adoptar esta conducta40. Luego de su aplicación se ha observado hasta un 30% de respuesta patológica completa en los pacientes operados41. A su vez, los resultados oncológicos a largo plazo de quienes presentan una respuesta patológica completa son significativamente mejores que los que no responden, no solo en términos de recurrencia local o a distancia sino también de supervivencia global y libre de enfermedad42.
El interés por asociar la resección local transanal del cáncer de recto a las terapias neoadyuvantes radica en que la RT preoperatoria puede potencialmente esterilizar los ganglios linfáticos mesorrectales comprometidos, disminuir el tamaño tumoral y con ello asegurar una resección local con márgenes negativos, y disminuir el estadio tumoral. A esto se le suma la miniinvasividad de la cirugía endoscópica transanal, que evita la morbilidad asociada a la cirugía radical. Sin embargo, hay que considerar que la resección de los tumores por cirugía transanal luego de QRT puede incrementar las complicaciones en términos de dehiscencia de la línea de sutura y dolor posoperatorio43,44.
Esta atractiva modalidad terapéutica (QRT + resección local transanal), que involucra el concepto de preservación de órgano aun con lesiones que van más allá de la submucosa, ha sido analizada en numerosos estudios. Entre los más relevantes se encuentra el estudio italiano prospectivo y aleatorizado que comparó los resultados de tumores de recto inferior (cT2N0) que recibieron curso largo de QRT preoperatoria y fueron operados por cirugía endoscópica transanal versus cirugía radical (resección total del mesorrecto). En este estudio, la recurrencia local fue similar en ambos grupos (8 y 6%, respectivamente) y la recurrencia a distancia fue la misma (4%), al igual que la supervivencia libre de enfermedad. Sin embargo, cabe destacar que la cirugía endoscópica transanal presentó recurrencias más tempranas cuando se la comparó con la cirugía radical45. A pesar de ello, los autores concluyen que, en pacientes seleccionados y luego de QRT neoadyuvante, la cirugía endoscópica transanal presenta los mismos resultados que la cirugía radical.
Otro estudio prospectivo y multicéntrico (ACOSOG Z6041) analizó los resultados a largo plazo de 79 pacientes portadores de tumores de recto distal cT2N0, que recibieron curso largo de QRT neoadyuvante y fueron resecados localmente por vía transanal (convencional o endoscópica)46. En esta serie, con una media de seguimiento de 56 meses, la recurrencia local y la supervivencia actuarial a 3 años fue de 4 y 88%, respectivamente. La tasa de respuesta patológica completa en este estudio fue del 44%, lo que significa que esta población de pacientes no hubiera requerido ningún tratamiento quirúrgico.
El estudio aleatorizado (GRECCAR 2), realizado sobre 15 centros de Francia, se propuso evaluar la superioridad de la resección local transanal versus la resección total del mesorrecto en tumores de recto distal (cT2-3N0-1) que presentaban buena respuesta a la QRT neoadyuvante47. Luego de analizar algo más de 70 pacientes por rama, los autores observaron casi la misma tasa de recurrencia local y supervivencia libre de enfermedad para ambos grupos (5 y 78% para la resección local y 6 y 76% para la cirugía radical). A su vez, al igual que el estudio ACOSOG Z6041, detectaron un alto porcentaje de respuesta patológica completa (40% y pT0). Sin embargo, no pudieron establecer la superioridad de la cirugía transanal luego de QRT neoadyuvante debido al alto número de pacientes que debieron ser sometidos a completion surgery (35%), lo cual aumentó la morbilidad relacionada con esta conducta.
El estudio prospectivo y multicéntrico holandés CARTS fue diseñado para cuantificar el número de pacientes con mínima enfermedad residual (ypT0-1) luego de curso largo de QRT neoadyuvante y cirugía endoscópica transanal48. Doce centros incluyeron 55 pacientes con tumores de recto distal (< 10 cm) cT1–3 N0M0 cuya indicación era amputación abdominoperineal o resección anterior baja. De estos, 47 completaron el tratamiento neoadyuvante y fueron sometidos a una resección transanal. La anatomía patológica reveló que 30 pacientes (55%) habían presentado buena respuesta al tratamiento (ypT0-1) y márgenes negativos. Con un escaso tiempo de seguimiento (media de 17 meses), los autores detectaron un 3% de recurrencia local en estos pacientes, concluyendo que esta estrategia permite conservar el recto en la mitad de los pacientes con tumores de recto tempranos. Más recientemente, una actualización de este estudio sobre los resultados a largo plazo y calidad de vida con mayor tiempo de seguimiento informó una recurrencia local actuarial a 5 años de 7,7%, y una supervivencia libre de enfermedad y global de 81,6 y 82,8%, respectivamente, con resultados óptimos en torno a la calidad de vida49.
En resumen, los estudios disponibles en la actualidad sugieren que la resección local transanal luego de realizar QRT neoadyuvante es una estrategia aceptable en aquellos casos en los que se obtenga buena respuesta al tratamiento neoadyuvante inicial (lesiones ypT0-1) obteniendo bajos índices de recurrencia local junto a una tasa alta de conservación del recto. Sin embargo, estos resultados deben balancearse contra la morbilidad posoperatoria y los resultados funcionales de esta estrategia.
BIBLIOGRAFÍA
- Mörschel M, Heintz A, Bussmann M, Junginger T. Follow-up after transanal endoscopic microsurgery or transanal excision of large benign rectal polyps. Langenbecks Arch Surg. 1998; 383(5):320-4.
- Guerrieri M, Baldarelli M, Morino M, Trompetto M, Da Rold A, Selmi I, et al. Transanal endoscopic microsurgery in rectal adenomas: experience of six Italian centres. Dig Liver Dis. 2006; 38(3):202-7.
- Moore JS, Cataldo PA, Osler T, Hyman NH. Transanal endoscopic microsurgery is more effective than traditional transanal excision for resection of rectal masses. Dis Colon Rectum. 2008; 51(7):1026-30; discussion 1030–1.
- McCloud JM, Waymont N, Pahwa N, Varghese P, Richards C, Jameson JS, et al. Factors predicting early recurrence after transanal endoscopic microsurgery excision for rectal adenoma. Colorectal Dis. 2006; 8(7):581-5.
- Allaix ME, Arezzo A, Cassoni P, Famiglietti F, Morino M. Recurrence after transanal endoscopic microsurgery for large rectal adenomas [Internet]. SurgEndosc. 2012; 26: 594-600. Available from: http://dx.doi.org/10.1007/s00464-012-2238-z
- Platell C, Denholm E, Makin G. Efficacy of transanal endoscopic microsurgery in the management of rectal polyps [Internet]. J Gastroenterol Hepatol. 2004; 19:767-72. Available from: http://dx.doi.org/10.1111/j.1440-1746.2004.03364.x
- Winawer SJ, Zauber AG, Ho MN, O’Brien MJ, Gottlieb LS, Sternberg SS, et al. Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup. N Engl J Med. 1993; 329(27):1977-81.
- Ramírez JM, Aguilella V, Gracia JA, Ortego J, Escudero P, Valencia J, et al. Local full-thickness excision as first line treatment for sessile rectal adenomas: long-term results. Ann Surg. 2009; 249(2):225-8.
- Kao KT, Giap AQ, Abbas MA. Endoscopic excision of large colorectal polyps as a viable alternative to surgical resection. Arch Surg. 2011;146(6):690-6.
- Giuliani A, Caporale A, Corona M, Ricciardulli T, Di Bari M, Demoro M, et al. Large size, villous content and distal location are associated with severe dysplasia in colorectal adenomas. Anticancer Res. 2006; 26(5B):3717-22.
- Serra-Aracil X, Caro-Tarrago A, Mora-López L, Casalots A, Rebasa P, Navarro-Soto S. Transanal endoscopic surgery with total wall excision is required with rectal adenomas due to the high frequency of adenocarcinoma. Dis Colon Rectum. 2014; 57(7):823-9.
- Monson JRT, Weiser MR, Buie WD, Chang GJ, Rafferty JF, Buie WD, et al. Practice parameters for the management of rectal cancer (revised). Dis Colon Rectum. 2013; 56(5):535-50.
- Bryant CLC, Lunniss PJ, Knowles CH, Thaha MA, Chan CLH. Anterior resection syndrome [Internet]. The Lancet Oncology. 2012; 13: e403–8. Available from: http://dx.doi.org/10.1016/s1470-2045(12)70236-x
- Kikuchi R, Takano M, Takagi K, Fujimoto N, Nozaki R, Fujiyoshi T, et al. Management of early invasive colorectal cancer. Risk of recurrence and clinical guidelines. Dis Colon Rectum. 1995; 38(12):1286-95.
- Maeda K, Koide Y, Katsuno H. When is local excision appropriate for “early” rectal cancer? [Internet]. Surg Today. 2014; 44: 2000-14. Available from: http://dx.doi.org/10.1007/s00595-013-0766-3
- Bach SP, Hill J, Monson JRT, Simson JNL, Lane L, Merrie A, et al. A predictive model for local recurrence after transanal endoscopic microsurgery for rectal cancer. Br J Surg. 2009; 96(3):280-90.
- Nascimbeni R, Burgart LJ, Nivatvongs S, Larson DR. Risk of lymph node metastasis in T1 carcinoma of the colon and rectum. Dis Colon Rectum. 2002; 45(2):200-6.
- Bipat S, Glas AS, Slors FJM, Zwinderman AH, Bossuyt PMM, Stoker J. Rectal cancer: local staging and assessment of lymph node involvement with endoluminal US, CT, and MR imaging--a meta-analysis. Radiology. 2004; 232(3):773-83.
- Santoro GA, Gizzi G, Pellegrini L, Battistella G, Di Falco G. The value of high-resolution three-dimensional endorectal ultrasonography in the management of submucosal invasive rectal tumors. Dis Colon Rectum. 2009; 52(11):1837-43.
- Landmann RG, Wong WD, Hoepfl J, Shia J, Guillem JG, Temple LK, et al. Limitations of early rectal cancer nodal staging may explain failure after local excision. Dis Colon Rectum. 2007; 50(10):1520-5.
- Kobayashi H, Mochizuki H, Kato T, Mori T, Kameoka S, Shirouzu K, et al. Is total mesorectal excision always necessary for T1-T2 lower rectal cancer? Ann Surg Oncol. 2010; 17(4):973-80.
- Saraste D, Gunnarsson U, Janson M. Local excision in early rectal cancer-outcome worse than expected: a population based study. Eur J Surg Oncol. 2013; 39(6):634-9.
- Gagliardi G, Newton TR, Bailey HR. Local excision of rectal cancer followed by radical surgery because of poor prognostic features does not compromise the long term oncologic outcome. Colorectal Dis. 2013; 15(11):e659-64.
- Nash GM, Weiser MR, Guillem JG, Temple LK, Shia J, Gonen M, et al. Long-term survival after transanal excision of T1 rectal cancer. Dis Colon Rectum. 2009; 52(4):577-82.
- Peng J, Chen W, Sheng W, Xu Y, Cai G, Huang D, et al. Oncological outcome of T1 rectal cancer undergoing standard resection and local excision. Colorectal Dis. 2011; 13(2):e14-9.
- Kidane B, Chadi SA, Kanters S, Colquhoun PH, Ott MC. Local resection compared with radical resection in the treatment of T1N0M0 rectal adenocarcinoma: a systematic review and meta-analysis. Dis Colon Rectum. 2015; 58(1):122-40.
- Greenberg JA, Shibata D, Herndon JE 2nd, Steele GD Jr, Mayer R, Bleday R. Local excision of distal rectal cancer: an update of cancer and leukemia group B 8984. Dis Colon Rectum. 2008; 51(8):1185-91; discussion 1191–4.
- Benati M, Bonadeo F, Bosio R, A DC, Mullen E, Ojea Quintana G y col. Resección transanal del cáncer de recto: resultados a corto y largo plazo. Rev Argent Cirug. 2006; 90(1):87-96.
- Tsai BM, Finne CO, Nordenstam JF, Christoforidis D, Madoff RD, Mellgren A. Transanal endoscopic microsurgery resection of rectal tumors: outcomes and recommendations. Dis Colon Rectum. 2010; 53(1):16-23.
- Borschitz T, Heintz A, Junginger T. The influence of histopathologic criteria on the long-term prognosis of locally excised pT1 rectal carcinomas: results of local excision (transanal endoscopic microsurgery) and immediate reoperation. Dis Colon Rectum. 2006; 49(10):1492-506; discussion 1500–5.
- Levic K, Bulut O, Hesselfeldt P, Bülow S. The outcome of rectal cancer after early salvage TME following TEM compared with primary TME: a case-matched study. Tech Coloproctol. 2013; 17(4):397-403.
- Hompes R, McDonald R, Buskens C, Lindsey I, Armitage N, Hill J, et al. Completion surgery following transanal endoscopic microsurgery: assessment of quality and short- and long-term outcome [Internet]. Colorectal Dis. 2013; 15:e576-81. Available from: http://dx.doi.org/10.1111/codi.12381
- Smart CJ, Cunningham C, Bach SP. Transanal endoscopic microsurgery [Internet]. Best PractRes Cl Ga. 2014;28:143-57. Available from: http://dx.doi.org/10.1016/j.bpg.2013.11.005
- Morino M, Allaix ME, Arolfo S, Arezzo A. Previous transanal endoscopic microsurgery for rectal cancer represents a risk factor for an increased abdominoperineal resection rate. Surg Endosc. 2013; 27(9):3315-21.
- Doornebosch PG, Ferenschild FTJ, de Wilt JHW, Dawson I, Tetteroo GWM, de Graaf EJR. Treatment of Recurrence After Transanal Endoscopic Microsurgery (TEM) for T1 Rectal Cancer [Internet]. Dis Colon Rectum. 2010; 53: 1234-9. Available from: http://dx.doi.org/10.1007/dcr.0b013e3181e73f33
- Jones HJS, Cunningham C, Nicholson GA, Hompes R. Outcomes following completion and salvage surgery for early rectal cancer: A systematic review. Eur J Surg Oncol. 2018; 44(1):15-23.
- Pérez RO, Habr-Gama A, São Julião GP, Proscurshim I, Fernández LM, de Azevedo RU, et al. Transanal Endoscopic Microsurgery (TEM) Following Neoadjuvant Chemoradiation for Rectal Cancer: Outcomes of Salvage Resection for Local Recurrence. Ann Surg Oncol. 2016; 23(4):1143-8.
- Chakravarti A, Compton CC, Shellito PC, Wood WC, Landry J, Machuta SR, et al. Long-term follow-up of patients with rectal cancer managed by local excision with and without adjuvant irradiation. Ann Surg. 1999; 230(1):49-54.
- Russell AH, Harris J, Rosenberg PJ, Sause WT, Fisher BJ, Hoffman JP, et al. Anal sphincter conservation for patients with adenocarcinoma of the distal rectum: long-term results of radiation therapy oncology group protocol 89-02. Int J Radiat Oncol Biol Phys. 2000; 46(2):313-22.
- Sauer R, Becker H, Hohenberger W, Rödel C, Wittekind C, Fietkau R, et al. Preoperative versus Postoperative Chemoradiotherapy for Rectal Cancer [Internet]. New Engl J Med. 2004; 351:1731-40. Available from: http://dx.doi.org/10.1056/nejmoa040694
- O’Neill BDP, Brown G, Heald RJ, Cunningham D, Tait DM. Non-operative treatment after neoadjuvant chemoradiotherapy for rectal cancer [Internet]. The Lancet Oncology. 2007; 8:625-33. Available from:http://dx.doi.org/10.1016/s1470-2045(07)70202-4
- Martin ST, Heneghan HM, Winter DC. Systematic review and meta-analysis of outcomes following pathological complete response to neoadjuvant chemoradiotherapy for rectal cancer [Internet]. Brit J Surg. 2012; 99:918-28. Available from: http://dx.doi.org/10.1002/bjs.8702
- Marks JH, Valsdottir EB, DeNittis A, Yarandi SS, Newman DA, Nweze I, et al. Transanal endoscopic microsurgery for the treatment of rectal cancer: comparison of wound complication rates with and without neoadjuvant radiation therapy. Surg Endosc. 2009; 23(5):1081-7.
- Pérez RO, Habr-Gama A, São Julião GP, Proscurshim I, Scanavini Neto A, Gama-Rodrigues J. Transanal endoscopic microsurgery for residual rectal cancer after neoadjuvant chemoradiation therapy is associated with significant immediate pain and hospital readmission rates. Dis Colon Rectum. 2011; 54(5):545-51.
- Lezoche E, Baldarelli M, Lezoche G, Paganini AM, Gesuita R, Guerrieri M. Randomized clinical trial of endoluminal locoregional resection versus laparoscopic total mesorectal excision for T2 rectal cancer after neoadjuvant therapy. Br J Surg. 2012; 99(9):1211-8.
- García-Aguilar J, Renfro LA, Chow OS, Shi Q, Carrero XW, Lynn PB, et al. Organ preservation for clinical T2N0 distal rectal cancer using neoadjuvant chemoradiotherapy and local excision (ACOSOG Z6041): results of an open-label, single-arm, multi-institutional, phase 2 trial. Lancet Oncol. 2015; 16(15):1537-46.
- Rullier E, Rouanet P, Tuech J-J, Valverde A, Lelong B, Rivoire M, et al. Organ preservation for rectal cancer (GRECCAR 2): a prospective, randomised, open-label, multicentre, phase 3 trial. Lancet. 2017; 390(10093):469-79.
- Verseveld M, de Graaf EJR, Verhoef C, van Meerten E, Punt CJA, de Hingh IHJT, et al. Chemoradiation therapy for rectal cancer in the distal rectum followed by organ-sparing transanal endoscopic microsurgery (CARTS study). Br J Surg. 2015; 102(7):853-60.
- Stijns RCH, de Graaf EJR, Punt CJA, Nagtegaal ID, Joost J M, van Meerten E, et al. Long-term Oncological and Functional Outcomes of Chemoradiotherapy Followed by Organ-Sparing Transanal Endoscopic Microsurgery for Distal Rectal Cancer [Internet]. JAMA Surgery. 2019; 154: 47. Available from: http://dx.doi.org/10.1001/jamasurg.2018.3752
