3. Aspectos Técnicos de la Resección Local Transanal
REV ARGENT COLOPROCT | 2019 | VOL. 30, N° 3: 17-25
RELATO ANUAL
CAPÍTULO 3
Aspectos Técnicos de la Resección Local Transanal
PREPARACIÓN PREOPERATORIA
El desarrollo de la cirugía transanal se basa principalmente en que las distintas alternativas técnicas de resección transanal tienen una morbilidad y mortalidad menor que la resección total del mesorrecto1. Sin embargo, la evaluación integral del paciente es un paso fundamental para asegurar los mejores resultados posibles. Hay que determinar si el paciente se encuentra en condiciones de afrontar el procedimiento propuesto, el tipo de anestesia que se aplicará y si existen comorbilidades que pueden tratarse u optimizarse. Consideramos conveniente que este proceso sea abordado por un equipo multidisciplinario, que debería incluir a un anestesiólogo, ya que la presencia de ciertos factores de riesgo influye en la elección de la técnica anestésica, en la complejidad de la monitorización perioperatoria y en la necesidad de cuidados específicos posoperatorios2. Durante la estadificación tumoral, el tacto rectal nos informa de la distancia al margen anal y su relación con el anillo anorrectal, la profundidad de la invasión, el tamaño y qué porcentaje de la circunferencia compromete. En general, se completa la estadificación local con una resonancia magnética y una ecografía endorrectal que nos brindará información sobre profundidad de invasión, potencial compromiso de ganglios linfáticos y otras características de interés necesarias para determinar si el paciente es candidato a una resección local. El empleo de uno u otro método de diagnóstico por imagen dependerá de la preferencia y disponibilidad del grupo tratante. Sin embargo, ambos estudios son aceptables sobre todo en la estadificación de lesiones tempranas3. Debe realizarse una videcolonoscopia completa para descartar la presencia de otro tumor (4,4%) o un pólipo sincrónico (36%)4.
El paciente debe ser informado detalladamente sobre todo lo que sucederá antes, durante y después de la cirugía. Se le deben explicar los detalles del procedimiento quirúrgico y el tipo de anestesia que se utilizará. En algunas cirugías es posible que se presente una perforación completa de la pared rectal con ingreso en la cavidad peritoneal. Esta situación debe ser explicada al paciente por la posibilidad de tener que realizar una reparación laparoscópica o bien la necesidad de una ostomía derivativa transitoria.
La higiene preoperatoria comienza en los dos o tres días previos a la cirugía con jabón de yodopovidona o clorhexidina, destinada a disminuir la carga bacteriana de la piel y la incidencia de infecciones. No es necesario el rasurado de la zona perianal antes de la cirugía, además puede aumentar el riesgo de infecciones en la zona, así como también la incomodidad en el posoperatorio por el prurito que suele ocasionar.
Para tener un campo quirúrgico limpio, la aplicación de un enema de 200 cm3 aproximadamente dos horas antes de la cirugía suele ser suficiente. La preparación mecánica oral puede ser recomendable si planeamos realizar una resección amplia que incluya toda la pared y cierre de una brecha de gran tamaño cuando existe el riesgo de comunicación del recto con el peritoneo, aunque es sabido que este tipo de preparación es estresante para el paciente y puede producir distintos grados de deshidratación5. Finalmente, con el paciente anestesiado y antes de la colocación de los campos quirúrgicos puede examinarse la limpieza del recto y es posible hacer un nuevo lavado si fuera necesario.
El riesgo de enfermedad tromboembólica depende del tipo y duración del procedimiento, así como también de los factores de riesgo ya conocidos: edad mayor de 60 años, cirugía por neoplasia, enfermedad tromboembólica previa, transfusiones recientes, hospitalización mayor de dos días, inmovilidad y la presencia de un catéter central. Las resecciones transanales son procedimientos relativamente cortos que permiten la pronta movilización del paciente por lo que se pueden considerar procedimientos de bajo riesgo para enfermedad tromboembólica, sobre todo si durante la cirugía se utilizan bombas de compresión neumática intermitente. En algunos casos puede ser necesaria la profilaxis con heparina de bajo peso molecular de acuerdo con la estimación del riesgo que se haga en cada caso en particular.
La profilaxis antibiótica debe cubrir gérmenes gramnegativos y anaerobios, en lo posible teniendo en cuenta la sensibilidad de estos gérmenes en el medio donde se desarrolla la actividad quirúrgica. En el Hospital Italiano de Buenos Aires (HIBA) utilizamos, durante la inducción anestésica, metronidazol 500 miligramos u ornidazol 1 gramo endovenoso más gentamicina 1,5 a 3 miligramos por kilogramo de peso por vía endovenosa. Sin embargo, si se piensa realizar una resección submucosa, probablemente no sea necesario administrar esta profilaxis.
Es conveniente que estos procedimientos se realicen bajo anestesia general, ya que la parálisis muscular ayuda a evitar la transferencia de los movimientos del diafragma al recto, disminuyendo su colapso. En caso de necesidad puede realizarse la resección transanal con anestesia espinal como se ha comentado previamente6.
Por último, aunque los procedimientos transanales suelen ser de corta duración, la retención urinaria es una complicación que puede verse con cierta frecuencia en cirugía orificial. Con el objetivo de evitar esta complicación se pueden abordar dos caminos. Por un lado, vaciar la vejiga espontáneamente inmediatamente antes de comenzar la inducción anestésica y, siguiendo el concepto de anestesia guiada por objetivos, realizar un aporte de fluidos endovenosos lo más restringido posible para disminuir el flujo urinario por minuto. La otra forma es la colocación de una sonda vesical luego de anestesiado el paciente, que puede ser retirada a las pocas horas de finalizado el procedimiento. Esta última conducta está acompañada de una tasa de infección urinaria relativamente baja7.
REQUERIMIENTOS Y EQUIPAMIENTO PARA RESECCIÓN TRANSANAL
La resección transanal evita las desventajas asociadas a una resección anterior tales como una elevada morbilidad y alteraciones de la función urogenital, sumadas a la eventual creación de un ostoma transitorio o definitivo8-10. Por otro lado, la resección mediante TEM/TEO o TAMIS presenta ventajas frente a la resección local convencional (RLC) en términos de menor índice de márgenes positivos, menor fragmentación de la pieza quirúrgica, recurrencia local más baja y una mejor sobrevida a largo plazo11.
La RLC ha sido extensamente utilizada durante muchos años12 con buenos resultados, aunque solo en lesiones muy próximas al margen anal. En la práctica vemos que los instrumentos permiten alcanzar con relativa comodidad lesiones cuyo borde superior no supere los 8-10 cm del margen anal. Sin embargo, a su vez, debe considerarse el tamaño de estas ya que, de tratarse neoplasias muy grandes, el defecto que deja su resección puede ser difícil de resolver.
Se debe disponer de una correcta iluminación del interior del recto para determinar con precisión los márgenes de resección. Para ello pueden ser útiles los frontoluz o los distintos tipos de valvas con iluminación disponibles en el mercado. La exposición se realiza a través de dilatadores específicos, lo que permite observar claramente la lesión (fig. 1).

Figura 1: Principales retractores utilizados para resecciones transanales. A: separador de Fansler, B: separador de Prat, C: separador de Parks y D: valva de Sims.
Deben utilizarse instrumentos manuales finos y largos para alejar las manos del campo operatorio evitando que obstruyan la línea de visión entre el cirujano y el tumor por resecar (fig. 2A). Es de gran utilidad marcar con el electrobisturí el margen que se le dará a la resección, asegurando además que se podrá manipular el borde superior de la pieza quirúrgica. Se comienza la disección por el margen distal, incidiendo con electrobisturí lentamente y con poca presión sobre los tejidos para favorecer una correcta hemostasia. Luego se toma el borde proximal de la incisión (fig. 2B) y se continúa la disección en profundidad, hacia los laterales y, finalmente, hacia proximal hasta resecar por completo la pieza (fig. 2 C). Debe tenerse extremo cuidado con la fuerza de tracción para evitar la fragmentación del espécimen. Una vez extraída la pieza, se verifica macroscópicamente la integridad de la resección y la adecuación de los márgenes. Posteriormente se la coloca sobre una superficie lisa (telgopor, goma eva o corcho) y se fijan sus bordes con alfileres o agujas, de manera tal que se evite la retracción de los tejidos hasta ser procesados por el patólogo (fig. 2 D).
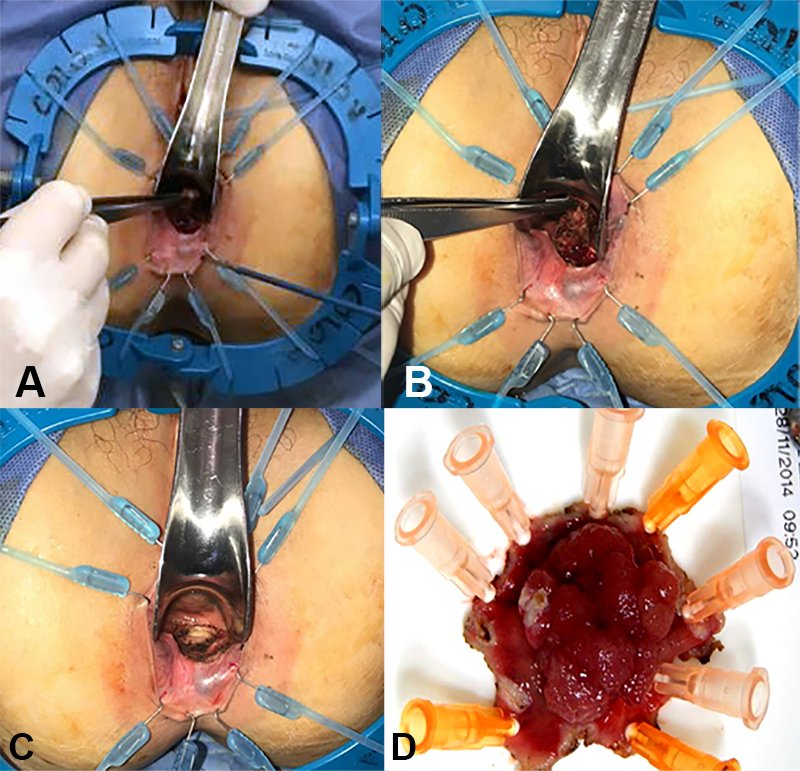
Figura 2: A, B y C) Resección local transanal convencional empleando separador de Lone Star y valva de Sims. D) Pieza de resección local.
Las principales dificultades de esta técnica radican en que, a mayor altura del borde superior de la lesión, es mayor la dificultad para manipularla y para observar con seguridad el margen por el que se realiza el corte. En lesiones muy bajas puede ser de gran ayuda la utilización de un separador Lone Star(R) (CooperSurgical, Connecticut, Estados Unidos), que brinda una magnífica exposición del canal anal (fig. 3 A). Finalizada la resección, se procede a lavar enérgicamente el recto con solución fisiológica y luego se cierra la brecha con sutura continua de material reabsorbible en sentido perpendicular al eje mayor del recto para evitar estenosis (fig. 3 B). Esta modalidad de resección local transanal fue la empleada inicialmente en nuestro país no solo por nuestro grupo en el tratamiento de casos seleccionados de cáncer de recto13-15 sino también por los doctores González y col.16, Bilenca y col.17, Rijana y col.18 y Bosisio y col., estos últimos para el tratamiento de adenomas vellosos de recto19.
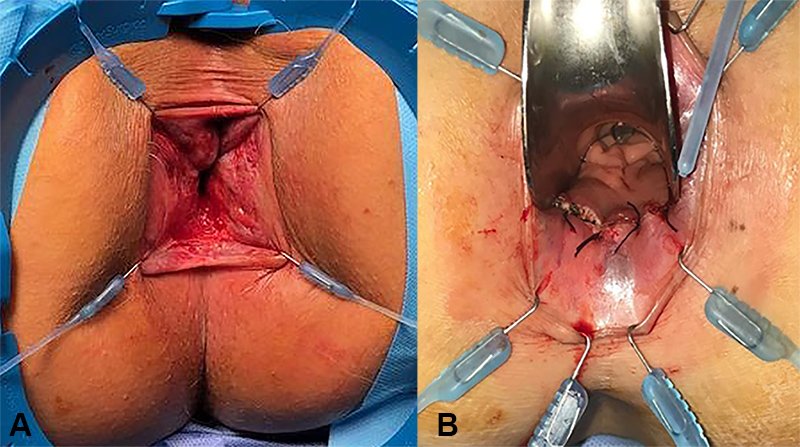
Figura 3: A) Separador Lone Star y B) cierre de la brecha de una resección transanal.
CIRUGÍA ENDOSCÓPICA TRANSANAL
La resección transanal con dispositivos de visión endoscópica tales como TEO, TEM o mediante la técnica TAMIS presenta menor índice de recidiva local que la resección local convencional y además permite resecar piezas completas que se encuentran más alejadas del margen anal20. Esto se logra mediante una visión de mejor calidad y la utilización de instrumental específicamente diseñado para este tipo de resecciones21.
Los rectoscopios de las plataformas TEM® (Richard Wolf, Knittingen, Alemania) fueron desarrollados a principios de la década de 198022. Tienen un diámetro externo de 4 cm, con longitudes disponibles de 12 y 20 cm para utilizar según la altura en la que se encuentra localizada la lesión. La endocámara de 10 mm, con visión estereoscópica (dos lentes yuxtapuestas) y angulación de 50° con respecto al eje mayor de la óptica, ofrece imágenes en tres dimensiones cuando se utiliza el binocular acoplado a la parte superior de la óptica. También permite la conexión a una cámara de video para proyectar la imagen en un monitor 2D o 3D. La visión en tres dimensiones ya sea por pantalla con tecnología 3D o bien a través del binocular es superlativa, pues ofrece la mejor calidad para realizar este tipo de cirugía.
La conexión a la cámara desciende en ángulo de 90° con respecto al cabezal, lo que puede generar incomodidad para trabajar ya que limita el movimiento de rotación de las manos. Dispone también de tres canales de trabajo adicionales. El instrumental específicamente diseñado para esta plataforma mucho antes de la era de la cirugía laparoscópica está especialmente adaptado para lograr los movimientos necesarios en el espacio reducido de trabajo. Tanto las pinzas de agarre, el electrocauterio y el portaagujas como la cánula de aspiración tienen una angulación en el extremo que se ubica en el recto y permite trabajar más ergonómicamente a través de movimientos de entrada y salida y de rotación sobre su mismo eje. Si bien la cirugía por TEM no es igual a la cirugía laparoscópica, el cirujano que se encuentra familiarizado con esta técnica, rápidamente se adapta a este nuevo concepto.
El rectoscopio es sostenido firme en su posición mediante un brazo de sostén en forma de U, con tres articulaciones regulables, que se fija a la mesa operatoria en la posición deseada. Esta posición puede variarse fácilmente cada vez que sea necesario mejorar la visión del campo operatorio (fig. 4 A). Posee una unidad multifuncional (fig. 4 B) que regula la insuflación de CO2 mediante el sensado continuo de la presión del sistema, la aspiración y la irrigación, y mantiene constante la presión endoluminal, facilitando el procedimiento al evitar el colapso intermitente del recto23. Además, la aspiración continua del gas intrarrectal impide la acumulación de humo. Por otro lado, el canal de irrigación permite limpiar la lente de la cámara sin necesidad de extraerla. Estas dos características hacen que los procedimientos sean más sencillos de realizar ya que hay menos interrupciones de las maniobras quirúrgicas.
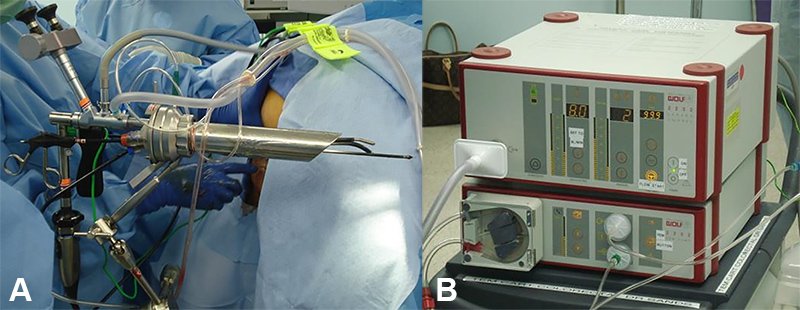
Figura 4: A) Equipo de cirugía endoscópica transanal (TEM) montado y listo para operar. Obsérvese el binocular hacia arriba de la óptica que permitía, antes del desarrollo de cámaras de video adaptables, observar el interior del recto con visión estereoscópica (similar a un microscopio). En B se ve la unidad multifuncional específica de insuflación, aspiración e irrigación. Cortesía del Dr. Steven Wexner.
Los dispositivos TEO® (Karl Storz GmbH, Tuttlingen, Alemania) constan de un rectoscopio metálico de 4 cm de diámetro y de 7, 15 o 20 cm de longitud para elegir según la altura en las que puede encontrarse el tumor. A diferencia de TEM no presentan visión estereoscópica ni estabilidad en la insuflación rectal, ya que utilizan un insuflador de laparoscopia; sin embargo, pueden alcanzarse resultados similares con ambos equipos24. El cabezal tiene cuatro canales, uno de los cuales es fijo para la endocámara y los otros tres (dos de 5 mm y uno de 12 mm) para los instrumentos de prensión, aspiración y corte (fig. 5). En el extremo inferior del mango tiene una válvula que permite la salida de gas que debe ser activada manualmente. En la parte superior del rectoscopio existe una entrada para irrigación que permite lavar el extremo de la endocámara una vez que está emplazada en su lugar de uso, aunque no siempre puede lavarse adecuadamente sin ser removida de la plataforma. La óptica 2D presenta un ángulo de visión de 70° y el pabellón que se une a la endocámara está angulado a 45°. Esta disposición evita el contacto de las manos del operador con la endocámara mientras realiza la cirugía y representa una gran ventaja frente a TEM. El rectoscopio es sostenido en la posición que fijó el operador mediante un brazo metálico con tres articulaciones que por el otro extremo se fija firmemente a la mesa operatoria.
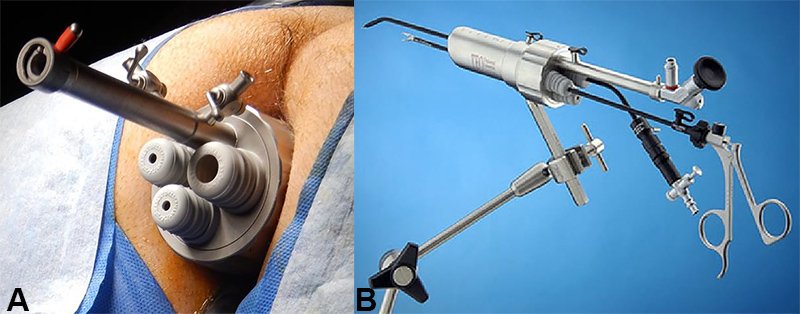
Figura 5: A) Rectoscopio TEO insertado en el recto y fijado a la mesa operatoria. B)Equipo ensamblado que muestra la relación del instrumental con la óptica y el brazo de fijación.
Este equipo puede trabajar con instrumental de videolaparoscopia del mismo fabricante (insuflador de CO2, sistema de video, instrumental quirúrgico), lo que hace más económico su uso si se lo compara con TEM. Por otro lado, no tiene un sistema estable de insuflado/aspiración de gas que hace dificultoso el procedimiento cuando se genera mucho humo o cuando el recto se contrae espasmódicamente.
Las lesiones muy próximas al margen anal presentan una dificultad particular, ya que el rectoscopio, al ser biselado, puede no obturar completamente el canal anal y perder capacidad de insuflación del recto. En estas circunstancias es probable que una RTT sea más apropiada o, de acuerdo con las características de la lesión, lo sea un abordaje combinado, realizando la disección distal mediante RTT y el resto mediante cirugía endoscópica. Sin embargo, con la suma de casos y experiencia hemos logrado resecar con estos equipos lesiones muy cercanas al margen anal en contacto con la línea pectínea (fig. 6).
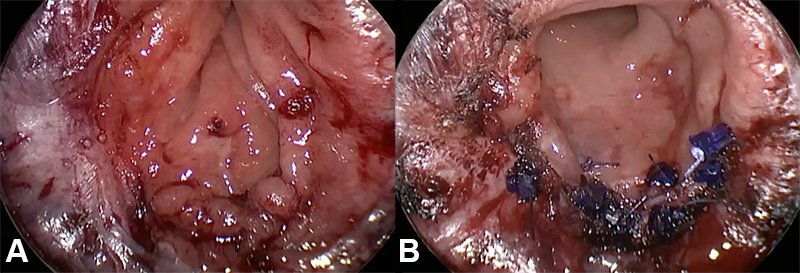
Figura 6: A) Resección local transanal por TEO de lesión en contacto con la línea pectínea. B) Defecto parietal cerrado con sutura continua.
TAMIS (Transanal Minimally Invasive Surgery) es una técnica de cirugía basada en TEM/TEO que se desarrolló a partir de un puerto único de incisión de cirugía laparoscópica o SILS® (Medtronic, Mansfied, MA) (fig. 7 A). De hecho, la primera comunicación de resección mediante TAMIS la realizaron Atallah y col. en 20111 utilizando este puerto. GelPoint Path transanal access plataform(R) (Applied Medical, Rancho Santa Margarita, CA, Estados Unidos) es una plataforma diseñada específicamente para resección transanal, de un solo uso, y es probablemente la opción más versátil en el presente (fig. 7 B). Esta plataforma cuenta con un cilindro semirrígido de 4 cm de diámetro y longitud variable, que es insertado y fijado en el canal anal mediante los topes que se encuentran en los extremos. En su borde externo se acopla un anillo que contiene una superficie de gel semisólido que permite la introducción de tres o cuatro trocares cortos para la endocámara e instrumentos quirúrgicos. Además de la conexión a la bomba de CO2 (similar a la utilizada en los equipos de laparoscopia), posee un canal de escape para la extracción del humo que facilita la visualización durante todo el procedimiento.

Figura 7: En A, el puerto SILS a partir del cual se desarrolló TAMIS. En B se observa el Gel PointPath, diseñado para cirugía transanal.
Existen modelos con una tercera entrada (en un trocar especial) para ser utilizada por la bolsa de estabilización de insuflación o ISB® por Insuflation Stabilization Bag (Applied Medical, California, Estados Unidos). Este reservorio de CO2 se coloca en la vía del gas entre el insuflador y el Gel PointPath y, mediante su elasticidad, le aporta complacencia al sistema, disminuyendo el movimiento oscilante del lumen rectal producto de las variaciones de presión en su interior25,26 (fig. 8).
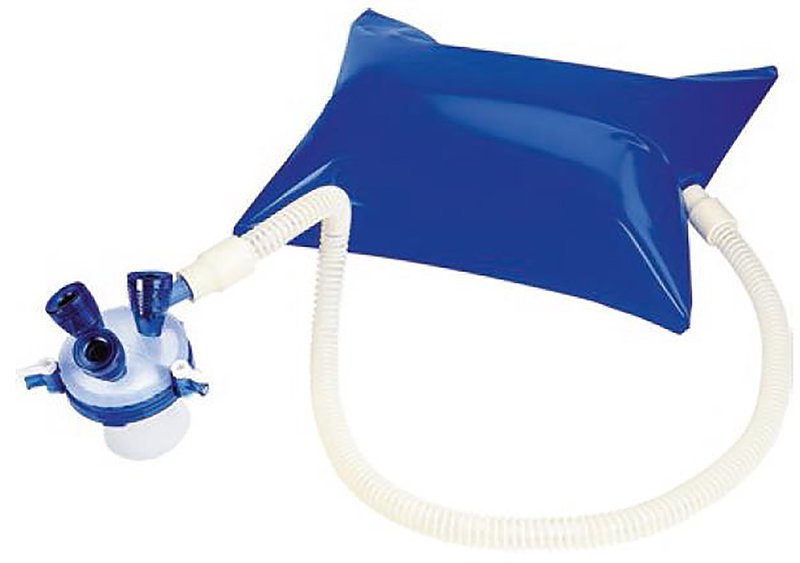
Figura 8: Bolsa de estabilización de insuflación conectada a Gel PointPath.
TAMIS puede realizarse con el instrumental de cirugía laparoscópica básica, lo que la convierte en una alternativa económica. Se recomienda que la endocámara para estos procedimientos tenga un ángulo de visión de al menos 30° ya que el espacio para trabajar es pequeño y la necesidad de crear la percepción de profundidad está dada por la mínima triangulación que permite la posición de la cámara y los instrumentos quirúrgicos. En nuestro país, los Dres. Minetti y col.27, Naiderman y col.28, Amarillo y col.29, y Moreira Grecco y col.30 han informado sus experiencias con la utilización de distintas plataformas de esta técnica endoscópica.
Existen otros puertos utilizados con menor frecuencia para realizar TAMIS, tales como el D-Port® (Karl Storz) y el Key Port® (Richard Wolf) (fig. 9).

Figura 9: Otros puertos utilizados para TAMIS. A) D-port fabricado por Karl Storz (Karl Storz, Barkshire, Reino Unido). B) Key Port, fabricado por Richard Wolf (Richard Wolf, Knittlingen, Alemania).
Todas estas plataformas han ampliado y diversificado la oferta a la hora de realizar estos procedimientos, adaptándolos a las necesidades de los cirujanos y a las posibilidades de las distintas instituciones (Tabla 1).
Tabla 1: Comparación de los puertos más frecuentemente utilizados para cirugía endoscópica transanal. Adaptado de Eldamshety y col.31
| TEM | TEO | TAMIS | |
| Rectoscopio | Rígido | Rígido | Flexible |
| Rectoscopio Longitud | 12-20 cm | 7,5 - 15 - 20 cm | 4 - 5,5 - 9 cm |
| Rectoscopio diámetro externo | 4 cm | 4 cm | 4 cm |
| Ayudante para videocámara | No | No | Sí |
| Uso | Reutilizable | Reutilizable | Descartable |
| Videocámara | Especial, 45°, binocular (3D) | Especial, 70°, (2D) | Convencional de laparoscopia |
| Equipo de insuflación de CO2 | Específico | Convencional de laparoscopia | Convencional de laparoscopia |
| Control de fluctuación de presión intrarrectal | Excelente | Bueno | Muy bueno con ISB* o Air Seal |
| Fijación | A la mesa operatoria | A la mesa operatoria | Al periné con puntos de sutura |
| Instrumentos de cirugía | Específicos curvos en la punta | Específicos curvos en la punta | Convencionales de laparoscopia |
| Costo | Fijo | Fijo | Variable (descartable) |
* ISB: Insufflation Stabilization Bag
ASPECTOS TÉCNICOS DE UNA RESECCIÓN ENDOSCÓPICA TRANSANAL
La planificación del procedimiento requiere ubicar topográficamente la lesión en el recto como se describió previamente. Es importante considerar la altura y la relación de la lesión con el fondo de saco de Douglas por la posibilidad de comunicar la luz rectal con el peritoneo durante la resección (2-30%)32-34, más frecuentemente en mujeres con fondo de saco de Douglas profundo y lesiones ubicadas en la cara anterior del recto. Puede ser útil la posición de Trendelenburg para producir el alejamiento de las asas intestinales del fondo pelviano evitando a la lesión térmica y favoreciendo la reparación del defecto parietal totalmente por vía transanal35,36. En plataformas como el TEO, TEM y en la resección local tradicional ubicar la lesión en hora seis facilita notablemente la ejecución del procedimiento. Para ello es necesario colocar al paciente en posición de litotomía cuando el tumor es posterior, en posición de navaja sevillana cuando el tumor es anterior o en decúbito lateral con los miembros inferiores flexionados sobre el abdomen cuando el tumor se encuentra en un lateral. De todos modos, la forma del extremo de los rectoscopios permite resecciones circunferenciales que pueden ser menos cómodas para el cirujano, pero que pueden realizarse con precisión, sin tener que variar la posición del paciente durante la cirugía37. El bisel del rectoscopio debe estar orientado hacia abajo, enfrentando la lesión, permitiendo que esta se encuentre en el centro del campo operatorio. Con TAMIS, plataforma con mayor flexibilidad, puede no ser necesario el posicionamiento de acuerdo con la localización, y la posición de litotomía es útil para cualquier localización, además es la posición preferida por los anestesiólogos ya que permite mayor comodidad para el manejo de la vía aérea38. Algunos pacientes presentarán lesiones extensas que ocupan más de un cuadrante y se debe prever una resección técnicamente más dificultosa.
Deben tenerse en cuenta todos los medios para evitar lesiones por decúbito, principalmente en prominencias óseas; también deberá asegurarse al paciente a la mesa operatoria por si fuera necesario modificar la lateralidad o la posición de Trendelenburg y evitar su deslizamiento.
Luego de que el paciente se encuentra en la posición más conveniente, debe dilatarse el canal anal con extremo cuidado, lenta y progresivamente, para evitar lesiones esfinterianas musculares o neurológicas que condicionen resultados funcionales posoperatorios adversos. Esto puede realizarse de manera digital al comienzo, o bien utilizando los dilatadores que cada plataforma provee. Es necesario que el paciente tenga una adecuada relajación muscular para evitar contracciones que hacen más difícil este paso.
El siguiente paso es insuflar el recto con CO2 generando el espacio necesario para realizar la resección. Utilizamos para ello un insuflador de alto volumen minuto, con una presión endoluminal similar a la utilizada en laparoscopia, 8-14 mm Hg. Un problema que se presenta con cierta frecuencia cuando se utiliza un insuflador de cirugía laparoscópica, diseñado para trabajar en una cavidad abdominal con gran distensibilidad (compliance) a la insuflación, es la contracción espasmódica del espacio intrarrectal debido a la particular relación entre los tiempos de insuflación y el sensado de presión de estos dispositivos, dificultando la fluidez del acto quirúrgico. En esta situación, sin embargo, primero que hay que descartar una pérdida de gas en el sistema, que facilite la salida del CO2 del interior del recto. TEM dispone de la unidad multifuncional con un sistema particular de insuflado que no tiene las dificultades propias de los insufladores laparoscópicos y mantiene estable la presión y el volumen.
Para Gel PointPath se han diseñado dos sistemas que resuelven esta situación: la bolsa de estabilización de insuflación descripta previamente (ISB) y el insuflador AirSeal® (ConMed, Nueva York, Estados Unidos). Este insuflador tiene la particularidad de poder sensar la presión intrarrectal de forma más directa y continua que los insufladores laparoscópicos y mantiene constante el volumen intrarrectal con una adecuada eliminación del humo39.
Otra dificultad que puede presentarse es la obstrucción visual que genera el humo dentro del pequeño espacio de cirugía. Para ello es importante quemar lentamente, de tal manera que el humo se produzca a una velocidad igual la capacidad de las válvulas o sistemas de aspiración de eliminarlo, o menor.
No se han informado casos de explosión por el uso de electrobisturí dentro del recto, quizá debido a que el uso de CO2 desplaza el gas metano impidiendo su acumulación como combustible40.
Antes de comenzar la resección de la lesión, incluso a través de la vía transanal convencional, es conveniente definir el margen lateral y marcar el perímetro por donde se realizará el corte. Esto se realiza mediante el electrocauterio, haciendo una línea de puntos a 1 cm aproximadamente del borde de la lesión en forma circunferencial, si se trata de un adenocarcinoma, o a 5 mm si se trata de un adenoma41. Este paso evita que durante la resección, cuando se produce retracción de los tejidos manipulados, la línea de corte se aproxime inapropiadamente al borde de la lesión, y además permite al comienzo del procedimiento saber si se podrá manipular adecuadamente el borde superior (fig. 10).
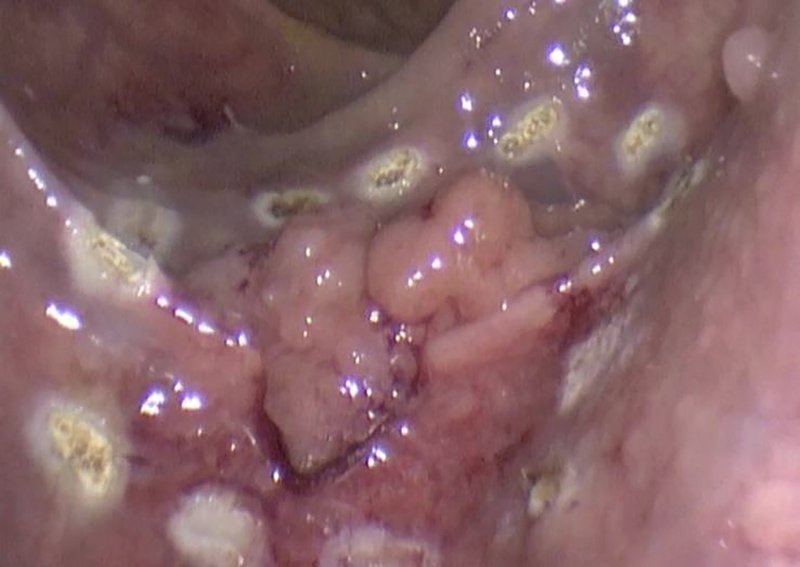
Figura 10: Marcado de una lesión en recto medio. Se observa la línea de puntos que será el margen de resección.
Según el diagnóstico preoperatorio (adenoma o adenocarcinoma) se realizará una resección con disección submucosa o bien una resección con espesor total de pared. Para realizar una resección submucosa puede infiltrarse esta capa con solución fisiológica y adrenalina al 1-2% a fin de separar la lesión de la capa muscular y disminuir el sangrado secundario al corte. En nuestro grupo hemos podido realizar, sin mayores dificultades técnicas, disecciones submucosas sin necesidad de infiltrar. En caso de una resección con espesor total de la pared, el corte se debe profundizar perpendicularmente a la superficie mucosa hasta llegar a la grasa mesorrectal. La dirección que lleva el corte es muy importante, ya que debemos evitar acercarnos al margen del tumor tanto en la superficie como en la profundidad, y en profundidad hay que tratar de no abrir la fascia mesorrectal, para que, en caso de necesitarse una resección radical diferida, no se violen los principios oncológicos de resección radical. Debemos evitar la manipulación excesiva de la pieza que se está resecando para evitar la fragmentación y el sembrado de células tumorales.
Algunos cirujanos utilizan bisturí armónico para la sección de pared completa, principalmente cuando se proponen resecar un pequeño segmento del mesorrecto adherido a la pared rectal42. En el HIBA utilizamos el electrobisturí en todos los casos, debido a que brinda seguridad en el corte, la hemostasia es segura en la mayoría de los casos y no aumenta los costos en forma innecesaria.
Debido al pequeño espacio intrarrectal, los movimientos horizontales o verticales se encuentran notablemente limitados si se los compara con la cirugía laparoscópica; por ello es importante entrenarse para desarrollar movimientos en el sentido del eje mayor del recto (entrar y salir) y movimientos rotacionales de los instrumentos. Creemos que el uso de los instrumentos desarrollados específicamente (TEO/TEM), luego de un entrenamiento apropiado, hace este tipo de procedimientos más fácil de realizar. Se debe evitar cruzar los instrumentos por delante de la cámara o cruzarlos entre sí, tratando de realizar solamente los movimientos antes descriptos.
La pieza quirúrgica debe ser extraída inmediatamente una vez resecada. Creemos conveniente que se lo haga desmontando los cabezales de los equipos TEM/TEO o la plataforma de gel en TAMIS de tal manera de evitar compresiones y tracciones de la pieza que puedan condicionar su ruptura o la siembra de células tumorales en a la luz rectal.
Luego de la resección de espesor total de pared queda una brecha que comunica la luz rectal con el ambiente perirrectal. El tamaño de esta estará en relación directa con el tamaño del tumor y el margen que se le haya dado (fig. 11).
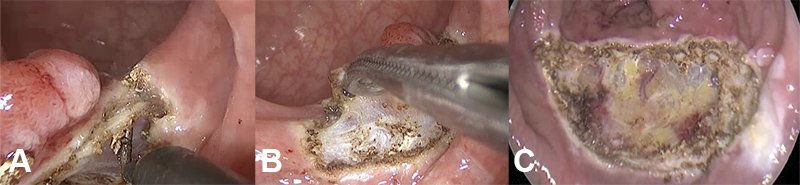
Figura 11: Resección de espesor total, en A se observa el inicio de la disección desde la derecha, en B el borde izquierdo y superior. En C, defecto de la pared rectal luego de extraída la pieza quirúrgica.
Es importante considerar que quizás el aspecto más complejo y extenso de una resección transanal por vía endoscópica puede ser justamente el cierre de la brecha. Si bien el uso cada vez más frecuente de cirugía laparoscópica ha facilitado el desarrollo de la cirugía endoscópica transanal, todavía son procedimientos que requieren una curva de aprendizaje elevada43. No hay duda de que se debe cerrar el defecto cuando la resección generó una comunicación de la luz rectal con la cavidad peritoneal; incluso puede ser necesario realizar una laparoscopia para verificar un cierre adecuado a través de una prueba neumática y lavar la cavidad ante una eventual contaminación. Sin embargo, cuando esta comunicación no se produce, cerrar la brecha continúa generando controversia. Brown y col.44 en un estudio retrospectivo estudiaron a 236 pacientes en quienes se cerró la brecha (TEM-C) y 105 en quienes se la dejó abierta (TEM-A) luego de TEM. Si bien no hubo diferencia en el tiempo operatorio entre los grupos, los cirujanos con mayor experiencia cerraban más frecuentemente la brecha (61 vs. 39%, p=0,01). El porcentaje de complicaciones fue mayor en el grupo TEM-A (19,0 vs. 8,4%, p=0,03), lo mismo que el de readmisiones (12,4 vs. 4,7%, p = 0,01). Los autores destacan que es seguro dejar abierta la brecha sobre la cara posterior cuando existe un mesorrecto grueso, aunque cerrar la brecha presenta menos complicaciones. En otro estudio, una revisión sistemática y metaanálisis reciente, se evaluaron 317 pacientes en quienes se cerró la brecha y 189 en un grupo con brecha abierta. No hubo diferencias en cuanto a morbilidad global (OR 1,26; IC 95% 0,32-4,91; p = 0,74), infección local (OR 0,62; IC 95% 0,23-1,62; p = 0,33), sangrado posoperatorio (OR 0,83; IC 95% 0,29-1,77; p = 0,63) o reoperación (OR 2,21; IC 95% 0,52-9,47; p = 0,29)45. Cabe destacar la ubicación del defecto parietal como un factor determinante, ya que si se encuentra en la cara anterior del recto, el mesorrecto resulta más delgado o inexistente y presenta mayor probabilidad de complicaciones posoperatorias, como perforación y entrada en la cavidad peritoneal46 o la creación de una fístula recto-vagina47. En ciertas situaciones puede ser imposible cerrar la brecha debido a su tamaño. Hahnloser y col. describen que, en el 30% de los pacientes operados por TAMIS, no era posible cerrarla a pesar de que el cirujano tenía el entrenamiento adecuado48 y la misma experiencia describieron Cataldo y col. con empleo de TEM49. Si se opta por cerrar el defecto, pueden presentarse dos situaciones: 1) si la brecha se encuentra próxima al anillo anorrectal, puede resultar más sencillo realizarlo por vía transanal convencional, mediante un separador de Parks o una valva de Sims, 2) si la opción es cerrarla mediante cirugía endoscópica, nos enfrentamos a la necesidad de realizar una sutura en un espacio sumamente pequeño, donde resulta difícil realizar nudos como se hace habitualmente en cirugía laparoscópica. En nuestra Institución realizamos habitualmente el cierre del defecto con una sutura continua de Vycril 3.0. El hilo se prepara con una longitud aproximada de 10 cm con un pequeño lazo en el extremo libre. Al colocar el primer punto que toma los dos bordes del defecto, la aguja pasa por dentro del lazo creado previamente y permite ajustar y fijar el punto inicial. También puede colocarse un clip metálico en el extremo del hilo para que funcione como tope al generar tracción de este. Posteriormente se realiza una sutura continua con puntos que tomen todo el espesor de la pared rectal; cada 3 o 4 puntos colocamos un clip metálico o plástico pequeño para fijar la sutura y evitar que se afloje (fig. 12).
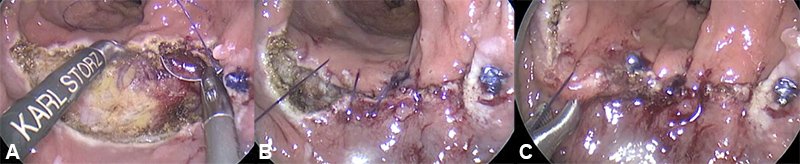
Figura 12: Cierre de la brecha. En A se observa el inicio del cierre por un lateral, se usó como tope del hilo un clip plástico. En B se observa la sutura continua, fijada en el medio por un segundo clip plástico. En C se observa el cierre completo de la brecha en forma hermética.
Luego de realizar el último punto, y con el defecto cerrado, colocamos un clip que fija el extremo del hilo y procedemos a cortar la aguja. En esta parte del procedimiento puede ser útil disminuir discretamente la presión del neumorrecto para favorecer la aproximación de los bordes del defecto que se va a reparar; esta maniobra puede ser tanto más necesaria cuanto mayor es el tamaño de la brecha. Siempre debe cerrarse la brecha en forma perpendicular al eje mayor del recto, observando un adecuado calibre al finalizar. También pueden utilizarse suturas autofijantes como V-Lock® (Medtronic, Minneapolis, Estados Unidos) o STRATAFIX® (Ethicon, Nueva Jersey, Estados Unidos), que en su superficie tienen pequeñas escamas que evitan el deslizamiento retrógrado del hilo, permitiendo ajustarlo solamente con la tracción. Cuando se decide cerrar la brecha es importante que el cierre sea hermético, ya que de esta forma disminuye la probabilidad de que se forme un absceso. Finalmente, debe constatarse un adecuado control de la hemostasia antes de finalizar el procedimiento.
BIBLIOGRAFÍA
- Atallah S, Albert M, Larach S. Transanal minimally invasive surgery: a giant leap forward. Surg Endosc. 2010; 24(9):2200-5.
- Casais M, Smientniansky M. Evaluación Prequirúrgica. En: Pekolj J, Ardiles V, Hyon SH, editores. Complicaciones de la cirugía abdominal. Cómo manejarlas. Buenos Aires: del hospital ediciones; 2015. pp. 210-3.
- Waage J, Taylor F, Read J, Brown G. Imaging Assessment of Early Rectal Cancer [Internet]. Early Gastrointestinal Cancers II: Rectal Cancer. 2014. pp. 3-14. Available from: http://dx.doi.org/10.1007/978-3-319-08060-4_1
- Chu DZJ, Giacco G, Martín RG, Guinee VF. The significance of synchronous carcinoma and polyps in the colon and rectum [Internet]. Cancer. 1986; 57: 445-50. Available from: 3.0.co;2-d">http://dx.doi.org/10.1002/1097-0142(19860201)57:3<445::aid-cncr2820570307>3.0.co;2-d
- Holte K, Nielsen KG, Madsen JL, Kehlet H. Physiologic Effects of Bowel Preparation [Internet]. Dis Colon Rectum. 2004; 47: 1397-402. Available from: http://dx.doi.org/10.1007/s10350-004-0592-1
- Lee TG, Lee SJ. Transanal single-port microsurgery for rectal tumors: minimal invasive surgery under spinal anesthesia [Internet]. Surg Endosc. 2014; 28: 271-80. Available from: http://dx.doi.org/10.1007/s00464-013-3184-0
- Zaouter C, Kaneva P, Carli F. Less Urinary Tract Infection by Earlier Removal of Bladder Catheter in Surgical Patients Receiving Thoracic Epidural Analgesia [Internet]. Region Anesth Pain M. 2009; 34: 542-8. Available from: http://dx.doi.org/10.1097/aap.0b013e3181ae9fac
- Ho P, Law WL, Chan SC, Lam CK, Chu KW. Functional outcome following low anterior resection with total mesorectal excision in the elderly. Int J Colorectal Dis. 2003; 18(3):230-3.
- Guren MG, Eriksen MT, Wiig JN, Carlsen E, Nesbakken A, Sigurdsson HK, et al. Quality of life and functional outcome following anterior or abdominoperineal resection for rectal cancer [Internet]. Eur J Surg Oncol (EJSO). 2005; 31: 735-42. Available from: http://dx.doi.org/10.1016/j.ejso.2005.05.004
- Heintz A, Mörschel M, Junginger T. Comparison of results after transanal endoscopic microsurgery and radical resection for T1 carcinoma of the rectum [Internet]. Surg Endosc. 1998; 12: 1145-8. Available from: http://dx.doi.org/10.1007/s004649900802
- Clancy C, Burke JP, Albert MR, Ronan O’Connell P, Winter DC. Transanal Endoscopic Microsurgery Versus Standard Transanal Excision for the Removal of Rectal Neoplasms [Internet]. Dis Colon Rectum. 2015; 58: 254-61. Available from: http://dx.doi.org/10.1097/dcr.0000000000000309
- Piccinini EE, Ugolini G, Rosati G, Conti A. Transanal local resection for benign and malignant rectal tumours [Internet]. Int J Colorectal Dis. 1995; 10: 112-6. Available from: http://dx.doi.org/10.1007/bf00341209
- Bonadeo F, Benati M, De Luca A, Sívori E, Corrao F, Beveraggi. Cáncer colorrectoanal. Análisis de la mortalidad postoperatoria. Rev Argent Cirug. 1981; 40(1):57-64.
- Benati M, Ojea Quintana G, Bonadeo F. Resultados de la resección local en el tratamiento del adenocarcinoma de recto. Rev Argent Cirug. 1990; 59(2):8-17.
- Benati M, Bonadeo F, Bosio R, Cortés AD, Mullen E, Ojea Quintana G, et al. Resección transanal del cáncer de recto: resultados a corto y largo plazo. Rev Argent Cirug. 2006;90(1):23–31.
- González J, Karalis I, Rico J, Santangelo HD. Cáncer de recto. Resecciones locales. Rev Argent Cirug. 1992; 63(2):77-9.
- Bilenca O, Pastore R, Griffero R. Resección local del adenocarcinoma de recto. Rev Argent Cirug. 1992; 63:80-2.
- Rijana R, Schlegel R, Jankilevich G, Rugna D, M. G. Resección local endorrectal en el cáncer de recto. Rev Argent Cirug. 2007; 92(3-4):126-34.
- Bosisio O, Graziano A, Ramírez Rojas P, Gómez C. Resección transanal de los adenomas vellosos del recto. Análisis retrospectivo. Rev Argent Cirug. 2001; 81(3-4):96-106.
- Mellgren A, Sirivongs P, Rothenberger DA, Madoff RD, García-Aguilar J. Is local excision adequate therapy for early rectal cancer? [Internet]. Dis Colon Rectum. 2000; 43: 1064-71. Available from: http://dx.doi.org/10.1007/bf02236551
- Middleton PF, Sutherland LM, Maddern GJ. Transanal Endoscopic Microsurgery: A Systematic Review [Internet]. Dis Colon Rectum. 2005; 48: 270-84. Available from: http://dx.doi.org/10.1007/s10350-004-0804-8
- Buess G, Hutterer F, Theiss J, Böbel M, Isselhard W, Pichlmaier H. [A system for a transanal endoscopic rectum operation]. Chirurg. 1984; 55(10):677-80.
- Saclarides TJ. TEM/local excision: Indications, techniques, outcomes, and the future [Internet]. J Surg Oncol. 2007; 96: 644-50. Available from: http://dx.doi.org/10.1002/jso.20922
- Serra-Aracil X, Mora-López L, Alcántara-Moral M, Caro-Tarrago A, Navarro-Soto S. Transanal endoscopic microsurgery with 3-D (TEM) or high-definition 2-D transanal endoscopic operation (TEO) for rectal tumors. A prospective, randomized clinical trial [Internet]. Int J Colorectal Dis. 2014; 29: 605-10. Available from: http://dx.doi.org/10.1007/s00384-014-1849-3
- Atallah S, Quinteros F, Martín-Pérez B, Larach S. Robotic transanal surgery for local excision of rectal neoplasms [Internet]. Journal of Robotic Surgery. 2014; 8: 193-4. Available from: http://dx.doi.org/10.1007/s11701-014-0463-2
- Waheed A, Miles A, Kelly J, Monson JRT, Motl JS, Albert M. Insufflation stabilization bag (ISB): a cost-effective approach for stable pneumorectum using a modified CO2 insufflation reservoir for TAMIS and taTME [Internet]. Tech Coloproctol. 2017; 21: 897-900. Available from: http://dx.doi.org/10.1007/s10151-017-1716-7
- Minetti A, Pitaco J, Crescenti D, Martínez E. Abordaje Microquirúrgico Transanal: Experiencia Inicial, Indicaciones y Resultados. Rev Argent Coloproct. 2017; 28(2):121-33.
- Naiderman D, Trinchero L, Cano D, Jury G, López Fagalde R, Reales J. Experiencia inicial en cirugía transanal mínimamente invasiva (TAMIS). Rev Argent Cirug. 2017; 109(1):19-24.
- Amarillo H, Rodríguez G, Díaz L, Tacchi P. Resección transanal de lesiones de recto vía TAMIS. Análisis de una serie inicial. Rev Argent Cirug. 2018; 110(3):156-60.
- Moreira Grecco A, Zapata G, Bollo C, Morales R, Saroto L. TAMIS: ¿Un Nuevo Estándar para el Tratamiento de los Pólipos de Recto? Revisión de la bibliografía y reporte de nuestra experiencia. Rev Argent Coloproct. 2019; 30(1):1-11.
- Eldamshety O, Metwally IH, Ghoneem E, Elkashef WF. Resection of rectal GIST using a novel technique: a report of two cases [Internet]. ecancermedicalscience. 2017; 11. Available from: http://dx.doi.org/10.3332/ecancer.2017.760
- Dafnis G, Påhlman L, Raab Y, Gustafsson U-M, Graf W. Transanal endoscopic microsurgery: clinical and functional results. Colorectal Dis. 2004; 6(5):336-42.
- Gavagan JA, Whiteford MH, Swanstrom LL. Full-thickness intraperitoneal excision by transanal endoscopic microsurgery does not increase short-term complications [Internet]. Am J Surg. 2004; 187: 630-4. Available from: http://dx.doi.org/10.1016/j.amjsurg.2004.01.004
- Serra-Aracil X, Vallverdú H, Bombardó-Junca J, Pericay-Pijaume C, Urgellés-Bosch J, Navarro-Soto S. Long-term Follow-up of Local Rectal Cancer Surgery by Transanal Endoscopic Microsurgery [Internet]. World J Surg. 2008; 32: 1162-7. Available from: http://dx.doi.org/10.1007/s00268-008-9512-1
- Blair S EJD. Transanal excision for low rectal cancers is curative in early-stage disease with favorable histology. Am Surg. 2000; 66(9):817-20.
- Eyvazzadeh DJ, Lee JT, Madoff RD, Mellgren AF, Finne CO. Outcomes After Transanal Endoscopic Microsurgery With Intraperitoneal Anastomosis [Internet]. Dis Colon Rectum. 2014;57: 438-41. Available from: http://dx.doi.org/10.1097/dcr.0000000000000063
- Allaix ME, Arezzo A, Arolfo S, Caldart M, Rebecchi F, Morino M. Transanal Endoscopic Microsurgery for Rectal Neoplasms. How I Do It [Internet]. Vol. 17, J Gastrointest Surg. 2013. p. 586–92. Available from: http://dx.doi.org/10.1007/s11605-012-2060-x
- deBeche-Adams T, Hassan I, Haggerty S, Stefanidis D. Transanal Minimally Invasive Surgery (TAMIS): a clinical spotlight review [Internet]. Surg Endosc. 2017; 31: 3791-800. Available from: http://dx.doi.org/10.1007/s00464-017-5636-4
- Bislenghi G, Wolthuis AM, van Overstraeten A de B, D’Hoore A. AirSeal system insufflator to maintain a stable pneumorectum during TAMIS [Internet]. Tech Coloproctol. 2015; 19: 43-5. Available from:http://dx.doi.org/10.1007/s10151-014-1244-7
- deBeche-Adams T, Hassan I, Haggerty S, Stefanidis D. Transanal Minimally Invasive Surgery (TAMIS): a clinical spotlight review [Internet]. Surg Endosc. 2017; 31:3791-800. Available from: http://dx.doi.org/10.1007/s00464-017-5636-4
- Blair S EJD. Transanal excision for low rectal cancers is curative in early-stage disease with favorable histology. Am Surg. 2000; 66(9):817-20.
- Burghardt J, Buess G. Transanal endoscopic microsurgery (TEM): a new technique and development during a time period of 20 years. Surg Technol Int. 2005; 14:131-7.
- Barendse RM, Dijkgraaf MG, Rolf UR, Bijnen AB, Consten ECJ, Hoff C, et al. Colorectal surgeons’ learning curve of transanal endoscopic microsurgery [Internet]. Vol. 27, Surg Endosc. 2013; 27: 3591-602. Available from:http://dx.doi.org/10.1007/s00464-013-2931-6
- Brown C, Raval MJ, Phang PT, Karimuddin AA. The surgical defect after transanal endoscopic microsurgery: open versus closed management. Surg Endosc. 2017; 31(3):1078-82.
- Menahem B, Alves A, Morello R, Lubrano J. Should the rectal defect be closed following transanal local excision of rectal tumors? A systematic review and meta-analysis. Tech Coloproctol. 2017; 21(12):929-36.
- Clermonts SHEM, Zimmerman DDE. Closure of the rectal defect after transanal minimally invasive surgery: a word of caution. Colorectal Dis. 2015; 17(7):642-3.
- Keller DS, Tahilramani RN, Flores-González JR, Mahmood A, Haas EM. Transanal Minimally Invasive Surgery: Review of Indications and Outcomes from 75 Consecutive Patients [Internet]. J Am Coll Surgeons. 2016; 222: 814-22. Available from: http://dx.doi.org/10.1016/j.jamcollsurg.2016.02.003
- Hahnloser D, Cantero R, Salgado G, Dindo D, Rega D, Delrio P. Transanal minimal invasive surgery for rectal lesions: should the defect be closed? Colorectal Dis. 2015; 17(5):397-402.
- Cataldo PA, O’Brien S, Osler T. Transanal Endoscopic Microsurgery: A Prospective Evaluation of Functional Results [Internet]. Dis Colon Rectum. 2005; 48:1366-71. Available from:http://dx.doi.org/10.1007/s10350-005-0031-y.
