Proctitis Infecciosa por Chlamydia Trachomatis
REV ARGENT COLOPROCT | 2019 | VOL. 30, Nº 2: 57-64
ARTÍCULO ORIGINAL
Proctitis Infecciosa por Chlamydia Trachomatis
Trabajo a Premio Anual
Laura Svidler López,1 Luciana La Rosa,
Marcelo Rodríguez Fermepin,3Andrea Carolina Entrocassi,3Karina Büttner,3Gabriela Sidra,1Brenda Natalia Mangariello,1Julieta Cittadini,2Marianela Grandoli,2Mónica Alejandra Pasarín,2Fernando Vázquez,2Omar Rubén Miravalle,2Ubaldo Alfredo Gualdrini,2Jorge Arias,2
Alejandro Gutiérrez,2Rodolfo Zannoli,1Héctor Pérez,1Mercedes Cabrini,1Diego Salusso,1
Silvina Figurelli,1Silvia Montibello,1Laura Scocozza1
1Hospital Juan A. Fernández.
2Centro Privado de Cirugía y Coloproctología.
3Universidad de Buenos Aires, Facultad de Farmacia y Bioquímica, Departamento de Bioquímica Clínica, Laboratorio de Clamidias.
RESUMEN
Introducción: Las infecciones transmisibles sexualmente (ITS) son motivo de consulta frecuente, encontrándose Chlamydia trachomatis (CT) entre las prevalentes. Este germen provoca proctitis de diversa gravedad según el biovar involucrado. Los casos más floridos suelen ser ocasionados por el biovar LGV, responsable de la entidad linfogranuloma venéreo. Se desconocen la prevalencia de CT como causa de proctitis en Argentina y los biovares implicados. Con el objetivo de estudiar estas variables, se diseñó un protocolo para detectar y genotipificar CT en pacientes con proctitis infecciosa.
Pacientes y métodos: Se incluyeron pacientes mayores de 18 años con cuadro de proctitis infecciosa atendidos en un centro público y otro privado. Se excluyeron pacientes con enfermedad inflamatoria intestinal y radioterapia pelviana. El estudio fue aprobado por un Comité de Ética y los pacientes firmaron un consentimiento informado. En las muestras de hisopado anal se realizó detección y tipificación molecular de CT.
Resultados: Entre 31de agosto de 2017 y 31 de mayo de 2018, se incluyeron 56 pacientes (1 mujer, 53 hombres, 2 mujeres trans), 79% HIV+. En 29 casos (52%) se detectó CT. Todos eran hombres que tienen sexo con hombres (HSH) y refirieron practicar sexo anal u oral receptivo no protegido. La mediana de edad de este subgrupo fue de 31 años; 83% HIV+ en tratamiento antirretroviral y mediana de CD4 637 cel/mm3. La coinfección con otras ITS fue del 41% (siendo las más frecuentes HPV, gonococia y sífilis). Los motivos de consulta más frecuentes fueron proctorragia, pujo y tenesmo, proctalgia y secreción. Las manifestaciones clínicas fueron variadas: proctitis, úlcera perianal, tumor endoanal/rectal y absceso/fístula. El 86% de las proctitis correspondió al biovar LGV, siendo 62% moderadas a graves.
La mediana de tiempo de evolución hasta el diagnóstico fue 21 días. Los casos más prolongados correspondieron a cuadros clínicos y endoscópicos más graves.
La duración del tratamiento se adecuó al biovar involucrado. Todos los pacientes respondieron favorablemente; sin embargo, las dos fístulas perianales requirieron resolución quirúrgica.
Conclusiones: Proctitis, úlceras y fístulas son manifestaciones inespecíficas; el hallazgo clínico y endoscópico per se no son suficientes para definir la etiología; sólo una anamnesis minuciosa permite presumir una ITS como agente causal. La tipificación logra definir el biovar, dato fundamental para adecuar el tratamiento, cortar la cadena de transmisión y contar con datos epidemiológicos a nivel local. Como resultado de esta investigación, el Ministerio de Salud de Nación proyectó la emisión de una alerta sobre la presencia de LGV en nuestro medio.
Tipo de estudio: Observacional, transversal, analítico, multicéntrico.
Palabras clave: Proctitis, Linfogranuloma venéreo, Chlamydia trachomatis, Infecciones de transmisión sexual, HIV, HSH
ABSTRACT
Introduction: Sexually transmitted infections (STI) are a frequent reason for consultation, being Chlamydia trachomatis (CT) among the most prevalent ones. It causes proctitis of varying severity depending on the biovar involved. The most severe cases are usually caused by the LGV biovar, responsible for the entity called lymphogranuloma venereum. The prevalence of CT as a cause of proctitis in Argentina and the biovars involved are unknown. In order to study these variables, a protocol was designed to detect and genotype CT in patients with infectious proctitis.
Patients and methods: Patients over 18 years old with infectious proctitis were attended in a public and private center. Patients with inflammatory bowel disease and pelvic radiation therapy were excluded. The study was approved by an Ethics Committee and the patients signed an informed consent. The detection and molecular typing of CT was performed in anal swab samples.
Results: Between 31-08-2017 and 31-05-2018, 56 patients were included (1 woman, 53 men, 2 trans women), 79% HIV +. In 29 cases (52%) CT was detected. All were MSM and reported to practice unprotected receptive oral or anal sex. The median age of this subgroup was 31 years; 83% HIV + on antiretroviral treatment and median CD4 637 cel / mm3. The coinfection with other STIs was present 41% (the most frequent were HPV, gonococcal and syphilis). The most frequent symptoms were bleeding, tenesmus, proctalgia and secretion. The clinical manifestations were varied: proctitis, perianal ulcer, endoanal / rectal tumor and abscess / anal fistula. 86% of the proctitis corresponded to the LGV biovar, being 62% moderate to severe. The median time of evolution until the diagnosis was 21 days. The most prolonged cases corresponded to more severe clinical and endoscopic symptoms. The duration of the treatment was adapted to the biovar involved. All patients responded favorably; however, the two perianal fistulas required surgical resolution.
Conclusions: Proctitis, ulcers and fistulas are nonspecific manifestations; the clinical and endoscopic findings per se are not sufficient to define the etiology; only a meticulous anamnesis allows us to presume an STI as a causative agent. The typification allows to define the biovar, a fundamental data to adapt the treatment, stop chain of transmission and provides local epidemiological data. As a result of this investigation, the Ministry of Health of the Argentina issued an alert about the presence of LGV in our country.
Type of study: Observational, cross-sectional, analytical, multicenter study.
Key words: Proctitis, Lymphogranuloma venereum, Chlamydia trachomatis, Sexually transmitted infections, HIV, MSM
Laura Svidler Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Luciana La Rosa Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Los autores declaran no tener nungún conflicto de interés.
INTRODUCCIÓN
Las infecciones transmisibles sexualmente (ITS) son un motivo de consulta médica frecuente. La Organización Mundial de la Salud estima que anualmente 357 millones de personas contraen alguna ITS, siendo la clamidiasis una de las más frecuentes.1
Chlamydia trachomatis (CT) es una bacteria intracelular responsable de la infección anual de cien millones de personas a nivel global. Existen diferentes genotipos de CT, organizados en dos biovares: TRIC y LGV. Los genotipos A, B y C producen tracoma ocular, los D a K ocasionas formas clínicas leves de ITS y los genotipos L1, L2 y L3, pertenecientes al biovar LGV, son los responsables de un cuadro más agresivo, conocido como linfogranuloma venéreo.2
La transmisión puede suceder a partir de diversas prácticas sexuales, incluidos el sexo anal y el contacto oral-anal.3
Los métodos diagnósticos están validados y ampliamente difundidos para la localización urogenital pero no así para la rectoanal. Si bien en general las infecciones anorrectales por CT no tienen la misma gravedad que las urogenitales, pueden actuar como reservorio.4 Asimismo, los pacientes con infección anorrectal presentan mayor riesgo de adquirir el virus de la inmunodeficiencia humana (HIV).5,6
La prevalencia de detección de CT a nivel anorrectal en individuos asintomáticos varía según las series, reportándose valores de hasta 17% en las mujeres2 y 24% en los HSH.7
La mayoría de las infecciones anorrectales no son sintomáticas; cuando lo son, y dependiendo de los genotipos implicados, el cuadro variará de una proctitis con síntomas mínimos a cuadros más graves.8-11
De acuerdo a la literatura, un número importante de proctitis infecciosas graves en Estados Unidos y Europa son producidas por CT, principalmente por el biovar LGV.12-14
En un estudio realizado en el consultorio externo de coloproctología del Hospital Juan A. Fernández entre agosto de 2015 y julio de 2016, el 41% de las ITS diagnosticadas, fueron por CT. Aunque no pudo establecerse el biovar involucrado, se sospechó LGV en las proctitis graves (un tercio de ellas, caracterizadas por la presencia de tumores que comprometían el calibre rectal).15 El porcentaje de infección por CT en proctitis sintomática de esta serie coincidió con la reportada por otros autores.16,17
Un trabajo efectuado en la República Argentina evaluó la prevalencia de infección por CT a nivel anal en una población de HSH asintomáticos mediante auto-toma de muestra, detectándose en el 2,9% de los participantes.18 Sin embargo, la prevalencia de CT en la infección rectal sintomática en Argentina no se conoce; así como tampoco los genotipos involucrados. La genotipificación es una herramienta útil ya que permite comprender mejor la epidemiología de la infección y adecuar el tratamiento en caso de detectarse el biovar LGV.19
El objetivo de este trabajo fue incrementar el conocimiento acerca de la prevalencia de CT como agente etiológico de la proctitis infecciosa y de los biovares TRIC y LGV mediante genotipificación. El objetivo secundario fue evaluar la asociación de CT con otras ITS.
DISEÑO
Estudio observacional, transversal, analítico, multicéntrico.
PACIENTES Y MÉTODOS
Ámbito del estudio
Consultorios externos de Coloproctología del Hospital Público “Juan A. Fernández” de la Ciudad Autónoma de Buenos Aires y del Centro Privado de Cirugía y Coloproctología de la misma Ciudad.
Población
Pacientes mayores de 18 años con historia clínica y sintomatología compatibles con proctitis infecciosa que consultaron a los centros participantes del estudio.
Criterios de inclusión
- Individuos mayores de 18 años que otorgaron consentimiento informado por escrito.
- Consulta por síntomas compatibles con proctitis (tenesmo rectal, secreción anal, urgencia evacuatoria, proctalgia) de probable origen infeccioso sospechado por el antecedente de prácticas sexuales anales receptivas con protección inadecuada.
Criterios de exclusión
- Historia de radioterapia pelviana.
- Enfermedad inflamatoria intestinal.
Diseño global del ensayo
Los pacientes fueron estudiados y tratados de acuerdo a las guías actuales de manejo de las ITS.10,14 Se realizó una anamnesis que incluyó antecedentes personales, historia de ITS del paciente y su o sus contactos y hábitos sexuales, alergias, consumo de medicamentos y adicciones. Se efectuó un examen clínico general, inguinal y proctológico. Este último mediante rectosigmoideoscopía rígida o eventual videocolonoscopía, cuando se consideró necesario (síntomas de colitis infecciosa o inflamatoria, de cáncer de colon o criterios para su pesquisa).
Se solicitaron estudios serológicos de HIV, Hepatitis A, B y C, VDRL y detección directa de CT, gérmenes comunes y Neisseria gonorrhoeae en muestras rectales. Las muestras de hisopado rectal para la detección de CT fueron remitidas para su procesamiento al “Laboratorio de Chlamydias” del Departamento de Bioquímica Clínica de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires. Se realizó extracción de ADN, PCR en tiempo real para la detección de marcadores moleculares de CT, Nested PCR del gen ompA para confirmar la detección y obtener productos de amplificación para la genotipificación y RFLP para asignar biovar (TRIC o LGV).
Se indicó Doxiciclina 100 mg dos veces por día por vía oral; dependiendo del biovar, durante una (biovar TRIC) o tres semanas (biovar LGV).2,10,14 Cuando el paciente se encontraba muy sintomático, se inició el tratamiento empírico y, de lo contrario, se esperó a los resultados de los estudios solicitados.
Se realizó seguimiento clínico y endoscópico hasta la resolución del cuadro.
Se diseñó una ficha para la recolección de datos, que luego fueron volcados a una base de datos de Excel creada para tal fin.
Consideraciones éticas
El protocolo se realizó de acuerdo a la Declaración de Helsinki y la Guía de Buenas Prácticas Clínicas y fue aprobado por el Comité de Ética en Investigación (CODEI) del Hospital Juan A. Fernández. Los datos de los pacientes fueron protegidos según la Ley Argentina de protección de datos personales número 25.326.
Las muestras utilizadas para el estudio fueron codificadas antes de ser remitidas para su análisis al laboratorio de la “Unidad de estudios de Chlamydiae y otras infecciones del tracto genital”, en la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires para preservar el anonimato del paciente.
Se respetó el secreto profesional en las distintas instancias de la atención.
Análisis estadístico
Se realizó el cálculo de tamaño muestral para la estimación de una proporción en estudios de prevalencia. Se utilizó la fórmula de Intervalo de Confianza del 95% para despejar el número muestral requerido para estimar la prevalencia mayor o igual al 17% de proctitis por CT según lo observado en la literatura (17% al 41%).2,16 El tamaño de la muestra requerido estimado fue de 38 pacientes.
Las variables continuas se expresaron en media ± desvío estándar (DS) o mediana y rango intercuartil veinticinco y setenta y cinco (IC 25-75) según su distribución. Se evaluó normalidad según valores de media, mediana, Skewness, Kurtosis, histograma y prueba de Wilk-Shapiro. Las variables categóricas se expresaron en porcentajes.
El análisis comparativo entre variables categóricas se realizó con la prueba de Chi Cuadrado o con la prueba exacta de Fisher según correspondiera y se calcularon medidas de asociación (riesgo relativo-RR- con su intervalo de confianza del 95%). Las variables continuas se compararon con la prueba estadística de T de Student o prueba de Mann-Whitney-Wilcoxon según tuvieran distribución normal o no, respectivamente. El nivel de significancia estadística se fijó en un valor de p < 0.05.
Se efectuó el análisis con el programa estadístico STATAMP versión 13.
RESULTADOS
Entre el 31 de agosto de 2017 y el 31 de mayo de 2018 se incluyeron 56 pacientes (1 mujer, 53 hombres y 2 mujeres trans). Ninguno de los incluidos fue referido por otro de la serie. Cuarenta y cuatro eran HIV+ (79%).
En 29 casos (52%) se detectó infección por CT; todos eran HSH y refirieron practicar sexo anal u oral receptivo no protegido o lubricación con saliva. La mediana de edad de este grupo fue de 31 años (IC: 25-75%: 26-37). El 83% tenía coinfección con HIV en tratamiento antirretroviral y con mediana de CD4 de 637 cel/mm3 (rango: 210-1628). La coinfección con otras ITS se detectó en el 41% de los casos, siendo las más frecuentes las lesiones por HPV (67%), gonococia (58%) y sífilis (33%). Los motivos de consulta fueron proctorragia (59%), pujo y tenesmo (59%), proctalgia (45%), secreción purulenta (45%), mucorrea (38%), alteración del ritmo evacuatorio (21%) y pérdida de peso (7%). Las manifestaciones clínicas fueron variadas: proctitis (86%), siendo moderada o grave en el 58%, úlcera perianal (38%), tumor endoanal/rectal (21%) y absceso/fístula (3,5%). Se asociaron adenopatías inguinales en el 64% de los casos.
De las proctitis por CT, cuatro resultaron biovar no LGV (14%) y 25 LGV (86%). La mediana de edad de estos subgrupos fue 22,5 y 33 años, respectivamente (p: 0.03). Se observó una elevada prevalencia de coinfección con otras ITS en los casos de LGV: HIV (84%), HPV (60%), gonococia (50%) y sífilis (40%) que se observó sólo en este subgrupo. En este mismo subgrupo, se detectó una infección con Gardnerella Vaginalis (atípica para esta localización).
La presencia de proctorragia fue exclusiva en el subgrupo LGV, siendo un hallazgo estadísticamente significativo (no LGV 0% vs. LGV 68%, p: 0.01). Sólo en el subgrupo LGV se identificaron tumores inflamatorios (24%), alteración en el ritmo evacuatorio (24%), anorexia (8%) y pérdida de peso (8%). También en este subgrupo predominaron las rectitis moderadas a graves (62%), con una diferencia estadísticamente significativa en las formas graves (no LGV: 0% vs. LGV: 33%, p: 0.01). Cabe destacar que un 38% de los pacientes con LGV presentaron síntomas mínimos y proctitis leve. En el subgrupo no LGV prevalecieron las proctitis leves (67%).
Las manifestaciones anales predominaron en el grupo LGV: úlceras (40% vs. 25%, p: 0.57), anitis (24% vs. 0%, p: 0.27) y abscesos/fístulas (4% vs. 0%, p: 0.68).
El tiempo promedio transcurrido desde el inicio de los síntomas hasta el diagnóstico fue de 21 días (rango:14-300). Los pacientes con tiempos de evolución más prolongados (180 y 300 días), tenían biovar LGV y se correspondieron con cuadros clínicos y endoscópicos más graves.
En función del biovar se administró el tratamiento: los casos del subgrupo no LGV recibieron una semana de doxiciclina 200 mg al día en dos tomas; mientras que a los casos de LGV se los trató durante tres semanas. Todos los pacientes respondieron adecuadamente; sin embargo, los dos que presentaban una fístula perianal requirieron tratamiento quirúrgico adicional.
DISCUSIÓN
Los distintos biovares de CT se asocian a diferentes manifestaciones clínicas. El TRIC habitualmente ocasiona formas clínicas leves mientras que el LGV es responsable de un cuadro más agresivo, conocido como linfogranuloma venéreo. Esta enfermedad es endémica en zonas tropicales y subtropicales y tiene muy baja incidencia en el resto del mundo. Sin embargo, desde 2003 se ha observado un aumento de las infecciones por cepas del biovar LGV a nivel mundial. Publicaciones recientes ponen en evidencia que la proctitis por CT es una forma de presentación emergente del linfogranuloma venéreo.20-24
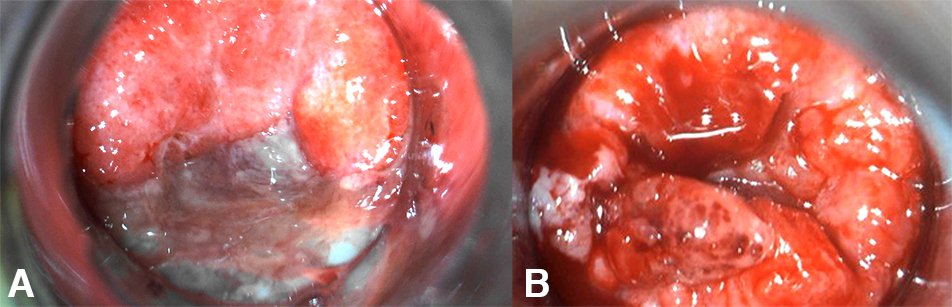
En esta serie la mitad de las proctitis fueron ocasionadas por CT, (fig. 1) siendo su prevalencia global similar a la de otras publicaciones.15-17 En los casos más graves, puede simular una EII, principalmente en HSH HIV+.2,3,10 En la presente serie, el caso con mayor tiempo de evolución había sido derivado con este diagnóstico.
Las manifestaciones coloproctológicas de la infección por ambos biovares de CT son variadas e inespecíficas: ulceraciones anales o perianales, secreción purulenta o sanguinolenta, tenesmo y dolor cólico en hemiabdomen inferior.2,8,9 La proctitis puede asociarse también a síntomas como constipación, mucorrea, sangrado rectal y prurito anal.8,10,11 Siendo en esta serie, la signo sintomatología predominante.
Este proyecto tenía como objetivo primario estudiar la prevalencia de los distintos biovares de CT como agente etiológico de proctitis infecciosa en nuestra población. Puesto que en nuestro medio solamente existían reportes de casos aislados de linfogranuloma venéreo rectal,25 resultó inesperada la detección predominante del biovar LGV en este estudio. De esta manera, esta serie de casos constituye la más extensa de la que se tenga conocimiento en Latinoamérica. Recientemente fueron publicados los primeros 8 casos de este estudio.26
A pesar del bajo número de pacientes con biovar TRIC, se observó una diferencia estadísticamente significativa en la edad de los pacientes, siendo mayor en el subgrupo LGV. Este hallazgo coincide con lo detectado en otras series.24 En la presente serie, al igual que en lo descrito en la bibliografía, la mayoría de los pacientes del subgrupo LGV fueron HSH HIV+ que mantuvieron prácticas sexuales anales u orales sin protección. Coincidiendo con otras series, se observó una elevada prevalencia de coinfección con otras ITS en los casos de LGV, predominado lesiones por HPV, gonococia y sífilis.27,28
CT y Neisseria gonorrhoeae han sido detectadas en anorrecto principalmente en HSH y mujeres que tienen sexo anal sin protección. Diversos estudios demuestran que deben ser pesquisadas en todo paciente con riesgo de contraer ITS, tanto a nivel urogenital como anorrectal, debido a la asociación entre ambas.4,14 En pacientes con gonococia se detectó 10-40% de coinfección con CT.29 En la presente serie, esta asociación se identificó en el 58% de los casos. El porcentaje mayor podría explicarse por la búsqueda sistemática de Neisseria gonorrhoeae en pacientes sintomáticos y a que se trata de una población de alto riesgo para el contagio de una ITS. La sífilis ha sido descrita, junto con el HIV, como un factor de riesgo para el contagio de CT biovar LGV, pudiendo estar presente hasta en el 70% de los casos.24 En nuestra serie se asociaron en el 40% de los pacientes.
La presencia de proctorragia fue exclusiva del subgrupo LGV, siendo un hallazgo estadísticamente significativo. Las lesiones tumorales estuvieron presentes sólo en el subgrupo LGV, así como la alteración del ritmo evacuatorio, la anorexia y la pérdida de peso, pero sin significancia estadística. Cabe resaltar, sin embargo, que más de la tercera parte de los pacientes con LGV manifestaron síntomas mínimos y proctitis leve. Esto impide tener una sospecha etiológica basada en la clínica; sólo la genotipificación permite diferenciar los biovares.
Con respecto a las manifestaciones anales, la mayor parte de los reportes hacen referencia exclusivamente al compromiso rectal por LGV. Son pocas las series que reportan lesiones orificiales, con una prevalencia menor al 10%.22,30 En esta serie se diagnosticaron un elevado porcentaje de úlceras anales. Aunque no fue estadísticamente significativo, las manifestaciones orificiales (úlceras, abscesos y fístulas) predominaron en el subgrupo LGV (fig. 2).
La proctitis es una manifestación inespecífica de diversos orígenes y el hallazgo endoscópico per se no es suficiente para definir su etiología, tal como se observa en esta casuística. Además, la presentación orificial es motivo de consulta frecuente y, en general, no es debida a infecciones de transmisión sexual. Por lo tanto, sólo una anamnesis minuciosa permite presumir una infección por CT. En esta serie, el alto nivel de sospecha clínica de infección de transmisión sexual anorrectal y la detección de CT con tipificación del biovar LGV permitieron el diagnóstico en una etapa temprana.
En conjunto, estas observaciones reflejan el polimorfismo clínico de la enfermedad.
Figura 1: Linfogranuloma venéreo rectal. A) Proctitis grave. B) Símil EII.
Figura 2: Manifestaciones oficiales. A) Úlceras anales. B) Fístula perianal.
CONCLUSIÓN
El estudio planteado permitió obtener información sobre la prevalencia de la infección rectal por Chlamydia trachomatis en la población que consulta con síntomas atribuibles a proctitis infecciosa.
El elevado número de pacientes diagnosticados en un corto periodo de tiempo, sugiere la presencia de un brote de LGV. Al igual que en las series europeas, en población HSH HIV+, predominó el biovar LGV sobre el TRIC.
El diagnóstico precoz de la infección por CT y su tratamiento son importantes para evitar las complicaciones de la infección crónica y controlar su transmisión. En este sentido, la genotipificación resultó clave.
Dada su potencial impacto en la salud pública, advertimos sobre la emergencia de esta entidad en nuestro medio. Sugerimos que, ante la detección de CT en anorrecto, particularmente en HSH HIV+, de no contarse con la posibilidad de identificar el genotipo, éste sea considerado biovar LGV y se prescriba el tratamiento correspondiente.
A partir de los resultados de este estudio, el Ministerio de Salud de la Nación proyectó la emisión de una alerta epidemiológica notificando la emergencia de la infección por LGV en nuestro medio.
BIBLIOGRAFÍA
- World Health Organization (WHO). Infecciones de Transmisión Sexual. Centro de Prensa. Agosto de 2016; Nota descriptiva N 110. http://www.who.int/es/news-room/fact-sheets/detail/sexually-transmitted-infections-(stis)
- Lanjouw E, Ourburg S, de Vries HJC, et al. 2015 European guideline on the management of Chlamydia trachomatis infections. Int J STD AIDS. 2015; 1-16.
- Assi R, Hashim PW, Reddy VB, Einarsdottir H, Longo E. Sexually transmitted infections of the anus and rectum. World J Gastroenterol. 2014; 20: 15262-68.
- Bazan JA, Carr Reese P, Esber A, et al. High prevalence of rectal gonorrhea and Chlamydia infection in women attending a sexually transmitted disease clinic. J Women’s Health (Larchmt). 2015; 24:182-89.
- Bernstein KT, Marcus JL, Nieri G, et al. Rectal gonorrhea and Chlamydia reinfection is associated with increased risk of HIV seroconversion. J Acquir Immune Defic Syndr. 2010; 53: 537-43.
- Workowski KA. Sexually Transmitted Infections and HIV: Diagnosis and Treatment. Top Antivir Med. 2012; 20: 11-16.
- van Liere GAFS, van Rooijen MS, Hoebe CJPA, Heijman T, de Vries HJC, Dukers-Muijrers NHTM (2015) Prevalence of and Factors Associated with Rectal-Only Chlamydia and Gonorrhoea in Women and in Men Who Have Sex with Men. PLoS ONE 10(10): e0140297. doi:10.1371/journal. Pone.0140297.
- Whitlow CB. Bacterial Sexually Transmitted Diseases. Clin Colon Rectal Surg. 2004; 17: 209-14.
- Bun RF. Enfermedades Anorrectales de Transmisión Sexual. Cirugía Digestiva, F. Galindo. www.sacd.org.ar, 2009; III-385, pág. 1-14.
- de Vries HJC, Zingoni A, Kreuter A, et al. 2013 European Guideline on the Management of Lymphogranuloma Venereum. J Eur Acad Dermatol Venerol. 2013; 29:1-6.
- Bignell C, Unemo M, Jensen GS, et al. 2012 European Guideline on the Diagnosis and Treatment of Gonorrhoea in Adults. Int J STD AIDS. 2013; 24 (2): 85–92.
- Nadal Sr, Manzione Cr. Sexually transmitted proctitis. J Coloproct, 2012; 32: 95-7.
- López-Vicente J, Rodríguez-Alcalde D, Hernández-Villalba L et al. Proctitis as the clinical presentation of lymphogranuloma venereum, a re-emerging disease in developed countries. Rev esp enferm dig. 2014; 106: 59-62.
- Frieden TR, Jaffe HW, Cono J, Richards CL, Iademarco MF. Sexually transmitted diseases. Treatment guidelines, 2015. MMWR Recomm Rep 2015; 64: 1-137.
- Svidler López L. Manifestaciones anorrectales de las infecciones de transmisión sexual. Leído en la sesión del 16/11/2016 de la Sociedad Argentina de Coloproctología (en prensa).
- Jian-Hong Li. Yu-, Yue.Ping Yin et al. Prevalence of anorectal Chlamydia trachomatis infection and its genotype distribution among men who have sex with men in Shenzhen China. Jpn J Infect Dis 2011, 64: 143-46.
- De Vries H, Zingoni A, White J, Ross J, Kreuter A. 2013 European Guideline on the management of proctitis, proctocolitis and enteritis caused by sexually transmissible pathogens. Int J STD AIDS 2014; 25: 465–74.
- Pando MA, Balán IC, Marone R et al. HIV and Other Sexually Transmitted Infections among Men Who Have Sex with Men Recruited by RDS in Buenos Aires, Argentina: High HIV and HPV Infection. PLoS One. 2012;7(6): e39834. doi: 10.1371/journal.pone.0039834. Epub 2012 Jun 29.
- Gallo Vaulet L, Entrocassi C, Portu AI, Castro E, Di Bartolomeo S, Ruettger A, Sachse K, Rodriguez Fermepin M. High Frequency of Chlamydia trachomatis Mixed Infections Detected by Microarray Assay in South American Samples. PLoS One. 2016; 15: e0153511. doi: 10.1371/journal.pone.0153511. eCollection 2016.
- Pallawela SN, Sullivan AK, Macdonald N, et al. Clinical predictors of rectal lymphogranuloma venereum infection: results from a multicentre case-control study in the U.K. Sex Transm Infect 2014; 90: 269-74.
- De Vrieze NH, van Rooijen M, Schim van der Loeff MF, de Vries HJ. Anorectal and inguinal lymphogranuloma venereum among men who have sex with men in Amsterdam, the Netherlands: trends over time, symptomatology and concurrent infections. Sex Transm Infect 2013; 89: 548-52.
- Rodríguez-Domínguez M, Puerta T, Menéndez B, et al. Clinical and epidemiological characterization of a lymphogranuloma venereum outbreak in Madrid, Spain: co-circulation of two variants. Clin Microbiol Infect 2014; 20: 219-25.
- Leguas H, García de Olalla P, Arando M, et al. Lymphogranuloma venereum: a hidden emerging problem, Barcelona, 2011. Euro Surveill 2012; 17. pii: 20057.
- Foschi C, Marangoni A, D’ Antuono A, et al. Prevalence and predictors of lymphogranuloma venereum in a high risk population attending a STD outpatients clinic in Italy. BMC Res Notes 2014, 7: 225.
- Bermejo A, Gagliardi M, Olivares L, Mazzaroni S, Cohen Sabban G. Linfogranuloma venéreo, nuevas presentaciones: a propósito de un caso. Med Cutan Iber Lat Am 2017; 45: 59-63.
- La Rosa L, Svidler López L, Entrocassi AC, Santos B, Caffarena D, Rodríguez Fermepin M. Polimorfismo clínico de linfogranuloma venéreo anorrectal en la Ciudad de Buenos Aires. MEDICINA (Buenos Aires) 2018; 78: 207-10.
- Cabello Úbeda A, Fernández Roblas R, García Delgado R et al. Anorectal Lymphogranuloma Venereum in Madrid: A Persistent Emerging Problem in Men Who Have Sex With Men. Sex Transm Dis, 2016; 43: 414-19.
- Ward H, Martin I, Macdonald N. Lymphogranuloma Venereum in the United Kingdom. CID, 2007; 44: 26–32.
- World Health Organization (WHO). Global action plan to control the spread and impact of antimicrobial resistance in Neisseria gonorrhoeae. World Health Organization (WHO), Department of Reproductive Health and Research. 2012; 1: 1-36. ttps://www.who.int/reproductivehealth/publications/rtis/9789241503501/en/
- Singhrao T, Higham E, French P. Lymphogranuloma venereum presenting as perianal ulceration: an emerging clinical presentation? Sex Transm Infect 2011; 87:123-124.
COMENTARIO
La investigación que se presenta aquí trae luz sobre un tema de gran actualidad y de necesaria ocupación como asunto de salud pública. Se plantea inicialmente el desconocimiento de la incidencia de la infección por LGV en la República Argentina, con lo cual no es sencilla la planificación de políticas de salud dirigidas. Los autores si pueden trabajar sobre una población de riesgo, en centros de salud de referencia regional y nacional que de alguna manera pueden dar idea de la magnitud del problema. Es destacable la precisión diagnóstica que alcanzaron y la articulación entre distintas entidades de salud.
Es de gran valor el aporte que hace este grupo especializado en ETS, donde destacan que gran parte del diagnóstico se basa en la anamnesis detallada y en los detalles epidemiológicos del paciente, para de esa manera dirigir los estudios diagnósticos y el tratamiento. Es un ejemplo de como la especialización brinda una mejor calidad de atención. Quizás la incidencia de la infección por LGV pueda ser aún más alta, debido a que uno de los criterios de inclusión establece que el paciente debe confirmar la práctica sexual de riesgo y probablemente no todos lo hagan.
Una gran proporción de pacientes con proctitis infecciosas tenían CT, eran HSH, HIV + y además coexistían otras ETS. Es destacable la alta proporción de biovar LGV frente al TRIC, y el consejo de tratar como LGV cuando no es posible diferenciar ambos biovar.
Los casos más graves tienen manifestaciones clínicas muy parecidas a la de un adenocarcinoma de recto que puede coexistir con una infección por LGV. Por ello el juicio clínico y la disponibilidad tecnológica permitirán descartar la presencia de un tumor maligno siempre que corresponda. Por otro lado, muchos pacientes presentan formas clínicas menores o asintomáticas, siendo de gran importancia el tratamiento de los contactos que pueden actuar como reservorio.
La prevalencia de alrededor del 20% en ambos géneros de la infección por CT en población de riesgo, debe mantener presente el diagnóstico diferencial frente a paciente con síntomas inespecíficos como proctorragia, tenesmo, etc. Finalmente, quiero felicitar y agradecer a los autores por compartir su experiencia con una serie numerosa de pacientes.
Ricardo Mentz, Hospital Italiano de Buenos Aires, C.A.B.A.
Sesión 9 de noviembre DE 2018
Dr. Rosatto: Mi pregunta es muy puntual, nosotros en nuestro medio, en el Hospital Austral tenemos muchas enfermedades de transmisión sexual, sobre todo lesiones por HPV, cada vez más, con esta situación de evitar los embarazos, tanto los heterosexuales, sobre todo las mujeres que tienen relaciones anales, y/o los homosexuales, que tienen lesiones por HPV, que es una de las que tienen mayor índice, ¿existe algún otro procedimiento que no sea la secuenciación del hisopado por PCR, para hacer diagnóstico de clamidia, o hay algo más sencillo, menos complejo o menos oneroso? La secuenciación supongo que debe tener un costo y no todos los lugares tienen acceso a esta
Dra. Svidler: Podríamos responderte, pero teniendo un clamidiólogo en la sala me parece que le tenemos que dar la palabra.
Dr. Rodriguez Fermepin: La pregunta es interesante, una pequeña aclaración, la genotipificación no es por secuenciación, es por PCR y es un truquito, no necesitamos secuenciar, es un poquito más sencillo, es una tipificación de otro tipo, pero con herramientas de biología molecular. Y sí es costosa, el problema es que estamos hablando de muestras que en general no están validadas las muestras anales para ninguna otra metodología, hay test rápidos, pero no sirve este tipo de muestra. Se podría hacer inmunofluorescencia directa en algunos casos, no está tampoco muy validado. Lo que pasa es que llegamos solamente hasta saber Chlamydia trachomatis. La única forma de confirmar la presencia de un linfogranuloma venéreo es con una tipificación molecular de RFLP, que es lo que hacemos nosotros, que es el gen que mostró Laura recién o secuenciar. Secuenciar es bastante más caro también. Lo que quizá se podría hacer es, viendo un primer estudio de LGV, si no se puede hacer lo que decían era, y coincido, es tratarlo como un LGV, si no sabemos, preferible dar un poco más de antibiótico, y no mantener al linfogranuloma venéreo en circulación.
Dr. Bun: Bueno, felicitaciones Laura, por el trabajo, la verdad que es muy interesante. Les quería hacer dos preguntas, y una consideración. Una de las preguntas es qué tiempo está teniendo o tardando este estudio, ya que por ahí tomar la decisión en la mitad de extender o no el tratamiento, y quizá es muy bueno, porque es una herramienta que cambia la conducta, lo que pasa es que muchas veces puede tardar esto, y quizá el paciente ya o terminó los 7 días, o hay que extender 21 días, qué tiempo están teniendo. Si tienen idea de costos. A nosotros nos pasa mucho en la práctica privada, en la prepaga en la que trabajamos, para pacientes HIV positivos exclusivamente tenemos mucho estas infecciones, y muchas veces desde el punto de vista práctico, por costos, etc., no se termina haciendo ningún tipo de búsqueda, sino que se trata empíricamente, y generalmente los infectólogos están en forma extendida pensando en esta alternativa del LGV, costos y tiempos. Y una consideración que me parece muy práctica, que muchas veces al igual que han mostrado ustedes muy bien en la manifestación clínica, estos pacientes muchas veces vienen con dolor y con secreción anal, y muchas veces son subtratados y se los trata como fístulas, como fisuras, como úlceras que no se las cataloga, el paciente quizá no sabe que es HIV positivo, y hay mucho retraso en tratamiento. Ahí mostraron varios pacientes que habían tenido mucho delay en el tratamiento, y eso lo vemos mucho, sobre todo en los pacientes HIV positivos, hay mucho retraso en el diagnóstico por una mala interpretación, porque uno no puede examinar la mucosa del recto donde está bien inflamado, y ve quizá la unta de una úlcera, el paciente está con dolor, y se interpreta o se malinterpreta como una fisura, eso pasa mucho. Me pareció muy importante destacar esa consideración en el diagnóstico diferencial. Felicitaciones.
Dra. Svidler: En realidad, con el tema tiempos los tiempos siempre son mayores que los que uno desearía, o que el paciente necesita, los que hacemos, los clamidiólogos nos detestan por eso, lo sabemos Marcelo, pero apurando y apurándose ellos, y suponiendo que todo esto sale bien, porque como nos han explicado ante nuestra insistencia es que alguno de esos pasos, yo relaté, puede fallar y hay que rehacerlo. Entonces, si todo sale bien, y según cuándo entra la muestra, porque se espera para alargar que haya unas cu8antas muestras, pueden ser 7 a 10 días, dependiendo, pero más o menos. Entonces, lo que hacemos es tratar, citar al paciente, cuando estimamos que vamos a poder tener resultado, si no lo tenemos le decimos que siga hasta tener el resultado, porque el problema es que si se corta el tratamiento después hay que volver a empezar y hacer las tres semanas de tratamiento. Si el paciente está muy sintomático, lo tratamos. Si el paciente está poco sintomático, y es una persona que sabemos que no va a salir del consultorio y va a seguir contagiando, entonces esperamos. Pero esto es paciente por paciente, situación por situación, y muchas veces los síntomas más groseros tienen que ver con la otra ETS asociada, la sífilis, o la gonococia, y para eso sí tenemos posibilidad de saberlo antes. Entonces, a veces nos manejamos en función de esos resultados, y esperamos o tratamos y vamos viendo. No sé si responde a tu pregunta. Y con lo del costo, no sé.
Dr. Rodriguez Fermepin: El costo que nosotros manejamos en la universidad, en donde no hay ningún afán comercial, son $600, que es el costo que nos sale la determinación. La determinación lleva, son tres reacciones de biología molecular, distintas, además de la extracción de NA, o sea, hay cuatro días hábiles de trabajo continuo, y cualquier cosa que hay que repetir lo estira. Por eso es un mínimo de una semana a diez días. Pero es el precio del costo de los reactivos.
Dra. Luciana La Rosa: Yo quería agregar algo y comentar sobre lo que dijiste vos respecto del retraso del diagnóstico, y me parece que el principal motivo del retraso del diagnóstico tiene que ver con una falla en la comunicación con el paciente. Si yo al paciente no le preguntó acerca de detalles de su vida sexual, el paciente por ahí me lo dice, la mayor parte de las veces no, y eso lleva a hacer tratamientos que no corresponden, y para mí, para nosotros, porque en eso somos exactamente iguales, hay que acabar con esa conspiración del silencio. Si no preguntamos, no sabemos, diagnosticamos equivocadamente, y me parece que ese es el principal problema.
Dr. Lumi: Estamos en horario de hacer el segundo llamado, yo quiero felicitar al grupo de trabajo por varias cosas, primero, quiero resaltar lo que dijiste, Laura, que se puede trabajar pese a distintas instituciones y a la geografía, uno queda en una punta de la ciudad y otro en otra, se puede hacer perfectamente, el impacto que ha generado esto en la salud pública, para que el Ministerio de Salud haga alertas y lo tenga en su agenda. Y eso lo ha hecho el Ministerio de Salud a partir de ustedes.