Papel de la Medicina Regenerativa y los Sellantes en la Enfermedad de Crohn Perianal
REV ARGENT COLOPROCT | 2019 | VOL. 30, Nº 2: 43-50
ARTÍCULO DE REVISIÓN
Papel de la Medicina Regenerativa y los Sellantes en la Enfermedad de Crohn Perianal
Fernando de la Portilla, Andrea Jiménez-Salido
Unidad de Coloproctología, Hospital Universitario Virgen del Rocío. Sevilla, España
Instituto de Biomedicina, CSIC. Sevilla, España
RESUMEN
La enfermedad de Crohn constituye una enfermedad inflamatoria crónica que puede cursar con con fistulas complejas en hasta un 20% de los pacientes. A pesar de la intensificación del tratamiento, asociado a no a la cirugía, todavía es considerable el porcentaje de pacientes que no responden al tratamiento.
En los últimos años se ha empezado a desarrollar nuevas terapias que permitan conseguir una mayor tasa de curación de estos pacientes, con las mínimas complicaciones posibles.
Es cuando aparecen agentes que pretenden de forma directa el sellado o intervienen en la reducción local de la inflamación.
Es objetivo de este artículo mostrar el papel de la Medicina Regenerativa en el tratamiento de estos pacientes.
Palabras claves: Enfermedad de Crohn; Fistula anal; Medicina Regenerativa; Plasma Rico Plaquetas; Células Madres
ABSTRACT
Crohn's disease is a chronic inflammatory disease that can occur with complex fistulas in up to 20% of patients. Despite the intensification of treatment, associated with no surgery, the percentage of patients who do not respond to treatment is still considerable.
In recent years, new therapies have been developed to achieve a higher cure rate for these patients, with the minimum possible complications.
It is when agents appear to pretend as seal fistula tract as the local reduction of inflammation.
The aim of this article is to show the role of Regenerative Medicine in the treatment of these patients.
Key words: Crohn's Diseases; Anal fistula; Regenerative Medicine; Platelet-Rich; Stem Cells
Fernando de la Portilla
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Los autores declaran no tener ningún conflicto de interés.
INTRODUCCIÓN
La enfermedad de Crohn constituye una enfermedad inflamatoria crónica que puede cursar con fístulas complejas en hasta un 20% de los pacientes. Con mucha frecuencia está asociada a colecciones perianales, lo cual dificulta el empleo de los tratamientos médicos y complica una eventual cirugía.1-3
La etiología de las fistulas en el Crohn no está aclarada y su aparición se debe, generalmente, a un trastorno en la función barrera del intestino y una alteración de la microbiota que activa la inmunidad innata. La inflamación local se ve perpetuada por una estimulación inadecuada del sistema immune con reclutamiento de leucocitos y secrección de citoquinas proinflamatorias en el tejido, lo que dificulta la curación de la fistula.4-5
La aparición de ellas constituye un factor negativo en el curso natural de su enfermedad, estando asociado a un curso más agresivo de la misma.6
Clásicamente, la cirugía ha tenido un papel relevante en el tratamiento de estos pacientes mediante la colocación de drenajes, sedales, creación de ostomías e incluso en casos severos, la proctectomía.4,7 Sin embargo, en los últimos años el tratamiento médico asociado o no a la colocación transitoria de drenajes, ha tomado un papel preponderante, en un intento de conseguir los mejores resultados.
Los inmunosupresores como la azatioprina, 6-mercaptopurina, metrotrexate y la ciclosporina han mostrado ser beneficiosos en la mayoría de pacientes; y en los casos más complicados en los que no funciona estas drogas, los tratamientos biológicos a base de anticuerpos monoclonales han mostrado tener una buena efectividad en la inducción y mantenimiento de la remisión de la enfermedad fistulosa perianal y la proctitis asociada.1,3,8-14 Aun así, todavía es considerable el porcentaje de pacientes que no responden al tratamiento o lo hacen parcialmente, con recurrencias de la fistula, y tampoco se debe olvidar que la existencia de complicaciones graves asociadas al tratamiento tampoco es despreciable11,14-17
Por ello, se plantea la necesidad de desarrollar nuevas terapias que permitan conseguir una mayor tasa de curación de estos pacientes, con las mínimas complicaciones posibles. Es cuando aparacen los agentes que buscan el sellado de la fistula, como la fibrina; u otros que además de ocluir la fistula, intervienen en la reducción local de la inflamación en la misma. En este grupo encontramos los factores de crecimiento derivados de plaquetas o más recientemente las células madre.1-3,18
La Medicina Regenerativa por lo tanto, abre una nueva opción terapéutica en estos pacientes, constituyendo un puente entre el tratamiento puramente médico y el quirúrgico.
1. Pegamento de fibrina
Fundamento de uso
El pegamento de fibrina es un sellante que simula la formación fisiológica de coágulos, lo que en teoría podría servir para el sellado del trayecto fistuloso, promoviendo la curación, hemostasia y angiogénesis.5
Conformación
Está formado por una solución de fibrinógeno (fibrinógeno, factor XIII, fibronectina y aprotinina), trombina y calcio iónico, que al inyectarse se mezclan, lo que conlleva una división del fibrinógeno en monómeros de fibrina que se agregan para formar un coágulo soluble. A la vez, la trombina y el calcio activan el factor XIII que convierte el coágulo soluble en insoluble que sella mecánicamente el trayecto de la fistula. Este coágulo se fibrinolisa gradualmente promoviendo la curación de los tejidos al fomentar la hemostasia y angiogénesis de los tejidos y actuando como andamio para el crecimiento de fibroblastos y depósito de colágeno. La aprotinina es un inhibidor específico de la fibrinólisis lo que permite retardarla, mejorando así los resultados obtenidos. El coágulo de fibrina sella mecánicamente el trayecto de la fístula a la vez que actúa como matriz para la migración, proliferación y activación de fibroblastos y a través de la formación de puentes de fibronectina, sirve de matriz para el crecimiento de los fibroblastos y células endoteliales pluripotentes, que adquieren la función del tejido normal una vez degradada la fibrina.19-21
Su uso en en el tratamiento de las fístulas de Crohn
La bibliografía existente sobre la aplicación de pegamento de fibrina en pacientes con patología fístulosa por enfermedad de Crohn es escasa, con series pequeñas y poco seguimiento de los pacientes a largo plazo, aunque parece tratarse de una técnica segura y reproducible.
Vitton et al.22 publicó en 2005 un estudio en el que trató a 14 pacientes con fístulas perianales secundarias a enfermedad de Crohn con sellante de fibrina y evalúo la eficacia del tratamiento. La tasa de curación completa fue del 57% al finalizar el seguimiento que fue de una media de 23.4 meses.
Grimaud et al.19 realizó un ensayo clínico multicéntrico randomizado para evaluar la eficacia y seguridad del uso del pegamento de fibrina en pacientes con enfermedad de Crohn perianal. Comparó pacientes que recibieron tratamiento con pegamento de fibrina y pacientes que no recibieron ningún tipo de tratamiento (grupo control). Se incluyeron 77 pacientes de los cuáles 36 recibieron tratamiento con sellante de fibrina. A las 8 semanas la tasa de curación en el grupo del sellante de fibrina es del 38% de los pacientes mientras que en el grupo control es del 16% (p=0.04), con pérdidas en el seguimiento de 7 pacientes. Sin embargo, no se realizaron pruebas de imagen en el seguimiento, por lo que no se confirmó la curación de la fistula radiológicamente, lo que puede sugerir que la tasa de curación sea menor al 38% reportado. Además, el seguimiento es de 8 semanas únicamente lo que no permite evaluar los efectos a largo plazo del tratamiento. La tasa de curación en pacientes tratados con sellantes de fibrina fue mayor en las fístulas simples (50%) que en las complejas (25%).
Por ello, a pesar de que es una opción terapéutica de bajo riesgo para el paciente, las bajas tasas de curación y el alto riesgo de recurrencia hacen del tratamiento con sellante de fibrina una opción con un éxito muy limitado.
2. Factores de crecimiento procedente de Plasma rico en Plaquetas.
Fundamento de uso
El plasma rico en factores de crecimiento derivados de plaquetas (PRGF) representa una alternativa de tratamiento en pacientes con fístulas perianales. Las plaquetas tienen un papel fundamental en el proceso de cicatrización de los tejidos blandos, y se ha utilizado en diferentes disciplinas quirúrgicas con éxito debido a sus propiedades de regeneración tisular en forma de diferenciación celular, quimiotaxis, síntesis de matriz extracelular y sus propiedades antiinflamatorias.23,24 En estudios in vitro se ha demostrado que existe una relación dosis-respuesta entre la concentración de plaquetas y la proliferación de células madre mesenquimales adultas, de fibroblastos y de colágeno tipo I, lo que puede mejorar la curación de las heridas.25,26
Mecanismo Acción
El mecanismo de acción del plasma rico en plaquetas se basa en varios aspectos. La fracción rica de las plaquetas debe promover a nivel local una disminución de la liberación de citoquinas, limitando la inflamación de los tejidos y estimulando los macrófagos que favorecen la regeneración tisular. Todo eso estimula la quimiotaxis, proliferación, diferenciación celular y la angiogénesis, que provoca finalmente una menor inflamación local que provoca el cierre del tracto fistuloso. Además, el sellado concomitante del mismo con la fibrina creada a partir de la fracción pobre del plasma debe evitar la migración de los factores inyectados, al mismo tiempo que actúa como andamio tisular.25,27,28
Técnica extracción de los factores y administración quirúrgica
La extracción del plasma rico en factores de crecimiento se realiza durante el procedimiento anestésico. Se extraen 40 cc de sangre venosa periférica en tubos estériles (Venoject®, Terumo Corporation, Madrid, España) con citrato sódico al 3,8%, que permite la anticoagulación sin alterar ni receptores de membrana ni morfología y adhesividad plaquetarias.
La técnica de aislamiento es la descrita por Anitúa29 que consiste en la centrifugación (centrífuga PRGF-Endoret, BiotecnologyInstitute, Alava, España) de las muestras sanguíneas a 1800 r.pm. durante 8 minutos, de manera que obtenemos tres extractos bien definidos, el inferior que corresponde a la serie roja, el intermedio que son los leucocitos y el superior que es el plasma. Éste último es el que empleamos como tratamiento, de manera que, al dividirla en dos, la parte superior corresponde a una fracción pobre en plaquetas y la inferior a la rica. Para poder extraer los factores de su interior es necesario degranularlas mediante la adición de cloruro cálcico al 10% (50 uL por cada ml de plasma obtenido) (Braun Medical S.A., Jaén, España).
Estas fracciones ya divididas son líquidas y, por tanto, pueden ser inyectadas cómodamente, sin embargo, pasados los 10 minutos se convierten en un pegamento de fibrina autóloga que puede servir como agente de sellado.
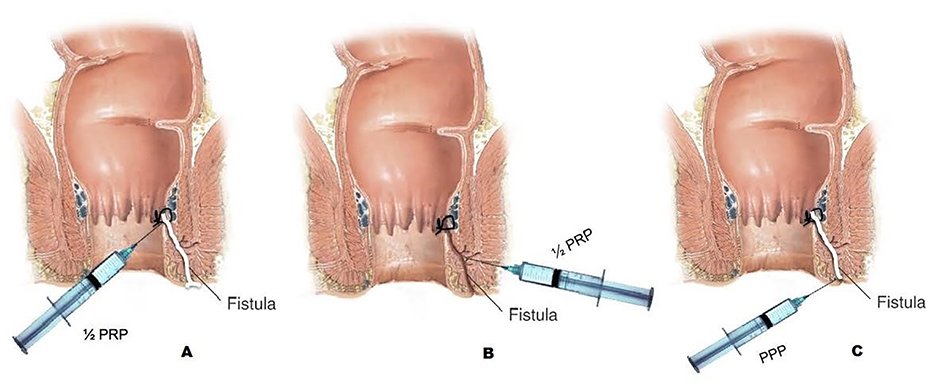
Los pasos son: (fig. 1)
- Inspección del trayecto y localización de los orificios interno (OFI) y externo (OFE), mediante la inyección de suero y la inserción de un estilete. Está contraindicada la utilización en el interior del trayecto de agua oxigenada u otras soluciones citotóxicas.
- Legrado del trayecto fistuloso de forma intensa.
- Cierre del OFI mediante una sutura absorbible 3/0.
- Inyección de mitad de la fracción rica en el OFI a nivel de la submucosa. La otra mitad de esta fracción es inyectada realizando pequeños habones en la pared del tracto fistuloso.
- Por último, se debe sellar la fístula con la fracción pobre que tras haber pasado un tiempo, ha adquirido la forma de tapón de fibrina. Para ello procedemos a instilarlo a través del OFE, ocupando toda la longitud del tracto fistuloso.
- Se finaliza el procedimiento extirpando la piel del OFE.
Figura 1: Aislamiento e Inyección factores de crecimiento: A) Inyección de mitad de fracción rica en OFI, B) Inyección de mitad de fracción rica en trayecto fistuloso, C) Sellado
del trayecto con fracción pobre.
Su uso en en el tratamiento de las fístulas de Crohn
Los PRGF se han utilizado con resultados esperanzadores en el tratamiento de las fístulas complejas de origen criptoglandular, pero prácticamente no se ha evaluado su acción en la enfermedad de Crohn perianal, recogiendo las publicaciones series de casos muy heterogéneas, con escaso seguimiento y diseño deficiente, aunque los resultados han sido esperanzadores.3,27,30,31
Göttgens et al.31 realizó un estudio piloto tratando a 10 pacientes con fistulas perianales y Crohn mediante cierre del orificio interno con colgajo de avance y sellado de la fístula con factores de crecimiento consiguiendo una tasa de curación del 70% de los pacientes, con un seguimiento medio de 23.3 meses. Wainstein et al.25-26 realizó un estudio observacional en el que trató a 9 pacientes con enfermedad de Crohn perianal mediante una técnica quirúrgica combinando el uso de células madre, factores de crecimiento y colgajo de avance endorrectal para cierre del orificio interno consiguiendo una tasa de curación del 60% de los pacientes con un seguimiento de 12 meses.
Nuestro grupo ha investigado intensamente este aspecto y estamos en condiciones de aportar las primeras conclusiones de un análisis preliminar. Un total de 21 pacientes fueron valorados a las 24 semanas y 15 pacientes a las 48 semanas. Se realizó una evaluación de la respuesta clínica y de la disminución del número de orificios fistulosos externos a las 24 y a las 48 semanas.
A las 24 semanas, 33.3% (7/21) de pacientes cumplían los criterios de curación completa y 38.1% (8/21) cumplían los criterios de curación parcial (orificio abierto asintomático). Por tanto, 28.6% de pacientes (6/21) permanecían sin curación. A las 48 semanas, 40% (6/15) de pacientes cumplían los criterios de curación completa y 40% (6/15) cumplían los criterios de curación parcial. Por tanto, 20% de pacientes (3/15) permanecían sin curación. Hubo una reducción significativa de orificios fistulosos abiertos, pasando de 17 orificios abiertos a las 24 semanas a 9 orificios abiertos a las 48 semanas (p=0,021).
Teniendo en cuenta los curados y parcialmente curados, el 80% de los pacientes (12/15) estaban asintomáticos al final del estudio. Dicha tasa de mejoría fue mayor en el grupo que recibió biológicos (86% vs 75%, p=0.527).
A pesar de lo anteriormente detallado, los estudios realizados en pacientes con enfermedad de Crohn perianal son limitados, pero los resultados son prometedores, por lo que puede constituir en el futuro una alternativa eficaz en el tratamiento de estos pacientes.
3. Células madre
Fundamento de uso
Las células madre mesenquimales constituyen un tratamiento prometedor de las fístulas perianales en pacientes con Crohn y existe evidencia de que su uso es seguro y eficaz, habiéndose empleado en diversas disciplinas quirúrgicas con éxito. Estas células presentan capacidad de autorrenovarse o autorreplicarse y, a la vez, originar células hijas comprometidas en determinadas rutas de desarrollo, que se convertirán finalmente por diferenciación en tipos celulares especializados.32
Conceptos básicos terapia celular
El origen de estas células puede ser autólogo o alogénico, facilitando éste último su uso más sistemático, ya que no obliga a la autoextracción y ulterior cultivo, con la demora temporal y de costos añadidos.
Las células madre pueden ser embrionarias, obteniéndose del embrión en estado de blastocisto y originando cualquier línea celular; adultas o multipotentes que sólo son capaces de renovarse y regenerar tejidos de la capa embrionaria de la que son originadas, pero que, en base al fenómeno de plasticidad celular, pueden diferenciarse hacia poblaciones celulares diferentes a las de su origen embrionario, lo cual les confiere también un alto potencial terapéutico; y las células pluripotentes inducidas (iPS) que son células somáticas sometidas a proceso de reprogramación nuclear mediante la expresión ectópica de factores de transcripción específicos y que adquieren características moleculares y funcionales de pluripotencia que las hacen semejante a una célula madre embrionaria.33.34
Las células madre embrionarias y las iPS son altamente beneficiosas, pero existen limitaciones a su uso debido a las propias regulaciones celulares, así como a consideraciones éticas y manipulación genética, de manera que no existe en la actualidad ningún ensayo clínico utilizándolas.35
Las células madre adultas, sin embargo, se obtienen de una manera más sencilla y no presentan restricciones de tipo ético o inmunorreactivo.
Las células madre mesenquimales tienen un papel preponderante en la terapia en la actualidad, siendo multitud de publicaciones la que se están realizando con esta fuente celular. Pueden obtenerse tanto del tejido adiposo mediante lipoaspiración como de la médula ósea; siendo la primera fuente de donación la más empleada. Estas células son las denominadas generalmente como células mesenquimales derivadas del tejido Adiposo.
Está demostrado que las células madre mesenquimales tienen una habilidad inherente para autorrenovarse, proliferar y diferenciarse hacia tejidos maduros dependiendo del microambiente que las rodea, lo que las hace muy atractivas para su uso en terapia celular y en medicina regenerativa.36
Mecanismo acción células mesenquimales procedente de grasa
El mecanismo de acción preciso de estas células no está totalmente aclarado, pero debe reflejar las características de las células madre mesenquimales.37,38 Estas células tienen la capacidad de migrar al sitio donde se encuentra la lesión o el proceso inflamatorio, estimulando la proliferación y diferenciación de las células progenitoras residentes a través de la secreción de factores de crecimiento, remodelando la matriz y también ejercer un efecto inmunomodulador y antiinflamatorio, que en conjunto ayudan a la cicatrización de los tejidos.39-42 Parece que también inducen un aumento de la epitelización y de la angiogénesis, mediante un proceso de diferenciación e interacción paracrina con las células cutáneas.43-45
El mecanismo de acción de las células madre mesenquimales en el trayecto fistuloso se basa en un reconocimiento de citoquinas proinflamatorias como el IFN-gamma, con la subsiguiente activación de la enzima IDO (Indoleamine 2, 3-dioxygenase), que es la responsable última de crear un microambiente capaz de suprimir los linfocitos activados –congelación de los linfocitos por inhibición de la fosforilización- consiguiendo la reducción de la liberación de mediadores proinflamatorios (TNF-a, IL-6, …) y aumentando los antiinflamatorios como la IL-10.46
Técnica extracción de células y administración quirúrgica
El protocolo de admnistración pasa irremediablemente primero por el aislamiento de las células Mesenquimales, ya sea de la médula ósea o de la grasa del paciente (autólogo) o de un donante sano (alogénico) pudiendo el origen ser autólogo o alogénico.
Las células de la médula ósea son aisladas por aspirado y luego son expandidas las MSCs ex vivo para su uso en el trayecto fistuloso.
Aunque existen diversos protocolos de expansión y diferenciación para las células obtenidas del tejido adiposo, que permiten obtener una gran variedad de resultados, normalmente las MSCs, se usan tras una digestión con colagenasas en condiciones de agitación constante, la solución obtenida se centrifuga a baja velocidad y se filtra el resultante por una malla de nylon de 40-200 micras. La nueva solución se centrifuga otra vez y las células se re-suspenden en un nuevo medio de expansión. Es importante tener en cuenta que este procedimiento ha de efectuarse en condiciones de extrema esterilidad.
En cuanto a la ruta de administración resulta importante remarcar que sólo existe un estudio que inyecta las MSCs alogénicas de médula ósea por vía intravenosa, siendo un objetivo secundario de este estudio valorar el cierre de las fístulas; el resto de experiencias publicadas emplean la vía intralesional.
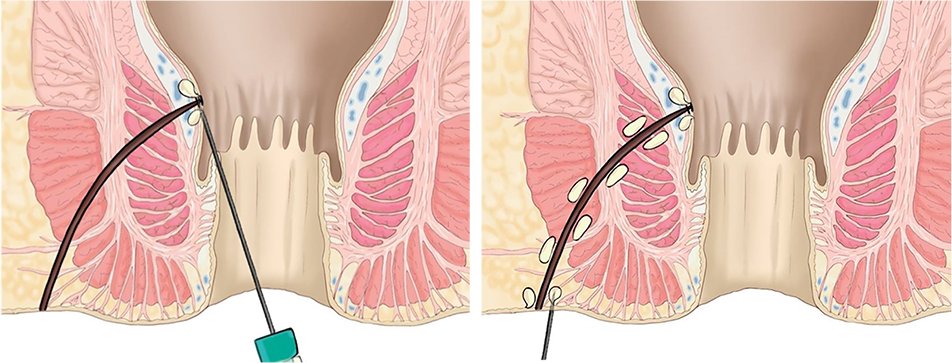
Antes de proceder a la inyección intralesional de las células obtenidas se debe someter el mismo a un intenso curetaje, evitando emplear sustancias citolíticas (como el peróxido de hidrógeno), tras lo cual se procede al cierre estanco del orificio fistuloso interno con una sutura reabsorbible. Por último administraremos la mitad de la dosis preparada en el orificio interno, realizando un pequeño habón submucoso y la otra mitad en el interior del trayecto fistuloso, si es posible en toda su longitud, no profundizando más de un par de milímetros (fig. 2).
Varios estudios contemplan la administración de las células empleando como adyuvante o andamio pegamento de fibrina, con el fin de mejorar el anclaje de las células en el tracto fistuloso.
La dosis necesaria para obtener un resultado óptimo aún está por determinar. La mayoría de estudios utilizan MSCs procedentes de grasa, aunque también hay estudios con médula ósea. En cuanto al tipo celular son innumerables las ventajas de la fuente alogénica (procedente de donantes seanos) frente a la autóloga, en términos de mayor accesibilidad, facilidad de expansión con buena estabilidad. Su uso es posible por su baja inmunicidad y el tiempo limitado de persistencia haciendo menor las posibilidades de crear un efecto adverso.
Figura 2: Inyección de las células madre. Izquierda: inyección en el orificio interno. Derecha: inyección de habones en el trayecto fistuloso.
Su uso en en el tratamiento de las fístulas de Crohn
Teniendo en cuenta lo publicado actualmente las tasas de curación varían en función del seguimiento establecido, pero de forma general podemos estimarla entre un 50 al 70%.18,47-58
Se han realizado varios ensayos clínicos evaluando la seguridad y eficacia del tratamiento del Crohn perianal mediante la utilización de células madre mesenquimales derivadas de la médula ósea (MSC) y del tejido adiposo (ASC).59
Ciccocioppo et al.51 evalúa a largo plazo la seguridad y eficacia de la utilización de células madre mesenquimales derivadas de la médula ósea. En su estudio incluyen 8 pacientes seguidos de forma prospectiva durante 72 meses; con una tasa inicial de curación de un 70% al año. La probabilidad de permanencia sin fistula fue de un 88% al año, 50% a los dos años y 37% durante los siguientes 4 años. Los autores concluyen que el hecho de que los índices de actividad vuelvan a aumentar a partir del segundo año puede llevar a pensar que esta terapia no es curativa, aunque sí mejora la tasa de remisión en pacientes con enfermedad refractaria. Por otra parte, casi todos los pacientes requirieron la reintroducción de terapia biológica o inmunosupresora a partir del segundo año.
Molendijk et al.48 evalúa la eficacia de la utilización de diferentes concentraciones de células madres derivadas de médula ósea frente a placebo en 21 pacientes no respondedores a otros tratamientos. A las 24 semanas, la tasa de curación fue del 80% administrando 3 × 107 células. En el grupo de placebo la tasa de curación fue del 33.3%. No se registran acontecimientos adversos por lo que concluyen que su uso es seguro.
La inyección de células madre del tejido adiposo ha sido evaluada por varios grupos españoles y de Corea del Sur.59
En el último ensayo clínico multicéntrico internacional fase III, publicado por Panés del grupo ADMIRE58, se evalúan los resultados a largo plazo del tratamiento con células madre mesenquimales alogénicas procedentes de tejido adiposo. Se incluyeron 212 pacientes con fístulas perianales complejas por enfermedad de Crohn refractarias a tratamiento. Se randomizaron a los pacientes en 2 grupos. En el grupo 1 se trataban a los pacientes con 12x107 células y el grupo 2 se trataban con placebo. A las 52 semanas de tratamiento, un 56.3% de los pacientes lograron la remisión clínica y radiológica de la enfermedad frente al grupo control en el que la tasa de curación fue del 38.6%. Los autores concluyen que el uso de células madre en el tratamiento de pacientes con Crohn perianal refractario a otros tratamientos es seguro y eficaz comparado con el placebo al año de seguimiento.
Los resultados obtenidos en los distintos ensayos son prometedores, habiéndose demostrado la seguridad del tratamiento. Sin embargo, aún queda por aclarar determinados aspectos de los nuevos tratamientos, como son la dosis adecuada, la vía de administración (intravenosa vs intralesional), la forma de administrarse (sola o junto con pegamento de fibrina), entre otros asuntos, que deberán ser investigados y resueltos en los próximos años.
CONCLUSIÓN
Con el desarrollo de las nuevas terapias celulares se abre una nueva vía de tratamiento para los pacientes con Crohn con fístulas complejas refractarias al tratamiento. Se ha ido avanzando en este campo con resultados prometedores, sobre todo, con las células madre, aunque como se ha visto, quedan aspectos de su aplicación aún por aclarar.
BIBLIOGRAFÍA
- Cho YB, Lee WY, Park KJ, Kim M, Yoo HW, Yu CS. Autologous adipose tissue-derived stem cells for the treatment of Crohn’s fistula: a phase I clinical study. Cell Transplant 2013; 22:279–285. doi: 10.3727/096368912X656045.
- Allan B. Dietz, Eric J. Dozois, Joel G. Fletcher, Greg W. Butler, Darcie Radel, Amy L. Lightner, Maneesh Dave, Jessica Friton, Asha Nair, Emily T. Camilleri, Amel Dudakovic, Andre J. van Wijnen, and William A. Faubion. Autologous Mesenchymal Stem Cells, Applied in a Bioabsorbable Matrix, for Treatment of Perianal Fistulas in Patients With Crohn’s Disease. Gastroenterology. 2017;Jul;153(1):59-62.e2. doi: 10.1053/j.gastro.2017.04.001.
- de la Portilla, F., Segura-Sampedro, J.J., Reyes-Díaz, M.L. Maestre, M.V., Cabrera, A.M., Jiménez-Rodríguez, R.M., Vázquez-Monchul, J.M., Diaz-Pavón, J.M., Padillo-Ruiz, F.J. Treatment of transsphincteric fistula-in-ano with growth factors from autologous platelets: results of a phase II clinical trial. Int J Colorectal Dis 2017;32(11):1545-1550. doi: 10.1007/s00384-017-2866-9.
- Aguilera-Castro L, Ferre-Aracil C, Garcia-Garcia-de-Paredes A, Rodriguez-de-Santiago E, Lopez-Sanroman A. Management of complex perianal Crohn’s disease. Ann Gastroenterol. 2017; 30(1): 33–44. doi:10.20524/aog.2016.0099.
- Marzo M, Felice C, Pugliese D, et al. Management of perianal fistulas in Crohn’s disease: An up-to-date review. World J Gastroenterology. 2015;Feb 7; 21(5): 1394–1403. doi: 10.3748/wjg.v21.i5.1394.
- Panés J, Rimola J. Perianal fistulizing Crohn’s disease: pathogenesis, diagnosis and therapy. Nat Rev Gastroenterol Hepatol. 2017 Nov;14(11):652-664. doi: 10.1038/nrgastro.2017.104.
- Singh B, George BD, Mortensen NJ. Surgical therapy of perianal Crohn’s disease. Dig Liver Dis. 2007;39:988–992. doi: 10.1016/j.dld.2007.07.157.
- Griggs L, Schwartz DA. Medical options for treating perianal Crohn’s disease. Dig Liver Dis. 2007;39:979–987. doi: 10.1016/j.dld.2007.07.156.
- Present DH, Rutgeerts P, Targan S. Infliximab for the treatment of fistulas in patients with Crohn’s disease. N Engl J Med. 1999;340:1398–1405. doi: 10.1056/NEJM199905063401804.
- Sands BE, Anderson FH, Bernstein CN. Infliximab maintenance therapy for fistulizing Crohn’s disease. N Engl J Med. 2004;350:876–885. doi: 10.1056/NEJMoa030815.
- Rutgeerts P, Feagan BG, Lichtenstein GR. Comparison of scheduled and episodic treatment strategies of infliximab in Crohn’s disease. Gastroenterology. 2004;126:402–413. doi: 10.1053/j.gastro.2003.11.014.
- Van der Hagen SJ, Baeten CG, Soeters PB. Anti-TNFalpha (infliximab) used as induction treatment of active proctitis in a multistep strategy followed by definitive surgery of complex anal fistulas in Crohn’s disease: a preliminary report. Dis Colon Rectum. 2005;48:758–767. doi: 10.1007/s10350-004-0828-0.
- Schroder O, Blumenstein I, Schulte-Bockholt A. Combining infliximab and methotrexate in fistulizing Crohn’s disease resistant or intolerant to azathioprine. Aliment Pharmacol Ther. 2004;19:295–301. doi: 10.1111/j.1365-2036.2004.01850.x
- Amy L. Lightner, William A. Faubion, Joel G. Fletcher. Interdisciplinary Management of Perianal Crohn’s Disease. Gastroenterol Clin North Am. 2017 Sep;46(3):547-562. doi: 10.1016/j.gtc.2017.05.008.
- Ochsenkuhn T, Goke B, Sackmann M. Combining infliximab with 6-mercaptopurine/azathioprine for fistula therapy in Crohn’s disease. Am J Gastroenterol. 2002;97:2022–2025. doi: 10.1111/j.1572-0241.2002.05918.x.
- Baert F, Noman M, Vermeire S. Influence of immunogenicity on the long-term efficacy of infliximab in Crohn’s disease. N Engl J Med. 2003;348:601–608. doi: 10.1056/NEJMoa020888.
- Vogel, JD, Johnson EK, Morris AM, Paquette IM, Saclarides TJ, Feingold DL, Steele SR. Clinical Practice Guideline for the Management of Anorectal Abscess, Fistula-in-Ano, and Rectovaginal Fistula. Dis Colon Rectum. 2016 Dec;59(12):1117-1133. doi: 10.1097/DCR.0000000000000733.
- García-Olmo D, García-Arranz M, Herreros D, Pascual I, Peiro C, Rodríguez-Montes JA. A phase I clinical trial of the treatment of Crohn’s fistula by adipose mesenchymal stem cell transplantation. Dis Colon Rectum. 2005;48:1416–23. doi: 10.1007/s10350-005-0052.
- Jean–Charles Grimaud., Nicolas Munoz–Bongrand, Laurent Siproudhis, Laurent Abramowitz, Agnès Sénéjoux, Véronique Vitton, Luc Gambiez, Bernard Flourié, Xavier Hébuterne, Edouard Louis, Benoit Coffin, Vincent de Parades, Guillaume Savoye, Jean–Claude Soulé, Yoram Bouhnik, Jean–Frédéric Colombel, Jean–François Contou, Yves François, Jean–Yves Mary,Marc Lémann, and the Groupe d’Etude Thérapeutique des Affections Inflammatoires du Tube Digestif (GETAID). Fibrin Glue Is Effective Healing Perianal Fistulas in Patients with Crohn’s Disease. Gastroenterol. 2010;138:2275–2281.
- Sehgal R, Koltun WA. Fibrin Glue for the Treatment of Perineal Fistulous Crohn’s Disease. Gastroenterol. 2010 Jun;138(7):2216-9. doi: 10.1053/j.gastro.2010.04.029.
- T. M. Hammond, M. F. Grahn and P. J. Lunniss. Fibrin glue in the management of anal fistulae. Colorectal Dis. 2004 Sep;6(5):308-19. doi: 10.1111/j.1463-1318.2004.00676.x
- V. Vitton, M. Gasmi, M. Barthet, A. Desjeux, P. Orsoni & J. C. Grimaud. Long-term healing of Crohn’s anal fistulas with fibrin glue injection. Aliment Pharmacol Ther 2005; 21: 1453–1457.
- Anitua E, Andia I, Ardanza B, Nurden P, Nurden AT. Autologous platelets as a source for healing and tissue regeneration. Thromb Haemost. 2004 Jan;91(1):4-15.
- Lara, F.J.P., Serrano, A.M., Moreno, J.U., Carmona, J.H., Marquez, M.F., Pérez, L.R., del Rey Moreno, A., Muñoz, H.O. Platelet-Rich Fibrin Sealant as a Treatment for Complex Perianal Fistulas: A Multicentre Study. J Gastrointest Surg 2015 Feb;19(2):360-8.
- Wainstein, C., Quera, R., Fluxá, D., Kronberg, U., Conejero, A., López-Köstner, F., Jofre, C., Zarate, A.J. Stem cell therapy in refractory perineal Crohn's disease: long-term follow-up. Colorectal Dis. 2018;20:O68–O75.
- Wainstein, C., Quera, R., Kronberg, U., Conejero, A., López-Kostner, F., Jofre, C., Zarate, A.J. Mesenchymal stem cells and platelet-rich plasma in the treatment of patients with perineal Crohn's disease. Int J Colorectal Dis 2016 Mar; 31(3):725-6.
- van der Hagen, S. J., Baeten, C. G., Soeters, P. B., van Gemert, W.G. Autologous platelet-derived growth factors (platelet-rich plasma) as an adjunct to mucosal advancement flap in high cryptoglandular perianal fistulae: a pilot study. Colorectal Dis. 2011 Feb;13(2):215-8.
- Göttgens KW, Vening W, van der Hagen SJ, van Gemert WG, Smeets RR, Stassen LP, Baeten CG, Breukink SO. Long-term results of mucosal advancement flap combined with platelet-rich plasma for high cryptoglandular perianal fistulas. Dis Colon Rectum 2014; 57:223–227.
- Anitua E. Plasma rich in growth factors: preliminary results of use in the preparation of future sites for implants. Int J Oral Maxillofac Implants2000;14(4):529–535.
- Moreno-Serrano A, García-Díaz JJ, Ferrer-Márquez M, Alarcón-Rodríguez R, Álvarez-García A, Reina-Duarte Á.Using autologous platelet-rich plasma for the treatment of complex fistulas. Rev. esp. enferm. dig. 2016 Mar;108(3): 123-128.
- Göttgens KWA, Smeets RR, Stassen LPS, Beets GL, Pierik M, Breukink SO. Treatment of Crohn’s disease-related high perianal fistulas combining the mucosa advancement flap with platelet-rich plasma: a pilot study. Tech Coloproctol. 2015 Aug;19(8):455-9.
- Gardner RL. Stem cells and regenerative medicine: Principles, prospects and problems. C. R. Biol. 2007;330:465–473. DOI: 10.1016/j.crvi.2007.01.005.
- Marshak DR, Gardner RL, Gottlieb D. Stem Cell Biology. New York: Cold Spring Harbor Laboratory Press; 2001. 550 p. DOI: 0-87969-575-7/01.
- Yamanaka S. Pluripotency and nuclear reprogramming. Phil. Trans. R. Soc. Lond. B. Biol. Sci. 2008;363: 2079–2087. DOI: 10.1098/rstb.2008.2261.
- Trebol Lopez J, Georgiev Hristov T, García-Arranz M, García-Olmo D. Stem cell therapy for digestive tract diseases: current state and future perspectives. Stem Cells Dev. 2011;20:1113–1129. DOI: 10.1089/scd.2010.0277.
- Stappenbeck TS, Miyoshi H. The role of stromal stem cells in tissue regeneration and wound repair. Science. 2009;324:1666–1669. DOI: 10.1126/science.1172687.
- Gimble JM, Guilak, F. Adipose-derived adult stem cells: Isolation, characterization, and differentiation potential. Cytotherapy.2003;5:362–369. DOI: 10.1080/14653240310003026.
- Gimble, JM, Katz AJ, Bunnell BA. Adipose-derived stem cells for regenerative medicine. Circ. Res. 2007;100:1249–1260. DOI: 10.1161/01.RES.0000265074.83288.09.
- Chapel A, Bertho JM, Bensidhoum M, et al. Mesenchymal stem cells home to injured tissues when co-infused with hematopoietic cells to treat a radiation-induced multi-organ failure syndrome. J Gene Med. 2003;5:1028–38. DOI: 10.1002/jgm.452.
- Le Blanc, K. Mesenchymal stromal cells: Tissue repair and immune modulation. Cytotherapy.2006;8:559–561. DOI: 10.1080/14653240601045399.
- Yagi H, Soto-Gutierrez A, Parekkadan B, et al. Mesenchymal stem cells: Mechanisms of immunomodulation and homing. Cell Transplant. 2010;19:667–679. DOI: 10.3727/096368910X508762.
- Yoo KH, Jang IK, Lee MW, et al. Comparison of immunomodulatory properties of mesenchymal stem cells derived from adult human tissues. Cell. Immunol. 2009;259:150–156. doi:10.1016/j.cellimm.2009.06.010.
- Falanga V, Iwamoto S, Chartier M, et al. Autologous bone marrow derived cultured mesenchymal stem cells delivered in a fibrin spray accelerate healing in murine and human cutaneous wounds. Tissue Eng. 2007;13:1299–312. doi:10.1038/jid.2012.77.
- McFarlin K, Gao X, Liu YB, et al. Bone marrow- derived mesenchymal stromal cells accelerate wound healing in the rat. Wound Repair Regen. 2006;14:471–8. doi:10.1111/j.1743-6109.2006.00153.x.
- Wu Y, Chen L, Scott PG, et al. Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis. Stem Cells. 2007;25:2648–59. doi: 10.1634/stemcells.2007-0226.
- De la Rosa O, Lombardo E, Beraza A, et al. Requirement of IFN-gamma-mediated indoleamine 2,3-dioxygenase expression in the modulation of lymphocyte proliferation by human adipose-derived stem cells. Tissue Eng Part A. 2009;15:2795–2806. doi: 10.1089/ten.TEA.2008.0630.
- Ciccocioppo R, Bernardo ME, Sgarella A, Maccario R, Avanzini MA, Ubezio C, Minelli A, Alvisi C, Vanoli A, Calliada F, Dionigi P, Perotti C, Locatelli F, Corazza GR. Autologous bone marrow derived mesenchymal stromal cells in the treatment of fistulising Crohn’s disease. Gut. 2011;60:788–98. doi: 10.1136/gut.2010.214841.
- Molendijk I, Bonsing BA, Roelofs H, Peeters KC, Wasser MN, Dijkstra G, van der Woude CJ, Duijvestein M, Veenendaal RA, Zwaginga JJ, Verspaget HW, Fibbe WE, van der Meulen-de Jong AE, Hommes DW. Allogeneic Bone Marrow-Derived Mesenchymal Stromal Cells Promote Healing of Refractory Perianal Fistulas in Patients With Crohn's Disease. Gastroenterol. 2015 Oct;149(4):918-27.e6. doi: 10.1053/j.gastro.2015.06.014.
- Garcia-Olmo D, Herreros D, Pascual I, Pascual JA, Del-Valle E, Zorrilla J, De-La-Quintana P, Garcia-Arranz M, Pascual M. Expanded adipose-derived stem cells for the treatment of complex perianal fistula: a phase II clinical trial. Dis Colon Rectum 2009;52:79–86. doi: 10.1007/DCR.0b013e3181973487.
- Guadalajara H, Herreros D, De-La-Quintana P, Trebol J, Garcia-Arranz M, Garcia-Olmo D. Long-term follow-up of patients undergoing adipose derived adult stem cell administration to treat complex perianal fistulas. Int J Colorectal Dis 2012;27:595–600. doi: 10.1007/s00384-011-1350-1.
- Ciccocioppo R, Gallia A, Sgarella A, Kruzliak P, Gobbi PG, Corazza GR. Long-term follow-up of Crohn disease fistulas after local injections of bone marrow-derived mesenchymal stem cells. Mayo Clin Proc 2015;90:747–755. doi: 10.1016/j.mayocp.2015.03.023.
- Lee WY, Park KJ, Cho YB, Yoon SN, Song KH, Kim do S, Jung SH, Kim M, Yoo HW, Kim I, Ha H, Yu CS. Autologous adipose tissue-derived stem cells treatment demonstrated favorable and sustainable therapeutic effect for Crohn’s fistula. Stem Cells 2013;31:2575–2581. doi: 10.1002/stem.1357.
- Cho YB, Park KJ, Yoon SN, Song KH, Kim do S, Jung SH, Kim M, Jeong HY1, Yu CS2. Long-term results of adipose-derived stem cell therapy for the treatment of Crohn’s fistula. Stem Cells Transl Med 2015;4: 532–537. doi: 10.5966/sctm.2014-0199.
- de la Portilla F, Alba F, García-Olmo D, Herrerías JM, González FX, Galindo A. Expanded allogeneic adipose-derived stem cells (eASCs) for the treatment of complex perianal fistula in Crohn’s disease: results from a multicenter phase I/IIa clinical trial. Int J Colorectal Dis 2013;28:313–323. doi: 10.1007/s00384-012-1581-9.
- Garcia-Olmo D, Guadalajara H, Rubio-Perez I, Herreros MD, de-la-Quintana P, Garcia-Arranz M. Recurrent anal fistulae: limited surgery supported by stem cells. World J Gastroenterol 2015;21:3330–3336. doi: 10.3748/wjg.v21.i11.3330.
- Park KJ, Ryoo SB, Kim JS, Kim TI, Baik SH, Kim HJ, Lee KY, Kim M, Kim WH. Allogeneic adipose-derived stem cells for the treatment of perianal fistula in Crohn's disease: a pilot clinical trial. Colorectal Dis. 2015 Nov 25. doi: 10.1111/codi.13223.
- Julián Panés, Damián García-Olmo, Gert Van Assche, Jean Frederic Colombel, Walter Reinisch, Daniel C Baumgart, Axel Dignass, Maria Nachury, Marc Ferrante, Lili Kazemi-Shirazi, Jean C Grimaud, Fernando de la Portilla, Eran Goldin, Marie Paule Richard, Anne Leselbaum, Silvio Danese, for the ADMIRE CD Study Group Collaborators. Expanded allogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianal fi stulas in Crohn’s disease: a phase 3 randomised, double-blind controlled trial. Lancet. 2016 Sep 24;388(10051):1281-90. doi: 10.1016/S0140-6736(16)31203-X.
- Julián Panés, Damián García-Olmo, Gert Van Assche, Jean Frederic Colombel, Walter Reinisch, Daniel C. Baumgart, Axel Dignass, Maria Nachury, Marc Ferrante, Lili Kazemi-Shirazi, Jean C. Grimaud, Fernando de la Portilla, Eran Goldin, Marie Paule Richard, Mary Carmen Diez, Ignacio Tagarro, Anne Leselbaum, and Silvio Danese, for the ADMIRE CD Study Group Collaborators. Long-term Efficacy and Safety of Stem Cell Therapy (Cx601) for Complex Perianal Fistulas in Patients With Crohn’s Disease. Gastroenterology Apr; 154 (5):1334 - 1342.e4 doi: 10.1053/j.gastro.2017.12.020.
- Forbes G. M. Mesenchymal Stromal Cell Therapy in Crohn’s Disease. Dig Dis 2017;35:115-122. doi:10.1159/000449091.
COMENTARIO
Existen múltiples alternativas terapéuticas para la enfermedad de Crohn perianal, que consiste en un verdadero desafío para el médico tratante. Sin dudas es importante un abordaje multidisciplinario entre el gastroenterólogo, el cirujano y el médico especialista en imágenes. Tener un diagnóstico certero basado en la endoscopia, imágenes (ecografía y/o resonancia magnética nuclear) y el examen físico es crucial para poder ofrecer un tratamiento óptimo.
El equipo de De la Portilla, del Hospital Virgen del Rocío de Sevilla analiza 3 terapias: pegamento de fibrina, factores de crecimiento procedente de plasma rico en plaquetas y células madre. Se detalla la conformación, mecanismo de acción y los resultados que se encuentran en la literatura internacional. Es de particular interés ya que sin dudas el tratamiento óptimo es combinado médico-quirúrgico, y los objetivos primordiales son la resolución y prevención de complicaciones sépticas, promoviendo la curación de las fístulas para de esta forma mejorar la calidad de vida de los pacientes.
Mariano Laporte, Hospital Alemán de Buenos Aires, C.A.B.A.