TAMIS: ¿Un Nuevo Estándar para el Tratamiento de los Pólipos de Recto? Revisión de la bibliografía y reporte de nuestra experiencia
REV ARGENT COLOPROCT | 2019 | VOL. 30, Nº 1 : 1-11
ARTÍCULO DE REVISIÓN
TAMIS: ¿Un Nuevo Estándar para el Tratamiento de los Pólipos de Recto? Revisión de la bibliografía y reporte de nuestra experiencia
Alejandro Moreira Grecco, Gonzalo Zapata, Carla Bollo, Rodrigo Morales, Luis Sarotto
Sección de Coloproctología División Cirugía Gastróenterologica, División de Cirugía Gastroenterológica, Hospital de Clínicas de Buenos Aires
RESUMEN
La morbilidad y alteración de la calidad de vida asociadas a la resección anterior del recto y amputación abdominoperineal determinaron un gran interés en el desarrollo del abordaje transanal. En los últimos años se ha visto un marcado desarrollo tecnológico en los dispositivos disponible para este abordaje. La cirugía por vía transanal ofrece ventajas en cuanto a sus resultados y complicaciones cuando se la compara a la cirugía por vía abdominal. La cirugía transanal mini-invasiva surge como una alternativa de abordaje videoendoscópico del recto. La resección local por cirugía endoscópica para los pólipos grandes de recto se ha convertido en un nuevo estándar de tratamiento en la mayoría de los centros, obteniendo piezas no fragmentadas con una alta tasa de márgenes negativos. En el presente estudio realizamos una revisión sobre la aplicación de TAMIS (TransAnal Minimally Invasive Surgery) al tratamiento de los pólipos de recto.
Palabras claves: pólipos de recto, tumor de recto, adenoma, TAMIS, TEO, ESD, TEM, cirugía trans-anal miniinvasiva
ABSTRACT
A great interest has developed in implementing trans anal minimally invasive surgery for the treatment of rectal adenomas and early rectal tumors. It present advantages when compare to radical surgery and peace meal endoscopic resections. TAMIS delivers non-fragmented specimens with clear resection margin in the majority of the cases. Such good technical results are mirrored with a low recurrence rate when evaluating rectal adenomas. This is a review of the application of TAMIS for the treatment of rectal adenomas.
Key words: Rectal Polyp; Rector Tumor; Rectal Cancer; Adenoma; Rectal; TAMIS; TEO; ESD; TEM; Transanal Minimally Invasive Surgery
Alejandro Moreira Grecco
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Los autores declaran no tener ningún conflicto de interés.
INTRODUCCIÓN
El abordaje de la patología rectal ha desafiado siempre al cirujano. La localización intra-pélvica del órgano y sus relaciones anatómicas hacen que su tratamiento merezca consideraciones especiales. A diferencia de la cirugía colónica, las operaciones del recto, resección anterior y amputación abdominoperineal, se asocian a una morbi-mortalidad mayor. Por otro lado, la eliminación del reservorio rectal y la necesidad de realizar una ostomía de protección o definitiva disminuyen la calidad de vida del paciente. El abordaje transanal evita los problemas de una resección mayor y ha sido propuesto como alternativa a la cirugía abdominal. Se ha revitalizado el interés en esta vía de cirugía con la introducción de instrumental especialmente diseñado para cirugía transanal que ha permitido facilitar su ejecución y mejorar los resultados. La cirugía transanal ofrece ventajas en cuanto a ser menos invasiva, presentar menores complicaciones, menor dolor postoperatorio y tener una estadía más corta. Por otro lado, preserva la función intestinal y anal sin necesidad de una ostomía.
En la actualidad, la cirugía endorrectal mini-invasiva se ha convertido en el estándar de tratamiento para algunas de las patologías rectales, reemplazando a la cirugía abdominal y a la cirugía tranasanal convencional.1 En el presente estudio, luego de su comunicación en las sesiones científicas de la Sociedad Argentina de Colorpoctología, realizamos una revisión de la bibliografía sobre cirugía transanal mini-invasiva (TAMIS) y reportamos nuestra experiencia en el tratamiento de los pólipos de recto por esta vía.
Cirugía Trans Anal Mini-invasiva (TAMIS)
El acrónimo TAMIS significa Cirugía Transanal Mini-invasiva o en inglés TransAnal Minimally Invasive Surgery. Ésta fue descripta en 2010 por Sam Atallah y colaboradores como una alternativa al TEM/TEO (Transanal Endoscopic Microsurgery/Transanal Endoscopic Operation).1 Se define como la utilización de un puerto multicanal (single port) de forma transanal combinado con el uso de instrumental de laparoscopía. El objetivo de esta técnica es ofrecer un abordaje transanal con menor costo y una curva de aprendizaje más corta comparada con el TEM/TEO.2 Originalmente, se describió con el uso de dos plataformas descartables (SILS port, Covidien, Mansfield, Masachusets, EE.UU. y Gel Point Path transanal access, Applied Medical, Rancho Santa Margarita, California, EE.UU.), aunque han surgido otros dispositivos con igual aplicación.
TAMIS presenta indicaciones aceptadas, controversiales e indicaciones poco convencionales, que se detallan en la tabla 1.3-5 La resección de pólipos adenomatosos de recto constituye la aplicación de mayor relevancia para el TAMIS. Son candidatos a resección local por TAMIS los adenomas de recto que no sean resecables por endoscopía por ser considerados dificultosos para una remoción con videocolonoscopía.6 Por ejemplo, los pólipos grandes (mayores a 4 cm) o los gigantes (mayores a 6 cm), los que se encuentren detrás de un pliegue o sobre una válvula rectal, o los que no puedan ser resecados en una sola pieza. La selección de estos pacientes necesita una íntima colaboración interdisciplinaria entre el gastroenterólogo, endoscopista y coloproctólogo. El objetivo debe ser ofrecer al paciente la terapéutica más efectiva con la menor morbilidad y que obtenga una pieza adecuada para su estadificación oncológica. TAMIS ofrece ventajas sobre las técnicas endoscópicas de resección por segmentos tipo “peace meal” en la que la lesión se extirpa en pequeños segmentos de menos de 2 cm de diámetro, al obtener una pieza única y completa para el estudio. Se ha comparado TAMIS con la disección submucosa endoscópica que también ofrece una resección completa de la lesión. Esta última si bien obtiene un espécimen de calidad, implica un entrenamiento aún más especializado que para la realización de cirugía endorrectal, insume un mayor tiempo operatorio, resultando en un mayor costo de tratamiento, a la vez que no permite la realización de una resección transmural y se ha asociado a una mayor tasa de recurrencia.7 Estos factores hacen que la disección endoscópica submucosa no se encuentre frecuentemente disponible en nuestro medio.
Tabla 1: Indicaciones TAMIS
|
Indicaciones Aceptadas |
|
|
Indicaciones controversiales |
|
|
Indicaciones poco convencionales |
|
Cuando comparamos TAMIS con las otras técnicas de cirugía transanal como el TEO/TEM, ésta ha demostrado tener resultados similares en cuanto a las indicaciones, resultados (estado de los márgenes) y complicaciones. Más aún, en la serie publicada por Melin y colaboradores, comparando 40 TEM con 29 TAMIS para la resección de adenomas vellosos de recto, TAMIS obtuvo muestras más voluminosas y mayor número de ganglios (presentes en el 17% de las muestras de TAMIS) que TEM (0% de las muestras).8
Un estudio multicéntrico comparativo entre TAMIS y TEO, que comparó en centros de alto volumen las dos técnicas en cuanto a los resultados medidos por fragmentación de la pieza operatoria y cantidad de márgenes positivos, incluyendo un total de 428 pacientes, no encontró diferencias significativas entre las dos técnicas.9 Los pacientes operados por TAMIS presentaron un tiempo operatorio más corto, probablemente por el menor tiempo de preparación del paciente (posición) y del set para comenzar la intervención. Al mismo tiempo, en el grupo TAMIS reportaron una estadía hospitalaria más corta. Una resección de baja calidad (pieza fragmentada o margen positivo) se dio en el 8% de los TEM y en el 11% de los TAMIS (p=0.233), no hubo diferencias en le entrada peritoneal, que fue del 3% en ambos grupos, ni en las complicaciones postoperatorias 11 contra 9% (p= 0.477). La sobrevida libre de enfermedad fue del 80% para los pacientes operados por TEM y del 78% para los operados con TAMIS (log rank p = 0.824). La incidencia de recurrencia local en los pacientes operados por cáncer, que no fueron rescatados con cirugía mayor inmediatamente, fue del 7% (8/117) en el grupo TEM y 7% (7/94) para el grupo TAMIS (p = 0.864). Los resultados reportados por Lee y colaboradores remarcan que los resultados son similares con ambas plataformas, dependiendo su elección de la preferencia del cirujano, disponibilidad y costo.9
A su vez, TAMIS ha revolucionado el tratamiento de tumores infrecuentes del recto como los neuroendocrinos y los GIST de pequeño tamaño, en los que la resección local es curativa. Se considera que se pueden tratar con resección local los tumores neuroendócrinos de menos de 2 cm de diámetro, con índice mitótico menor a 2 mitosis por 10 campos de alto poder y con un índice de proliferación Ki-67 menor al 2%.10 Aunque en ocasiones, sólo se tenga disponible en el preoperatorio el tamaño de la lesión como única indicación y que las demás variables se obtengan luego de resecado el tumor.
La resección local de los cánceres de recto presenta indicaciones establecidas y debe realizarse en casos seleccionados. Son pasibles de resección local los tumores T1 con factores histológicos favorables (buena diferenciación, ausencia de invasión linfovascular y perineural, ausencia de componente mucinoso). Se ha considerado la resección local para las lesiones T2, aunque su alta tasa de recurrencia hizo que esta indicación cada vez menos se considere como aceptable.11 Otra indicación de resección local en cáncer de recto la constituyen los pacientes, que por la presencia de comorbilidades o por elección propia, no sean candidatos de una resección radical. En estos casos la resección local se considera como un procediendo paliativo.
Para la realización de TAMIS, se utilizan puertos monotrocar, especialmente diseñados para la cirugía transanal (fig. 1). A través del mismo, se genera un neumorrecto y se realiza la cirugía con instrumental de laparoscopia convencional familiar para el cirujano entrenado. Se indica preparación colónica previa a la operación y ésta se realiza bajo anestesia general. Aunque se reporta con éxito la realización de anestesia raquídea, asociada a algunas ventajas, como ser la prevención de la lesión esfinteriana, inhibición del peristaltismo (ayuda en mantener el neumorrecto), pero con un aumento asociado de retención de orina.12 Habitualmente, se coloca al paciente en posición de litotomía, independientemente de la localización de la lesión, debido a que el anoscopio otorga una visión de 360°. La resección se realiza de manera homologa al TEM.
Figura 1: Set de TAMIS: Gel Point Path Transanal access.
La principal ventaja de las técnicas de resección transanal combinadas con laparoscopio (TEM/TAMIS) es que ofrecen un campo y visualización operatoria óptimos. La posibilidad de generar neumorrecto y poder evaluarlo con una óptica de laparoscopia hace que la imagen obtenida sea similar o superior a la que se obtiene con una endoscopía. Cuando se compara ésta con la visualización que se obtiene a través de un separador anal tipo Parks, la ventaja resulta evidente. El campo operatorio amplio ofrecido por TAMIS, permite la correcta delimitación de las lesiones y su resección con adecuado margen de seguridad. Por otro lado, la manipulación a través de instrumentos de laparoscopia, realizada en el lugar de la lesión, y sin la necesidad de tracción de la misma hacia el ano, como sucede durante una resección de Parks, resulta en una menor fragmentación de la pieza de resección. La obtención de un espécimen de calidad para el estudio anatomopatológico, permite que la evaluación de los márgenes sea correcta. La resección completa de las lesiones y la no fragmentación de la pieza se traducen en un bajo índice de recurrencia local, como se desprende de las series mencionadas a continuación, incluida la de los autores.13 La superioridad de las técnicas mininvasivas se ve reflejada en el reporte de Moore, el mismo comparó los resultados de 89 resecciones transanales clásicas y 82 pacientes operados por TEM en el tratamiento de adenomas de recto.14 Los márgenes de resección estuvieron libres en el 71% de las resecciones tipo Parks y en el 91% de las realizadas vía TEM. Por otro lado, la resección convencional ofreció piezas no fragmentadas en el 65% de los casos, comparado con el 94% obtenido con la resección con TEM. La recurrencia fue del 27% para la resección transanal vs. el 5% para los pacientes tratados por TEM. Teniendo en cuenta éste y otros reportes, algunos autores han sugerido que se debería abandonar la resección transanal convencional en favor de las técnicas mini-invasivas para el tratamiento de la patología rectal.15,16
TEM y TAMIS otorgan la posibilidad de tratar lesiones en todo el recto, desde la línea pectínea hasta la unión recto-sigmoidea (fig. 2). En la serie de Albert, que incluyó 50 pacientes operados por TAMIS, 25 adenomas y 25 adenocarcinomas, la distancia media del margen anal fue de 8 cm (3–14), se obtuvieron márgenes macroscópicos negativos en todos los casos, y sólo el 6% de los márgenes histológicos fueron positivos.17La morbilidad del procedimiento fue del 8%. Posteriormente, el mismo grupo de trabajo, presentó una extensa serie con 200 pacientes (90 operados por lesiones benignas y 110 por cánceres de recto) con un seguimiento de 78 meses, donde la distancia al margen anal de las lesiones fue de 7.9 cm (2-17cm) y se pudieron obtener todos los márgenes macroscópicos negativos con sólo el 7% de márgenes microscópicos positivos. En este reporte, la fragmentación de la pieza fue del 5%, no hubo mortalidad y la morbilidad fue del 11%.18
Una revisión bibliográfica realizada por Martin Pérez, confirma la reproducibilidad de resultados de la serie de Albert. La misma incluyó 390 resecciones realizadas vía TAMIS, donde el tamaño medio de las lesiones fue de 3,1 cm y la distancia al margen anal fue de 7,6 cm (3 a 15cm), la tasa de márgenes positivos fue de 4,36% (12/275), de fragmentación de la pieza fue 4,1% y la recurrencia 2,7%.19
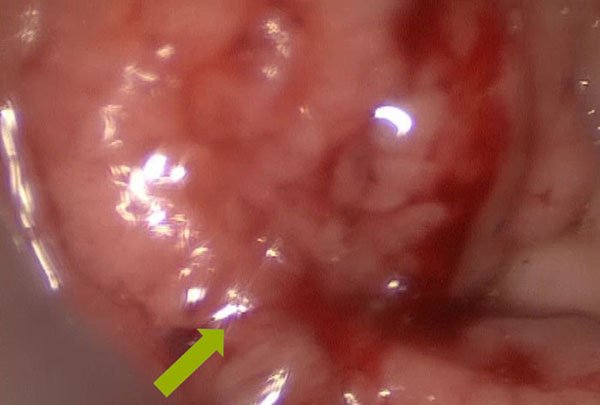
Figura 2: Línea pectínea observable luego de la colocación del set de acceso transanal en un paciente con poliposis rectal.
Realizamos una revisión complementaria con las publicaciones posteriores a 2010, recabando 64 trabajos sobre TAMIS, de estos 23 incluían más de 6 casos y excluyendo los reportes de caso en la base Pubmed (medline; con las palabras clave TAMIS, Transanal minimally invasive surgery, rectal polyp, rectal adenoma, en idioma inglés). (datos no publicados) En esta, la distancia media al margen anal fue de 7,23 cm, y la tasa de márgenes positivos del 11,1% (27/243 pacientes). La recurrencia para las lesiones fue del 5.78%.
A pesar del bajo porcentaje de márgenes positivos en la mayoría de las series, algunos reportes presentan una tasa elevada de límites comprometidos sobre todo durante la curva de aprendizaje.20 En nuestra sección, realizamos una tinción vital con azul de metileno para diferenciar el área patológica de la mucosa normal, de manera homóloga a lo que se realiza durante una cromo-endoscopía (fig. 3). La utilización de tinción nos permitió desarrollar e implementar la técnica, incluso durante la curva de aprendizaje, con una tasa de márgenes comprometidos menor al 8%.21,22
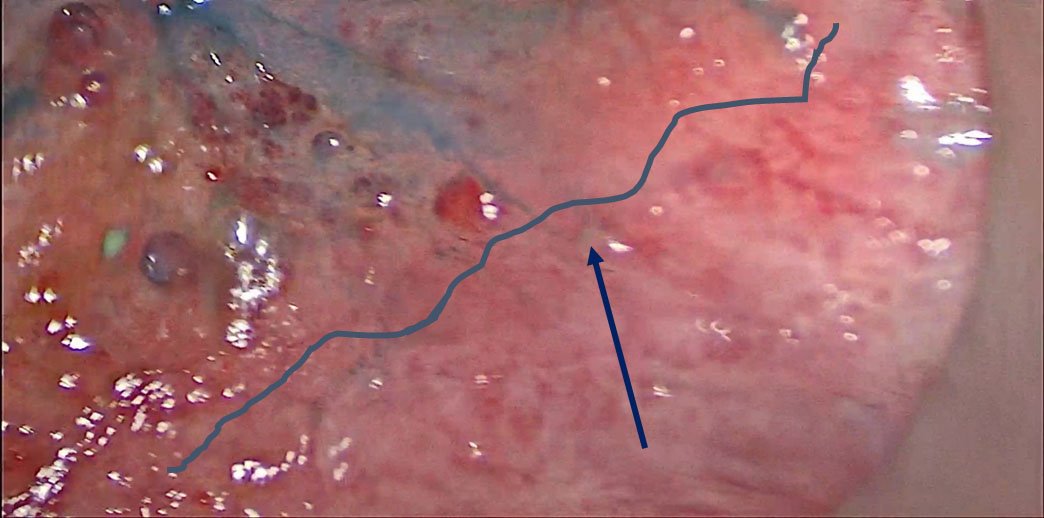
Figura 3: Pólipo de recto medio durante TAMIS, antes y después de la tinción con azul de metileno al 1%. Se evidencia luego de la tinción claramente el límite exacto de la lesión.
Si bien no existe consenso sobre la necesidad de realizar el cierre de la brecha rectal, existe una tendencia a recomendarlo.23 Hay escasos reportes específicos de TAMIS que evalúan el papel del cierre de la herida rectal.24 Todas las series publicadas desde la introducción del TAMIS reportan el cierre de la brecha en todos los casos en los que fue posible, avalando el uso rutinario del mismo. Aunque se pueden extrapolar los resultados de los estudios comparativos entre cierre y no cierre realizados con TEO/TEM en los que él no cierre no aumentó la tasa global de complicaciones, pero sí el uso de antibióticos. Ramírez y col. realizaron un estudio de aleatorización sobre 44 pacientes operados por TEM con o sin cierre de la herida, reportaron menor pérdida de sangre, mayor tiempo operatorio, e igual estadía en el grupo con cierre de la brecha, pero sin diferencias en las complicaciones comparados con el grupo de herida abierta.23 Un reporte canadiense, que comparó 236 TEM con cierre con 105 TEM con brecha abierta, destacó que los cirujanos con más experiencia realizaban más cierres (61% vs. 39%) que los de menor experiencia. A su vez, hubo menos complicaciones en el grupo con cierre (abierto:19% vs. cerrado: 8% p= 0,03). Aunque sin significancia estadística, también hubo una tendencia a presentar menor sangrado 4,7 vs. 7,6% e infección 2,1 vs. 6,7% en el grupo en el que se cerraba la herida rectal.[24] A su vez, la tasa de readmisión también fue menor en este grupo (4,7 vs. 12,4%; p=0,01). Hanloser y colaboradores, en un estudio multicéntrico con 75 pacientes TAMIS utilizando la plataforma SILS port (Covidien, Mansfield, Masachusets, EE.UU), reportó que el cierre llevó entre 9 a 105 minutos, con 8% infecciones sin diferencias entre los grupos.25 En los pacientes sin cierre la duración del tratamiento con antibióticos fue significativamente mayor, aunque no hubo una diferencia en la morbilidad estadísticamente significativa, hubo una tendencia a menores complicaciones en el centro que usaba ultracision (Ethicon, Cincinati, EE.UU.), cierre de la brecha y sin preparación mecánica del colon.23-26
Teniendo en cuenta la tendencia a presentar menores complicaciones cuando se cierra la brecha rectal luego de una resección transmural realizada por TAMIS, y que esta se realiza de rutina en la mayoría de los centros de alto volumen, creemos que la brecha rectal se debe cerrar en todas las ocasiones en las que sea técnicamente posible. En las que no lo sea, se puede dejar la herida abierta, siempre que esta se encuentre en el recto extra peritoneal. En los casos en los que la brecha queda abierta, es conveniente prolongar el tratamiento antibiótico postoperatorio (fig. 4).
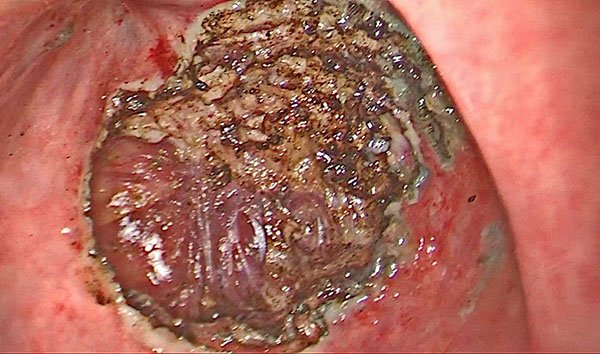
Figura 4: Herida rectal abierta luego de una resección de un pólipo rectal a 12 cm del margen anal. Se puede evidenciar la resección de espesor completo de la pared rectal y la exposición de la grasa mesorrectal.
Con el aprendizaje de todo procedimiento novedoso, también debemos aprender a manejar complicaciones específicas del mismo. Si bien, la cirugía transanal mininvasiva se asocia a un bajo índice de complicaciones cuando se la compara con una resección rectal por vía abdominal, se han descripto hemorragia, acceso a la cavidad peritoneal, abscesos perirrectales, dehiscencias de sutura y alteración de la continencia. La hemorragia habitualmente es autolimitada y se produce en el 1 al 15% de los pacientes. El cierre disminuiría la incidencia de sangrado postoperatorio.27 El acceso accidental a la cavidad peritoneal se relaciona a determinados factores de riesgo, como ser el sexo femenino, cáncer, lesiones circunferenciales o voluminosas, la situación anterior o alta (≥7cm del margen anal) de las lesiones en el recto (fig. 5).
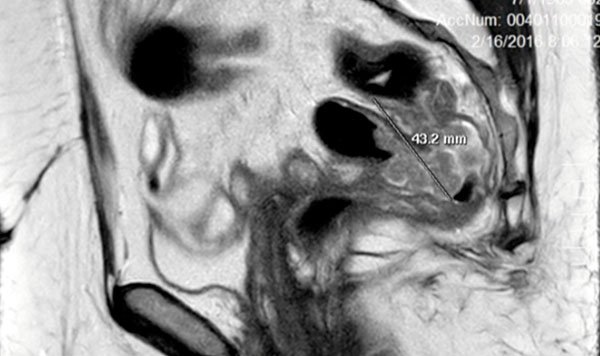
Figura 5: Lesión de recto superior en cara anterior del mismo en una paciente histerectomizada. Durante la resección de esta lesión se produjo un acceso a la cavidad peritoneal. La lesión era sésil y no pediculada como lo sugiera la RMN.
Teniendo en cuenta estos factores de riesgo y en que es posible mediante la estadificación preoperatoria prever la posibilidad de tener un acceso peritoneal, es que algunos autores no la consideren una complicación de la técnica sino un evento esperado.28 La incidencia de perforación peritoneal es del 5.8%.29 La comunicación con el peritoneo puede repararse por vía transanal, la mayoría de las ocasiones, o se debe convertir a la cirugía a una laparoscopia (10.7%).30 A medida que se obtiene mayor experiencia con las resecciones transanales, aumentan los casos de acceso peritoneal. No se ha relacionado la apertura peritoneal con un aumento de la morbilidad o a un peor pronóstico oncológico ni con un aumento en la tasa de recidiva.31 La dehiscencia de la sutura en la pared rectal puede ocurrir con frecuencia, especialmente en los pacientes que han recibido radiación previa. La misma se puede traducir en dolor y tenesmo, proctorragia, o contaminación del mesorrecto. La formación de abscesos puede darse por debajo de la línea de sutura o una vez que esta se ha separado (fig. 6). Las complicaciones sépticas pelvianas, se pueden manejar con un drenaje transrectal si la línea de sutura está intacta, con lavado rectal o solamente con tratamiento antibiótico con buena respuesta.
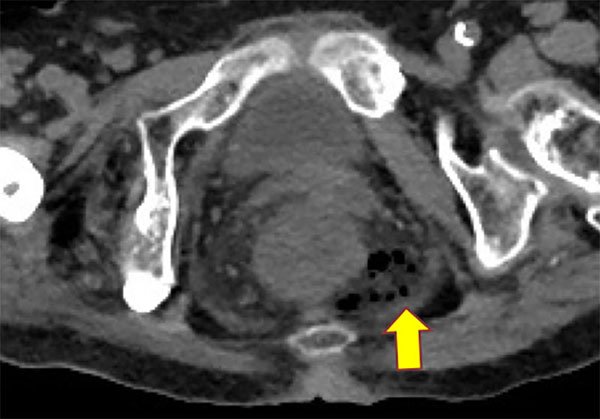
Figura 6: Tomografía computada al tercer día postoperatorio de una resección de un pólipo de recto medio en el que se dejo la brecha abierta. La paciente presento leucocitosis y fiebre. El cuadro presento una evolución favorable con el tratamiento antibiótico endovenoso.
De estas complicaciones, la alteración de la continencia es tal vez la que más preocupación genere con respecto al método. Al comparar TAMIS como alternativa al TEO, hay que tener en cuenta los resultados en calidad de vida y en las mediciones de incontinencia fecal. El diámetro 40 mm de los rectoscopios operativos utilizados en TEO, han despertado la inquietud de evaluar qué ocurre con el esfínter anal cuando se lo dilata para la realización de la cirugía endorrectal. La dilatación anal y el rectoscopio pueden lesionar el esfínter anal externo o interno. Se ha reportado una disfunción transitoria asociada a la realización de cirugías TEO.27,32 Pudiendo haber lesiones ecográficas del esfínter anal en el 29% de los pacientes, incontinencia de severidad variable en el 21%, disfunciones anorrectales en el 50% de los pacientes a la tercer semana postoperatoria, asociado a una diminución de la presión manométrica de reposo y contracción, en el seguimiento a corto plazo.33 El anoscopio flexible y de menor diámetro (30 mm) de TAMIS tiene la ventaja potencial de inducir menor daño al esfínter anal por su menor diámetro y su flexibilidad. Schiphorst y col. registró los puntajes de incontinencia pre y post TAMIS en 35 pacientes, obteniendo que el 88% de los pacientes de la muestra mejoró sus puntajes de incontinencia. Sólo el 10% de los pacientes con continencia normal desarrollaron incontinencia y en más de la mitad de estos fue transitoria durante el postoperatorio.20 Verseveld evaluó en una serie de 24 pacientes tratados por TAMIS por cáncer de recto T1 con resultados de calidad de vida e incontinencia fecal, y un seguimiento mínimo de 6 meses.34 El puntaje FISI (Fecal Incontinence Severity Index) se mantuvo inalterado luego de la cirugía (9.8 vs 7.3; P = 0.26), a la vez que no hubo cambio en la encuesta de calidad de vida relacionada a incontinencia fecal (FIQOLS).35 Los pacientes que tuvieron un aumento en el FISI tenían significativamente menor distancia al margen anal desde el tumor (4.4 vs 7.4 cm; P = 0.04) y tumores significativamente más grandes (21 vs 9 cm2; P = 0.05).36 Sí se observó luego de la cirugía una mejoría en el reporte de calidad de vida EuroQol EQ-5D (EQ-VAS: 77 vs 83; P = 0.04). Ambos resultados avalan la ausencia de lesión esfinteriana significativa luego de una cirugía TAMIS. La mejora en la calidad de vida se vió principalmente en el subtipo de análisis “coping and behaviour’’. En este estudio, la continencia mejoró en el 79% de los pacientes luego de la cirugía, en sintonía con lo reportado por Schiphorst, donde el 88% de los pacientes operados mejoraron la continencia.20
Para la realización de TAMIS se utilizan instrumentos de laparoscopia tradicionales (no curvos) para los cuales el cirujano con entrenamiento en cirugía laparoscópica está habituado.1 Este hecho hace que la curva de aprendizaje pueda adquirirse con más facilidad que con otro tipo de instrumental. Lee ha reportado que la curva de aprendizaje, teniendo en cuenta las resecciones R1 menores al 10% (márgenes histológicos positivos menores al 10%), se puede obtener luego de los 24 casos en un centro de alto volumen.37 A la vez que el tiempo operatorio se estabiliza luego de este número de casos.
TAMIS presenta algunas limitaciones, cuando se la compara con el TEM. Si bien es posible tratar lesiones muy altas en recto, en esta posición la falta de distensión del recto dificulta la cirugía. La estabilidad de la cámara es dada por el asistente, debido a que la misma no se encuentra fija al anoscopio. El manejo del humo puede resultar inconveniente durante algunos procedimientos. A pesar de utilizar instrumental de laparoscopia convencional, TAMIS también presenta una curva de aprendizaje. El costo de los dispositivos utilizados en algunos casos aún puede ser elevado.
Nuestra experiencia
En la Sección de Coloproctología, División de Cirugía Gastroenterológica del Hospital de Clínicas José de San Martín comenzamos nuestra experiencia en TAMIS en el año 2013 hasta marzo de 2018, registrando todos los casos tratados de manera prospectiva. Elegimos para la realización de los procedimientos una plataforma flexible Gel Point Path Transanal Access (Applied Medical, EEUU.). La principal indicación en nuestro servicio de TAMIS fue la patología rectal benigna, en particular los pólipos no resecables por endoscopía, tumores neuroendócrinos (menores a 2 cm), biopsia escisional en tumores de recto (para descartar invasión), y algunas indicaciones atípicas (como el tratamiento de estenosis anastomóticas).
Realizamos las intervenciones bajo anestesia general, en posición ginecológica, con preparación mecánica del colon y profilaxis antibiótica. Al comienzo del acto operatorio utilizamos de rutina una tinción vital con azul de metileno de la lesión adenomatosa a resecar para mejorar la identificación de los márgenes de la lesión de manera homologa a lo realizado durante una cromoendoscopia. Hemos comunicado las ventajas y resultados de la misma en la Academia Argentina de Cirugía.21
En esta comunicación, sobre una serie de 21 pacientes operados con TAMIS entre enero de 2013 y el diciembre de 2016, seleccionamos 12 pacientes operados por adenomas de recto no resecables por endoscopía. De esta muestra, la edad media fue de 58 años, la distancia al margen anal 7,6 cm, con un compromiso de la circunferencia del 32% de la luz rectal. El tiempo operatorio medio fue de 64 minutos. En todos fue posible obtener un espécimen de calidad no fragmentado para el estudio anatomopatológico. Se realizó el cierre de la brecha rectal en el 90% de los casos en los que las cirugía fue completada por TAMIS (10/11). Uno de los casos fue convertido a una resección anterior laparoscópica por un acceso peritoneal. Este último se trató de una mujer con antecedentes de histerectomía con una lesión anterior de 5 cm. de diámetro en el recto superior. La anatomía patológica informó adenomas con diferentes grados de displasia (5 tubulares, 4 tubulovelloso, 1 tubulovelloso con CIS, 1 velloso, 1 juvenil) con el margen profundo libre en todos los casos y con un margen lateral en contacto con el límite de resección, obteniendo un promedio para la muestra de 92% de márgenes libres. Realizamos un seguimiento medio de 28 meses (DS: 13,4) con examen físico con tacto rectal trimestral, rectosigmoideoscopía semestral y videocolonoscopía anual. Durante el periodo de seguimiento no detectamos recurrencias.
En nuestra experiencia, las resecciones por TAMIS se asocian a un bajo índice de complicaciones, habiendo registrado 2 casos de neumomesorrecto asociado a fiebre (un caso con brecha abierta y uno cerrada, 9%), una proctorragia leve de 3 meses de duración (4,7%), y un acceso peritoneal (4,7%). Las complicaciones infecciosas del meso fueron resueltas con tratamiento médico con antibióticos parenterales, la proctorragia remitió espontáneamente, y la perforación advertida durante la resección fue tratada con una resección anterior. No registramos alteraciones de la continencia fecal en el postoperatorio.
CONCLUSIONES
La cirugía transanal mini-invasiva constituye una alternativa a TEO/TEM con resultados equiparables y una implementación más sencilla. Ofrece resultados superadores al compararse con la resección transanal convencional con una marcada disminución de las tasas de recidiva local en el tratamiento de los adenomas de recto. La baja morbilidad asociada a la cirugía mini-invasiva también la posiciona como una alternativa a la cirugía rectal abdominal. Estos factores de mejora determinan un cambio de paradigma en la cirugía transanal y definen a TAMIS como un nuevo estándar de tratamiento.
BIBLIOGRAFÍA
- S. Atallah, M. Albert, and S. Larach, “Transanal minimally invasive surgery: a giant leap forward,” Surg Endosc, vol. 24, no. 9, pp. 2200–2205, 2010.
- E. C. McLemore et al., “Transanal minimally invasive surgery for benign and malignant rectal neoplasia,” Am. J. Surg., vol. 208, no. 3, pp. 372–381, 2014.
- Y. Qi, D. Stoddard, and J. R. T. Monson, “Indications and Techniques of Transanal Endoscopic Microsurgery (TEMS),” J. Gastrointest. Surg., vol. 15, no. 8, pp. 1306–1308, 2011.
- Y. H. Kinoshita T, Kanehira E, Omura K, Tomori T, “Transanal endoscopic microsurgery in the treatment of rectal carcinoid tumor.,” Surg Endosc, vol. 21, no. 6, pp. 970–4, 2007.
- M. Cantero Ramon, “Cirugía Transanal a través de Puerto Único (TAMIS). Revisión frente otras Técnicas de Excisión Endoscópica de Lesiones Rectales,” Rev Arg Coloproct, vol. 24, no. 2, pp. 55–60, 2013.
- K. Mönkemüller, H. Neumann, L. C. Fry, H. Ivekovic, and P. Malfertheiner, “Polypectomy techniques for difficult colon polyps,” Dig. Dis., vol. 26, no. 4, pp. 342–346, 2009.
- W. Mao, X. Liao, S. Shao, W. Wu, Y. Yu, and G. Yang, “Comparative evaluation of colonoscopy-assisted transanal minimally invasive surgery via glove port and endoscopic submucosal dissection for early rectal tumor,” Int. J. Surg., vol. 42, pp. 197–202, 2017.
- A. A. Melin, S. Kalaskar, L. Taylor, J. S. Thompson, C. Ternent, and S. J. Langenfeld, “Transanal endoscopic microsurgery and transanal minimally invasive surgery: is one technique superior?,” Am. J. Surg., vol. 212, no. 6, pp. 1063–1067, Dec. 2016.
- L. Lee et al., “Quality of Local Excision for Rectal Neoplasms Using Transanal Endoscopic Microsurgery Versus Transanal Minimally Invasive Surgery,” Dis. Colon Rectum, vol. 60, no. 9, pp. 928–935, 2017.
- D. S. Klimstra, I. R. Modlin, D. Coppola, R. V Lloyd, and S. Suster, “The pathologic classification of neuroendocrine tumors: a review of nomenclature, grading, and staging systems.,” Pancreas, vol. 39, no. 6, pp. 707–712, 2010.
- A. A. Althumairi, S. L. Gearhart, A. A.A., and G. S.L., “Local excision for early rectal cancer: Transanal endoscopic microsurgery and beyond,” J. Gastrointest. Oncol., vol. 6, no. 3, pp. 296–306, 2015.
- T.-G. Lee and S.-J. Lee, “Transanal single-port microsurgery for rectal tumors: minimal invasive surgery under spinal anesthesia,” Surg. Endosc., vol. 28, no. 1, pp. 271–280, Jan. 2014.
- C. Clancy, J. P. Burke, M. R. Albert, P. R. O’Connell, and D. C. Winter, “Transanal Endoscopic Microsurgery Versus Standard Transanal Excision for the Removal of Rectal Neoplasms,” Dis. Colon Rectum, vol. 58, no. 2, pp. 254–261, 2015.
- J. S. Moore, P. A. Cataldo, T. Osler, and N. H. Hyman, “Transanal endoscopic microsurgery is more effective than traditional transanal excision for resection of rectal masses,” Diseases of the Colon and Rectum, vol. 51, no. 7. pp. 1026–1030, 2008.
- S. Atallah and D. Keller, “Why the Conventional Parks Transanal Excision for Early Stage Rectal Cancer Should Be Abandoned,” Dis. Colon Rectum, vol. 58, no. 12, pp. 1211–1214, 2015.
- H. Hakiman, M. Pendola, and J. W. Fleshman, “Replacing Transanal Excision with Transanal Endoscopic Microsurgery and/or Transanal Minimally Invasive Surgery for Early Rectal Cancer.,” Clin. Colon Rectal Surg., vol. 28, no. 1, pp. 38–42, Mar. 2015.
- M. R. Albert, S. B. Atallah, T. C. DeBeche-Adams, S. Izfar, and S. W. Larach, “Transanal Minimally Invasive Surgery (TAMIS) for Local Excision of Benign Neoplasms and Early-stage Rectal Cancer,” Dis. Colon Rectum, vol. 56, no. 3, pp. 301–307, 2013.
- L. Lee et al., “Transanal Minimally Invasive Surgery for Local Excision of Benign and Malignant Rectal Neoplasia,” Ann. Surg., p. 1, Mar. 2017.
- B. Martin-Perez, G. D. Andrade-Ribeiro, L. Hunter, and S. Atallah, “A systematic review of transanal minimally invasive surgery (TAMIS) from 2010 to 2013,” Tech. Coloproctol., pp. 775–788, 2014.
- A. H. W. Schiphorst, B. S. Langenhoff, J. Maring, A. Pronk, and D. D. E. Zimmerman, “Transanal Minimally Invasive Surgery,” Dis. Colon Rectum, vol. 57, no. 8, pp. 927–932, 2014.
- A. Moreira Grecco; G. Zapata; J Landa; R. Morales; R. Reverendo; G. Carles; L.Sarotto, “Validación de la tinción vital durante el tratamiento de adenomas de recto mediante cirugía endorectal (TAMIS),” Validación de la tinción vital durante el tratamiento de adenomas de recto mediante cirugía endorectal (TAMIS). buenos aires, 2017.
- G. A.M., D. F., Z. G., and D. F. M.E., “Methylene blue mucosal staining improves polyp margin identification during tamis. A validation study,” Surg. Endosc. Other Interv. Tech., vol. 30, p. S335, 2016.
- J. M. Ramirez, V. Aguilella, D. Arribas, and M. Martinez, “Transanal full-thickness excision of rectal tumours: Should the defect be sutured? A randomized controlled trial,” Color. Dis., vol. 4, no. 1, pp. 51–55, 2002.
- C. Brown, M. J. Raval, P. T. Phang, and A. A. Karimuddin, “The surgical defect after transanal endoscopic microsurgery: open versus closed management,” Surg. Endosc. Other Interv. Tech., vol. 31, no. 3, pp. 1078–1082, 2017.
- D. Hahnloser, R. Cantero, G. Salgado, D. Dindo, D. Rega, and P. Delrio, “Transanal minimal invasive surgery (TAMIS) for rectal lesions: should the defect be closed?,” Color. Dis., p. n/a-n/a, 2014.
- A. M. Paganini, A. Balla, S. Quaresima, G. D???Ambrosio, P. Bruzzone, and E. Lezoche, “Tricks to decrease the suture line dehiscence rate during endoluminal loco-regional resection (ELRR) by transanal endoscopic microsurgery (TEM),” Surg. Endosc. Other Interv. Tech., vol. 29, no. 5, pp. 1045–1050, 2015.
- R. Heras MA, Cantero, “Cirugía Transanal a través de Puerto Único ( TAMIS ). Revisión frente otras Técnicas de Excisión Endoscópica de Lesiones Rectales,” Argent Coloproct, vol. 24, no. 2, pp. 55–60, 2013.
- G. Baatrup, T. Borschitz, C. Cunningham, and N. Qvist, “Perforation into the peritoneal cavity during transanal endoscopic microsurgery for rectal cancer is not associated with major complications or oncological compromise,” Surg. Endosc., vol. 23, no. 12, pp. 2680–2683, 2009.
- M. Morino, M. E. Allaix, F. Famiglietti, M. Caldart, and A. Arezzo, “Does peritoneal perforation affect short- and long-term outcomes after transanal endoscopic microsurgery?,” Surg. Endosc., vol. 27, no. 1, pp. 181–188, Jan. 2013.
- J. H. Marks, J. L. Frenkel, C. E. Greenleaf, and A. P. D’Andrea, “Transanal endoscopic microsurgery with entrance into the peritoneal cavity: is it safe?,” Dis. Colon Rectum, vol. 57, no. 10, pp. 1176–82, 2014.
- M. Morino and M. E. Allaix, “Transanal endoscopic microsurgery: what indications in 2013?,” Gastroenterol. Rep., vol. 1, no. 2, pp. 75–84, 2013.
- H.-S. Wang, J.-K. Lin, S.-H. Yang, J.-K. Jiang, W.-S. Chen, and T.-C. Lin, “Prospective study of the functional results of transanal endoscopic microsurgery.,” Hepatogastroenterology., vol. 50, no. 53, pp. 1376–80.
- R. M. Herman, P. Richter, P. Walȩga, and T. Popiela, “Anorectal sphincter function and rectal barostat study in patients following transanal endoscopic microsurgery,” Int. J. Colorectal Dis., vol. 16, no. 6, pp. 370–376, 2001.
- M. Verseveld, B. M. Renée Barendse, B. P. Martijn Gosselink, C. Verhoef, B. J. Eelco R de Graaf, and B. G. Pascal Doornebosch, “Transanal minimally invasive surgery: impact on quality of life and functional outcome,” Surg. Endosc., vol. 30.
- T. H. Rockwood et al., “Patient and surgeon ranking of the severity of symptoms associated with fecal incontinence: the fecal incontinence severity index.,” Dis. Colon Rectum, vol. 42, no. 12, pp. 1525–32, Dec. 1999.
- M. Verseveld, R. M. Barendse, M. P. Gosselink, C. Verhoef, E. J. R. de Graaf, and P. G. Doornebosch, “Transanal minimally invasive surgery: impact on quality of life and functional outcome.,” Surg. Endosc., vol. 30, no. 3, pp. 1184–7, Mar. 2016.
- L. Lee et al., “Establishing the learning curve of transanal minimally invasive surgery for local excision of rectal neoplasms.,” Surg. Endosc., Aug. 2017.
COMENTARIO
El equipo de Coloproctologia del Hospital de Clínicas publica su experiencia en el novedoso abordaje denominado TAMIS. Desde su descripción, hace varios años, la técnica ha crecido exponencialmente. En la actualidad existen indicaciones precisas para este tipo de abordaje, cuya principal ventaja radicaría en evitar la morbilidad de la cirugía abdominal de recto, sin comprometer los resultados oncológicos.
En el análisis de los autores se destacan 12 pacientes operados por patología benigna, con una tasa de complicaciones aceptable y acorde a la descripta en la literatura.
Sería de interés recibir en un futuro publicaciones de este tipo, para el tratamiento de la patología maligna de recto. Un adecuado diagnostico imagenológico asociado a la discusión del caso clínico con todos los especialistas involucrados (gastroenterólogos, especialistas en imágenes, cirujanos y demás especialidades tratantes) permitirían adecuar el tratamiento a cada paciente en particular. Sin dudas el TAMIS en determinados pacientes permitiría evitar la cirugía radical y una eventual ostomia por lo tanto, su difusión en el tratamiento de patología maligna es muy importante.
Dr. Mariano Laporte, Hospital Alemán, Buenos Aires.