Manejo Actual de la Enfermedad Diverticular Aguda del Colon
Manejo Actual de la Enfermedad Diverticular
Aguda del Colon
Nicolás Matias Barbalace
Residente de Cuarto Año. Servicio de Cirugía General.
Unidad Asistencial por más Salud. Hospital Dr. César Milstein. C.A.B.A.
Esta monografía es propiedad de la Sociedad Argentina de Coloproctología y no puede ser publicada, en todo o en parte, o resumirse, sin consentimiento escrito de la Comisión Directiva de esta Sociedad y de su autor.
INTRODUCCIÓN
La enfermedad diverticular o diverticulosis es la patología benigna más frecuente del colon, por lo general es un hallazgo que se evidencia en la videocolonoscopía por screening en la actualidad, mientras que en décadas anteriores su hallazgo era muy frecuente en los estudios colónicos contrastados. El divertículo (Refugio o posada al costado del camino) es un saco o bolsa anormal que sobresale de la pared de un órgano hueco, en este caso, el colon. Un divertículo verdadero posee de todas las capas de la pared intestinal, mientras que un divertículo falso o seudodivertículo carece de parte de la pared intestinal normal.
Los divertículos más comunes en el colon humano son protrusiones de la mucosa a través de las capas musculares del intestino. Como estas herniaciones de la mucosa carecen de las capas musculares normales, se trata de seudodivertículos. La diverticulosis o enfermedad diverticular es la presencia de divertículos en el colon.
Los divertículos representan en realidad herniaciones de la mucosa a través del colon, en los lugares más débiles de la pared del colon, justamente por donde las arteriolas penetran en la capa muscular. Se encuentran en el borde mesentérico de las tenias antimesentéricas. En algunos casos, la arteriola que penetra en la pared es desplazada hasta la cúpula del divertículo. Esta relación entre la arteriola y el divertículo explica la hemorragia masiva que a veces complica la diverticulosis.
Suelen afectar al colon sigmoideo principalmente y quedan confinados al sigma en casi la mitad de los casos. El área siguiente, en orden de frecuencia, es el colon descendente (=40% de los sujetos afectados); solo del 5 al 10% de los pacientes con diverticulosis muestra estas lesiones en todo el colon. Los divertículos originados en el colon izquierdo generalmente son los que se producen por un aumento de la presión intraluminal mientras que los del colon derecho habitualmente son verdaderos, congénitos y no necesariamente originados por el aumento de la presión intraluminal
La prevalencia de la enfermedad está estimada entre el 5% y el 10% en menores de 40 años, aumentando su incidencia al 70% a los 65 años de edad y llegando a su máxima incidencia (75%) en pacientes mayores de 70 años.
HISTORIA
La enfermedad diverticular del colon es una entidad de reciente aparición, observándose un aumento manifiesto en el siglo XX. En 1700, Littre describió por primera vez la enfermedad diverticular adquirida del colon como saculaciones del colon.
En 1849, Cruveilhier dio la primera descripción del proceso anatomopatológico de los divertículos, con la formación de fístulas benignas con la vejiga.
En 1899, Graser introdujo el término “peridiverticulitis”, que sugería que la patogenía de los divertículos era la herniación de la mucosa a través de la zona de penetración del vasa recta.
En 1904, Beer postuló que el mecanismo de la diverticulitis era la impactación de materia fecal en el cuello del divertículo, y que causaba inflamación y abscesificación, con posible fistulización.
En 1908, Telling comunicó 80 casos de diverticulitis del colon sigmoideo. En 1917, Telling y Gruner publicaron su descripción clásica de la enfermedad diverticular complicada.
EMBRIOLOGÍA
No puede hacerse una exposición completa de la anatomía del colon y recto sin tener un conocimiento del origen del tubo digestivo. El estudio de la anatomía embriológica del intestino anterior, medio y posterior nos servirá para analizar las relaciones anatómicas maduras desde el punto de vista estructural y funcional.
El techo endodérmico del saco vitelino da origen al tubo intestinal primitivo. A comienzos de la tercera semana del desarrollo, el tubo intestinal se divide en tres regiones: el intestino medio, que se abre ventralmente, se encuentra entre el intestino anterior colocado en el pliegue cefálico y el posterior, en el pliegue caudal. El desarrollo progresa por los estadios de herniación fisiológica, retorno al abdomen y fijación. Durante esta fase adquiere su longitud y se forman los vasos sanguíneos y linfáticos propios.
Las estructuras derivadas del intestino anterior terminan en la segunda porción del duodeno y dependen, para su irrigación, de la arteria celíaca. El intestino medio, que se extiende entre la ampolla duodenal y la porción distal del colon transverso, recibe la perfusión de la arteria mesentérica superior (AMS). El tercio distal del colon transverso, el colon descendente y el recto surgen en el pliegue del intestino posterior y son irrigados por la arteria mesentérica inferior (AMI). Las venas y los conductos linfáticos siguen de forma especular a las arterias y contienen las mismas divisiones embrionarias. Los tejidos derivados del endodermo se juntan en la línea pectínea con el proctodeo derivado del ectodermo o invaginación de la fosita anal.
El desarrollo distal del recto es complejo. La cloaca es una región especializada del recto primitivo distal, que se compone de tejidos endodérmicos y ectodérmicos. Esta región se incorpora a la zona de transición anal que rodea la línea pectínea (dentada) del adulto. La cloaca se continúa con el intestino posterior, pero aproximadamente hacia la sexta semana empieza a dividirse y diferenciarse en los elementos anterior (urogenital) y posterior (anal y esfinteriano). AI mismo tiempo, los tractos urogenital y gastrointestinal quedan separados por la migración caudal del tabique urogenital. El esfínter anal externo se forma en la décima semana de desarrollo a partir de la cloaca posterior, cuando finaliza el descenso del tabique urogenital. El esfínter anal interno aparece en la doceava semana a partir de las capas ensanchadas de músculo circular del recto.
ANATOMÍA
El colon y el recto se componen de un tubo de diámetro variable con una longitud aproximada de 150 cm. El íleon terminal desemboca en el ciego a través de una invaginación engrosada y areolar, la válvula ileocecal. El ciego es un segmento sacular del colon proximal, con un diámetro medio de 7,5 cm y una longitud de 10 cm. Pese a su relativa distensibilidad, la dilatación aguda del ciego llega hasta un diámetro mayor de 12 cm, acontecimiento que se puede registrar en una radiografía simple de abdomen, y que ocasiona necrosis isquémica y perforación de la pared intestinal con posterior peritonitis. Este grado de distensión cecal causado por obstrucción o seudoobstrucción requiere, a veces, la intervención quirúrgica.
El colon ascendente, cuya longitud es de aproximadamente 15 cm, sube por el lado derecho hasta el hígado formando el ángulo hepático; al igual que el colon descendente, su cara posterior se fija al retroperitoneo, mientras que las caras lateral y anterior son estructuras auténticamente intraperitoneales. La línea blanca de Toldt representa la fusión entre el mesenterio y el peritoneo posterior. Esta sutil marca de referencia peritoneal sirve al cirujano como referencia para movilizar el colon y el mesenterio desde el espacio retroperitoneal.
El colon transverso mide unos 45 cm de longitud. Esta estructura, que cuelga entre las flexuras hepática y esplénica fijas, está totalmente investida de peritoneo visceral. El ligamento nefrocólico afianza la flexura hepática y se sitúa directamente sobre el riñón derecho, duodeno e hilio hepático. El ligamento nefrocólico se sitúa delante del bazo y fija la flexura esplénica en el hipocondrio izquierdo. El ángulo de la flexura esplénica es más alto, agudo y profundo que el de la flexura hepática. La flexura esplénica suele abordarse disecando el colon descendente a lo largo de la línea de Toldt, por la cara inferior, y penetrando luego en la transcavidad de los epiplones después de rechazar el epiplón del colon transverso. Con esta maniobra se moviliza la flexura, cuya exposición requiere entonces una tracción mínima. El epiplón mayor se une a la cara superior del colon transverso y es una doble capa fusionada de peritoneo visceral y parietal que contiene cantidades variables de grasa. Contribuye de manera decisiva a evitar las bridas entre las heridas quirúrgicas abdominales y el intestino subyacente y suele utilizarse para cubrir el contenido intraperitoneal al cerrar las incisiones. El epiplón se puede movilizar y colocar entre el recto y la vagina tras la reparación de una fístula rectovaginal alta o bien utilizar para llenar los espacios pélvico y perineal que quedan tras la extirpación del recto.
El colon descendente queda ventral al riñón izquierdo y baja unos 25 cm desde la flexura. Su diámetro es menor que el del colon ascendente. A la altura de la cresta pélvica se observa una transición entre el colon descendente, de paredes relativamente finas y fijo, y el colon sigmoideo, más grueso y móvil. La longitud del colon sigmoideo, estructura de gran movilidad, varía entre 15 y 50 cm. El sigma es un tubo muscular, de pequeño diámetro, con un mesenterio largo y suelto que suele formar un bucle en omega dentro de la pelvis. El mesosigma suele insertarse en la pared lateral pélvica izquierda, creando un pequeño receso del mesenterio conocido como fosa intersigmoidea. Este pliegue mesentérico constituye una referencia quirúrgica del uréter izquierdo.
IRRIGACIÓN DEL COLON
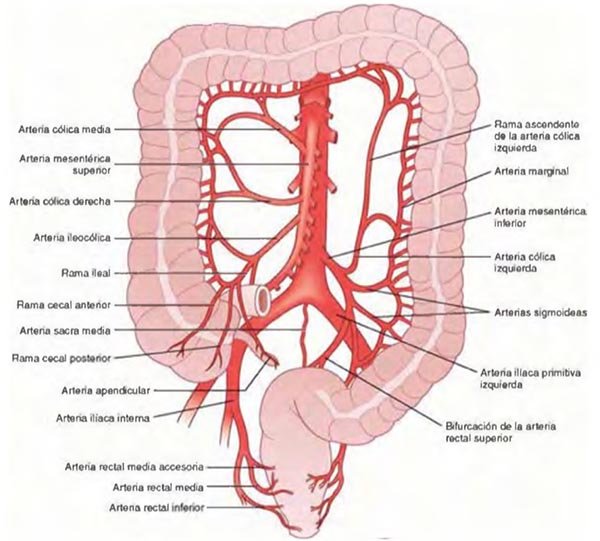
Figura 1: Irrigación de Colon. Gordon PH, Nivatvongs S [eds] (1999): Principles and practice of surgery for the colon, rectum and anus, ed 2, St Louis, [Figura] Quality Medical Publishing, p 23
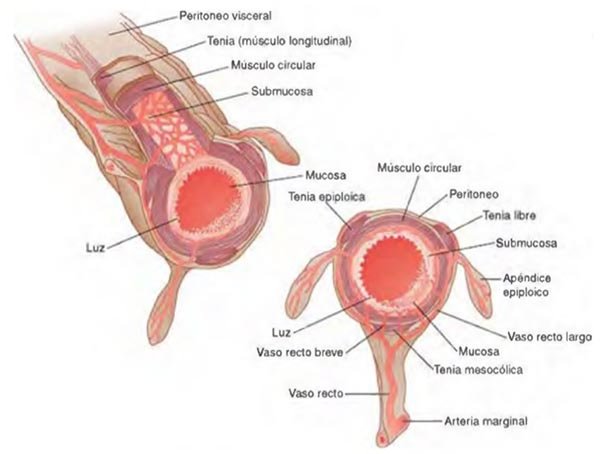
Figura 2: Irrigación de Colon. Ibíd, p 26.
FISIOPATOLOGÍA DE LA ENFERMEDAD DIVENTRICULAR
Si bien se reconocen ciertos factores que pueden influenciar en la generación de divertículos, no están del todo claras dichas relaciones. A continuación, se mencionarán interacciones que influenciarían en la etiopatología de la enfermedad como la motilidad colónica, microbiota, dieta, inflamación y los factores genéticos.
Motilidad colónica
La degeneración neural asociada a la edad según estudios sugieren la disminución de células de cajal y del plexo mientérico lo que generaría alteraciones en la contractibilidad del colon, influenciando en la peristalsis del mismo, y así, aumentando la presión intraluminal produciendo progresivamente una hipertrofia de la muscular.
Alteraciones en la microbiota
Se encontró que los índices de Firmicutes / bacteroidetes y la carga de proteobacterias fueron comparables entre los pacientes con diverticulitis y los controles, mientras que se evidenció una mayor diversidad en diverticulitis para Proteobacteria y todos phyla combinados.
Dieta
Es un punto de conflicto en la etiopatogenia. La dieta con alto contenido de fibras disminuiría la posibilidad de contraer diverticulosis, favoreciendo los movimientos peristálticos del colon y así el tránsito intestinal disminuyendo la presión intraluminal del mismo.
"Patients with a history of diverticulosis or DD commonly seek dietary and lifestyle recommendations to reduce their risk of occurrence/recurrence of the disease and/or complications”.1 Esta cita hace referencia a la disminución de riesgo de contraer diverticulitis y su recurrencia la dieta alta en fibras.
Inflamación
Estaría relacionada a los síntomas y a la recurrencia de la enfermedad. Se observa un infiltrado inflamatorio crónico microscópico, un aumento de la citokinas pro inflamatorias TNF alfa.
La obesidad aumentaría la incidencia de la diverticulitis por el efecto pro inflamatorio de las adipoquinas y quemoquinas.
La persistencia endoscópica e histológica de la inflamación está recientemente identificada como un factor de riesgo para la recurrencia de la enfermedad.
Factores genéticos
Se encontraron recientemente ciertos genes que favorecerían la aparición de la enfermedad diverticular. TNFSF15 está presente en pacientes que padecen de chron (Severidad) y colitis ulcerosa (refractariedad). TNFSF15-SNP se encontraría aumentado en enfermedad diverticular, más específicamente los alelos GG homocigotos están presente en el 62% de los pacientes. También puede funcionar como predictor de diverticulitis. El 8% de los pacientes con diverticulitis poseen homocigosis AA, el 35% heterocigosidad AG y 56% de homocigosis GG.
CLASIFICACIÓN DE LA ENFERMEDAD DIVERTICULAR
Enfermedad diverticular
Presencia de divertículos en el colon.
Enfermedad diverticular asintomática no complicada
Presencia de divertículos sin manifestaciones clínicas ni complicaciones. Generalmente es un hallazgo de un estudio contrastado o videocolonoscópico.
Enfermedad diverticular sintomática no complicada
Síntomas atribuibles a la diverticulosis con la ausencia de inflamación visible o diverticulitis. Episodios de dolor abdominal sin evidencia de inflamación. Dichos dolores disminuyen con la eliminación de flatulencias o con los movimientos intestinales. Puede estar asociado a distensión abdominal, diarrea o constipación. El cuadro doloroso abdominal no estaría acompañado de hipertermia ni de alteraciones en los parámetros de laboratorio.
Enfermedad diverticular sintomática no complicada recurrente
Múltiples episodios de enfermedad diverticular sintomática no complicada a lo largo de un año.
Colitis segmentaria asociada a enfermedad diverticular
Una forma crónica de la diverticulitis en la que puede evidenciarse inflamación macroscópica en la videocolonoscopía. Los síntomas incluyen dolor abdominal, diarrea y sangrado.
Diverticulitis aguda / Sigmoiditis
Inflamación aguda de los divertículos. A su vez se puede clasificarse en complicada (perforación libre, fístula, oclusión intestinal, abscesos, sepsis) y no complicada.
DIAGNÓSTICO DE LA ENFERMEDAD DIVERTICULAR
En la mayoría de los casos la enfermedad diverticular no da síntomas excepto cuando presenta una de sus complicaciones (Inflamación, Obstrucción, Hemorragia, Fistula, Perforación). De acuerdo a distintas estadísticas las manifestaciones clínicas se presentan en un 20-30% de los pacientes con divertículos colónicos.
Colon por enema
Nos permite el examen de toda la extensión del colon incluso hacia proximal a una estenosis. Las desventajas del mismo son que es un estudio de larga duración, alta exposición a la radiación, no generando aceptación por parte de los pacientes además de no evaluar el componente extramural y a distancia. Idealmente habría que realizarlo con contraste hidrosoluble a baja presión para evitar complicaciones. No es aconsejable realizarlo durante un evento agudo.
Colonoscopía virtual tomográfica
Es un estudio que nos permite un análisis visual de todo el colon y realizar un score de severidad específico para la enfermedad diverticular que puede influenciar en la toma de decisiones terapéuticas. Es muy aconsejable en casos donde la videocolonoscopía no es completa, ha fallado o no es viable como en un dolor abdominal agudo. La desventaja es que no nos informaría la magnitud de la enfermedad por fuera de la luz colónica.
Tomografia computada
Es el gold standard en la enfermedad diverticular aguda, ya que nos permite diferenciar entre una enfermedad diverticular complicada y una no complicada. En dicho estudio se puede clasificar la diverticulitis en los distintos tipos de HINCHEY, los cuales influenciarán directamente en la conducta terapéutica.
Sirve para guiarnos en un drenaje percutáneo de colecciones y para el seguimiento posterior. Nos permite visualizar el engrosamiento de la pared colónica, la presencia de divertículos, el engrosamiento de la grasa pericólica, aire libre o intramural, trayecto contrastado intramural, abscesos pericólicos y líquido libre en cavidad abdominal.
Ultrasonido
Puede ser utilizado en el diagnóstico, es libre de radiación, pero su sensibilidad es operador dependiente. Con operadores con experiencia y equipos de alta calidad se lograría una sensibilidad y especificidad similar a la tomografía axial computada.
Los hallazgos principales son: engrosamiento de la pared e hiperecogenicidad del colon por inflamación; también se la realiza para excluir patología pélvica o ginecológica. La principal desventaja es que no diferencia entre enfermedad de Crohn, carcinoma, linfoma o diverticulitis aguda.
Según Lembcke, Frankfurt, Strobel, Erlangen, Dirks y Winnenden: “US is considered the first choice of imaging in diverticular disease. Vice versa, CT has definite indications in unclear / discrepant situations – or insuficient US-performance.” 2
In the hand of experienced ultrasonographers sensitivity and specificity of US are 98 %, and direct visualization of the inflamed diverticulum amounts to 96 % in uncomplicated diverticulitis, – but it is more difficult if complications dominate (77 %, specificity 99 %) (…) The German Guideline fosters the development that this diagnostic gap can definitely be closed by qualified ultrasonography (…) Because in Germany legal radiation protection applies according § 23(1) RöV from 2011, radiology is only allowed, “if a justifying indication applies. Subsequently, long in the shade of CT, US has entered the pole position for imaging diverticulitis (…) In the case of conflicting results (e.g. disparate to the clinical impression) CT is regarded a valuable complementary method.3
En dichas citas podemos inferir que según las guías alemanas el estudio de elección para el diagnóstico y posterior seguimiento de la diverticulitis es la ecografía abdominal, debido a que obtienen similares resultados con respecto a la sensibilidad y especificidad comparándola con la tomografía axial computada, dejando a ésta para utilizar solamente en casos en los que haya una discrepancia clínica, o bien una ecografía insuficiente o que aún deja sospechas.
Videocolonoscopía
Es la herramienta principal para el diagnóstico y control de la enfermedad diverticular. Está contraindicada en procesos abdominales agudos, por lo que quedaría limitado su uso para screening o seguimiento de la enfermedad.
TRATAMIENTO DE LA ENFERMEDAD DIVERTICULAR
A continuación, describiremos las distintas opciones terapéuticas a evaluar en la enfermedad diverticular en base a una serie de estudios en los cuales se toman diferentes parámetros.
Enfermedad diverticular sintomática no complicada
Se detallan algunas de las medidas que podrían tenerse en cuenta para alivianar el dolor abdominal, disminuir el riesgo de diverticulitis o bien la recurrencia de la misma. Su eficacia no estaría demostrada certeramente.
- Fibra: Acorde a las guías el primer tratamiento consta de una dieta con alto contenido de fibras, asociado a espasmolíticos lo cual ayudaría a los movimientos peristálticos y disminuyendo así la presión intraluminal.
- Mesalazina: El mecanismo de acción no estaría aún claro, pero actuaría a nivel del epitelio intestinal inhibiendo la cascada proinflamatoria (cyclo-oxygenase, thromboxane-synthetase and PAF- synthetase), actuando como un antiinflamatorio. También inhibiría la interleuquina 1 y los radicales libres actuando, así como un antioxidante.
- Probióticos: La fisiopatología de los mismos es inhibir la adherencia de los patógenos, aumentar la liberación de IGA en las placas de peyer, aumentar la actividad del sistema inmune inhibiendo la liberación de citoquinas proinflamatorias y estimulando las antiinflamatorias. La manipulación de la flora colónica puede ser utilizada en el control de la inflamación y asimismo en el control de los síntomas en los pacientes.
- Rifaximina: Es un antibiótico derivado semisintético de la rifampicina. Se administra por vía oral y tiene la propiedad de presentar una absorción prácticamente nula. Su mecanismo de acción consiste en inhibir la síntesis del ARN bacteriano, dificultando de esta forma la multiplicación del agente infeccioso.
Diverticulitis aguda
En la mayoría de los casos se presenta de manera leve (Hinchey 1a), siendo el tratamiento de la misma de manera ambulatoria indicándose antibioticoterapia (Ciprofloxacina en conjunto con metronidazol de primera línea) durante 7/10 días y dieta con líquidos claros.
Pacientes que no toleran la vía oral, que por sus comorbilidades o por diversos motivos no estarían aptos para el manejo ambulatorio (inmunosuprimidos, entorno familiar, cercanía al centro de control) o ante la presencia de un cuadro de diverticulitis complicada requerirán internación y tratamiento endovenoso.
A continuación, se muestra una tabla con la clasificación para la enfermedad diverticular aguda: Hinchey con su clasificación original, la modificación de Wasvary, Ambrosseti y Dharmarajan basadas en los hallazgos tomográficos.
- En tipo 0 una dieta rica en fibras y verduras prevendría la ocurrencia de la diverticulitis. Además, el bienestar físico y un índice de masa corporal dentro de los valores normales sería beneficioso. Siempre se darán pautas de alarma.
- En tipo 1a (Diverticulitis no complicada) para aquellos pacientes que se presentan sin dolor abdominal severo, sin fiebre mayor a 38 grados, con tolerancia a la vía oral, estaría indicada dieta con líquidos claros y antibióticos vía oral (Ciprofloxacina-metronidazol) ajustándose en los casos de alteración renal. El dolor abdominal podría tratarse con espasmolíticos y medicación analgésica. Se lo citará a control en las siguientes 24/48 horas y se darán pautas de alarma.
En casos de inmunosupresión o comorbilidades se recomienda hospitalización para tratamiento antibiótico endovenoso. - En tipo 1b (Diverticulitis con flemón peridiverticular) o 2a (Absceso menor a 4 cm) se indicaría tratamiento antibiótico, principalmente en pacientes con la presencia de leucocitosis, fiebre mayor a 38,5 grados y proteína c reactiva elevada. La primera opción sería ciprofloxacina junto con metronidazol seguida por ampicilina - sulbactam. Se indicaría internación para tratamiento endovenoso, reposo digestivo y colocación de sonda nasogástrica en el caso de distensión abdominal, náuseas y vómitos.
- En tipo 2 debería de quedar hospitalizado según las guías de referencia. Se indica tratamiento antibiótico preferentemente vía oral salvo que no pueda ser tolerado y se optaría por el endovenoso. Solamente se indicaría la cirugía en los casos en los que no haya buena respuesta por parte del paciente. Considerándose falta de respuesta al incremento de los signos de sepsis a pesar del doble tratamiento antibiótico con drenaje percutáneo en el caso que lo requiera.
Si la respuesta es satisfactoria debería considerarse la cirugía analizando caso por caso luego de un periodo libre de inflamación.
En el caso de abscesos retroperitoneales o paracólicos debería realizarse drenaje percutáneo, si son muy pequeños, no punzables, se realizará el control de los síntomas manteniendo el tratamiento conservador con antibiótico endovenoso. - Abscesos mayores a 4 cm (2b) Se indica drenaje percutáaneo además de tratamiento antibiótico, mientras que cuando son menores de 4 cm se resolvería únicamente con tratamiento antibiótico. Tomamos como valor corte del absceso en 4 cm, pero en la literatura se evalúa dicho límite, pudiéndose encontrar como valor de corte entre 3 a 6,5 cm. Hay ciertos predictores de falla del Drenaje percutáneo, como colección residual, inmunodeficiencias, insuficiencia renal, abscesos menores a 5 cm. Su efectividad en colecciones de 5 cm o más ronda de 74 - 94%.

Figura 3. Clasificación de la enfermedad diverticular aguda. Anne F. Peery. (2016). Recent Advances in Diverticular Disease. Curr Gastroenterol Rep, [Tabla] 18, 37.
En Hinchey I y II sin repuesta al tratamiento médico deberá realizarse cirugía.
En peritonitis purulenta o fecal (Tipo III/IV) se realizará cirugía de urgencia luego del diagnóstico sin diferir la conducta. El debate actual gira alrededor de si se realizará una operación de Hartmann (OH), una resección con anastomosis primaria con/sin ostomía de protección (RAP) o bien lavado y drenaje de cavidad abdominal (LDC) laparoscópico.
En Minimally Invasive Management of Complicated Diverticular Disease: Current Status and Review of Literature los autores sostienen: ”As per the guidelines of standards committee of American Society of Colon and Rectal Surgeons, urgent surgery is performed in patients of acute diverticulitis with sepsis and diffuse peritonitis or those who fail to improve despite medical therapy and/or percutaneous drainage”.4 Dicha cita nos afirma que en las diverticulitis Hinchey III, IV y ante la falta de respuesta al tratamiento médico debemos realizar cirugía de urgencia.
Influencian la severidad de la enfermedad, la condición del intestino donde vamos a realizar la anastomosis (Vascularización, inflamación), las condiciones clínicas del paciente (Estado nutricional y comorbilidades) y la experiencia del equipo quirúrgico.
Es importante diferenciar el paciente que se encuentra en shock séptico del que no, para eso se deberán evaluar los siguientes signos: temperatura corporal menor a 36 o mayor a 38 grados, ritmo cardíaco mayor a 90 latidos por minuto, leucocitosis o leucopenia, taquipnea y Paco2 menor a 4. En estos casos se requerirá de una optimización preoperatoria que se basará en la infusión de antibiótico y solución cristaloide isotónica endovenosa, colocación de una vía central manteniendo la presión venosa entre 8 y 12 mmhg, intubación para respiración mecánica asistida, mantención de la presión arterial por arriba de 65 mmhg de diastólica, corrección de electrolitos y medio interno y hematocrito mayor a 30%. Se debe revaluar al paciente a las 2/3 horas.
La OH fue considerada durante mucho tiempo el gold standard para la diverticulitis con peritonitis y todavía se utiliza a pesar de las altas tasas de morbilidad y mortalidad. La continuidad intestinal solo se realizará en el 20-50% debido a los altos riesgos operativos en la segunda cirugía. Sin embargo, se justifica por el hecho que elimina el sector intestinal contaminado y evita la posible dehiscencia anastomótica con la posterior contaminación abdominal. Dentro de sus desventajas podemos nombrar la alta morbilidad por la propia colostomía con sus complicaciones y posterior reconstrucción intestinal, la dehiscencia del muñón, y una mayor probabilidad de infección de la herida quirúrgica. Debe considerarse en pacientes ancianos o inestables (shock séptico) con comorbilidades graves reduciéndose el tiempo quirúrgico y la contaminación abdominal.
La RAP debe realizarse siempre que pueda llevarse a cabo debido a que se restablece el tránsito intestinal en el mismo acto quirúrgico disminuyendo la tasa de morbimortalidad y evitando una segunda intervención quirúrgica lo que implica mayores costos y riesgos operativos. Se debe contemplar el estado general del paciente, la condición local del colon y la experiencia del equipo quirúrgico. La complicación más seria de la RAP es la dehiscencia anastomótica, por lo que se debe considerar la defuncionalización para reducir el riesgo de la misma.
La American Society of Colon and Rectal surgeons describe ciertos factores a tener en cuenta para la elección de una realización de RAP vs. OH, encontrando predictores fuertes para la realización de una cirugía no reconstructiva como: IMC mayor a 30, Mannheim peritonitis index mayor a 10 (VER ANEXO), inmunosupresión y Hinchey III/IV. También debe de tenerse en cuenta la inestabilidad hemodinámica, la acidosis, falla aguda de órgano y comorbilidades como la diabetes y la falla crónica de órganos.
El LDC consta de un lavado laparoscópico de la cavidad abdominal con la colocación de drenajes además de la administración endovenosa de antibióticos. Dentro de sus ventajas reduce el riesgo que genera una resección de colon en una situación aguda, síntomas dolorosos, evita un ostoma, mejora rápidamente la condición clínica del paciente y disminuye la estadía hospitalaria. Nos permite diferir la resección intestinal pudiendo utilizar un procedimiento mínimamente invasivo reduciendo la morbimortalidad (infección de herida quirúrgica, dehiscencia anastomótica) de un procedimiento de urgencia. Los mejores resultados se obtienen en el tipo III donde no encontramos una perforación visible al acto operatorio. Es una variante atractiva a realizar en aquellos pacientes que no tienen una buena respuesta al tratamiento conservador ya que disminuyen significativamente las morbimortalidades que nos dan los procedimientos resectivos. La desventaja es que deja el foco séptico, y a su vez la posibilidad de recurrencia por lo que estaría contraindicado realizarlo en aquellos pacientes donde la sepsis esté generada principalmente por el segmento colónico afectado.
"So far, studies suggest that peritoneal lavage is suitable only for purulent peritonitis (Hinchey III). In cases where perforation is identified, the patient requires some form of resection."5
Debido a la falta de literatura prospectiva y de indicaciones precisas para dicho método surge una alta tasa de variables en la literatura, ya que se hace difícil la comparación de los pacientes que se utilizan en dichos estudios debido a la alta variabilidad de los mismos.
En Hinchey III/IV se recomienda realizar ostoma de protección en caso de RAP.
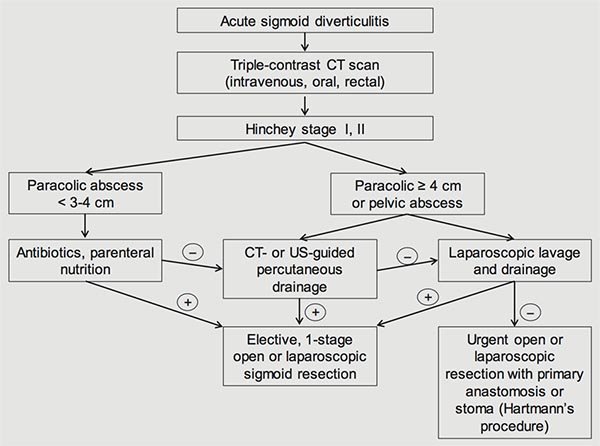
Figura 4. Manejo de la enfermedad diverticular aguda. Ferdinand Köckerling. (2015). Emergency Surgery for Acute Complicated Diverticulitis. Viszeralmedizin [Figura] 31, 107–110.
¿Se recomienda cirugía electiva para la enfermedad diverticular?
En los años 90 la American Society of Colon and Rectal Surgeons (ASCRS), the European Association for Endoscopic Surgery (EAES) and the American College of Gastroenterology (ACG) estaban de acuerdo con la sigmoidectomía profiláctica luego de 2 episodios de diverticulitis aguda o bien un episodio en un paciente con menos de 50 años basado en estudios de Parks y Farmakis quienes sugerían que el próximo episodio de diverticulitis aguda sería más severo y con menos respuesta al tratamiento médico aumentando casi a un 60% su mortalidad. Actualmente diferentes estudios demostraron que lo dicho anteriormente carece de evidencia, adoptándose una alternativa más prudente y evaluando caso por caso en particular para la toma de decisiones. Se demostró que las complicaciones severas de la enfermedad diverticular como las perforaciones colónicas se dan en el primer episodio de diverticulitis. En conclusión, no debería de tenerse en cuenta la cantidad de episodios de diverticulitis previa para la toma de decisiones quirúrgicas. Además, la sigmoidectomía no protege completamente la recurrencia de la enfermedad y está asociada en un 20% a complicaciones como pueden ser la urgencia e incontinencia fecal, y el vaciamiento rectal incompleto.
Se deberá considerar la cirugía electiva teniendo en cuenta el número y severidad de los episodios, edad, comorbilidades o factores de riesgo, intervalo entre episodios, la persistencia de síntomas en esos intervalos, y cuando se altera la calidad de vida e inmunosuprimidos.
En el artículo Elective Surgery for Sigmoid Diverticulitis – Indications, Techniques, and Results sus autores advierten:
More recent data show that an increase in the number of episodes is not associated with an increase in septic complications [12, 37–39]. Perforations, which may require emergency surgery, generally occur as a primary event and/or after the first episode of the disease [40]; thus, surgical prophylaxis cannot be achieved after the second episode [41]. Such emergency procedures, however, have a major influence on morbidity and mortality, as Ritz et al. [40] showed in a cohort of over 900 patients (…) On the whole, however, resections performed in the inflammation- free period (6–8 weeks after onset) yield better results than ‘early elective’ procedures [21], appearing to have lower rates of anastomotic leakage, wound infection, and conversions to open surgery.6
Esta cita hace referencia a que para realizar una cirugía de tipo electiva habría que esperar al menos 6 a 8 semanas luego de la inflamación aguda, ya que disminuiría las complicaciones.
CONCLUSIONES
La enfermedad diverticular o diverticulosis es una patología del colon con una alta incidencia en la población general, que ha aumentado con el pasar de los años, ya sea por el avance y la disposición en los métodos diagnósticos o bien por el cambio del hábito dietario en la población global, favoreciendo así su ocurrencia.
Para poder enfocarnos en el tratamiento se debe saber diferenciar entre una enfermedad diverticular no complicada y la diverticulitis aguda con sus complicaciones. Para ello podemos contar con distintos métodos diagnósticos que incluyen desde el interrogatorio, el examen semiológico, y el examen de sangre hasta métodos complementarios de imágenes como los descriptos anteriormente.
Una vez diagnosticada la diverticulitis aguda debemos en un principio diferenciar aquellos pacientes que podrían tratarse ambulatoriamente con tratamiento médico y control estricto, de aquellos que requerirán internación, ya sea para tratamiento médico endovenoso acompañado o no de un procedimiento mínimamente invasivo como es el drenaje percutáneo o bien la conducta quirúrgica. A su vez, con respecto a esta conducta quirúrgica, y teniendo en cuenta cada caso particular, debemos seleccionar qué procedimiento utilizaremos (Operación de Hartmann; Resección con anastomosis primaria con o sin ostomía de protección o bien lavado de cavidad abdominal laparoscópico).
Para dicha elección nos debemos basar principalmente en la clasificación tomográfica de HINCHEY que divide la diverticulitis aguda en 4 tipos principales.
En los tipos I y II, en un principio, no se requeriría un procedimiento quirúrgico mayor, siendo el tratamiento médico lo primordial. En el tipo Ia el paciente no precisará internación y se manejará de manera ambulatoria, mientras que en los tipos Ib y II se indicará internación para control y tratamiento antibiótico endovenoso. Cuando encontramos abscesos mayores a 5 cm además deberá realizarse un drenaje percutáneo del mismo.
Tanto en los tipos III como IV, y ante la falta de respuesta al tratamiento instaurado en los I y II, deberá realizarse un procedimiento quirúrgico mayor que puede ser la Operación de Hartmann, la resección con anastomosis primaria con o sin ostomía de protección y el lavado drenaje laparoscópico de la cavidad abdominal.
Con respecto a estos procedimientos está demostrado que la anastomosis primaria en los pacientes operados tiene menor tasa de morbimortalidad, evitando todos los problemas operativos que se llevarían a cabo en una segunda cirugía de una reconstrucción del tránsito intestinal de un Hartmann previo. Con respecto a la realización o no de ostomía de protección se puede dilucidar que es altamente beneficioso la realización de la misma, ya sea para evitar las complicaciones como la dehiscencia anastomótica (peritonitis fecal) y disminuir la estadía hospitalaria.
Para poder elegir el procedimiento quirúrgico indicado en cada paciente, hay que evaluar particularmente cada caso, teniendo en cuenta el estado nutricional y hemodinámico del paciente en conjunto con sus comorbilidades, la presencia o no de un cuadro séptico, el hallazgo quirúrgico (Vascularización y estado macroscópico de sectores en donde se realizará la anastomosis) y la experiencia propia de cada equipo quirúrgico.
El lavado y drenaje de la cavidad abdominal laparoscópico estaría indicado para casos particulares en los tipos III en los que no evidenciamos una perforación clara en el acto operatorio. Podría ser una solución en aquellos pacientes en el que el shock séptico no dependa del estado del colon sino de su repercusión sistémica que genero el mismo ya que, si así lo fuera, en dicho procedimiento se dejaría el foco séptico sin obtener buenos resultados. O bien podría realizarse en aquellos pacientes que estén en un mal estado general que no soportarían una cirugía mayor en una primera instancia. En estos casos se realizará un control de daños con el fin de estabilizar el estado general del paciente para luego sí proceder a realizar una cirugía definitiva. Como mencione anteriormente la falta de literatura prospectiva y de indicaciones precisas para dicho método surge una alta tasa de variables en la literatura, ya que se hace difícil la comparación de los pacientes que se utilizan en dichos estudios debido a la alta variabilidad de los mismos.
BIBLIOGRAFÍA
- Tursi A., Diverticulosis today: unfashionable and still under-researched. Therapeutic Advances in Gastroenterology. 2016; 9(2): 213–228.
- Lembcke B, J; Frankfurt / M; Strobel D, Erlangen; Dirks K, Winnenden; Ultrasound Obtains Pole Position for Clinical Imaging in Acute Diverticulitis. DEGUM-Mitteilungen;2015: 30, 191-195.
- Ibíd.
- Kaushik M., Bhullar J. S., Bindroo S, (2015), Minimally Invasive Management of Complicated Diverticular Disease: Current Status and Review of Literature, DOI 10.1007: p6.
- Ibíd, p. 8
- Jurowich C., Germer C., Elective Surgery for Sigmoid Diverticulitis – Indications, Techniques, and Results. Viszeralmedizin, 2015; 31: 112–116.
- Sibilla Focchi, Alberto Carrara, Ettore Contessini Avesani. (2015). Advances in management of patients with acute diverticulitis. Journal Of acute disease, 4(4), 280-286.
- Daniel Feingold, Scott R. Steele, Sang Lee. (2014). Practice Parameters for the Treatment of Sigmoid Diverticulitis. Diseases of the colon and rectum, 57, 285-294.
- Maxime Barat, Anthony Dohan, Karine Pautrat. (2016). Acute colonic diverticulitis: an update on clinical classification and management with MDCT correlation. Abdominal Radiology, 10.1007, s00261-016-0764-1.
- Leifeld L, Germer CT,. Böhm S, Dumoulin FL, Häuser W, Kreis M, Labenz J, Lembcke B, Post S, Reinshagen M, Ritz J-P, Sauerbruch T, We- del T, von Rahden B, Kruis W. S2k-Leitlinie Divertikelkrankheit/Divertikulitis. S2k Gui- delines Diverticular Disease/Diverticulitis. DOI http://dx.doi. org/10.1055/s-0034-1366692. Z Gastroen- terol 2014; 52: 663–710
- Antonio Tursi. (2016). Diverticulosis today: unfashionable and still under-researched. Therapeutic Advances in Gastroenterology, 9(2), 213–228.
- G. A. Binda, R. Cuomo, A. Laghi. (2015). Practice parameters for the treatment of colonic diverticular disease: Italian Society of Colon and Rectal Surgery (SICCR) guidelines. Tech Coloproctol, DOI 10.1007, s10151-015-1370-x.
- Antonello Forgione, Salman Yousuf Guraya. (2015). Elective colonic resection after acute diverticulitis improves quality of life, intestinal symptoms and functional outcome: experts’ perspectives and review of literature. Updates Surg, DOI 10.1007, s13304-016-0349-0.
- Manu Kaushik, Jasneet Singh Bhullar, Sandiya Bindroo. (2015). Minimally Invasive Management of Complicated Diverticular Disease: Current Status and Review of Literature. Dig Dis Sci, DOI 10.1007, s10620-015-3924-1.
- B. Lembcke. (2015). Ultrasonography in acute diverticulitis – credit where credit is due. Z Gastroenterol, 54, 47–57.
- Anne F. Peery. (2016). Recent Advances in Diverticular Disease. Curr Gastroenterol Rep, 18, 37.
- John Simpson. (2004). Recent Advances in Diverticular Disease. Current Gastroenterology Reports, 6, 417–422.
- Stephan K. Böhm. (2015). Risk Factors for Diverticulosis, Diverticulitis, Diverticular Perforation, and Bleeding: A Plea for More Subtle History Taking. Viszeralmedizin, 31, 84–94.
- Bernhard Lembcke. (2015). Diagnosis, Differential Diagnoses, and Classification of Diverticular Disease. Viszeralmedizin , 31, 95–102.
- Elena Kruse, Ludger Leifeld. (2015). Prevention and Conservative Therapy of Diverticular Disease. Viszeralmedizin, 31, 103–106.
- Christian F. Jurowich, Christoph T. Germer. (2015). Elective Surgery for Sigmoid Diverticulitis – Indications, Techniques, and Results. Viszeralmedizin, 31, 112–116.
- Christoph Holmer, Martin E. Kreis. (2015). Management of Complications Following Emergency and Elective Surgery for Diverticulitis. Viszeralmedizin, 31, 118–123.
- Walter Eliseia, Antonio Tursib. (2016). Recent advances in the treatment of colonic diverticular disease and prevention of acute diverticulitis. Annals of Gastroenterology, 29, 24-32.
- Marja A. Boermeester, David J. Humes, George C. Velmahos. (2016). Contemporary Review of Risk-Stratified Management in Acute Uncomplicated and Complicated Diverticulitis. World J Surg, DOI 10.1007, s00268-016-3560-8.
- Antonio Tursi. (2015). New medical strategies for the management of acute diverticulitis. Expert Rev. Gastroenterol. Hepatol., Early online, 1–12.
- Ferdinand Köckerling. (2015). Emergency Surgery for Acute Complicated Diverticulitis. Viszeralmedizin, 31, 107–110.
- Dharmarajan S, Hunt SR, Birnbaum EH, Fleshman JW, Mutch MG: The efficacy of nonoperative manage- ment of acute complicated diverticulitis. Dis Colon Rectum 2011;54:663–671.
- Wilkins T, Embry K, George R (2013) Diagnosis and management of acute diverticulitis. Am Fam Physician 87:612–620
- Bugiantella W, Rondelli F, Longaroni M, Mariani E, Sanguinetti A, Avenia N (2015) Left colon acute diverticulitis: an update on diagnosis, treatment and prevention. Int J Surg 13:157–164.
- Hall JF, Roberts PL, Ricciardi R, Read T, Scheirey C, Wald C, et al. Long-term follow- up after an initial episode of diverticulitis: what are the predictors of recurrence? Dis Colon Rectum. 2011;54(3): 283–8.
- Vennix S, Morton DG, Hahnloser D et al (2014) Systematic review of evidence and consensus on diverticulitis: an analysis of national and international guidelines. Colorectal Dis 16(11): 866–878.
- Leifeld L, Germer CT, Bohm S et al (2014) S2 k guidelines diverticular disease/ diverticulitis. Z Gastroenterol 52(7):663–710.
- Biondo S, Golda T, Kreisler E et al (2014) Outpatient versus hospitalization management for uncomplicated diverticulitis: a prospective, multicenter randomized clinical trial (DIVER Trial). Ann Surg 259(1):38–44.
- Tursi A, Papagrigoriadis S. Review article: the current and evolving treatment of colonic diverticular disease. Aliment Pharmacol Ther 2009;30:532-46.
- Muralidar V, Madhu C, Sudhir. (Dec 05, 2014). Ef cacy of Mannheim Peritonitis Index (MPI) Score in Patients with Secondary Peritonitis. jcdr, Vol-8(12), 1-3.
- Townsend C, Beauchamp D, Evers M, Mattox K. (2009). Colon y recto. En Sabiston tratado de cirugia (1348-1432). España: Elsevier Saunders.
- Gordon PH, Nivatvongs S [eds]: Principles and practice of surgery for the colon, rectum and anus, ed 2, St Louis, 1999, Quality Medical Publishing, p 23.
- Gordon PH, Nivatvongs S [eds]: Principles and practice of surgery for the colon, rectum and anus, ed 2, St Louis, 1999, Quality Medical Publishing, p 26.
- Lembcke B, J; Frankfurt / M; Strobel D, Erlangen; Dirks K, Winnenden;. (2015). Ultrasound Obtains Pole Position for Clinical Imaging in Acute Diverticulitis. DEGUM- Mitteilungen, 30, 191-195.
Anexo

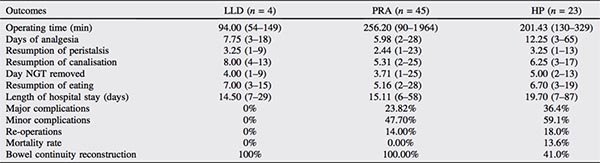
Comparación de alternativas quirúrgicas. Sibilla Focchi, Alberto Carrara, Ettore Contessini Avesani. (2015). Advances in management of patients with acute diverticulitis.
Algoritmo en el manejo de la diverticulitis aguda. Antonio Tursi. (2015). New medical strategies for the management of acute diverticulitis. Expert Rev. Gastroenterol. Hepatol., Early online: 9.
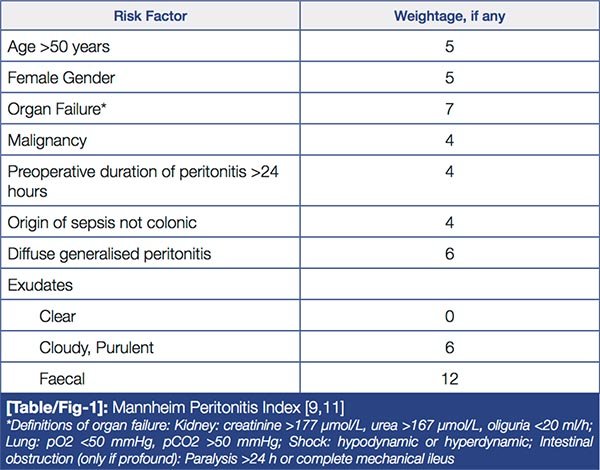
Mannheim peritonitis index. Muralidar V, Madhu C, Sudhir. (Dec 05, 2014). Eficacy of Mannheim Peritonitis Index (MPI) Score in Patients with Secondary Peritonitis. jcdr,
Vol-8(12), 1-3.
