Respuesta al Tratamiento Neoadyuvante con Capecitabine y Radioterapia en el Cáncer de Recto Inferior Localmente Avanzado
Cristian Rodriguez, Julio Lococo, Mauricio Fantozzi, Pablo Vecchio, José Lucena, Juan Tricarico, Alejandro Usqueda, Hernan Penzi,
Bruno Calarota, Luis Pedro, Vicente Dezanzo
Complejo Médico Hospitalario Churruca-Visca, C.A.B.A., Argentina
Cristian Rodriguez
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
Los autores declaran no tener ningún conflicto de interés.
RESUMEN
Introducción: La importancia del tratamiento neoadyuvante con quimio y radioterapia en el manejo de los tumores de recto extraperitoneal localmente avanzado ha quedado claramente demostrada. La droga que ha sido históricamente más utilizada para este fin fue el 5-Fluorouracilo (5-FU). Una nueva molécula de administración por vía oral, la prodroga capecitabine, ha reemplazado al 5-FU en el tratamiento neoadyuvante en los últimos tiempos, con mejores resultados y mayor comodidad.
Objetivo: Valorar la eficacia, toxicidad y complicaciones del tratamiento neoadyuvante con capecitabine más radioterapia en el tratamiento del cáncer de recto extraperitoneal localmente avanzado.
Diseño: Estudio observacional, descriptivo, retrospectivo.
Población y Métodos: Se incluyeron 33 pacientes (66% de sexo masculino) con tumores de recto extraperitoneal localmente avanzado (cT3/cT4 o cN+) con indicación de neoadyuvancia. La dosis de radioterapia fue de 45 Gy más un boost de 5,04 Gy administradas en 25 sesiones durante un período de 5 semanas. La dosis de capecitabine fue de 850 mg/m2, dos veces al día durante los días en que se administraba la radioterapia. Se reevaluó a los pacientes entre la 8º y 10º semana. Aquellos pacientes con respuesta clínica completa (RCC) se les ofreció ingresar al protocolo de Watch & Wait, mientras que aquellos pacientes con respuesta clínica incompleta o nula se les indicó la resección quirúrgica entre las 10-12 semanas post-tratamiento neoadyuvante.
Resultados: 10 pacientes (30,3%) tuvieron respuesta clínica completa (RCC). De estos, 7 entraron a protocolo Watch & Wait. Se operaron 26 pacientes, luego de un promedio de 11,71 semanas posteriores a la neoadyuvancia, siguiendo en todos los casos la técnica de excisión total del mesorrecto. Se observó un 19,3% de RPC y un downstaging del 57,69%. A dieciséis pacientes (61,53%) se les efectuó una resección anterior ultrabaja con ostomía de protección. Nueve pacientes fueron sometidos a una amputación abdominoperineal (34,61%) y una paciente recibió una operación de Hartmann (3,84%). El principal efecto adverso fue la diarrea grado I en el 36% de los casos, seguida por la dermatitis grado I en el 33%. Tuvimos dos dehiscencias anastomóticas que se resolvieron sin reintervención.
Conclusiones: El tratamiento neoadyuvante con capecitabine es una opción segura, con alta tasa de respuesta clínica y patológica completa, con escasa toxicidad y complicaciones, y el beneficio de la comodidad de su administración por vía oral.
Palabras claves: Tumor de Recto; Capecitabine; Neoadyuvancia; Radioterapia; Quimioterapia
ABSTRACT
Background: The importance of neoadjuvant chemotherapy and radiation therapy in the management of extraperitoneal rectal tumors locally advanced has been clearly demonstrated. The drug has been historically used for this purpose was 5-fluorouracil (5-FU). A new molecule oral administration, the prodrug capecitabine, has replaced the 5-FU in the neoadjuvant treatment in recent times, with better results and greater comfort.
Objective: To evaluate the efficacy, toxicity and complications of neoadjuvant capecitabine plus radiation therapy in the treatment of locally advanced rectal cancer extraperitoneal.
Design: Observational, descriptive, retrospective study.
Population and Methods: 33 patients (66% male) with extraperitoneal rectal tumors locally advanced (cT3 / cT4 or cN +) with indication of neoadjuvant were included. Radiation dose was 45 Gy plus a boost of 5.04 Gy administered in 25 sessions over a period of 5 weeks. Capecitabine dose was 850 mg / m2 twice daily on days that radiotherapy was administered. It was reevaluated patients between the 8th and 10th week. Patients with clinical complete response (CCR) were offered to enter the protocol Watch & Wait, while patients with incomplete or no clinical response were instructed surgical resection neoadjuvant between 10-12 weeks post-treatment.
Results: 10 patients (30.3%) had clinical complete response (CCR). Of these, seven entered Watch & Wait protocol. 26 patients were operated after a mean time of 11,71 weeks (range 10-15), in all cases following the total mesorectal excision technique. 19.3% of RPC and downstaging of 57.69% was observed. Sixteen patients (61.53%) were made ultra-low anterior resection with protective stoma. Nine patients underwent an AP amputation (34.61%) and one patient received a Hartmann operation (3.84%). The main side effect was diarrhea grade I in 36% of cases, followed by the degree I dermatitis in 33%. We had two anastomotic dehiscences which resolved without reoperation.
Conclusions: Neoadjuvant capecitabine therapy is a safe choice, with high rate of complete clinical and pathological response with low toxicity and complications, and the benefit from the comfort of oral administration.
Keywords: Rectal Cancer; Capecitabine; Neoadjuvant; Radiotherapy; Chemotherapy
INTRODUCCIÓN
Aún con la mejoría de los detalles técnicos en la disección de las fascias rectales para el tratamiento del cáncer de recto, aquellos pacientes que desarrollan estos tumores y fundamentalmente los que se localizan en el recto inferior, están expuestos a una mayor probabilidad de recurrencia local con el tratamiento quirúrgico como único recurso.1
El tratamiento neoadyuvante con radio y quimioterapia ha logrado una clara disminución en las tasas de recurrencia local de estos tumores, con un índice de efectividad superior y una menor toxicidad en comparación con la radioterapia postoperatoria.2
Es por este motivo que la radioquimioterapia neoadyuvante se ha posicionado como el tratamiento estándar en el manejo del cáncer de recto extraperitoneal localmente avanzado.
El agente quimioterápico en la neoadyuvancia del cáncer de recto que ha sido por muchos años el más utilizado es el 5-fluorouracilo (5-FU). Su corta vida media, el requerimiento de colocación de una vía central y sus potenciales complicaciones, han conducido a la búsqueda de drogas de administración oral para su reemplazo.3
El capecitabine es una nueva molécula de reciente lanzamiento en el mercado como agente quimioterápico de administración oral. Se trata de una fluoropirimidina diseñada para transformarse luego de su absorción en 5-FU a nivel de las células tumorales.4,5
Se presenta la experiencia del tratamiento neoadyuvante con quimio y radioterapia con capecitabine en pacientes con cáncer de recto extraperitoneal localmente avanzado, valorando su eficacia y tolerancia. El objetivo primario de este estudio es valorar la tasa de respuesta de tratamiento neoadyuvante, y el objetivo secundario evaluar su tolerancia y complicaciones.
MATERIAL y MÉTODO
Estudio observacional, retrospectivo realizado sobre una base de datos prospectiva, de todos aquellos pacientes con tumores de recto extraperitoneal localmente avanzado, que recibieron tratamiento neoadyuvante con radioterapia y capecitabine, entre los meses de noviembre de 2011 y diciembre de 2014, en el Servicio de Coloproctología del Complejo Médico Hospitalario Churruca-Visca de la ciudad de Buenos Aires. Se explicó detalladamente las características del tratamiento a cada uno de los pacientes previo a firmar el consentimiento informado.
Criterios de Inclusión
- Pacientes mayores de 18 años.
- Diagnóstico confirmado por biopsia de adenocarcinoma de recto.
- Tumores de recto a menos de 9 cm del margen anal.
- T3-T4, o N+.
- Tumores con indicación de Amputación Abdominoperineal (Op. Miles).
- Performance Status <2 (ECOG).6
Criterios de Exclusión
- Embarazo o Lactancia.
- Metástasis a distancia.
- Radioterapia previa.
Evaluación Pre-tratamiento
Todos los pacientes fueron evaluados mediante un completo interrogatorio, examen clínico, proctológico, rectosigmoideoscopia rígida, laboratorio completo incluyendo marcadores tumorales (CEA y Ca 19.9), colonoscopía (en aquellos casos en que el tumor no era estenosante), tomografía de tórax, resonancia magnética de abdomen y pelvis de alta resolución.
Esquema de Quimio y Radioterapia
La dosis de capecitabine fue de 850 mg/m2, dos veces al día durante los días en que se administraba la radioterapia. La dosis de radioterapia fue de 45 Gy más un boost de 5,04 Gy administradas en 25 sesiones durante un período de 5 semanas. Dosis total de 5040 cGy.
Cirugía
Luego de finalizado el tratamiento neoadyuvante, todos los pacientes fueron re-evaluados y re-estadificados a las 8-10 semanas con iguales estudios que previo a la neoadyuvancia. Aquellos pacientes con RCC se les ofreció ingresar al protocolo de Watch & Wait,7,8 mientras que aquellos pacientes con respuesta clínica incompleta o nula se les indicó la resección quirúrgica entre las 10-12 semanas post-tratamiento neoadyuvante.
Complicaciones Postoperatorias y Toxicidad:
Se clasificaron las complicaciones en tempranas y tardías, en relación a si estas sucedían antes o después de los 30 días postoperatorios. Mientras que las toxicidades se evaluaron de acuerdo a la clasificación de National Cancer Institute Common Safety Criteria version 2.0.9
RESULTADOS
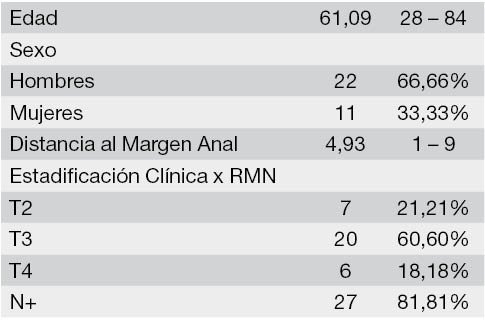
Se enrolaron 33 pacientes que cumplieron con los criterios de inclusión. La edad media fue de 61,09 años (IC 95% 56,30-65,87). El 66,66% (22/33) de los pacientes fueron de sexo masculino. La altura promedio de los tumores con relación al margen anal es 4,93 cm (IC 95% 4,17-6,70). Las características clínicas y demográficas son resumidas en la tabla 1.
Tabla 1: Características clínicas y demográficas
Respuesta Clínica
De los 33 pacientes, 10 (30,30%) tuvieron respuesta clínica completa (RCC) luego de la re-evaluación realizada entre las 8 y 10 semanas posteriores a la neoadyuvancia. De estos pacientes, 7 entraron en protocolo Watch & Wait, los 3 restantes fueron operados debido a la preferencia de los mismos.
Dos de los pacientes que no fueron operados presentaron recidiva local a los 12 y 18 meses post-QRT los cuales fueron rescatados quirúrgicamente. Los 5 pacientes restantes siguen bajo estricto seguimiento clínico.
Procedimientos Quirúrgicos
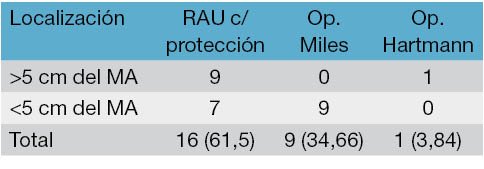
Se operaron 26 pacientes luego de un promedio de 11,71 (10-15) semanas posteriores a la neoadyuvancia, siguiendo en todos los casos la técnica de excisión total del mesorrecto descripta por Heald.10 A dieciséis pacientes (61,53%) se les efectuó una resección anterior ultrabaja con ostomía de protección. Nueve pacientes fueron sometidos a una amputación abdominoperineal (34,61%) y una paciente recibió una operación de Hartmann (3,84%). De los 16 pacientes con la localización del tumor inicial a menos de 5 cm del margen anal, 9 (56,2%) fueron sometidos a una amputación abdominoperineal y 7 (43,8%) a la realización de una resección anterior baja. Todos aquellos pacientes con una ubicación inicial del tumor a más de 5 cm del borde anal fueron sometidos a una resección anterior ultrabaja con colostomía en asa de protección, salvo en un caso, al que se le realizó una resección de Hartmann (Tabla 2).
Dentro de las complicaciones postoperatorias tempranas tuvimos 1 dehiscencia parcial de herida perineal, 1 absceso pelviano por fístula anastomótica que se drenó espontáneamente por vía anal, la misma evolucionó con estenosis a nivel de la sutura rectal y posteriormente fue tratada con dilatación digital.
Con respecto a las complicaciones tardías tuvimos 1 colección presacra por dehiscencia de anastomosis subclínica que fue manejada sin cirugía, 1 eventración paracolostómica y una estenosis anastomótica (previamente mencionada).
Tabla 2: Localización tumoral y tipo de cirugía
 >
>
Respuesta Patológica Completa
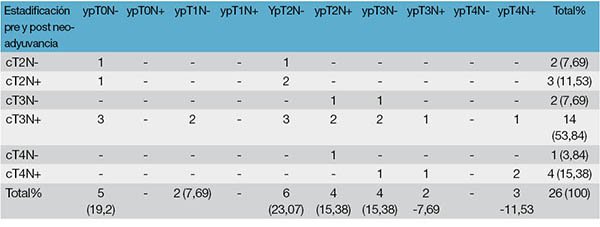
La respuesta patológica completa (RPC) de aquellos pacientes que fueron resecados quirúrgicamente luego de la neoadyuvancia fue del 19,23% (5/26). De ellos 3 (60%) habían tenido una RCC (grupo de pacientes que no quisieron ingresar al protocolo de Watch & Wait). Dos pacientes presentaron progreso en su estadio (7,69%). Adicionalmente, en 1 caso (3,84%) se halló un nicho de células tumorales aisladas en la grasa perirectal y se consideró como ypT3.
El downstaging se logró en el 57,69% de los casos. El promedio de ganglios resecados fue de 11,19 (rango 2-24). Se logró negativizar los ganglios en el 46,15% de los pacientes que fueron operados (Tabla 3).
Tabla 3: Comparación de estadio clínico con estadio patológico post neoadyuvancia
Seguimiento
Luego de una media de 22,34 (rango 6-35) meses de seguimiento, seis pacientes fallecieron (18,18%): 4 por progresión de enfermedad, 1 por causa cardiológica y otro por un tromboembolismo pulmonar.
Tuvimos 3 recidivas locales (9,09%), 2 de ellas del grupo de Watch & Wait a los a los 12 y 18 meses de finalizada la quimioradioterapia, los cuales fueron rescatados quirúrgicamente, aún todos con vida. Cuatro pacientes (12,12%) con recidiva a distancia (metástasis hepáticas y/o pulmonares), todos fallecidos.
Toxicidad
La radioterapia fue interrumpida en una paciente por fractura de fémur secundario a un traumatismo, pero continuó con el tratamiento quimioterápico, alcanzando luego de finalizar el mismo una respuesta clínica completa.
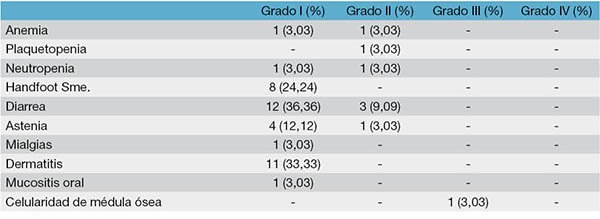
El principal efecto adverso fue la diarrea grado I en el 36% de los casos, seguida por la dermatitis grado I en el 33%.
Si bien en otras series el síndrome mano-pie es bastante frecuente, en nuestra serie fue solo del 24% pero solamente Grado I. El resto de los efectos adversos pueden verse en la tabla 4.
No tuvimos que interrumpir el tratamiento con capecitabine en ningún paciente. En 3 casos fue necesario disminuir la dosis por presentar diarrea grado II.
Un paciente perteneciente al grupo de RCC, presentó luego de 30 meses de seguimiento un cuadro de aplasia medular moderada, el cual evoluciona actualmente en forma satisfactoria.
Tabla 4: Toxicidades
DISCUSIÓN
El cáncer de recto extraperitoneal presenta la característica de una elevada tasa de recidiva local y a distancia.11 Por este motivo se han ensayado diferentes esquemas de tratamiento local complementario al tratamiento quirúrgico base de tratamiento definitivo. Desde la publicación de los resultados del German Rectal Cancer Study en el 2004, el tratamiento estándar para el cáncer de recto inferior localmente avanzado es la indicación preoperatoria de neoadyuvancia basada en 5-fluorouracilo (5-FU) + leucovorina asociado a radioterapia (5040 cGy), y posteriormente cirugía con escisión total del mesorrecto (ETM).12
A pesar de la importancia del 5-FU para el tratamiento del cáncer de recto extraperitoneal, su vida media corta y la necesidad de una vía central para infusiones continuas, ha llevado a los investigadores a diseñar una formulación oral de la droga. En junio de 2005, la Food and Drug Administration (FDA) aprueba la utilización de la prodroga capecitabine (fluoropirimidina vía oral) para el tratamiento del cáncer colorrectal estadio III.3
La incorporación en los últimos años de la prodroga quimioterápica capecitabine en el esquema de neoadyuvancia, no solo ha reemplazado al 5-FU endovenoso, tanto en infusión continua como en bolo, sino además mejorado la tolerancia y eficacia del tratamiento.13
Esto se debe a que la capecitabine presenta la ventaja que luego de su absorción a través del tracto digestivo, se convierte en 5-FU a través de tres reacciones enzimáticas secuenciales. La enzima final en esta transformación es la timidina fosforilasa (TP), la cual se encuentra en niveles muy elevados en el tejido tumoral. Además, la radioterapia induce un aumento de la TP (up-regulation) explicando de esta manera el efecto sinérgico de los mismos.3
En el presente estudio, se incluyeron 33 pacientes con diagnóstico de adenocarcinoma de recto extraperitoneal localmente avanzado a los cuales se les realizó radioquimioterapia neoadyuvante con 50.4 Gy y capecitabine 825 mg/m2 dos veces por día.
Con este esquema de tratamiento implementado se obtuvo un alto grado de eficacia, 22 pacientes tuvieron algún grado de respuesta clínica (66,6%), de los cuales 10 tuvieron respuesta clínica completa (30,3%). A su vez, la respuesta patológica completa fue del 19,23% y el downstaging de 57,19%. En dos de los casos observamos una suba del estadio (7,69%) lo cual creemos que se debe a una subestadificación de los métodos por imágenes, en este caso la resonancia magnética nuclear. Estos hallazgos son comparables con aquellos estudios preliminares de fase II donde uno de los principales objetivos era la eficacia del tratamiento neoadyuvante con esta droga14-18 (Tabla 5).
Tabla 5: Comparación de nuestra serie con estudios previos
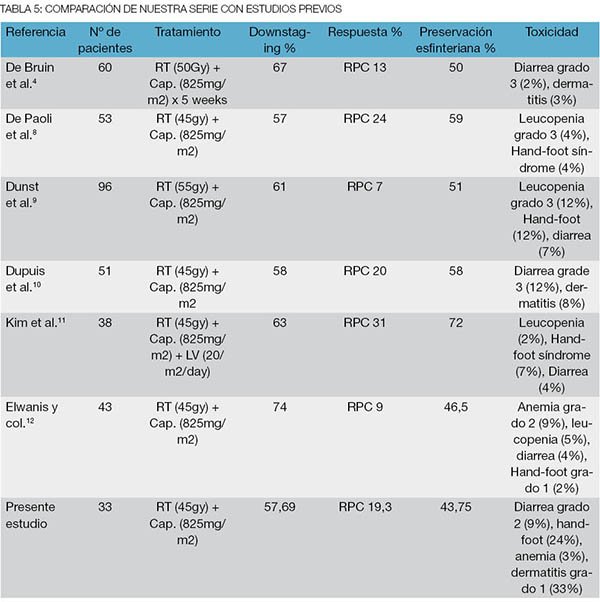
Dos ensayos prospectivos, multicéntricos, aleatorizados compararon la eficacia del capecitabine frente al 5-FU. Uno es el NSABP-04 R, estudio fase III, que posee 4 brazos de investigación que compara capecitabine y 5-FU en infusión continua intravenosa con y sin oxaliplatino; el segundo es un ensayo aleatorizado de 2 brazos (Fédération Française de Cancérologie Digestive ACCORD 12) que compara capecitabine con o sin oxaliplatino en el tratamiento neoadyuvante del cáncer de recto. El primero de ellos (NSABP-04 R) presentó una RPC de 17,8 vs 20,7% cuando comparó 5–FU con capecitabine sin oxaliplatino (p=0,14). El ACCORD 12/0405-Prodige 2 a su vez reportó, una RPC 13,9% en el brazo Cap 45 (capecitabine + radioterapia 45 Gy) y 19,2% en el brazo Capox 50 (capecitabine + oxaliplatino + radioterapia 50 Gy). En el estudio francés los autores concluyen que la mayor tasa de RPC lograda en el brazo Capox 50 se debe al incremento de la dosis de radioterapia y a no a la adición de oxaliplatino.19,20
En nuestro medio el grupo del Dr. Leiro presentó su experiencia en el tratamiento de estos tumores, operando un total de 80 pacientes luego de recibir tratamiento quimioradioterápico neoadyuvante con 5FU- leucovorina o capecitabine, logrando una RPC del 16% y una RCC también del 16%.21 Esta diferencia en la respuesta clínica, en comparación a nuestro trabajo, podría deberse a la ausencia en la discriminación entre una u otra droga en dicho trabajo.
Estos valores correspondientes a RPC que presentamos podrían ser hipotéticamente mayores si tomáramos en cuenta aquellos pacientes que ingresaron en el protocolo de Watch & Wait y más aún si consideramos el caso de respuesta casi completa ypT3 por nicho de células atípicas en la grasa perirectal.
Con respecto a la toxicidad, el esquema quimioterápico fue bien tolerado. No presentamos toxicidad grado IV y solamente en tres casos tuvimos que disminuir la dosis de capecitabine por presentar diarrea grado II. Estos resultados son comparables a estudios previos. Creemos que un factor importante a tener en cuenta es la administración de la capecitabine solamente en los días que el paciente recibe la radioterapia descansando el mismo por 48 horas.4,14-16,22
Las limitantes de este trabajo son principalmente su escaso número de pacientes enrolados y su carácter retrospectivo y descriptivo, pero creemos que es una aceptable muestra de lo que sucede en nuestro ámbito dado el escaso número de casos por habitante.
Si bien en términos absolutos los costos del tratamiento con capecitabine son mayores a la infusión endovenosa de 5-FU, la necesidad de colocar un catéter venoso central, con todas las potenciales complicaciones que ello implica (infección, trombosis, sangrado), la necesidad de internación o concurrir a la institución todos los días, hacen de esta droga una muy buena opción para el tratamiento neoadyuvante del cáncer de recto extraperitoneal.
CONCLUSIÓN
Si bien los resultados obtenidos en el presente estudio (RCC del 30,3%, la RPC del 19,3%, y un downstaging del 57,69%), nos habilita a implementar al capecitabine como esquema de neoadyuvancia en el tratamiento de recto inferior localmente avanzado, coincidimos que es necesario estudios prospectivos y randomizados y de costo efectividad a nivel nacional que demuestren la mayor eficacia y tolerancia de la droga en el esquema de neodyuvancia.
BIBLIOGRAFÍA
- Olivier D, Brigitte V. Preoperative Treatment Combining Capecitabine with Radiation Therapy in Rectal Cancer: A GERCOR Phase II Study. Oncology 2007;73:169–176.
- Lee K, Song M. A Phase II Study of Additional Four-Week Chemotherapy With Capecitabine during the Resting Periods After Six-Week Neoadjuvant Chemoradiotherapy in Patients With Locally Advanced Rectal Cancer. Ann Coloproctol 2013;29(5):192-197.
- Hirsch B, Zafar S. Capecitabine in the management of colorectal cancer. Cancer Management and Research 2011:3 79–89.
- De Bruin A, Nuyttens J. Preoperative chemoradiation with capecitabine in locally advanced rectal cáncer. Netherlands The Journal of Medicine 2008; 66(2): 71-76.
- Miwa M, Ura M. Design of a novel oral fluoropyrimidine carbamate, capecitabine, which generates 5-fluorouracil selectively in tumors by enzymes concentrated in human liver and cancer tissue. Eur J Cancer. 1998; 34: 1274–1281. Farmacocinética.
- Oken M, Creech R. Toxicity And Response Criteria Of The Eastern Cooperative Oncology Group. Am J Clin Oncol. 1982; 5:649-655.
- Habr-Gama A, de Souza P. Low rectal cancer: impact of radiation and chemotherapy on surgical treatment. Diseases of the colon and rectum. 1998; 41: 1087-1096.
- Habr-Gama A, Perez R. Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy: long-term results. Annals of surgery. 2004; 240:711-717.
- Trotti A, Byhardt R. Common toxicity criteria: version 2.0. an improved reference for grading the acute effects of cancer treatment: impact on radiotherapy. Int J Radiat Oncol Biol Phys. 2000 Apr 1;47(1):13-47.
- Heald R, Husband E. The mesorectum in rectal cancer surgery--the clue to pelvic recurrence?. Br J Surg. 1982; 69: 613-616.
- Valentini V, Van Stiphout R. Nomograms for predicting local recurrence, distant metastases, and overall survival for patients with locally advanced rectal cancer on the basis of European randomized clinical trials. J Clin Oncol 2011;29:3163-72.
- Sauer R, Becker H. German Rectal Cancer Study Group. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med. 2004; 351: 1731-1740.
- Saif M, Shahrukh H. Capecitabine vs continuos infusión 5-FU in neoadjuvant treatment of rectal cáncer. A retrospective review. Int J Colorectal Dis. 2008; 32: 139-145.
- De Paoli A, Chiara S. Capecitabine in combination with preoperative radiation therapy in locally advanced, resectable, rectal cancer: a multicentric phase II study. Ann Oncol. 2006; 17(2): 246-51.
- Dunst J, Debus J.. Neoadjuvant capecitabine combined with standard radiotherapy in patients with locally advanced rectal cancer: mature results of a phase II trial. Strahlenther Onkol. 2008; 184 (9):450-6.
- Dupuis O, Vie B. Preoperative treatment combining capecitabine with radiation therapy in rectal cancer: A GERCOR phase II study. Oncology. 2007;73:169–76.
- Kim J, Kim T. Preoperative concurrent radiotherapy with capecitabine before total mesorectal excision in locally advanced rectal cancer. Int J Radiat Biol Phys. 2005 Oct 1; 63 (2): 346-53.
- Elwanis M, Maximous D. Surgical treatment for locally advanced lower third rectal cancer after neoadjuvent chemoradiation with capecitabine: prospective phase II trial. World J Surg Oncol. 2009 Jun 9;7:52.
- Gérard J, Azria D. Comparison of two neoadjuvant chemoradiotherapy regimens for locally advanced rectal cancer: results of the phase III trial ACCORD 12/0405-Prodige 2. J Clin Oncol. 2010; 28: 1638-1644.
- O´Connell M, Linda H. Capacitabine and Oxaliplatin in the preoperative multimodality treatment of rectal cancer: surgical end points from National Adjuvant Breast and Bowel Project Trial R-04. J Clin Oncol. 2014; 32: 1927-1934.
- Leiro F, Roca E. Respuesta clínica y patológica luego del tratamiento neoadyuvante en el cáncer de recto. Rev. Argent. Cirug. 2010; 99 (3-4): 83-94.
- Hofheinz R, Wenz F. Chemoradiotherapy with capecitabine versus fluorouracil for locally advanced rectal cancer: a randomised, multicentre, non-inferiority, phase 3 trial. Lancet Oncol. 2012 Jun;13(6):579-88.
