Ablación de las Neoplasias Intraepiteliales Escamosas Anales de Alto Grado, Precursoras del Cáncer Anal, con Coagulación Infrarroja
Rita L. O. Pastore,1 María Victoria Galperin,2 Gisela J. Presencia,2 Laura Svidler López,3
Gabriela L. Sidra,4 María Cecilia Mayo5
División Cirugía, Sector Coloproctología, Hospital Juan A. Fernández, CABA.
Rita L. O. Pastore
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
RESUMEN
Introducción: Las neoplasias intraepiteliales anales de alto grado (AIN-AG) sin tratamiento progresan a carcinoma anal escamoso invasor (CAE) en 8-13% de los casos. Esto disminuye al 1,2% con la ablación dirigida por anoscopía de alta resolución (AAR). El tratamiento ideal de la AIN-AG no está establecido. Goldstone, en 2005 introdujo el coagulador infrarrojo (CIR) para la ablación de estas lesiones y demostró que tiene tanta efectividad como la cirugía, aunque menor morbilidad y la ventaja de no requerir quirófano. No hemos encontrado publicaciones con esta técnica en nuestro medio. El objetivo de este trabajo es evaluar los resultados de la ablación de las AIN-AG con CIR, las complicaciones del método y la recurrencia temprana.
Diseño: Observacional, retrospectivo, con base de datos prospectiva.
Pacientes y Método: Se incluyeron individuos con AIN-AG en conducto anal y/o región perianal diagnosticadas en el Consultorio de Detección Temprana de Displasia Anal del Hospital Juan A. Fernández mediante biopsia dirigida por AAR y tratadas con CIR con el aparato Redfield®, entre marzo 2013-agosto 2014 previo consentimiento informado escrito. Tras infiltración con anestesia local las lesiones fueron coaguladas con repetidos pulsos de 1,5 segundos hasta visualizar los vasos de la submucosa. Se controló entre los 3 y 6 meses con AAR y biopsia de lesiones sospechosas.
Resultados: Fueron 14 pacientes (10 hombres que tienen sexo con hombres, todos VIH-positivos y 4 mujeres, 2 VIH-positivas). Edad mediana: 37,5 (rango 20-59) años. La AIN-AG se localizaba en el conducto anal en 11 pacientes y en la región perianal en 3. En la AAR diagnóstica todos presentaban sólo un área de AIN-AG. El procedimiento fue bien tolerado. Una paciente VIH-positiva presentó secreción purulenta a los tres días de la ablación, que se trató con antibióticos. Esta paciente y otro más tuvieron dolor post-procedimiento manejado con anti-inflamatorios no esteroides. En la AAR de control se hallaron 2 (14,3%) recurrencias, una interpretada como persistencia por margen insuficiente de una lesión extendida y otra diagnosticada al momento de realizar CIR, que no había sido observada en la AAR realizada 1 mes antes. La eficacia por lesión individual tratada fue del 92,9%.
Conclusiones: El tratamiento de las AIN-AG en el consultorio mediante CIR es bien tolerado, tiene mínimas complicaciones y resulta efectivo en el corto plazo. Es necesario un seguimiento más prolongado para evaluar la tasa de recidiva y la utilidad para prevenir la progresión al CAE.
Palabras clave: Neoplasia Intraepitelial Anal de Alto Grado; Coagulación Infrarroja; VPH; VIH
ABSTRACT
Background: High-grade anal intraepithelial neoplasia (HGAIN) without treatment progresses to invasive squamous cell carcinoma (SCC) in 8-13% of cases, and that incidence decreases to 1,2% with ablation targeted with high resolution anoscopy (HRA). The ideal treatment for HGAIN is not established yet. Goldstone, in 2005 introduced the infrared coagulator (IRC) for the ablation of these lesions, and with great experience demonstrated that it is as effective as surgery but has less morbidity and the advantage of not requiring the operating room. To our knowledge there are not publications with this technique in our country. The aim of this study is to assess the results of HGAIN ablation with CIR, the method complications, and early recurrence.
Design: Observational, retrospective study, with prospective database.
Patients and Methods: Individuals with HGAIN in the anal canal or the perianal region, diagnosed with biopsy targeted with HRA and treated with the IRC in the Anal Dysplasia Clinic of the Hospital Juan A. Fernández, between March 2013 and August 2014, were included. After written informed consent, HRA was repeated in the outpatient clinic to localize the area to be treated with the IRC Redfield®. After local anesthesia the lesions were coagulated with repeated 1.5 seconds pulses until the submucosa vessels were visualized. Control with HRA and biopsy of suspicious lesions was performed between 3-6 months of the procedure.
Results: Fourteen patients (10 men who have sex with men, all HIV-positive, and 4 women, 2 HIV-positive). Median age: 37.5 (range 20-59) years. The HGAIN was localized at the anal canal in 11 patients, and in the perianal region in 3. In the diagnostic HRA all patients presented only one area of HGAIN. The procedure was well tolerated. Only one HIV-positive woman presented purulent discharge 3 days after ablation, and was treated with antibiotics. The latter and another patient had post-procedure pain, managed with non-steroidal anti-inflammatory drugs. In the control HRA, 2 (14,3%) recurrences were found, 1 was interpreted as persistency due to insufficient margin of a extended lesion, and 1 diagnosed during the CIR of other lesion, that had went unaware at the initial HRA performed one month before. The efficacy for individual lesion treated was 92.9%.
Conclusions: The treatment of HGAIN with IRC in the outpatient department is well tolerated, has minimal complications, and is effective in the short term. It is necessary a longer surveillance to assess the recurrence rate and the usefulness for preventing progression to SCC.
Key words: High-grade Anal Intraepithelial Neoplasia; Infrared Coagulation; HPV; HIV
INTRODUCCIÓN
En las últimas 3 décadas la incidencia del cáncer anal escamoso (CAE) aumentó un 96% en hombres y un 39% en mujeres1 y continúa incrementándose en más de un 2% por año en ambos sexos.2 La población de mayor riesgo la constituyen los hombres que tienen sexo con hombres (HSH) VIH-positivos, en quienes la incidencia es de 92-144 cada 100.000 habitantes por año.3-5
El virus del papiloma humano (VPH) se asocia fuertemente al desarrollo del carcinoma anal e imita al cáncer de cérvix produciendo neoplasias intraepiteliales escamosas anales (AIN, por su sigla en inglés), de bajo grado (AIN 1) y alto grado (AIN 2 y AIN 3).
El riesgo de progresión de la AIN 1 a AIN 2-3 se observa en el 62% de los VIH-positivos y en el 36% de los HSH VIH-negativos dentro de los 2 años de evolución de la enfermedad.6 Si bien las AIN 1 y 2 pueden involucionar espontáneamente, esto es más raro en las AIN 3.7 Varios estudios han demostrado que las AIN de alto grado (AIN-AG) sin tratamiento progresan al CAE entre el 8-13% de los casos.8-11 Esta incidencia disminuye al 1,2% con la ablación dirigida por la anoscopía de alta resolución (AAR).12
En el 2005 Goldstone y col.13 publicaron por primera vez el uso del coagulador infrarrojo (CIR) para el tratamiento de estas lesiones precursoras, demostrando su eficacia para prevenir el desarrollo del carcinoma anal, con similares índices de recurrencia, pero menores complicaciones estenóticas y de incontinencia anal que las producidas por la exéresis quirúrgica. Una ventaja adicional es que puede ser realizada con anestesia local y en el consultorio externo. Otros autores internacionales han obtenido resultados igualmente satisfactorios,11,14-16 aunque hasta el presente no se ha publicado ninguna experiencia con esta técnica en el medio nacional. El objetivo de este trabajo es evaluar los resultados de la ablación de las AIN-AG con el CIR, analizando la tolerancia, las complicaciones del método y el índice de recurrencia temprana.
MATERIAL Y MÉTODO
Se incluyeron individuos con AIN-AG en el conducto anal y/o la región perianal diagnosticadas en el Consultorio de Detección Temprana de la Displasia Anal del Hospital Juan A. Fernández, entre marzo 2013 y agosto 2014. El estudio fue aprobado por el Comité de Ética en la Investigación de nuestra institución. Previo consentimiento informado por escrito se realizó la pesquisa de la displasia anal con la citología anal exfoliativa (PAP anal) y la AAR, también denominada anoscopía magnificada, cuya técnica ha sido descripta previamente.17 Brevemente, con el paciente en decúbito lateral izquierdo se realiza el PAP anal con un hisopo de fibras sintéticas (Cytobrush) humedecido en agua que se inserta en el canal anal hasta 5-6 cm del margen y se retira lentamente rotándolo 360º en dirección de las agujas del reloj mientras se aplica a las paredes del canal anal una presión suave. El material obtenido es colocado en un portaobjetos y fijado en alcohol al 96%. Para el informe anatomopatológico se utilizó la Clasificación de Bethesda:
- Normal,
- ASCUS: Células escamosas atípicas de significado indeterminado,
- ASC-H: Células escamosas atípicas, no se puede excluir lesión intraepitelial escamosa anal de alto grado (H-ASIL),
- lesión intraepitelial escamosa anal de bajo grado (L-ASIL),
- lesión intraepitelial escamosa anal de alto grado (H-ASIL).18
A continuación se procedió a la AAR con un videocolposcopio digital utilizando una técnica similar a la de la colposcopia cervical. Primero se introduce a través de un anoscopio transparente una gasa embebida en ácido acético al 5% que tiñe de blanco las lesiones intraepiteliales anales (ASIL). Luego el anoscopio se retira lentamente hasta visualizar con el colposcopio la zona de transformación anal donde se hallan habitualmente las ASIL y particularmente las H-ASIL. Puede usarse Lugol para poner más de manifiesto las lesiones acetoblancas. Todas las lesiones sospechosas por ser acetoblancas, presentar puntillado, mosaico o vasos atípicos, se biopsian con una pinza mini-Tischler®, previa infiltración de lidocaína con epinefrina. Se toman fotografías y/o se filman las zonas biopsiadas para ayudar posteriormente a localizar las H-ASIL a tratar.
Solo se realizó la ablación de las AIN-AG (AIN 2 y 3) confirmadas por la biopsia dirigida por la AAR, es decir que el tratamiento no fue basado en la apariencia visual de una lesión.
El procedimiento se realizó con el aparato Redfield® de coagulación infrarroja, utilizado clásicamente para el tratamiento de las hemorroides. El mismo está compuesto por un disparador con una guía que administra pulsos de luz infrarroja y una base que posee una perilla que permite ajustar los pulsos (fig. 1). En el consultorio externo de Coloproctología, con el paciente en decúbito lateral izquierdo se repitió la AAR para localizar la lesión identificada y biopsiada en la AAR previa (fig. 2 A). En algunos casos se colocó Lugol para poner más de manifiesto la lesión, que no toma el Lugol a diferencia de las áreas circundantes sanas (fig. 2 B). Se realizó anestesia local infiltrativa con lidocaína al 1% con epinefrina 1/100.000, con una jeringa de 1cm y aguja de 27G que permite infiltrar y simultáneamente observar la lesión a través del anoscopio (fig. 2 C). Es conveniente infiltrar un área mayor a la de la lesión por la difusión del calor. Luego se procedió a la ablación de la lesión efectuando varios disparos, con pulsos de 1,5 seg, abarcando toda la lesión con 2 mm de margen (fig. 2 D). La clave es ir lo suficientemente profundo para destruir totalmente la lesión, por lo que se repitió hasta que los vasos de la submucosa fueron identificados y coagulados (fig. 2 E). Posteriormente se retiró la escara, descamada espontáneamente o con la ayuda de un hisopo o una pinza mini-Tischler (fig. 2 F). Ocasionalmente el leve sangrado ocasionado fue cohibido con una nueva aplicación del coagulador. No se produjo humo ni olor.

Figura 1: Aparato coagulador infrarrojo Redfield® compuesto por un disparador (A), una guía (B) que administra pulsos de luz infrarroja y una base con una perilla para ajustar los pulsos (C).
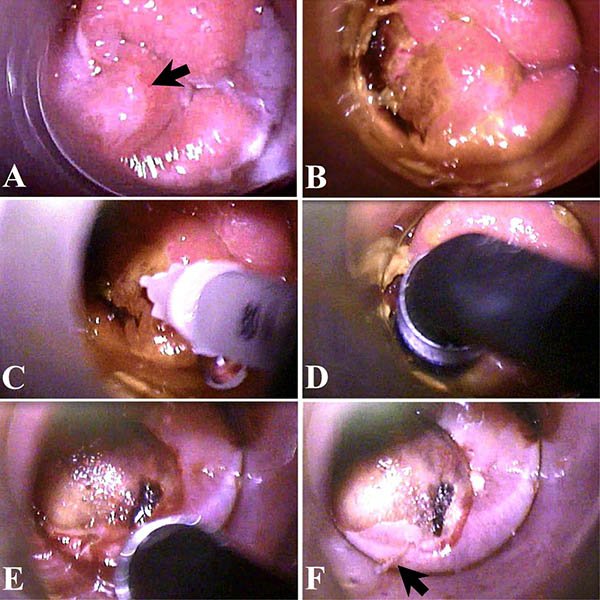
Figura 2: Ablación mediante coagulación infrarroja de una lesión intraepitelial de alto grado del conducto anal. A) Se observa la lesión acetoblanca (flecha) luego de la aplicación de ácido acético al 5%, ubicada proximalmente a la zona de trasformación anal. B) Luego de la aplicación de Lugol se observa que se tiñe levemente (color mostaza) a diferencia del área periférica normal que se observa color marrón oscuro. C) Infiltración de lidocaina al 1% con epinefrina 1/100.0000. D) Ablación con pulsos de luz infrarroja. E) Escara post-coagulación. F) Parte de la escara desprendida (flecha).
Se realizó un control entre los 3 y 6 meses del procedimiento con AAR, biopsiando las zonas sospechosas. Se biopsió la zona tratada solo cuando se consideró patológica. Si la biopsia fue normal se indicó el seguimiento con PAP y AAR c/12 meses en los HIV negativos y c/6 meses en los HIV positivos.
RESULTADOS
Se incluyeron 14 pacientes (10 HSH, todos VIH positivos y 4 mujeres, 2 VIH positivas). Edad mediana: 37,5 (rango 20-59) años. Las AIN-AG se localizaban en el conducto anal en 11 pacientes y en la región perianal en 3. Todos los pacientes presentaban sólo un área de AIN-AG en la AAR inicial.
El procedimiento fue bien tolerado y sin complicaciones. En 3 pacientes se observó un sangrado leve del lecho que se controló satisfactoriamente con la aplicación del coagulador infrarrojo. Post-ablación, un paciente con AIN-AG perianal refirió dolor de intensidad 7/10 que se manejó adecuadamente con AINES. Otra paciente VIH positiva con lesión en el conducto anal refirió dolor de intensidad 6/10 y secreción mucopurulenta escasa, que se trató con AINES y antibióticos orales con buena respuesta.
En la AAR de control se hallaron 2 (14,3%) recurrencias. Una en un paciente con nueva AIN-AG a los 3 meses que se interpretó como persistencia por margen insuficiente en la ablación de una lesión extendida y se trató con nueva CIR. La otra en una paciente VIH positiva en quien se detectó al momento del CIR otra zona sospechosa no observada en la AAR inicial realizada 1 mes antes; se trató el área con confirmación histológica y se biopsió el nuevo hallazgo que resultó otra AIN-AG, la cual fue tratada con CIR en una nueva sesión. De este modo, la efectividad por lesión individual tratada fue del 92,9%.
De los 4 pacientes con seguimiento mayor a 12 meses, uno se perdió posteriormente y los otros 3 no tuvieron recidiva de la AIN-AG ablacionada, aunque 2 de ellos tuvieron recidiva de condilomas asociados que se trataron también con CIR.
DISCUSIÓN
Dado que existen escasos estudios randomizados que comparen diferentes tratamientos, el manejo de las AIN-AG es controvertido.19 Particularmente en los VIH positivos, lo incierto de la eficacia y las complicaciones asociadas con las terapéuticas resectivas hacen que no haya una uniformidad en el manejo de estas lesiones.20 A diferencia de lo que ocurre en el cuello uterino donde el tratamiento de la neoplasia intraepitelial de alto grado se realiza mediante la extirpación parcial o total de la zona de transición escamo-columnar, la zona de transición anal no puede ser resecada totalmente sin un alto riesgo de estenosis y/o alteraciones funcionales de la evacuación. Dado que el tratamiento quirúrgico frecuentemente tiene una morbilidad no despreciable21 y carece de una eficacia segura ya que las recurrencias están garantizadas, algunos autores sugieren que las AIN-AG en personas VIH positivas no deberían tratarse hasta que se desarrolle el CAE.8,9
Con relación a la rapidez de esta posible transformación maligna, Scholefield y col.8 publicaron un 9% de progresión de AIN 3 a enfermedad invasora en 60 meses de seguimiento. No obstante, puede evolucionar en un plazo tan corto como de 8,9 meses en los HSH VIH-positivos.22
Para quienes deciden tratar las AIN-AG las opciones terapéuticas incluyen tratamientos tópicos con imiquimod, 5-fluoruracilo, o ácido tricloroacético, la destrucción con criocirugía, coagulación infrarroja, electroagulación, laser, o la exéresis quirúrgica.2,19
Aunque la ablación puede ser realizada con electrocoagulación con similar éxito que con el CIR,2 el aparato e instrumental necesarios no siempre están disponibles en el consultorio externo.
La ablación con coagulación con el CIR dirigida por AAR es un procedimiento de destrucción local precisa en tamaño y profundidad, que resulta bien tolerado, además de poder realizarse en el consultorio y con anestesia local.13-15,20 Las complicaciones post-procedimiento son raras.13-15,20
Nosotros utilizamos el CIR para tratar las AIN-AG diagnosticadas por biopsia de lesiones sospechosas halladas en la AAR realizada durante la pesquisa de la displasia anal en individuos de riesgo. En esta serie preliminar se aplicó a los pacientes con una sola lesión que en general ocupaba menos de una hemicircunferencia anal. Pacientes con lesiones más extendidas y/o asociadas con múltiples condilomas fueron tratados en quirófano con exéresis y electrocoagulación bajo anestesia local o regional. El CIR aventaja a otras terapéuticas también ambulatorias que hemos utilizado en algunos pacientes, como la topicación con ácido tricloroacético al 80-90% o el imiquimod. La más larga duración de estos tratamientos y la mayor molestia local que ocasionan influyen en la adherencia del paciente a los mismos, hecho que no ocurre con el CIR.
Goldstone y col. han comunicado la eficacia a corto plazo del CIR tanto en VIH positivos como VIH negativos seguidos durante una mediana de 18 y 19 meses después de la primera ablación, con un éxito terapéutico por cada lesión individual del 72% y 81%, respectivamente, en HSH.13,23
Las lesiones metacrónicas, es decir aquellas localizadas en una zona diferente a la del tratamiento inicial, fueron la causa mayor de recurrencia. Desarrollaron lesiones metacrónicas luego de un primera y segunda ablación el 59% y 45%, respectivamente de los HSH VIH positivos y el 45% y 22% de los VIH negativos. El tiempo mediano de cualquier recurrencia en HSH, VIH positivos y VIH negativos después del primer tratamiento con el CIR fue de 7 y 11 meses, sin ninguna progresión al CAE.
La recurrencia es más elevada con un seguimiento más prolongado y exhaustivo. El reporte a largo plazo (mediana de seguimiento de 48 y 69 meses en VIH negativos y VIH positivos) de esta cohorte original de 96 HSH (44 VIH positivos), tratada entre 1998 y 2012 con repetidas ablaciones con CIR mostró que al año de la primera ablación la probabilidad de recurrencia fue del 61% en los VIH positivos y el 38% en los VIH negativos.20 La probabilidad de cura de una lesión individual fue del 67% en los VIH positivos y del 80% en los VIH negativos. Al año de la segunda ablación, la recurrencia fue del 49% vs 28%, respectivamente. Los VIH positivos tuvieron una probabilidad 1,9 veces mayor de recurrir que los VIH negativos (P<0,009). Los índices de recurrencia disminuyen con cada nueva ablación. La mayoría de las recurrencias se debieron a lesiones metacrónicas (82% y 52% en los VIH positivos y negativos, respectivamente). No hubo ninguna progresión al CAE. 20
Pineda y col.,12 comunicaron los resultados a largo plazo del tratamiento de las AIN-AG en 246 pacientes, realizado en el quirófano con cirugía convencional combinada con ablación con el CIR en el consultorio. Tuvieron una recurrencia del 57% con un seguimiento promedio de 19 meses, similar para los individuos VIH positivos como negativos. Un 1,2% progresaron al CAE y 78% estaban libres de AIN-AG al momento del último seguimiento. A los 12 meses la tasa de recurrencia fue del 40%, demostrando que su detección es mayor con un seguimiento más prolongado.
Otros autores comunican una eficacia del 64% al 87% y coinciden en la ausencia de recurrencia al año y de progresión al CAE, con un índice de recurrencia del 13%-26% a 30 meses.11,14,16
En la presente serie hubo 2 recurrencias. Una considerada persistencia de una lesión extendida tratada 3 meses antes y otra lesión metacrónica que elegimos asumir como recurrencia, aunque podría interpretarse como lesión sincrónica perdida en la AAR inicial. Constituye un 14,3% de recurrencia global y un 7,1% de recurrencia de las lesiones tratadas individualmente, lo que resulta en un 92,9% de eficacia. Sin embargo, el seguimiento solo superó el año en 4 pacientes, de los cuales uno se perdió. Debe tenerse en cuenta que las recurrencias en los pacientes VIH positivos, como son la mayoría de esta serie, son más frecuentes y aparecen más rápidamente que en los VIH negativos, por lo que es necesario un seguimiento continuo.20
Por otra parte, podría haber un sub-diagnóstico de las recurrencias ya que en la AAR de control no fueron biopsiadas las áreas previamente tratadas cuando se consideraron normales. Silveira y col.,24 en un estudio prospectivo encontraron un 13% de AIN-AG en biopsias al azar de una mucosa aparentemente normal en la AAR, las que hubieran pasado inadvertidas sin la biopsia sistemática.
El procedimiento tuvo una buena tolerancia y transcurrió sin complicaciones, como en otras series,11,14,16,20 lo que lo hace ideal para su aplicación en el consultorio.
CONCLUSIONES
El tratamiento de las AIN-AG en el consultorio mediante el CIR es bien tolerado, tiene mínimas complicaciones y resulta efectivo en el corto plazo. Es necesario un seguimiento más prolongado para evaluar la tasa de recidiva y la utilidad para prevenir la progresión al CAE.
AGRADECIMIENTOS
Agradecemos a la Fundación Roemmers por el apoyo financiero otorgado para la adquisición del aparato Redfield® de coagulación infrarroja y de material imprescindible para el desarrollo de esta investigación.
BIBLIOGRAFÍA
- Johnson LG, Madeleine MM, Newcomer LM, Schwartz SM, Daling JR. Anal cancer incidence and survival: the surveillance, epidemiology, and end results experience, 1973-2000. Cancer. 2004;101:281–88.
- Goldstone SE, Johnstone AA, Moshier EL. Long-term outcome of ablation of anal high-grade squamous intraepithelial lesions: Recurrence and incidence of cancer. Dis Colon Rectum. 2014; 57: 316–32.
- Bower M, Powles T, Newsom-Davis T, Thirlinel Ch, Stebbing J, Mandalia S, et al. HIV-associated anal cancer: has highly active antiretroviral therapy reduced the incidence or improved the outcome? J Acquir Immune Defic Syndr. 2004;37:1563–65.
- Diamond C, Taylor TH, Aboumrad T, Bringman D, Anton-Culver H. Increased incidence of squamous cell anal among cancer men with AIDS in the era of highly active antiretroviral therapy. Sex Transm Dis. 2005;32:314–20.
- Garcia FU, Haber MM, Butcher J, Sharma M, Nagle D. Increased sensitivity of anal cytology in evaluation of internal compared with external lesions. Acta Cytol. 2007;51:893–99.
- Palefsky JM, Holly EA, Ralston ML, Jay N, Berry JM, Darragh TM. High incidence of anal high-grade squamous intraepitelial lesions among HIV-positive and HIV-negative homosexual and bisexual men. AIDS. 1998; 12: 495–503.
- Scholefield JH, Ogunbiyi OA, Smith JH, Rogers K, Sharp F. Treatment of anal intraepithelial neoplasia. Br J Surg. 1994; 81:1238–40.
- Scholefield JH, Castle MT, Watson NF. Malignant transformation of high-grade anal intraepithelial neoplasia. Br J Surg. 2005;92:1133–36.
- Devaraj B, Cosman BC. Expectant management of anal squamous dysplasia in patients with HIV. Dis Colon Rectum. 2006;49:36–40.
- Watson AJ, Smith BB, Whitehead MR, et al. Malignant progression of anal intra-epithelial neoplasia. ANZ J Surg. 2006;76:715–17.
- Weis SE, Vecino I, Pogoda JM, Susa JS. Treatment of high-grade anal intraepithelial neoplasia with infrared coagulation in a primary care population of HIV-infected men and women. Dis Colon Rectum. 2012; 55:1236–43.
- Pineda CE, Berry JM, Jay N, Palefsky JM, Welton ML, et al. High-resolution anoscopy targeted surgical destruction of anal high-grade squamous intraepithelial lesions: a ten-year experience. Dis Colon Rectum. 2008;51:829-35.
- Goldstone SE, Kawalek AZ, Huyett JW. Infrared coagulator: a useful tool for treating anal squamous intraepithelial lesions. Dis Colon Rectum. 2005;48:1042–54.
- Stier EA, Goldstone SE, Berry JM, et al. Infrared coagulator treatment of high-grade anal dysplasia in HIV-infected individuals: an AIDS malignancy consortium pilot study. J Acquir Immune Defic Syndr. 2008;47:56–61.
- Cranston RD, Hirschowitz SL, Cortina G, Moe AA. A retrospective clinical study of the treatment of high-grade anal dysplasia by infrared coagulation in a population of HIV-positive men who have sex with men. Int J STD AIDS. 2008;19: 118–120.
- Sirera G, Videla S, Piñol M, Coll J, García-Cuyás F, Vela S, et al. Long-term effectiveness of infrared coagulation for the treatment of anal intraepithelial neoplasia grades 2 and 3 in HIV-infected men and women. AIDS. 2013;27:951–59.
- Presencia GJ, Pastore RLO, Svidler López L, Sidra GL, Orellana MA, Piccone M, et al. Detección temprana de la displasia anal con citología (PAP) y anoscopía de alta resolución (AAR) en la población de riesgo: Experiencia inicial. Rev Argent Coloproct. 2015;1:12-16.
- Bergeron C. El Sistema de Bethesda 2001. En: Alonso P, Lescano E, Hernández M. Cáncer cervicouterino. Diagnóstico, prevención y control. Bs As.: Ed Panamericana. 2005. p. 219-24.
- Weiss SE. Current treatment options for management of anal intraepithelial neoplasia. Onco Targets Ther. 2013:6;651–65.
- Goldstone RN, Goldstone AB, Russ J, Goldstone SE. Long-term follow-up of infrared coagulator ablation of anal high-grade dysplasia in men who have sex with men. Dis Colon Rectum. 2011;54:1284–1292.
- Brown SR, Skinner P, Tidy J, Smith JH, Sharp F, Hosie KB. Outcome after surgical resection for high-grade anal intraepithelial neoplasia (Bowen’s disease). Br J Surg. 1999;86:1063–1066.
- Kreuter A, Potthoff A, Brockmeyer NH, et al. Anal carcinoma in human immunodeficiency virus-positive men: results of a prospective study from Germany. Br J Dermatol 2010; 162:1269–77.
- Goldstone SE, Hundert JS, Huyett JW. Infrared coagulator ablation of high-grade anal squamous intraepithelial lesions in HIV-negative males who have sex with males. Dis Colon Rectum 2007;50:565–75.
- Silvera R, Gaisa M, Goldstone SE. Random biopsy during high resolution anoscopy increases diagnosis of anal high-grade squamous intraepithelial lesions. JAIDS. 2014;65:65–71.
