CAPÍTULO 11
Complicaciones de la coloproctectomía restaurativa
Los resultados de la coloproctectomía con reservorio ileal mejoran con la experiencia del equipo quirúrgico,1,2 existiendo claras evidencias de que aquellas unidades con un mayor número de cirugías presentan menores tasas de fallos y mejores tasas de salvataje de los reservorios (centros que realizan al menos 10 al año).3 Se ha descripto en centros especializados que la tasa de mortalidad ronda al 1%,3-5 mientras que la morbilidad continua siendo alta 18 - 54%,6-9 llevando a un 5-12% de fallos.8 Dentro de las causas para ello se encuentran la complejidad técnica, la naturaleza y severidad de la enfermedad (especialmente en la CU) y las alteraciones producidas por el tratamiento médico preoperatorio (Tabla 30).
Las dos patologías por las cuales se suele realizar esta cirugía son: la CU y la poliposis adenomatosa familiar; siendo la primera de ellas más propensa a desarrollar complicaciones.10-13 Dozois y cols.,10 en un estudio de 1989, compara los resultados de esta cirugía en ambas patologías (94 PAF y 758 CU) encontrando una mortalidad de 0,3% en los pacientes con colitis ulcerosa vs 0% en PAF, en cuanto a la tasa de complicaciones postoperatorias generales, sin bien no hubo diferencias significativas (29 vs 26%), si las hubo en la necesidad de reoperación por sepsis (6% vs 0%). Lo mismo sucedió con los resultados a largo plazo, los cuales favorecieron al grupo de poliposis con un menor número de depociciones, menor tasa de pérdidas nocturnas y menos pouchitis. En nuestra experiencia las complicaciones generales fueron significativamente menores en los pacientes con poliposis, siendo el porcentaje de pouchitis del 0%, aunque la tasa de sepsis pélvica fue levemente mayor (CU 17% vs Poliposis 19,6%). En cuanto a los fracasos del reservorio también fue mayor en el grupo de inflamatorias 1/112 en poliposis (0.8%) contra 24/488 (4.9%).
Varios autores, entre ellos nuestro grupo,14,15 no encuentran una relación entre el desarrollo de complicaciones y los resultados funcionales, excepto en lo referente a la continencia. Gualdrini y cols.14 realizan un estudio sobre 144 pacientes (71 sin complicaciones y 73 con complicaciones), encontrando una mayor tendencia a presentar escapes en los pacientes con complicaciones (34%) respecto de aquellos sin ellas (20%; p<0.08 NS), esto fue más evidentes en las sépticas (Tabla 31).
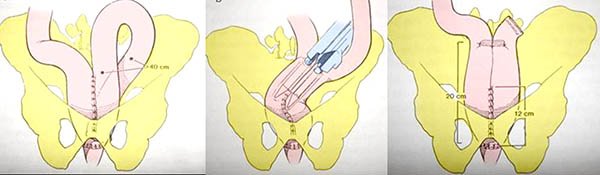
Las complicaciones podrán presentarse en el intra o en el postoperatorio, dentro de las primeras encontramos:
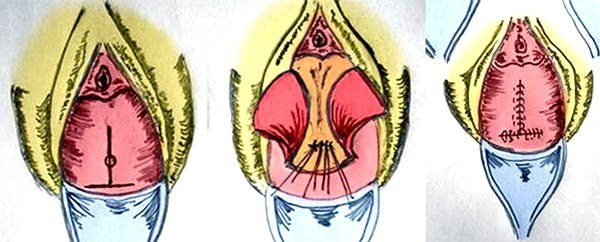
Dificultad para anastomosar la bolsa al conducto anal (ya fueron descriptas las maniobras que se pueden realizar para que esta anastomosis se realice sin tensión).
Falla de las suturas mecánicas, ya sea de la curva cortante que se utiliza para cerrar el muñón rectal (se soluciona con la realización de una jareta o solenoide transanal o desde cavidad según sea mas fácil técnicamente); de la circular (anillos incompletos o anastomosis incompletas) se resuelve con la realización de puntos transanales.
Sangrado del reservorio (control de hemostasia dentro de la bolsa antes de realizar la anastomosis ileoanal).
Las complicaciones postoperatorias se clasificaran de acuerdo al tiempo de aparición en tempranas, aquellas que se presentan hasta los 30 días del postoperatorio y tardías las que se presentan luego de dicho lapso (Tabla 32). Siendo las más frecuentes de aparición temprana la sepsis pélvica, las dehiscencias anastomóticas, la obstrucción del intestino delgado y el sangrado del reservorio. De acuerdo a su causa también se clasificaran en complicaciones sépticas relacionadas al reservorio o no sépticas (Tabla 33).
TABLA 30: COMPLICACIONES DE LA COLOPROCTECTOMÍA CON RESERVORIO ILEAL
|
Tabla 1: COMPLICACIONES DE LA COLOPROCTECTOMÍA CON RESERVORIO ILEAL |
Seidel N 55 % |
Johnson N 64 % |
Blumberg N 145 % |
Fazio 1005 % |
Kelly N 1193 % |
Meagher N 1310 % |
Tekkis N 2491 % |
Zittan N 758 % |
Hueschen N 706 % |
Udaondo N558 |
|
|
Cu % |
Crohn % |
||||||||||
|
Absceso |
17 |
5 |
7 |
8.2 |
5 |
- |
|
17.8 |
8.4 |
- |
- |
|
sepsis pelvica |
|
|
|
|
|
|
11.8 |
|
18.55 |
16 |
34.6% |
|
Dehiscencia de ileoanal |
9 |
- |
2.1 |
2.9 |
- |
- |
5.5 |
12.1 |
8.65 |
7.69% |
|
|
Dehiscencia de la bolsa |
|
|
|
|
|
|
|
4.97 |
- |
||
|
Fístula pouch vaginal |
- |
11 |
1.4 |
6.8 |
- |
- |
11.8 |
3.4 |
3.46 |
30.76% |
|
|
Fístula de la punta de la J |
1.7 |
7.69 |
|||||||||
|
Fístula perianal |
6.7 |
42.3 |
|||||||||
|
Fístula pouch perineal |
|
|
|
|
|
|
|
|
|
0.4 |
3.8 |
|
Estenosis |
17 |
3 |
- |
14 |
- |
- |
16.8 |
|
|
12,7 |
11.5 |
|
Pouchitis |
24 |
19 |
10 |
23.45 |
2 |
- |
14.2 |
|
|
22.29 |
50 |
|
Hemorragia del pouch |
|
|
|
|
|
|
1.6 |
|
|
1.9 |
- |
|
Estenosis de asa aferente |
|
|
|
|
|
|
|
|
|
0.21 |
7.69 |
|
Necrosis del pouch |
|
|
|
|
|
|
|
|
|
0.21 |
- |
|
Piopouch |
|
|
|
|
|
|
|
|
|
0.43 |
- |
|
Estenosis del pouch |
|
|
|
|
|
|
|
7.3 |
|
0.21 |
- |
|
Obstrucción int delgado |
23 |
- |
26 |
25 |
15 |
15 |
12.3 |
17.7 |
|
|
|
Tabla 31: Resultados funcionales cedido por Gualdrini y cols
Tabla 32: Complicaciones
|
TEMPRANAS |
TARDIAS |
|
Hemorragia |
Fístulas |
|
Complicaciones sépticas relacionadas al reservorio |
Complicaciones sépticas relacionadas al reservorio |
|
Obstrucción intestinal |
Obstrucción intestinal |
|
Disfunción urinaria aguda |
Estenosis |
|
Deshidratación |
Pouchitis |
|
Dehiscencia de suturas de la bolsa ileal |
Cuffitis |
|
Necrosis de la bolsa |
Disfunción sexual |
|
Fístulas |
Síndrome del reservorio irritable |
Tabla 33: Clasificación de las complicaciones
|
Complicaciones sépticas relacionadas al reservorio |
Complicaciones no sépticas |
Complicaciones infrecuentes del reservorio |
|
Dehicencias anastomóticas |
Oclusión intestinal |
Prolapso |
|
Abscesos |
Hemorragia |
Volvulo |
|
Fístulas del reservorio |
Estenosis |
Displasia y cáncer |
|
|
Pouchitis |
|
|
|
Cuffitis |
|
11.1 COMPLICACIONES
11.1.2 Complicaciones sépticas relacionadas al reservorio
Las complicaciones sépticas relacionadas la reservorio son las fístulas, las dehiciencias anastomóticas y la sepsis pélvica (abscesos pélvicos), pudiendo su incidencia disminuir con la mayor experiencia de equipo quirúrgico. En una serie de Hueschen y cols.16 de 706 pacientes, de los cuales 131 presentaron complicaciones sépticas, el 76,3% desarrollo fístulas, el 15,3% dehiscencia de anastomosis y el 8,4% abscesos pélvicos, con una tasa de fallos del reservorio de 19.6% a 3 años, 31.1 a los 5 y 39.2 a los 10 años.
En cuanto a lo relacionado con la experiencia, al igual que varias series internacionales, nuestro grupo presenta en el año 1999 los primeros 10 años con esta técnica en un trabajo que incluía a 178 pacientes divididos en dos grupos (grupo 1: 1987- agosto 1993; grupo 2: septiembre 1993-1997), en el cual se hallaron diferencias estadísticamente significativas entre ambos periodos tanto para las complicaciones tempranas como para las comunes a toda cirugía siendo: 6,74% el desarrollo de fístulas (2do periodo 1,12%); dehiscencia 29.20% (8.98%) y sepsis pélvica 26,96% en el primer periodo y 7,86% en el segundo, debiendo remover un reservorio por una fístula entre este o la anastomosis ileoanal y la pared abdominal consecuencia de una sepsis pélvica. También se encontraron diferencias en las tasas de reoperaciones y de fracasos.2
Sepsis pélvica
La sepsis pélvica es la complicación más temida ya que puede comprometer la viabilidad del reservorio, siendo unas de las causas más comunes de fallo del mismo (50-80%).17,18 Se presenta en 5- 37%9,19-24 de los pacientes y generalmente se debe a dehiscencia de la anastomosis ileoanal, y menos frecuente a dehicencia de alguna de las otras suturas del reservorio (punta o cuerpo de la J), a una contaminación durante la cirugía o a un hematoma infectado. Factores adversos preoperatorios tales como el estado general del paciente, pueden incidir en su desarrollo. También se ha asociado a mayor riesgo la CU que la poliposis adenomatosa familiar.
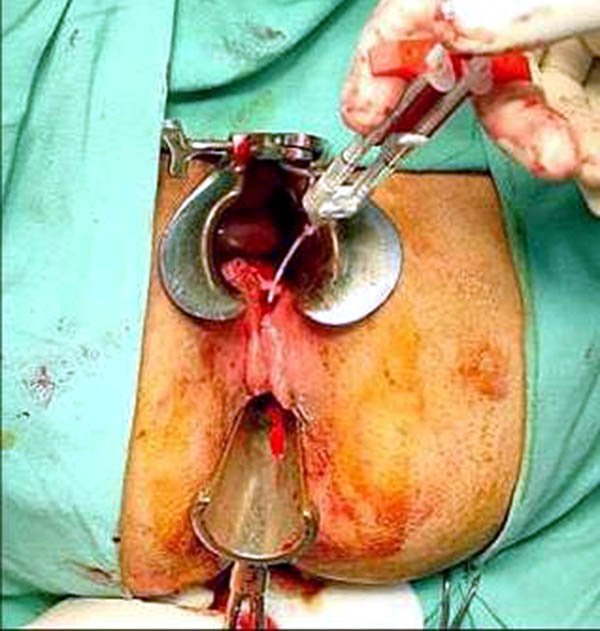
Los pacientes se presentan con fiebre, leucocitosis, en algunos casos dolor abdominal, ileo o pseudodiarrea (disfunción ileostómica). Puede tener signos de peritonitis local o generalizada; salida de material purulento por el drenaje quirúrgico que se aboca a la pelvis o por el ano, menos frecuentemente estas colecciones drenan a través de la vagina. Al examen se comprobara al tacto abombamiento de algunas de las paredes del reservorio con zonas de dehiscencia de la anastomosis ileoanal, de elección realizar el examen bajo anestesia lo cual permitirá evaluar más minuciosamente la anastomosis y drenar en forma correcta.
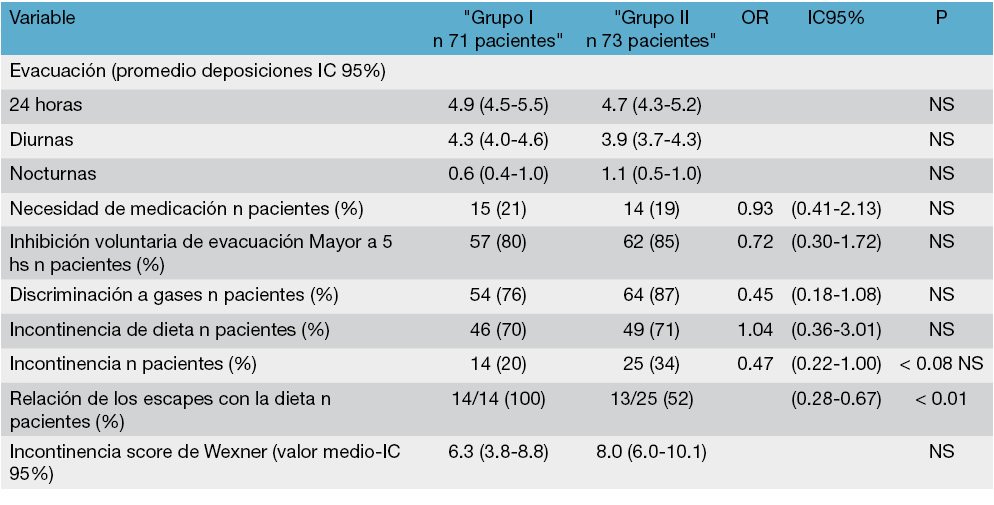
Dentro de los exámenes complementarios la tomografia computada nos permitira evaluar si la colección esta confinada a la pelvis o si hay compromiso abdominal, así como también realizar el diagnóstico diferencial entre un flemón (estadío temprano), el cual presenta buena respuesta al tratamiento con antibióticos de amplio espectro o de una colección líquida pélvica (foto 77).
Foto 77: TC que muestra colección pélvica pop sepsis.
En caso de colección peri reservorio, la misma se drena a través de la bolsa pudiendo realizar lavados por el cabo distal de la ileostomía, generalmente este gesto asociado a antibióticos de amplio espectro es suficiente en mas del 90% de los casos. En algunos esta dehiscencia dará lugar a una fístula o seno el cual demorara el cierre del ostoma. Otras veces se requerirá el cierre del cabo distal del mismo o su divorcio, para evitar el paso de materia fecal.
Algunos cirujanos prefieren colocar un catéter de drenaje a través de la dehiscencia de la anastomosis,19 gesto que nuestro grupo excepcionalmente utiliza. Esta formalmente contraindicado drenar la colección a través de la vagina o de la piel perineal, ya que esto provocara una fístula de difícil resolución.
En casos de colecciones intraabdominales localizadas, el drenaje percutáneo se encuentra indicado, pero cuando estamos en presencia de una sepsis abdominal (2-6%), la laparotomía es la regla y el pronóstico es ominoso en cuanto al futuro del reservorio.
En nuestra experiencia los pacientes que requirieron drenaje quirúrgico, tuvieron mayor porcentaje de remoción de la bolsa y peores resultados funcionales, comparados con los que no fueron operados.9,19
En aquellos casos en que la coloproctectomía restaurativa se realizó en una sola etapa, es mandatorio la laparotomía precoz con confección de ileostomía desfuncionalizante.
Absceso entre el manguito y el reservorio ileal
Cuando de describió esta técnica se realizaba una mucosectomía amplia con manguitos de 5 o más centímetros de longitud y anastomosis manual, observándose la posibilidad de desarrollar colecciones entre el reservorio ileal y la muscular denudada de mucosa. Los pacientes presentaban proctalgia, secreción anal, fiebre y sensación de pujo. El diagnóstico se realizaba durante el examen bajo anestesia momento el cual también se efectuaba el drenaje.19,25
Dehiscencias anastomóticas
Las dehiscencias de anastomosis pueden ser causa o efecto de una sepsis pélvica. Son su efecto cuando la colección pélvica al buscar su drenaje espontáneo lo hace a través de la zona de menor resistencia, o ser consecuencia de su drenaje transanal. Otras causas son las anastomosis a tension o mal vascularizadas.6,20,22
Su diagnóstico se realiza a través del examen bajo anestesia, el cual mediante el tacto nos permitirá evaluar la discontinuidad de la línea de sutura (ileoanal). En caso de sospechar dehiscencia de la punta o del cuerpo de la J, la tomografía computada o radiografía contrastada con material hidrosoluble endoanal es de elección. La fibrosis y estenosis22 podrán ser resultado de la cicatrización de esta complicación.
Las dehiscencias parciales tardías suelen encontrarse en los pouchogramas que se realizan previo al cierre de ileostomía, en general son asintomáticas y la persistencia de la ileostomía por más tiempo es la solución. En algunos casos dará lugar a senos que pueden ser asintomáticos y no requerir tratamiento o pueden dar lugar a fiebre, dolor y supuración por lo cual deben ser tratadas con un flap avanzado de mucosa, sección del tabique formado entre el seno y la pared intestinal mediante el uso de tijera laparoscópica, intentar obliterar el trayecto con adhesivos de fibrina o con sistema vacuum,26-28 o realizar descenso del pouch y nueva anastomosis ileoanal.
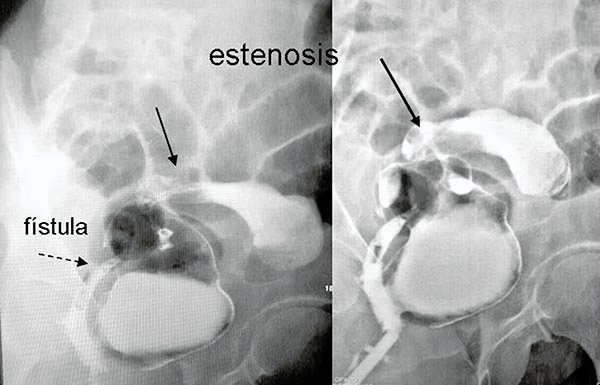
Fístulas (foto 78, 79)
Las fístulas relacionadas con el reservorio pueden presentarse en cualquier momento luego de la cirugía, pero suelen hacerlo algunos meses después,29 su incidencia es del 4 al 16% y su tratamiento suele ser dificultoso. Estas pueden originarse en cualquiera de las suturas del reservorio y comunicarse con la pared abdominal, vagina, periné o vejiga entre otros. Entre sus causas se encuentran: 1. la sepsis pelvica; 2. los errores técnicos: fallas en el disparo de la sutura mecanica, utilización de engrapadoras con ganchos pequeños que producen isquemia, atrapamiento de la cara posterior de la vagina en la linea de sutura; 3. fallas en la confección del reservorio; 4. en caso de anastomosis manual dejar un manguito residual inadecuadamente largo (>2-3 cm), mucosectomía dificultosa; 5. Tension en la anastomosis; 6. Erosión o decúbito del agrafe sobre la vagina; 7. Enfermedad de Crohn insospechada.
Las fístulas pueden ser asintomáticas o producir síntomas incapacitantes y requirir múltiples cirugías con resultados poco alentadores, generando malos resultados funcionales alejados o persistencia de la ileostomía con importante deterioro de la calidad de vida o requerir hasta la remoción del reservorio.
Las fístulas reservorio vesicales son extremadamente raras,6,30 se presentan con los mismos síntomas de las fístulas entero o colovesicales. Su tratamiento consiste en la resección del trayecto fistuloso con cierre de los orificios en la vejiga y la bolsa, si se preservo el omento una buena opción es su interposición.6
Foto 78: Fístulas de la anastomosis íleoanal.
Foto 79: Fístula del cuerpo del pouch.
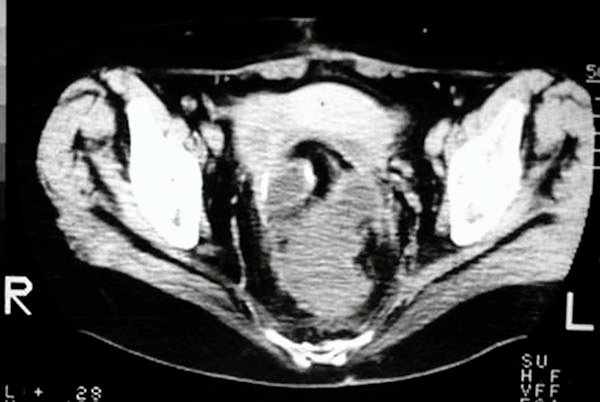
Fístulas reservorio - vaginales (FRV) (fotos 80, 81)
La fístula entre el pouch y la vagina es una seria complicación que se presenta con una incidencia del 2 al 16%.19,21,31-33 Nuestro grupo presenta una tasa de FRV del 10,8%, siendo uno de los factores más importante en su desarrollo el cambio de diagnóstico hacia EC.32 Entre sus causas, además de las descriptas anteriormente, se encuentran las lesiones advertidas o inadvertidas del tabique recto vaginal durante la disección de la cara anterior rectal, y menos frecuentemente las criptoglandulares.
El sitio principal de desarrollo de las FRV es la anastomosis ileoanal, seguida de otra región del reservorio. Un estudio del St. Marks encuentran que el 76% de estas se origina en la anastomosis ileoanal, el 13% en el reservorio y un 10% tienen origen criptoglandular.31,34
Estas fístulas pueden ser oligosintomáticas o ser realmente un problema para las pacientes luego del cierre de la ileostomía, pudiendo pasar inadvertidas mientras se mantiene desfuncionalizada.
Si la paciente es asintomática u oligosintomática, la conducta expectante podrá llevar al cierre de la misma (con un tiempo mínimo de espera de 6 meses).32,35 En nuestra experiencia con esta conducta 8 de 23 pacientes respondieron (5 tenían aun la ileostomía y a 3 ya se les había cerrado y no fue necesaria rehacerla).
La vía de abordaje dependerá del sitio donde se origina la fístula. Si esta se origina en la anastomosis ileoanal el abordaje endoanal o transvaginal es lo indicado, en aquellos casos en que la fístula es alta (a nivel del anillo anorrectal o mas arriba) el abordaje abdominal o abdominoperineal es lo apropiado.
En aquellas pacientes sintomáticas se han descripto múltiples técnicas asociadas a la derivación intestinal que van desde la utilización de adhesivos de fibrina y botones o plug hasta el flap avanzado de mucosa,7,35,36 la colocación de sedales, la reparación interponiendo los músculos elevadores previo cierre de los dos orificios, la interposición del músculo recto interno de la pierna o mediante la liberación, descenso de 36035-38 y sección del segmento distal de la bolsa con nueva anastomosis a nivel de la línea dentada.
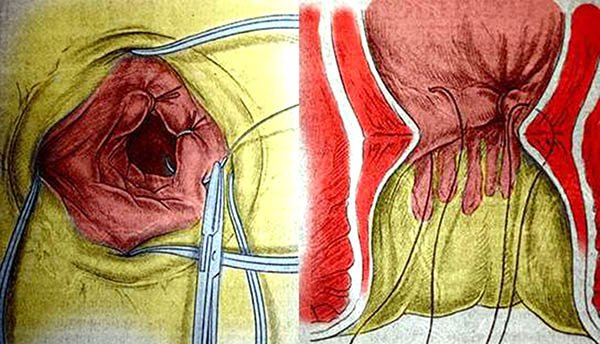
Las fístulafístulas bajas pueden ser resueltas a través de un colgajo de avance mucoso a través de un abordaje transanal o transvaginal, este último evita lesionar los esfínteres, se realiza una incisión en U o en T invertida en la cara posterior de la vagina y esta se diseca del reservorio. El orificio en el íleon es resecado y se cierra el defecto en forma transversal con material reabsorvible. Luego se cubre con el colgajo de vagina y se reseca el extremo en el cual se encontraba el orificio19,39 (dibujo 17). Las tasas de éxito obtenidas con este abordaje varian del 27 al 78,6%.35,40 Gorgun y cols.,6 al igual que nuestro grupo, prefiere la reparación de la fístula desde el lado del reservorio, ya que este es el lado de mayor presión, estos encontraron 60 mujeres con FRV, a la mayoría de ellas se las trato con métodos locales (el más frecuente fue el flap ileal), realizandose al 65% una ileostomía derivativa, obteniendo curación en el 44% de las pacientes con la primer cirugía y luego 4 más a las que se les realizó un nuevo colgajo ileal.
Esta complicación es una de las causas más frecuentes de fallos y remoción del reservorio, la mitad de las pacientes con FRV presentan una buena evolución, un 25% si bien mantiene el resevorio, presenta secresión por vagina y el 20-35% requieren ileostomía derivativa o remoción del repertorio.9,40,41
El uso de adhesivos de fibrina y de botones o plug anales, sin bien no tiene morbilidad, tiene un alto costo en nuestro medio y altas tasas de fracasos tanto a nivel nacional como internacional (foto 82).42
Foto 80: Fístula pouch vaginal baja.
Foto 81: Pouchogramas que muestran fistulas pouch vaginales.
Dibujo 17: Secuencia de reparación de fístula pouch vaginal desde vagina.
Foto 82: Colocación de adhesivo de fibrina en fistula pouch vaginal.
Fístulas perianales e ileoanales
Las fístulas perianales e ileoanales tempranas son consecuencia de defectos técnicos, dehiscencia de sutura o el resultado de un absceso, en tanto que las tardías son secundarias a infección criptogenética o a una enfermedad de Crohn.
Estas son tratadas al igual que las criptogneticas dependiendo de la cantidad de esfínter involucrado, en las superficiales podrá realizarse una fistulotomía, en caso de comprometer gran cantidad de masa esfinteriana puede utilizarse un sedal. Las originadas en la anastomosis ileoanal son más difíciles de resolver, ya que por su origen más alto involucran la totalidad del esfínter, entre las opciones terapéuticas se encuentran el colgajo de mucosa o descenso y la reanastomosis ileoanal con o sin ileostomía desuncionalizante.6,9,24
Fístulas reservorio- cutánea o entero cutánea
Las fístulas del reservorio ocurren como consecuencia de complicaciones sépticas relacionadas al pouch, dehiscencia de las anastomosis, del extremo del asa eferente o de una lesión inadvertida del intestino delgado. Aquellas que aparecen en postoperatorio alejados son sospechosas de una enfermedad de Crohn no diagnosticada.19
Las fístulas enterocutáneas se originan generalmente en una injuria inadvertida del intestino delgado luego de la coloproctectomía o del cierre de la ileostomía,19 en general, de ser dirigida y de bajo debito, en ausencia de colecciones interpuestas, líquido libre u obstrucciones distales, el tratamiento conservador con nutrición parenteral total o dietas de absorción alta puede ser suficiente.
En el caso de que se origine en el reservorio y el paciente aun se encuentre con una ileostomía desfuncionalizante, la permanencia de esta última por un lapso mayor de tiempo puede ser suficiente para su cicatrización, de persistir será necesario la laparotomía con resección del trayecto fistuloso y cierre del orificio con preservación del ostoma.
La presentación aguda de fístulas enterocutáneas, se deben en general a dehiscencia de la punta o del cuerpo de la J o a lesiones del intestino delgado inadvertidas, que suelen acompañarse de peritonitis, siendo la regla la laparotomía.
La fuga en la punta de la bolsa J es menos frecuente que la fuga anastomótica, pero también se la ha asociado a un mayor riesgo de fallos del reservorio.43 Para evitar esto, algunos autores sugieren realizar un corte oblicuo en el intestino delgado y no una sección transversal.29 En nuestra experiencia, en los 10 casos observados, la sintomatología se presentó después del cierre ileostomico, en general en forma aguda con peritonitis, excepto un paciente que se opero en forma programada y que el hallazgo fue una fístula de la punta de la J al delgado proximal, el mismo a los 2 años desarrollo afectación perianal severa por lo cual se reseco la bolsa.
Kirat y cols.44 en un estudio previo que incluía 27 pacientes con fuga de la punta de la “J”, encontraron que los síntomas predominantes eran el dolor abdominal y la fiebre. En este grupo el 93% de los pacientes requirió cirugía, a un paciente se le reseco el reservorio, a 25 se le realizó salvaje de la bolsa (23 reparaciones y 2 nuevas bolsas). Existen varios reportes con tratamiento endoscópico para esta complicación.45 Lian y Shen46 describen la primera resolución endoscópica en una paciente de 58 años, afebril y con síntomas crónicos. El procedimiento consistió en lavado y debridamiento de la fístula, con posterior cierre del mismo con clips tipo garra de oso mediante un procedimiento tipo OTSC (Ovesco), presentando buena evolución. Posteriormente el mismo grupo presenta 12 casos con la misma técnica con un éxito del 66,6%.47
11.1.2 Complicaciones no sépticas
Oclusión intestinal
La oclusión intestinal es la complicación más frecuente no relacionada al reservorio luego de la coloproctectomía restaurativa, reportandose una incidencia que varia del 6,72 al 35%,1,7,18,19,22,31,48,49 mayoritariamente después del cierre de la ileostomía, por lo cual algunos autores sugieren que al evitar la ostomia de protección su incidencia disminuiría,19 ya que una de las causas de obstrucción es la disminución del calibre intestinal a nivel de la anastomosis termino terminal, hecho que parece haber disminuido al realizar esta anatomosis con sutura mecánica latero lateral.
Esta complicación no depende de la experiencia del equipo quirúrgico y se debe en la mayoría de los casos a adherencias, bridas, hernias internas, volvulos o torsiones relacionadas con la ileostomía.19,22,31,48 Para Bennis y cols.20 si se confirma en estudios con gran número de pacientes y seguimiento a largo plazo, el desarrollo de menos adherencias con el abordaje laparoscópico, este debería asociarse a menos cuadros de oclusión intestinal. Los pacientes generalmente debutan con cuadros suboclusivos que mejoran rápidamente con reposo digestivo, colocación de sonda nasogastrico y reposición hidroelectrolitica; aunque un 25%19 a 1/3 de los pacientes51 van a requerir una reoperación con la finalidad de solucionar la causa de la oclusión.
Se han ideado estrategias para evitar la formación de adherencias.18 Becker y cols. llevaron a cabo un ensayo multicéntrico controlado aleatorizado con una barrera bioreabsorbible de hialuronato de sodio, encontrando una reducción de las adherencias. Posteriomente el mismo grupo presenta la utilización de glicerol hialuronato/carboximetilcelulosa encontrando que si bien la tasa de adherencias a la linea media disminuía, su utilización se asociaba a mayores complicaciones infecciosas.53
Hemorragia del reservorio
La hemorragia del reservorio suele ocurrir en el postoperatorio inmediato, se presenta con una incidencia del 1,6% al 7% y generalmente se debe a sangrados que se producen en las lineas de sutura, el mejor tratamiento es la prevención por lo cual antes de realizar la anastomosis ileoanal debemos cerciorarnos de que la bolsa no sangre a través de la colocación de una gasa desplegada dentro de la bolsa para constatar la ausencia de sangrado, en caso contrario se deberá evertir el pouch como dedo de guante y cohibir la hemorragia con puntos o fulguración.7
En caso de que el sangrado se presente en el postoperatorio si el mismo compromete el estado hemodinámico del paciente debe efectuarse un examen bajo anestesia que permita irrigar el reservorio con agua helada e identificar el sitio de sangrado el cual puede fulgurarse, suturarse o coagularse con una inyección de una solución de adrenalina 1:10000.1,2,7,19,21,22 En caso de no individualizar el sitio de sangrado dentro de la bolsa y que la hemorragia continue una opción es colocar gasas compresivas en el interior de la misma.
La hemorragia menos frecuentemente se da secundariamente a una sepsis pelvica, requiriendo examen bajo anestesia, hemostasia y resolución de la misma. Los sangrados intraabdominales pueden deberse a lesiones de los vasos mesentericos, del lecho de la colectomía, vasos pre sacros (si la disección fue inadecuadamente fuera de plano), o de los vasos de la pared lateral pélvica requiriendo laparotomia y excepcionalmente el desmonte del reservorio. En aquellos casos de hemorragia pélvica incontrolable el taponaje de la pelvis puede estar indicado, con posterior control a las 48 horas (second look).21
Los hematomas de la pared del reservorio son una rara complicación que pueden llevar a la formación de tejido de cicatrización que dará lugar a una pobre función 22 o a fugas en la bolsa, Sagar y cols.19 sugieren tratar a estos pacientes con antibióticos de amplio espectro, realizar una observación cuidadosa y colocación de un catéter transanal para mantener la bolsa descomprimida y relativamente vacía.
Complicaciones genitourinarias
Como cualquier cirugía pélvica en la coloproctectomía restaurativa existen riesgos de complicaciones genitourinarias, las cuales se deberán fundamentalmente a la lesión inadvertida del plexo hipogástrico, observandose más frecuentemente cuando se realiza la proctectomía por fuera de la fascia propia del recto (resección total del mesorrecto) evitable con una disección dentro de esta, como así también mantener el eje mesentérico inferior hemorroidal superior para no lesionar los plexos simpáticos y parasimpáticos precavoaórticos.7,54 Siendo otra causa la sépsis pélvica y las secuelas cicatrizales.55,56
La retención urinaria en el postoperatorio inmediato se presenta aproximadamente en el 5%55,56-16%57 de los operados y usualmente es transitoria, en tanto que la vejiga neurogénica es extremadamente rara.55,56 Otras alteraciones que pueden ocurrir son: la hipocontractilidad del músculo detrusor, la incompetencia del cuello vesical, perdida de la compliance de la vejiga y obstrucción de la salida vesical.
Si bien se ha asociado un mayor riesgo de daño cuando se realiza la resección total del mesorrecto, la mejor visualización y la purificación de la técnica hacen que los nervios se puedan preservar, no encontrando diferencias en la actualidad entre las disecciones.58,59 Slors y cols.60 en 76 pacientes a los que le realizó la resección por fuera de la fascia propia del recto no encuentra complicaciones vesicales severas, mientras que Lindsey y cols.61 tampoco pueden demostrar los beneficios de una disección más cercana al recto en lo referido a los trastornos sexuales, no encontraron diferencias significativas en las tasas de impotencia parcial y completa entre ambas disecciones, siendo para la impotencia completa de 2,2% en la disección cercana a la pared vs 4,5%, cuando se realiza por fuera de la fascia propia del recto (P=0.67). Para la impotencia parcial las tasas fueron de 13,5 % vs 13,3% (P=0.99).
Las complicaciones genitourinarias se presentan en un 1-27%.57 En hombres la función eréctil es mediada por el parasimpático, mientras que la eyaculación por el simpático. La impotencia ronda el 0-25,7 % y la eyaculación retrógrada 0-19% por injuria nerviosa,2,7,21,61,62 el sildenafil ha demostrado mejorar la disfunción eréctil pero no tiene impacto sobre la eyaculación retrograda.
Sunde y cols.63 encontraron que la funcionalidad del reservorio en mujeres puede relacionarse con la actividad sexual, empeorando cuando la función es pobre y mejorando cuando los resultados de la cirugía son satisfactorios. En concordancia Metcalf y cols.64 encontraron que en un 49% de pacientes que tenían disfunciones sexuales previas a la cirugía, su actividad sexual se incrementaba luego debido a un mejoramiento de la salud en general. Por otro lado Pemberton65 refiere un 7-8% de dispareunia y Farouk y cols.66 mencionan un 19% de restricción postoperatoria de la actividad sexual, debido a dolor pélvico a causa de deformación postoperatoria de los anexos y alteración de las secresiones vaginales o miedo a escapes durante el acto sexual. Millan Scheiding y cols.33 refieren que hasta un 20% de las mujeres presentaran dispaurenia o incontinencia fecal durante el coito.
Varios estudios mostraron que luego de la cirugía la fecundidad puede verse reducida. Johnson y cols.67 encuentran que hasta un 40% de las mujeres operadas presentan dificultades para embarazarse; entre las causas se señala la disección pélvica con adherencias que involucran las trompas de Falopio.68-71 Aunque en los últimos tiempos esto se ve mejorado debido a la cirugía laparoscópica.72
En cuanto a la vía de parto, tanto la vía vaginal como una cesárea pueden ser realizadas.7,71,72 Varios autores han hallado lesiones ocultas en los esfínteres que en general no se traducen en peor función de los reservorios a mediano plazo.21,73,74 Tendremos en contra la primera el riesgo de la continencia, el cual seria importante en aquellos casos de alto riesgo de injuria obstétrica (parto instrumental, episiotomía, feto de mas de 4 kg, trabajo de parto prolongado mayor a 2 hs.).72 La decisión acerca de la forma de parto deberá consensuarse con la paciente y el obstetra.
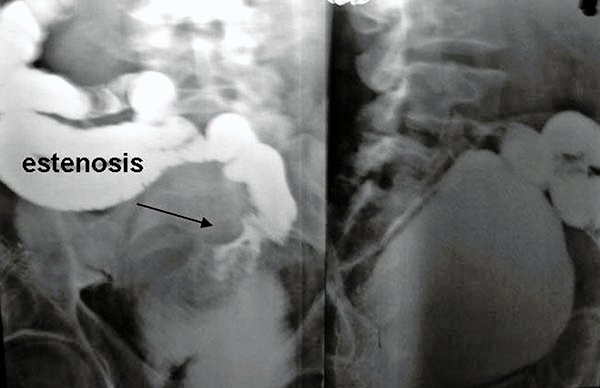
Estenosis
La disminución del calibre de la anastomosis ileanal no es un hallazgo infrecuente, pero debido a que las heces suelen ser blandas o líquidas, generalmente son asintomáticas y ceden fácilmente a la dilatación digital. Se describe que alrededor del 8-4019,21,22,24,31,48,50 de las estricturas presentan síntomas tales como diarrea, urgencia evacuatoria, constipación y sensación de evacuación incompleta.
Dentro de las causas encontramos los abscesos en el manguito residual, las suturas circulares de diámetro pequeño (menor a 28 mm), las anastomosis a tensión o dehiscencias parciales de la misma.19,22 De acuerdo a su longitud y a la presencia de fibrosis se podrán caracterizar y dar una idea de la posible respuesta al tratamiento, siendo las estenosis cortas y no fibróticas las que mejor responden a las dilataciones.75
El tratamiento es la dilatación digital, con bujías de Hegar o con balones (nuestro grupo prefiere los de acalasia de 2,5-3 cm de diámetro) (foto 83). Otra técnica, para estenosis cortas menores de 1 cm. es la descripta por Benoist y col.,76 la cual consiste en colocar entre 4 y 6 puntos separados de material reabsorbible tomando la circunferencia estenótica, esto produce isquemia y necrosis, ampliando la boca anastomótica, se debe tener especial cuidado en la cara anterior para no involucrar la vagina (dibujo 18).
Dibujo 18: Puntos de Bonoist adaptado.
Foto 83: Dilatación con bujías de estenosis de anastomosis íleoanal.
En aquellas que son refractarias se puede resecar la estenosis y confeccionar un colgajo de mucosa del íleon sobre el área extirpada si la estenosis es corta y la bolsa flexible; desconexión transanal de la bolsa con descenso de 360 de la misma o raramente la resección de la bolsa con ileostomía permanente.
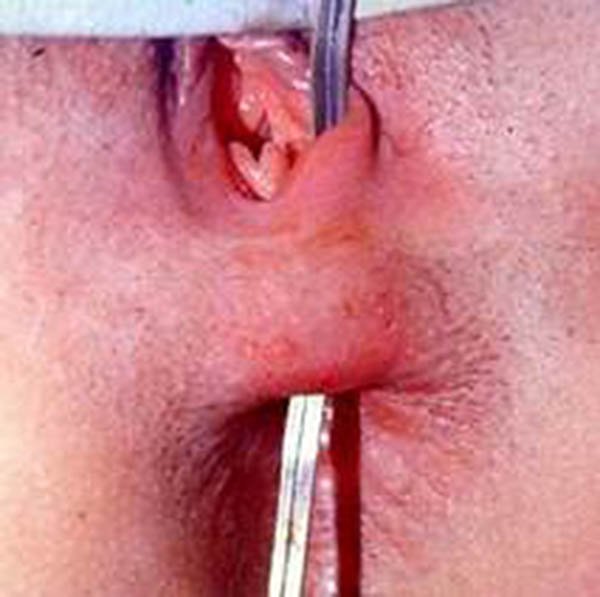
Cuando las estenosis se ubican dentro de la bolsa o en el asa aferente debemos sospechar de un diagnóstico tardío de enfermedad de Crohn (foto 84, 85). Dichas estenosis se pueden identificar a través de pouchogramas (pouch por enema doble contraste) y luego manejados endoscópicamente por medio de una dilatación endoscópica con balón, si esto no fuera posible y se certifica la enfermedad de Crohn la resección del reservorio no debe ser descartada.19,21,22,31
Foto 84: Estenosis de pouch en J.
Foto 85: Estenosis en pouch en S.
Trombosis venosa portal
El riesgo de desarrollar una trombosis venosa portal es 3 veces mayor en los pacientes con enfermedad inflamatoria intestinal que en la población general, el riesgo aumenta particularmente en la enfermedad activa, la presencia de sepsis y en el postoperatorio. Los pacientes se pueden presentar con un ileo postoperatorio prolongado, dolor abdominal, fiebre, distensión, nauseas, vómitos y leucocitos, o ser asintomáticos y ser un hallazgo de la tomografía.19,22,77.78 La trombosis venosa portal sintomática se presenta en el 6% de los pacientes sometidos a coloproctectomía restaurativa y hasta en un 40% cursa en forma asintomática (incidencia 40-45%);19,22,48,78 siendo su tratamiento la anticoagulación por 3 a 6 meses.19 Ball y cols.78 encontraron que pacientes que presentan trombosis venosa de la porta serian más propensos a desarrollar pouchitis posteriormente.
Necrosis del reservorio
Es una rara complicación que puede darse en forma temprana debido a una mala vascularización del reservorio con una incidencia de 0,701,79 - 3,57%,80 se observaba más frecuentemente cuando la operación se realizaba con mucosectomía rectal y sutura manual a nivel de la línea de las criptas, lo que requería la ligadura de troncos o arcadas vasculares para que el ápice de la bolsa alcanzara comodamente el conducto anal. En nuestra serie solo se presentó un caso en un paciente operado en otra institución por megacolon tóxico, al cual se le había ligado la arteria ileobicecoapendiculocolica y resecado un sector importante de íleon.
También se puede presentar como una complicación crónica en forma secundaria a volvulos de intestino delgado con compromiso vascular, aunque con una incidencia mínima, informada generalmente solo como presentación de casos.81
Las alternativas quirúrgicas son la resección del reservorio con ileostomía definitiva o la realización de un nuevo reservorio si la longitud del intestino delgado permite su realización y la anastomosis sin tensión.
Pouchitis
La pouchitis es la inflamación inespécifica de la mucosa del reservorio ileal reincidente que se presenta con diarrea con o sin sangre, urgencia evacuatoria, distensión abdominal, fiebre y dolor que generalmente se da en pacientes con coloproctectomía restauradora por colitis ulcerosa y muy raramente en aquellos con poliposis adenomatosa familiar, presentándose antes o después del cierre de ileostomía. El hospital Saint's Marks de Londres, la define por una tríada compuesta por: diarrea, manifestaciones inflamatorias endoscópicas y evidencia histológica de inflamación aguda, mientras que para la Clínica Mayo este síndrome se caracteriza por un incremento de la frecuencia y del contenido líquido de las deposiciones, restos de sangre en las heces, asociados a urgencia evacuatoria, incontinencia, dolor cólico abdominal, mal estado general y fiebre.7 Según el indice de actividad de la pouchitis (Tabla 34) esta se define cuando presenta un puntaje mayor a 7.
Si bien su etiología es desconocía se ha propuesto como posibles mecanismos al desarrollo de CU en áreas de metaplasia colónica y sobrecrecimiento bacteriano,21,33 donde juega un papel muy importante larespuesta inmune del huésped y la microbiota del reservorio.33,82-84
Aquellos pacientes en los cuales se sospecha pouchitis deberán ser sometidos a endoscopia baja y biopsia del reservorio, pudiendo observarse en el estudio una apariencia endoscópica similar a la CU con puntillado hemorrágico, perdida del patron vascular, muco secreción, material purulento, fibrina y la presencia de ulceraciones superficiales; los hallazgos histopatológicos que podrán observarse incluyen infiltración de leucocitos polimorfonucleares con ulceración superficial, sobre cambios inflamatorios crónicos21 y microabscesos cripticos.
Tabla 34: Reporte de casos de vólvulos del pouch
|
referencia |
tipo de reservorio |
resolucion |
|
Ullah y cols. 2007 |
W |
redo |
|
Jain y cols. 2010 |
J |
redo |
|
Warren y cols. 2010 |
? |
pexia del reservorio |
|
Arima y cols. 2013 |
J |
pexia del reservorio |
|
Tyagi y cols. 2014 |
S |
pexia del reservorio |
|
Mullen y cols. 2016 |
J |
cierre de la brecha mesenterica |
|
Muñoz y cols. 2017 |
J |
redo |
|
Udaondo 2017 |
J |
pexia del reservorio |
Es la complicación más frecuente del reservorio ileal en pacientes con CU y se estima que su incidencia es de alrededor del 40-50% a 10 años,19,31,33,48,82-84 pudiendo alcanzar a un 70% a los 20 años.19 Puede ser aguda o crónica dependiendo del tiempo de duración, considerándola crónica cuando los síntomas persisten por más de 4 semanas. Desde otros puntos de vista también se puede clasificar en:
- Idiopática o secundaria;
- En remisión o activa;
- Infrecuente (menos de 3 episodios al año) o frecuente (más de 3);
- y según su respuesta a los antibióticos en respondedora, antibiótica dependiente o refractaria.
Existen factores pre, peri y postoperatorios relacionados a un mayor riesgo de desarrollar pouchitis,7,21 y contrariamente a lo que sucede en la Enfermedad de Crohn el habito tabaquico parecería tener un efecto protector, reduciendo la incidencia de pouchitis.82,86,87 Entre los primeros se discuten la influencia de la severidad y extensión de la enfermedad (considerados en un inicio factores influyentes, parecen no serlo) la presencia de manifestaciones extracolónicas (generalmente coinciden sus exacerbaciones con los episodios de pouchitis), la presencia de colangitis esclerosante primaria (teniendo un riesgo acumulativo a 10 años del 79%),90 los polimorfismos del gen antagónico del receptor de la Interleucina-1, la presencia de anticuerpos citoplasmáticos de neutrófilos perinucleares82 y el aumento del mediador leucotrieno B4.91
Shen y cols.85 publican, en el año 2006, un estudio sobre 240 pacientes sometidos a coloproctectomía restauradora (61 con pouchitis), encontrando como factores de riesgo a los que presentaban displasia OR 3,89, los no fumadores OR 5.09, los que nunca habían usado ansioliticos OR 5.19 y los que utilizaban Aines OR 3.24. Dentro de los factores perioperatorios se adjudicada un mayor riesgo dependiendo del número de etapas operatorias, la presencia de sepsis pélvica, desnutrición, isquemia y posible denervación esfintérica.7 Datos recientes sugieren que el desarrollo de pouchitis es independiente de la técnica quirúrgica con respecto a la construcción del reservorio, el uso de ileostomía de protección y del tipo de abordaje.72,92-94
En relación a los factores postoperatorios han sido implicados en un mayor riesgo la presencia de estenosis, el cambio de la flora bacteriana, la pérdida de los factores tróficos mucosos, la disminución de la inmunidad de la mucosa, el incremento de la citotoxicidad de los ácidos biliares y el aumento de los niveles de factor activador de las plaquetas u oxígeno derivado de los radicales libres, causados por la isquemia mucosa transitoria y el back wash ileitis.7,83
Se define como ileitis pre reservorio a la inflamación del asa inmediatamente previa al reservorio (asa aferente) que generalmente se asocia a inflamación del reservorio y suele responder al tratamiento con antibióticos.
El tratamiento de primera linea son los antibióticos ciprofloxacina 500 mg cada 12 hs o metronidazol 500 mg cada 8 horas, con excelentes tasas de respuesta. Hurst y cols.95 encuentra una tasa de mejoría con metronidazol o ciprofloxacina del 96%. En las formas crónicas el uso en conjunto de ambos antibióticos ha demostrado buenos resultados. En los últimos años se ha comenzado a dar importancia al uso de probióticos ya que parecería que disminuyen el número de recaídas manteniendo el tiempo de remisión.21,82
Holubar y cols.99 en una revisión de 11 trabajos randomizados, encuentran que para el tratamiento de la pouchitis aguda la cirpofloxacina fue más efectiva para inducir la remisión que el metronidazol, mientras que en las formas crónicas el uso de probióticos fue más efectivo que el placebo en mantener la remisión. Aunque posteriormente estos hallazgos fueron corroborados nuevamente pero con evidencia de baja calidad por el mismo grupo.97
Otras alternativas son el uso de salicilasozulfopiridina 1gr. cada 6 horas, corticoides orales o en enemas, supositorios de 5 ASA, enemas con sucralfrato, amoxicilina-clavulánico, eritromicina, tetraciclina, mesalazina, enemas de ciclosporina, azatioprina, ácidos grasos de cadena corta, alopurinol, infliximab.7,19,21,82
La mayoría de los cuadros agudos revierten con tratamiento médico pero alrededor de un 5-15%7,98 puede pasar a la cronicidad, en algunas ocasiones la pouchitis se torna crónica e intratable y presenta los mismos problemas que llevaron a la coloproctectomía restaurativa, en estos casos se debe proceder a la remoción del reservorio situación que puede ocurrir en un 1% de todas las bolsas.
Segal y cols.98 presentan en el año 2016 una revisión sistemática y meta análisis de 21 trabajos encontrando que los antibióticos (ciprofloxacina y metronidazol), en pouchitis crónica presentan una tasa de remisión del 70% (IC del 95%: 50-90%) y los agentes biológicos lo hacen en un 53% (95% IC: 30-76%) ambos con P <0,001. Si bien el bismuto también indujo significativamente la remisión tuvo un gran intervalo de confianza, lo que sugiere que el verdadero efecto se desconoce. Los esteroides y el tacrolimus si bien indujeron remisión no lograron significación. Concluyendo que se necesitan estudios con un mayor número de pacientes.
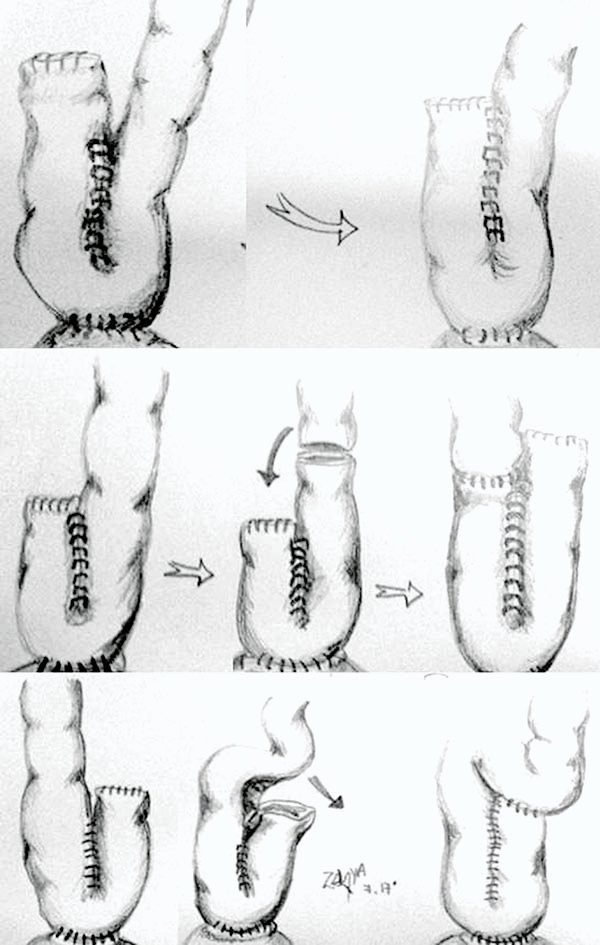
Cuffitis
La cuffitis es la inflamación del manguito residual que no es resecado en la técnica de doble sutura mecánica, presentandose en el 9-22% de los pacientes.7,21 La realización de la anastomosis entre el reservorio ileal y el ano efectuada con esta técnica deja la zona de alta presión que comprende una longitud de mucosa entre 1 y 2 cm por encima de la línea de las criptas, con lo que se logra una mejor sensorialidad, discriminación, menor cantidad de escapes y mantiene una presión normal al esfuerzo en el postoperatorio. Sin embargo, existe riesgo de inflamación, displasia y cáncer.21,83
La cuffitis se suele presentar con aumento del número de deposiciones, urgencia, disconfort y sangrado. Síntomas que suelen mejorar con el uso de supositorios de mesalazina, la cual se puede asociar en caso de no responder a ciprofloxacina 500 mg cada 12 horas durante dos semanas. En los raros casos de resistencia al tratamiento médico o la asociación con displasia, estará indicada la mucosectomía con una nueva anastomosis ileoanal.99-101 La mucosa residual debe ser disecada del músculo rectal por vía perineal. Para facilitar la disección se inyecta la submucosa con una solución de adrenalina 1:100000, la disección con mucosectomia deberá ir desde la línea pectinea hasta el nivel de la anastomosis ileo anal, se debe liberar luego el reservorio en forma radial para luego poder descenderlo hasta la línea de las criptas y anastomosarlo con sutura manual.
Esta técnica es compleja y puede ser de muy difícil realización cuando existe fibrosis y cicatrices extensas. La probabilidad de éxito del procedimiento se puede juzgar mediante la colocación de un dedo en la parte inferior de la bolsa, para ver si se puede deslizar libremente hacia el suelo pélvico. La falta de movilidad de la bolsa puede impedir la construcción de una anastomosis sin tensión, por lo cual se deberá recurrir a la movilización transabdominal de la bolsa para facilitar el procedimiento.19
Síndrome de reservorio irritable
El síndrome del reservorio irritable es un desorden funcional de causa desconocida con síntomas que se superponen con los de una pouchitis o cuffitis, pero sin los hallazgos endoscópicos ni histológicos (índice de actividad menor a 7), que puede encontrarse hasta en un 28%21- 42,6%102 de los pacientes. Estaría relacionado con el síndrome de intestino irritable previo a la realización del pouch, aunque estudios manométricos revelaron que podría aparecer de novo después de la ileoanoanastomosis debido a alteraciones sensitivo motoras de la bolsa.102
Su diagnóstico es de exclusión, se deben eliminar los diagnósticos de pouchitis, cuffitis, enfermedad celiaca, intolerancia a la lactosa o a la fructosa y sobrecrecimiento bacteriano.
La mayor parte de los pacientes responden al tratamiento utilizado para el síndrome de in- testino irritable que incluye modificación de la dieta, suplementos de fibras, antidiarreicos, anticolinérgicos y terapia antidepresiva.102
11.1.3 Complicaciones poco frecuentes
Cáncer relacionado al reservorio ileal
La incidencia de cáncer relacionado al reservorio ileal es 0 a 18,5%,103-108 siendo el principal factor involucrado la presencia de adenocarcinoma en la pieza de proctocolectomía,109 otros factores son la presencia de back wash ileitis y de manifestaciones extraintestinales. Con respecto a la mucosectomía, esta no evita el riesgo de desarrollar cáncer.29,110-111
Se ha señalado que la técnica con doble sutura mecánica se podría asociar a mayor riesgo de cáncer relacionado al reservorio, encontrando Remzi y cols.112 una incidencia de displasia a nivel de la zona transicional de alrededor de un 5%. En nuestra experiencia de 40 pacientes a los cuales se les tomo biopsia de la zona anal de transición en ningún caso se encontró displasia.
M’Koma y cols.,113 en el año 2011. realizan una revisión de las publicaciones sobre cánceres relacionados a los reservorios ileales encontrando 43 casos de los cuales 32 lo habían desarrollado en la zona anal de transición pero de ellos 28 pacientes habían sido sometidos a mucosectomia. Este hallazgo se puede deber a que quedan áreas microscópicas de mucosa en la zona a anastomosar manualmente luego de la mucosectomia hasta en un 20% de los casos.29,114 Larson y cols.115 encuentran focos de mucosa remanente en el manguito en alrededor del 14% de los pacientes y hasta en un 7% a nivel de la anastomosis.
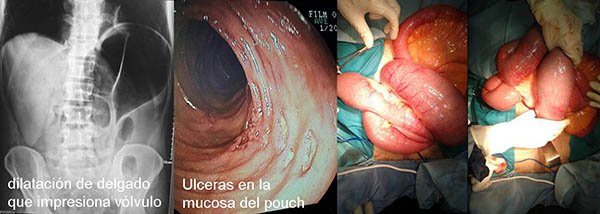
Vólvulo del reservorio o del asa aferente al mismo
El vólvulo del reservorio es una rara complicación. Existen pocas publicaciones sobre esta eventualidad y rara vez es sospechada ante cuadros suboclusivos. La tomografía computada o la enterorresonancia pueden ayudar en el diagnóstico ya que pueden mostrar una torsión del mesenterio.31 Para que pueda desarrollarse algunos autores sugieren que debe existir una falta de adherencias, mientras que algunos reportes sugieren lo contrario, otra causa descripta es la presencia de hernias internas (rotación a través de brecha en mesenterio).116 El tratamiento dependerá de la vitalidad del reservorio, en aquellos casos en que exista isquemia la resección del mismo debe realizarse siendo de elección confeccionarlo nuevamente (redo), cuando esto no es posible se realizara una ileostomía terminal. Si en cambio solo se observa la torsión del reservorio pero sin compromiso vascular que produzca isquemia, se realizara la detorsión y se fijara a través de puntos de pexia. Esto último también puede realizarse por un abordaje laparoscópico.117 Patel y cols. describen una mortalidad del 35%118 (Tabla 34).
En nuestra serie de 600 reservorios (CU y PAF) recientemente diagnosticamos en el intraoperatorio un caso. El paciente con cuadros crónicos de dolor abdominal tipo cólico, asociado a cuadros suboclusivos, presencia de pseudodiarrea y distensión abdominal e imagen en grano de café en la directa de abdomen (Fotos 86). En la laparotomía se observa elongación y dilatación del reservorio con el asa afarente al mismo y el tercio superior del mismo rotado sobre el meso, debido a que no se encontró compromiso vascular se decidió realizar la pexia del mismo al parietocolico derecho. Muñoz y cols., del mismo grupo, describen un caso (no publicado aún) de vólvulo asociado a isquemia al cual se le realiza un redo, sin mortalidad asociada.
Foto 86: Vólvulo del reservorio.
Prolapso del reservorio
El prolapso mucoso o completo del reservorio ileal es una complicación muy poco frecuente,19,31 con una prevalencia del 0,3%124- 0,4%.125 Ehsan y cols.125 realizaron una encuesta para conocer las complicaciones crónicas de la coloproctectomía restaurativa, recibieron 269 respuestas dentro de los cuales 35 indicaron que habían tratado 83 pacientes con prolapso del reservorio ileal. Los signos y sintomas incluían el prolapso transanal, sensación de obstrucción a la defecación, escurrimiento y dolor. Cincuenta y dos pacientes necesitaron cirugía realizándose reparación transanal, pexia del reservorio por vía abdominal, revisión del reservorio transabdominal o resección del mismo.
Al igual que el prolapso rectal por vía abdominal se podrá utilizar un abordaje laparotómico o laparoscópico con o sin malla. En el caso de que el prolapso sea solo mucoso puede solucionarse con agentes formadores de materia fecal, bio feedback, ligaduras elásticas, o resección transanal de la mucosa redundante.19,120 Wu y cols.126 describen el tratamiento endoscopico con ansa caliente.
Ragupathi y cols.127 presentan el primer caso de pexia del reservorio con malla asistidos por robot.
11.1.4 Complicaciones de la ileostomía
La confección de una ileostomía, si bien puede minimizar la repercusión de una sepsis pélvica, se asocia por un lado a un mayor riesgo de oclusión intestinal y por otro lado a las complicaciones de la ostomia per se. Como se ha descripto anteriormente muchas de ellas son causadas por una mala técnica, siendo el hundimiento de la ileostomía el más frecuente, otras complicaciones son la isquemia y necrosis, el prolapso, las fístulas, la dermatitis periostómica, eventraciones paraostómicas y deshidratación por exceso de debito (por ser una ileostomía localizada a un nivel alto del intestino delgado, por disfunción ileostómica o por alteraciones en la ingesta).
Después del cierre de la ileostomía el paciente puede presentar complicaciones relacionadas a la pared, tales como infección del sitio quirúrgico y eventraciones o complicaciones relacionadas con la anastomosis, tales como dehiscencia, sangrado o fístulas (0.8 a 10%) que si son de bajo debito y presentan buen tránsito distal en la mayoría de los casos cierran espontáneamente con dieta de absorción alta.
11.1.5 Otras
Disfunción del reservorio
La disfunción del pouch se caracteriza por el número exagerado de deposiciones, de escaso volumen, urgencia defecatoria e incontinencia. Las causas pueden ser obstructivas, enfintéricas o por escaso volumen del reservorio. Existen referencias de enfinteroplastias realizadas con éxito en las causas esfintéricas.18
En casos de reservorios de poco volumen (pequeños), una opción es seccionar el asa aferente, varios centímetros por encima del extremo cerrado del asa eferente, abrir este último (punta de la J) y suturarlo al extremo proximal del asa afrente seccionada luego cerrar el extremo distal de la misma, invirtiendo el sentido de la J (dibujo 19). Otro procedimiento es abrir el extremo del asa eferente y suturar un asa de delgado más próxima a modo de S o W.
Dibujo 19: Adaptada de Dehni.
Cuando el reservorio es pequeño pero existe un asa eferente larga no suturada, la ampliación de la anastomosis laterollateral, seccionando el tabique amplía su volumen. Schoetz128 ha descrito este procedimiento en forma transanal con sutura mecánica con buenos resultados. Takagi y cols.129 utilizan suturas lineales laparoscópicas guiado por endoscopía para seccionar el puente entre las asas y aumentar el volumen del mismo.130
En caso de que el asa eferente sea excesivamente larga (más de 15 cm.), esta podrá ubicarse por detrás del pouch dilatándolo, dando lugar a cuadros oclusivos; para su resolución Klinger propone una técnica similar con sutura mecánica (Dibujo 20).
En cuanto a los pacientes con un gran número de deposiciones, en general presentan excelentes resultados con tratamiento médico (uso de agentes constipantes tipo loperamida, formadores de masa asociados a baja ingesta liquida, secuestradores de sales biliares tipo resinas de colestiramina), asociado a dietas de absorción alta e hipofermentativas. Cuando todas las medidas conservadoras fallaron, existen opciones quirúrgicas como interponer un asa de yeyuno en forma antiperistáltica.
Dibujo 20: Técnica de Kingler adaptado.
11.2 FRACASO DE RESERVORIO
Se considera fracaso del reservorio a todos aquellos casos en que la bolsa se debe resecar ya sea por las complicaciones o por los malos resultados funcionales, o cuando no se puede cerrar la ileostomía. La mortalidad asociada a la excisión de la bolsa varia del 0-1.4%, mientras que la morbilidad sera del 53 al 62%,18,129 siendo una de sus complicaciones el retardo en la cicatrización del lecho perineal que podrá tratarse como se ha descripto en la EC.
La tasa de fracaso varía del 3,5 al 17% aumentando a medida que aumenta el tiempo de seguimiento de las series.2,6,9,20,21,115,132,133 Hueting y cols.134 realizan una revisión y metaanalisis de 43 estudios observacionales, encontrando una incidencia de falla de la bolsa de 6,8 a 8,5% luego de 5 años de seguimiento. Existen factores preoperatorios que hacen suponer un mal pronóstico para la continuidad del reservorio ileal, entre ellos encontramos la enfermedad de Crohn, la historia de abscesos y fístulas perianales y la hipotonia esfinteriana. Se han asociado fuertemente en los fallos tempranos la presencia de sepsis pélvica, mientras que los que ocurren tardíamente se relacionan con el mal funcionamiento o con un diagnóstico tardío de enfermedad de Crohn.
En cuanto a los factores postoperatorios la sepsis pélvica es responsable de entre el 50 y 80%17,18,132 de los fallos, otras complicaciones que llevan al fracaso son las fístulas reservorio vaginales, las estenosis anastomoticas, la pobre funcionalidad, la pouchitis intratable, la incontinencia fecal incontrolable y la presencia de neoplasia en el manguito o en el reservorio. Tulchinsky y cols.17 refieren que la pouchitis es responsable del 10% de los fracasos y la pobre función de 1/3. Fazio y cols.135 en un estudio sobre la cuantificación del riesgo de fallos del reservorio encuentran 8 factores que son predictores independientes de fallo del reservorio: el diagnóstico histopatológico (Crohn vs no Crohn), comorbilidades, antecedentes de patología anal, disminución de las presiones esfinterianas, dehiscencias o estenosis de anastomosis, sepsis pélvica y fístulas perineales.
Larson y cols.115 realizan una revisión de 10 trabajos sobre saltavaje del reservorio, encontrando una tasa del 50 al 97% como así también que 2/3 de los pacientes presentan buenos resultados clínicos (49% a 93%), aunque estos no eran tan buenos cuando la causa de la revisión de la bolsa fue una sepsis pélvica.
Antes de tomar la decision de resecar la bolsa se debe ser cauto y aguardar el tiempo que sea necesario con la ileostomía. Cuando nos enfrentamos a altas chances de resecar la bolsa se debe discutir con el paciente todos los riesgos potenciales como lesiones nerviosas, retardo de la cicatrización de la herida perineal, alto debito por la ileostomía.
11.3 CIRUGÍAS DE REVISIÓN DE LA BOLSA
Para solucionar aquellas complicaciones que no respondieron a los procedimientos locales o a la persistencia de la ostomía, se han descriptos opciones quirúrgicas que si bien todos los cirujanos deben conocer y tener en cuenta es de elección que estos pacientes se deriven a centros de referencia, ya que se asocian a una mayor complejidad técnica y a un mayor riesgo de complicaciones.
Al considerar realizar este tipo de rescate se deberá evaluar la funcionalidad de los esfínteres, la compliance de los tejidos blandos de la pelvis, revisar la anatomía patológica para descartar una probable enfermedad de Crohn (la cual se asocia a un mayor número de fallos de las cirugías de rescate), determinar el estado de salud en general y los deseos del paciente.136
Los principales beneficios se obtienen en pacientes con alteraciones funcionales por mala confección de la bolsa, por ejemplo con un asa ileal eferente excesivamente largo.137-139
Estas son definidas como cirugía radical revisional de salvaje del reservorio y van desde desmontar la anastomosis ileoanal, evaluar el reservorio y realizar una nueva anastomosis ileoanal, hasta la confección de una nueva bolsa (redo). Sus indicaciones140 pueden ser por complicaciones no sépticas como obstrucciones mecánicas al tracto de salida de la bolsa y pérdida de la capacidad de la misma o por complicaciones sépticas.
Sagar y Pellino132,138 clasifican a las indicaciones en causas mecánicas que dan lugar disfunción y entre las que se encuentran estenosis de la anastomosis ileoanal (16%), manguito rectal largo (muñon rectal retenido 13 -30%), asa eferente larga (36%), síndrome del asa aferente-asa ciega larga y móvil que produzce obstrucción del tracto de salida (1 - 1.9%), un pouch de escaso volumen o demasiado grande (0.7%), prolapso o intususcepción del reservorio 0.3% y rotación o volvulo de la bolsa; en causas infecciosas/inflamatorias tales como sepsis pélvica (40 -50%), pouchitis (40 -50%), cuffitis (15%), enfermedad de Crohn (3 - 13%).
Si bien Sagar136 contraindica estos procedimientos en complicaciones sépticas y EC, al igual que otros autores,141,142 Fazio y cols.140 la realizaron en pacientes con sepsis caracterizada por una cavidad fibrosa bien definida de absceso pélvico revestida con tejido de granulación y colonizada con microorganismos entéricos. Las indicaciones fueron senos crónicamente infectados, fístulas de la bolsa y estenosis anastomóticas obteniendo en CU una tasa del 95% de pacientes que tienen un reservorio funcional luego de 6 meses de cirugía, con un 57% de pacientes con buena o excelente calidad de vida. MacLean y cols.51 encuentran que la tasa de éxito para la revisión del reservorio llega hasta un 73,6% incluyendo las indicaciones sepsis pélvica. Baixauli y cols.143 no encontraron diferencias en cuanto a las cirugías de revisión realizadas por complicaciones sépticas (controladas) y complicaciones no sépticas.
El procedimiento consiste en la movilización cuidadosa de la bolsa, con desconexión de la misma de la anastomosis ileoanal, desde el abdomen o con ayuda de disección transanal. Si quedara mucosa rectal residual se debe realizar la mucosectomía en este momento, teniendo especial cuidado de no lesionar el complejo esfinteriano. Se procederá a evaluar el reservorio y solucionar el problema que llevo a la reoperación: la resección del muñón rectal o del asa eferente del reservorio si estas son anormalmente largas, la sección de la punta de la J si esta es larga o la remoción y realización de una nueva bolsa. La anastomosis entre el nuevo reservorio y el conducto anal se realizara en forma manual con puntos separados. Se completa la cirugía con una ileostomía de protección.138
Una técnica no convencional de salvaje de la bolsa es la inversión y rotación de 180 del mismo. Por un abordaje abdominoperineal se desconecta la anastomosis ileoanal, una vez liberado se resecan los trayectos fistulosos y se cierran, luego se rota 180 grados el reservorio y se anastomosa con el conducto anal.138,144
Una de las principales limitantes con la que nos encontraremos para realizar un nueva cirugía pélvica son las adherencias firmes en la pelvis, que en algunos casos hacen poco viable una disección segura, sin lesión nerviosa, vascular, ni ureteral, en estos casos es de buena practica que los uréteres sean tutorizados con catéteres doble J para facilitar su hallazgo y no lesionarlos. Otras, son el riesgo de complicaciones y sepsis luego de una re-anastomosis, y los pobres resultados funcionales por la fibrosis pélvica que circunda al reservorio disminuyendo su compliance.
Otra sera la longitud del mesenterio que impida que la bolsa llegue a la pelvis sin tensión, para ello se han descripto distintas tácticas:
- Denhi utiliza yeyuno con interposición ileal, en dos pacientes a los cuales se les debió resecar la bolsa por necrosis, se elige un asa de yeyuno para conformar una nueva bolsa J de 18 cm observando que esta llegue a la pelvis, se secciona el mesenterio y una vez realizado el reservorio, se interpone el intestino delgado distal entre el yeyuno proximal y la bolsa J, luego se confecciona un ostoma defuncionante.145
- Loriau y cols.146 utilizan un segmento de yeyuno interpuesto entre este y el reservorio ileal.
También se ha descripto la utilización de la curvatura mayor gástrica.
Con respecto a este último, existen pocas publicaciones, se confecciona un reservorio a expensas de la curva mayor gástrica de 20 x 6 cm, los vasos gastroepiploicos derechos son cuidadosamente disecados de la curva gástrica mayor, comenzando en su origen y progresando hacia cefálico hasta un punto situado a 15 cm de su extremo, preservando las ramas gástricas superiores. Los resultados funcionales encontrados en 5 pacientes son similares a los que se encuentran con el reservorio en J, con una media de deposiciones de 6 diarias y una nocturna, aunque con un seguimiento a corto tiempo. Una complicación importante es la relacionada a la secreción ácida, por lo cual estos pacientes están medicados con inhibidores de la bomba de protones, pudiendo estos pacientes presentar úlceras, hemorragias, escurrimiento de jugo gástrico y dermatitis.147,148
El riesgo de fallo del redo se relacionado fuertemente con la presencia de sepsis pélvica, tanto cuando fue la indicación de cirugía como cuando se desarrollo como complicación de la misma. Remzi y cols.129 sobre 502 cirugías de revisión de la bolsa, encuentran que este es el principal indicador de fallos; mientras que Tekkis y cols.149 sobre 112 operaciones encuentra que aquellas realizadas por complicaciones sépticas (39%) fallaban más que aquellas que se realizaban por complicaciones no sépticas (15%).
Fazio y cols. comienzan siempre la cirugía revisional por vía transanal, si no pueden resolver la compilación por esta vía recién allí pasaran al abordaje abdominal.
BIBLIOGRAFÍA
- Fazio VW, Wu JS, Lavery IC: Repeat heal Pouch-Anal Anastomosis to Salvage Septic Complications of Pelvic Pouches. Clinical Outcome and Quality of Life Assessment. Annals of Surgery 1998;228(4):588-597.
- Meagher AP, Farouk R, Dozois RR y colab.: J ileal pouc-anal anastomosis for chronic ulcerative colitis: complica- tions and long-term outcome in 1310 patients. Br J Surg. 1998;85:800-803.
- Gorgun E, Remzi FH: Complications of Ileoanal Pouches. Clinics in colon and rectal surgery. 2004;17(1):43-55.
- Graziano A., Masciangioli G: Ileal Pouch: Complications And Treatment en New Trends in Coloproctology. Reis Neto J.A. Ed. Revinter 2000; 295-316.
- Fazio V, et al: Ileal pouch anal anastomosis. Complications and function in 1005 patients. Ann Surg 1995; 222(2):120-127.
- Graziano A, Ramirez Rojas P Y Collia Avila K; Complicaciones de la cirugía de la rectocolitis ulcerosa. Cirugía Digestiva, F. Galindo. www.sacd.org.ar, 2009; III-352, pág. 1-15.
- Dozois RR, Kelly KA, Welling DR, et al. Ileal pouch-anal anastomosis: comparison of results in familial adenomatous polyposis and chronic ulcerative colitis. Ann Surg 1989;210:268-273.
- Ganschow P, Warth R, Hinz U, et al: Early postoperative complications after stapled vs handsewn restorative proctocolectomy with ileal pouch-anal anastomosis in 148 patients with familial adenomatous polyposis coli: a matched-pair analysis. Colorectal Disease 2013;16, 116–122.
- Barton JG, Paden MA, Lane M, Postier RG. Comparison of postoperative outcomes in ulcerative colitis and familiar polyposis patients after ileoanal pouch operations. Am J Surg 2001; 182: 616–20.
- Heuschen UA, Hinz U, Allemeyer EH et al. Risk factors for ileoanal J pouch related septic complications in ulcerative colitis and familial adenomatous polyposis. Ann Surg 2002; 235: 207–16.
- Gualdrini U; Graziano A; Lumi C; et al: Resultados funcionales a largo plazo luego de la coloproctectomía con reservorio ileal en pacientes con y sin complicaciones postoperatorias Acta Gastroenterol Latinoam 2007; 37(3): 143-149.
- Schoetz DJ Jr. Coller JA, Veidenheimer MC. Can the pouch be saved? DisColonRectum. 1988;31:671-675.
- Heuschen UA, Allemeyer EH, Hinz U, et al: Outcome after septic complications in J pouch procedures. Br J Surg. 2002 Feb;89(2):194-200.
- Tulchinsky H, Hawley PR, Nicholls J. Long-term failure after restorative proctocolectomy for ulcerative colitis. Ann Surg. 2003;238:229–234.
- Ramirez RL, Fleshner P: Reoperative Inflammatory Bowel Disease Surgery. Clin Colon Rectal Surg 2006;19:195–206.
- Sagar PM, Pemberton JH: Intraoperative, postoperative and reparative problems with ileoanal pouches. British Journal of Surgery 2012; 99: 454–468
- Bennis M, Tiret E: Surgical management of ulcerative colitis. Langenbecks Arch Surg (2012) 397:11–17
- Bach SP, Mortensen NJ: Ileal pouch surgery for ulcerative colitis. World J Gastroenterol 2007 June 28; 13(24): 3288-3300.
- Uyeda JW, MD, LeBedis CA, MD, Penn DR, et al: Ileal Pouch-Anal Anastomosis Surgery: Anatomy, Postoperative Complications, and Image-Guided Intervention. Semin Ultrasound CT MRI 2013;34:299-310.
- Lightner AL, Mathis KL, Dozois EJ, et al: Results at Up to 30 Years After Ileal Pouch–Anal Anastomosis for Chronic Ulcerative Colitis. Inflamm Bowel Dis 2017;23:781–790.
- Galandiuk S, Scott NA, Dozois RR et al: Ileal pouch anal anastomosis. Reoperation for Pouch-related Complications. Ann Surg 1990;212(4):446-452.
- Lindquist K, Nilsell K, Liljeqvist L: Cuff abscesses and ileoanal anastomotic separations in pelvic pouch surgery. An analysis of possible etiologic factors.Dis Colon Rectum. 1987 May;30(5):355-9.
- Van Koperen PJ, Van Berge Henegouwen MI, Slors JF, et al: Endo-sponge treatment of anastomotic leakage after ileo-anal pouch anastomosis: report of two cases. Colorectal Dis. 2008 Nov;10(9):943-4.
- Gardenbroek TJ, Musters GD, Buskens CJ, et al: Early reconstruction of the leaking ileal pouch-anal anastomosis: a novel solution to an old problem.Colorectal Dis. 2015 May;17(5):426-32.
- van Koperen PJ, van Berge Henegouwen MI, Rosman C, et al: The Dutch multicenter experience of the endo-sponge treatment for anastomotic leakage after colorectal surgery. Surg Endosc. 2009 Jun;23(6):1379-83.
- Selvaggi F, Pellino G, Canonico S, et al: Systematic review of cuff and pouch cancer in patients with ileal pelvic pouch for ulcerative colitis. Inflamm Bowel Dis. 2014 Jul;20(7):1296-308.
- Shen B: Diagnosis and Management of Postoperative Ileal Pouch Disorders. Clin Colon Rectal Surg. 2010 Dec; 23(4): 259–268.
- Sherman J, Greenstein AJ, Greenstein AJ, et al: Ileal J Pouch Complications and Surgical Solutions: A Review. Inflamm Bowel Dis 2014;20:1678–1685.
- Graziano A, Masciangioli G, Coraglio M: Fístula pouch vaginal luego de la coloproctectomía y pouch ileal con anastomosis ileoanal. Manejo y evolución. Rev Arg Cir 2014;106(2):95-102.
- Millan Scheiding M, Rodriguez Moranta F, Kreisler Moreno E, et al: Estado actual del tratamiento quirúrgico electivo de la colitis ulcerosa. Revision sistemática. Cir Esp 2012;90(9):548-557.
- Heriot AG, Tekkis PP, Smith JJ, Bona R, Cohen RG, Nicholls RJ. Management and outcome of pouch-vaginal fístulas following restorative proctocolectomy. Dis Colon Rectum 2005; 48: 451-458.
- Tsujinaka S, Ruiz D, Wexner S, et al. Surgical Management of pouch vaginal fistula after restorative proctocolectomy. J Am Coll Surg. 2006;202:912-8.
- Shah N, Remzi F, Massmann A, et al. Management and treatment outcome of pocuh vaginal fistulas following restorative proctocolectomy. Dis Colon Rectum. 2003;46:911-7.
- Lee P, Fazio V, Church J, et al: Vaginal fistula following restorative roctocolectomy. Dis Colon Rectum. 1997;40:752-9.
- Wexner S, Rothenberger D, Jensen L, et al. Ileal Pouch Vaginal fistulas: incidence, etiology and management. Dis Colon Rectum 1989;32:460-5.
- Burke D, van Laarhoven CJ, Herbst F, Nicholls RJ. Transvaginal repair of pouch – vaginal fistula. Br J Surg 2001; 88: 241 – 245.
- Mallick IH, Hull TL, Remzi FH, Kiran RP: Management and outcome of pouch-vaginal fistulas after IPAA surgery. Dis Colon Rectum. 2014 Apr;57(4):490-6.
- Lolohea S, Lynch AC, Robertson GB, Frizelle FA. Ileal pouch – anal anastomosis – vaginal fistula: a review. Dis Colon Rectum 2005; 48: 1802 – 1810.
- Gajsek U, McArthur DR, Sagar PM. Long-term efficacy of the button fistula plug in the treatment of ileal pouch – vaginal and Crohn’s-related rectovaginal fistulas. Dis Colon Rectum 2011; 54: 999 – 1002.
- MacRae HM, McLeod RS, Cohen Z, O’Connor BI, Ton EN. Risk factors for pelvic pouch failure. Dis Colon Rectum. 1997;40:257–62.
- Kirat HT, Kiran RP, Oncel M, Shen B, Fazio VW, Remzi FH. Management of leak from the tip of the “J” in ileal pouch-anal anastomosis. Dis Colon Rectum. 2011;54:454–9.
- Wei Y, Gong JF, Zhu WM: Endoscopic closure instead of surgery to close an ileal pouch fistula with the over-the-scope clip system. World J Gastrointest Endosc. 2017 Feb 16; 9(2): 95–98.
- Lian L, Shen B. Closure of leak at the tip of the “J” after ileal pouch-anal anastomosis using a novel over-the-scope clipping system. J Colo- proctol 2014; 34: 120–123.
- Gursimran K, Shen B: Endoscopic treatment of leak at the tip of the J ileal pouch. Endoscopy International Open 2017; 05: E64–E66.
- Broder JC, Tkacz JN, Anderson SW, et al: Ileal pouch-anal anastomosis surgery: imaging and intervention for post-operative complications. Radiographics. 2010 Jan;30(1):221-33.
- Michelassi F, Lee J, Rubin M, et al: Long-term Functional Results After Ileal Pouch Anal Restorative Proctocolectomy for Ulcerative Colitis. A Prospective Observational Study. Ann Surg 2003;238: 433–445.
- Tonolini M, Campari A, Bianco R: Ileal pouch and related complications: spectrum of imaging findings with emphasis on MRI. Abdom Imaging (2011) 36:698–706.
- MacLean AR, O’Connor B, Parkes R, et al; Reconstructive surgery for failed ileal pouch-anal anastomosis: a viable surgical option with acceptable results. Dis Colon Rectum. 2002 Jul;45(7):880-6.
- Becker JM, Dayton MT, Fazio VW, et al: Prevention of postoperative abdominal adhesions by a sodium hyaluronate-based bioresorbable membrane: a prospective, randomized, double-blind multicenter study. J Am Coll Surg. 1996 Oct;183(4):297-306.
- Cohen Z, Senagore AJ, Dayton MT, et al: Prevention of postoperative abdominal adhesions by a novel, glycerol/sodium hyaluronate/carboxymethylcellulose-based bioresorbable membrane: a prospective, randomized, evaluator-blinded multicenter study. Dis Colon Rectum. 2005 Jun;48(6):1130-9.
- Dozois EJ: Proctocolectomy and Brooke Ileostomy for Chronic Ulcerative Colitis. Clinics in colon and rectal surgery. 2004;17(1):65-70.
- De Laurier G., Nelson H.: Anastomosis reservorio ile- al-ano. In: Hicks T., Beck D., Opelka F., Timmcke A., Compli- caciones de la cirugía colorrectal. 1a ed. Masson Williams & Wilkins España, 1998: 359.
- Prudhomme M. y colab.: Complications after ileal pouch- anal canal anastomosis. Persp Col and Rectum Surg 1999, 11, (2): 57-68.
- Zorcolo L, Casula G: Urinary and Sexual involvement in IBD. Inflammatory Bowel Disease and Familial Adenomatous Polyposis: ... https://books.google.com.ar/books?isbn=8847004349.
- Hicks CW, Hodin RA, Savitt L, Bordeianou L. Does intramesorectal exci- sion for ulcerative colitis impact bowel and sexual function when com- pared with total mesorectal excision? Am J Surg 2014;208:499–504.
- Mantzouranis G, Fafliora E, Glanztounis G, et al: Inflammatory Bowel Disease and Sexual Function in Male and Female Patients: An Update on Evidence in the PastTen Years. Journal of Crohn’s and Colitis, 2015, 1–9 doi:10.1093/ecco-jcc/jjv140.
- Slors FJ, van Zuijlen PP, van Dick GJ, et al: Sexual and bladder dysfunction after total mesorectal excision for bening disease. Scand J Gastroenterol 2000;232:48-51.
- Lindsey I, George BD, Kettlewell MG, et al: Impotence after mesorectal and close rectal dissection for inflammatory bowel disease.Dis Colon Rectum. 2001 Jun;44(6):831-5.
- Shin T, Okad H: Infertility in men with inflammatory bowel disease. World J Gastrointest Pharmacol Ther 2016 August 6; 7(3): 361-369.
- Sunde ML, Øresland T, Færden AE: Correlation between pouch function and sexual function in patients with IPAA. SCANDINAVIAN JOURNAL OF GASTROENTEROLOGY 2015, VOL. 51, NO. 3, 295–303.
- Metcalf AM, DOZOIS RR, KELLY KA y colab.: Sexual function in women after proctocolectomy. Ann Surg 1986;204:624-627.
- Pemberton J y colab.: Ileal pouch anal anastomosis for ch- ronic ulcerative colitis. Long term results. Ann Surg 1987; 504-513.
- Farouk R, Dozois RR, Pemberton JH, Larson D: incidence and subsequent impact of pelvic abscess after ileal pouch anal anastomosis for chronic ulcerative colitis. Dis Co- lon Rectum, 1998;41:1239.
- Johnson P, Richard C, Ravid A, Spencer L, Pinto E, Hanna M, Cohen Z, McLeod R. Female infertility after ileal pouch-anal anastomosis for ulcerative colitis. Dis Colon Rectum 2004; 47: 1119-1126.
- Rajaratnam S.G., Eglinton T.W., et al: Impact of ileal pouch-anal anastomosis on female fertility: meta-analysis and systematic review. Int J Colorectal Dis 2011;26:1365–1374.
- Ording O.K., Juul S., Berndtsson I., Oresland T., Laurberg S. Ulcerative colitis: female fecundity before diagnosis, during disease, and after surgery compared with a population sample. Gastroenterology 2002;122:15–19.
- Waljee A., Waljee J., Morris A.M., Higgins P.D. Threefold increased risk of infertility: a meta-analysis of infertility after ileal pouch anal anasto- mosis in ulcerative colitis. Gut 2006;55:1575–1580.
- Ilnyckyj A: Surgical treatment of inflammatory bowel diseases and pregnancy. Best Practice & Research Clinical Gastroenterology Vol. 21, No. 5, pp. 819–834, 2007ñ
- Oresland T, Fasth S, Nordgren S, et al: A prospective randomized comparison of two different pelvic pouch designs. Scand J Gastroenterol 1990; 25: 986-996ñ
- Sultan AH, Kamm MA, Hudson CN, Thomas JM, Bartram CI. Anal-sphincter disruption during vaginal delivery. N Engl J Med 1993; 329: 1905-1911ñ
- Remzi FH, Gorgun E, Bast J, et al: Vaginal delivery after ileal pouch-anal anastomosis: a word of caution. Dis Colon Rectum 2005; 48: 1691-1699ñ
- Lewis WG, Kuzu A, Sagar PM, et al: Stricture at the pouch-anal anastomosis after restorative proctocolectomy. Dis Colon Rectum. 1994;37:120–125.
- BENOIST S, PARRIS Y, BERDAH S y colab..New treatment for ileal pouch-anal or coloanal anastomotic stenosis.Dis.Col.Rectum.1998;41,7; 935-937.
- Remzi FH, Fazio VW, Oncel M, et al: Portal vein thrombi after restorative proctocolectomy. Surgery. 2002 Oct;132(4):655-61; discussion 661-2.
- Ball CG, MacLean AR, Buie WD, et al: Portal vein thrombi after ileal pouch-anal anastomosis: its incidence and association with pouchitis. Surg Today. 2007;37(7):552-7.
- Poggioli G, Marchetti F, Selleri S, et al: Redo pouches: salvaging of failed ileal pouch-anal anastomoses.Dis Colon Rectum. 1993 May;36(5):492-6.
- Keighley M. y colab.: An audit of restorative proctocolec- tomy. Gut., 1993; 34:680-684.
- Patel S, Salotera G, Gurjar S, et al: Ileo-anal pouch necrosis secondary to small bowel volvulus: A case report. World Journal of Emergency Surgery 2008, 3:18 doi:10.1186/1749-7922-3-18.
- Van Assche G, Dignass A, Bokemeyer B, et al: Second European evidence-based consensus on the diagnosis and management of ulcerative colitis Part 3: Special situations. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis Part 3: Special situations. Journal of Crohn’s and Colitis 2013;7:1–33.
- Ross H, Steele SR, Varma M, et al: Practice Parameters for the Surgical Treatment of Ulcerative Colitis. Dis Colon Rectum 2014; 57: 5–22.
- Morgan XC, Kabakchiev B, Waldron L, et al: Associations between host gene expression, the mucosal microbiome, and clinical outcome in the pelvic pouch of patients with inflammatory bowel disease. Genome Biology 2015;16:67 DOI 10.1186s13059-015-0637-x.
- Shen B, Fazio VW, Remzi FH, et al. Risk factors for diseases of ileal pouch-anal anastomosis after restorative proctocolectomy for ulcerative colitis. Clin Gastroenterol Hepatol 2006;4:81–9 [quiz 2–3].
- Merrett MN, Mortensen N, Kettlewell M, et al: Smoking may prevent pouchitis in patients with restorative proctocolectomy for ulcerative colitis. Gut 1996; 38: 362-364,
- Ståhlberg D, Gullberg K, Liljeqvist L, et al: Pouchitis following pelvic pouch operation for ulcerative colitis. Incidence, cumulative risk, and risk factors. Dis Colon Rectum 1996; 39: 1012-1018,
- Schmidt CM, Lazemby AJ, Hendrickson RJ, et al.: Preoperative terminal ileal an colonic resection histopat-hology predicts risk of pouchitis in patients after ileaoanal pull through procedure. Ann Surg 1998;227(5):654-62.
- Samarasekera DN, Stebbing JF, Mortensen NJ, y colab.: Out come of restorative proctocolectomy with ileal reservoir for ulcerative colitis: comparison o distal colitis with more proximal disease. Gut 1996;38(4):574-7.
- Penna C, Dozois R, Tremaine W, et al: Pouchitis after ileal pouch-anal anastomosis for ulcerative colitis occurs with increased frequency in patients with associated primary sclerosing cholangitis. Gut 1996; 38: 234-239.
- Boerr L y cols.: Increased mucosal levels of leukotriene B4 in pouchitis: evidence for a persistent inflammatory state. Eu- ropean Journ of Gastroenterol and Hepatol 1996;8:57.
- Sagar PM, Godwin PG, Holdsworth PJ, et al: Influence of myectomy, ileal valve, and ileal reservoir on the ecology of the ileum. Dis Colon Rectum 1992; 35: 170-177-61.
- Heuschen UA, Hinz U, Allemeyer EH, et al: One- or two-stage procedure for restorative proctocolectomy: rationale for a surgical strategy in ulcerative colitis. Ann Surg 2001; 234: 788-794.
- Pace DE, Seshadri PA, Chiasson PM, et al: Early experience with laparoscopic ileal pouch-anal anastomosis for ulcerative colitis. Surg Laparosc Endosc Percutan Tech 2002; 12: 337-341.
- Hurst RD, Molinari M, Chung TP, et al: Prospective study of the incidence, timing and treatment of pouchitis in 104 consecutive patients after restorative proctocolectomy. Arch Surg 1996; 131: 497-500; discussion 501-502.
- Holubar SD, Cima RR, Sandborn WJ, et al: Treatment and prevention of pouchitis after ileal pouch-anal anastomosis for chronic ulcerative colitis. Cochrane Database Syst Rev. 2010 Jun 16;(6):CD001176.
- Singh S, Stroud AM, Holubar SD, et al: Treatment and prevention of pouchitis after ileal pouch-anal anastomosis for chronic ulcerative colitis. Cochrane Database Syst Rev. 2015 Nov 23;(11):CD001176.
- Segal JP, Ding NS, Worley G, et al: Systematic review with meta-analysis: the management of chronic refractory pouchitis with an evidence-based treatment algorithm. Aliment Pharmacol Ther 2017; 45: 581–592.
- Fazio VW, TJANDRA JJ: Transanal mucosectomy, ileal pouch advencement for anorectal dysplasia or inflammation after restorative proctocolectomy. Dis Colon Rectum 1994;37:1811.
- Remzi F, FAZIO V, DELANEY C y colab.: Dysplasia of the anal transitional zone after ileal pouch - anal anastomosis. Re- sults of prospective evaluation after a minimun of ten years. Dis Colon Rectum 2003;98:A726.
- Litzendorf ME, Stucchi AF, Wishnia S, et al: Completion Mucosectomy for Retained Rectal Mucosa Following Restorative Proctocolectomy with Double-Stapled Ileal Pouch–Anal Anastomosis. J Gastrointest Surg (2010) 14:562–569 DOI 10.1007/s11605-009-1099-9.
- Shen B, ACHKAR JB, LASHNER BA, et al: Irritable pouch syndrome: a new strategy of diagnosis for symptoma tic patients with ileal pouch anal anastomosis. Am J Gastroenterol 2002;97(4):972-77.
- Scarpa M, van Koperen PJ, Ubbink DT, et al. Systematic review of dysplasia after restorative proctocolectomy for ulcerative colitis. Br J Surg. 2007;94:534–545.
- O’Riordain MG, Fazio VW, Lavery IC, et al. Incidence and natural history of dysplasia of the anal transitional zone after ileal pouch-anal anastomosis: results of a five-year to ten-year follow-up. Dis Colon Rectum 2000;43:1660–1665.
- Shepherd NA, Jass JR, Duval I, et al. Restorative proctocolectomy with ileal reservoir: pathological and histochemical study of mucosal biopsy specimens. J Clin Pathol. 1987;40:601–607.
- Ziv Y, Fazio VW, Sirimarco MT, et al. Incidence, risk factors, and treatment of dysplasia in the anal transitional zone after ileal pouch-anal anastomosis. Dis Colon Rectum. 1994;37:1281–1285.
- Banasiewicz T, Marciniak R, Paszkowski J, et al. Pouchitis may increase the risk of dysplasia after restorative proctocolectomy in patients with ulcerative colitis. Colorectal Dis. 2012;14:92–97.
- Chambers WM, Mc CMNJ. Should ileal pouch-anal anastomosis include mucosectomy? Colorectal Dis. 2007;9:384–392.
- Bobkiewicz A, Krokowicz L, Paszkowski J, et al: Large bowel mucosal neoplasia in the original specimen may increase the risk of ileal pouch neoplasia in patients following restorative proctocolectomy for ulcerative colitis. Int J Colorectal Dis (2015) 30:1261–1266.
- Um JW, M’Koma AE: Pouch-related dysplasia and adenocarcinoma following restorative proctocolectomy for ulcerative colitis. Tech Coloproctol. 2011 March; 15(1): 7–16.
- Wu X, Remzi FH, Liu X, et al: Disease Course and Management Strategy of Pouch Neoplasia in Patients with Underlying Inflammatory Bowel Diseases. Inflamm Bowel Dis 2014;20:2073–2082.
- Remzi FH, Fazio VW, Delaney CP, et al. Dysplasia of the anal transitional zone after ileal pouch-anal anastomosis: results of prospective evaluation after a minimum of ten years. Dis Colon Rectum 2003;46:6–13.
- M’Koma AE, Moses HL, Adunyah SE. Inflammatory bowel disease-associated colorectal cancer: proctocolectomy and mucosectomy do not necessarily eliminate pouch-related cancer incidences. Int. J. Colorectal Dis. 26(5), 533–552 (2011).
- Connelly TM, Koltun WA: The surgical treatment of inflammatory bowel disease ‐associated dysplasia. Expert Rev. Gastroenterol. Hepatol 2013;7(4):307–322.
- Larson DW, Pemberton JP: Current Concepts and Controversies in Surgery for IBD. Gastroenterology 2004;126:1611–1619.
- Mullen MG, MD, Cullen JM, MD, Michaels AD, et al: ileal j-pouch volvulus following total proctocolectomy for ulcerative colitis. J Gastrointest Surg. 2016 May ; 20(5): 1072–1073.
- Brady JT, Steele SR: Laparoscopic Detorsion of an Ileal Pouch and Pouch Pexy. Dis Colon Rectum. 2017 Feb;60(2):248.
- Warren C, Donnelly ME, Gardiner KR, et al: Succesful managent of ileo anal pouch volvulus. Colrectal Dis 2010;13:105-107.
- Myrelid P, Druvefors P, Andersson P: Case Report. Recurrent Volvulus of an Ileal Pouch Requiring Repeat Pouchopexy: A Lesson Learnt. Case Report in Surgery Volume 2014 (2014), Article ID 807640, 3 pageshttp://dx.doi.org/10.1155/2014/807640.
- Jain A, Abbas MA, Sekhon HK, et al: Volvulus of an ileal J-pouch. Inflamm Bowel Dis 2010;16:3–4.
- Ullah MZ, Fajobi OA, Bhargava AM. Long-axis rotational volvulus in a W ileo- anal pouch: an unusual but potentially preventable problem. Dis Colon Rectum 2007;50:540–3.
- Arima K, Wantanabe M, Iwatsuki M, et al .Volvulus of an ileal pouch-rectal anastomosis after subtotal colectomy for ulcerative colitis: report of a case. Surg Today 2013. PMID: 24048765.
- Tyagi G, Gupta U, Verma A, et al: Volvulus of ileal S-pouch: A rare complication of ileal pouch anal anastomoses. International Journal of Surgery Case Reports 5 (2014) 717–719.
- Joyce MR, Fazio VW, Hull TT, et al: Ileal pouch prolapse: prevalence, management, and outcomes. J Gastrointest Surg. 2010 Jun;14(6):993-7.
- Ehsan M, Isler JT, Kimmins MH, et al: Prevalence and management of prolapse of the ileoanal pouch. Dis Colon Rectum. 2004 Jun;47(6):885-8.
- Wu X, Liub X, Lanc N, et al: Management of ileal pouch prolapse with endoscopic hot snare. J COLOPROCTOL. 2013;33(2):92–94.
- Ragupathi M, Patel CB, Ramos-Valadez DI, et al: Robotic-Assisted Laparoscopic “Salvage” Rectopexy for Recurrent Ileoanal J-Pouch Prolapse. Gastroenterology Research and Practice Volume 2010, Article ID 790462, 4 pages doi:10.1155/2010/790462.
- Schoetz DJ Jr. Coller JA, Veidenheimer MC. Can the pouch be saved? DisColonRectum 1988;31:671-675.
- Takagi K, Nagata H, Ishizuka M, et al: Endoscopy-assisted transanal division of an apical pouch bridge after restorative proctocolectomy with a J-shaped ileal pouch. Surg Laparosc Endosc Percutan Tech. 2008 Oct;18(5):486-8.
- Poola, V.P., Holubar, S.D., Dozois, E.J. Endoscopically assisted transanal division of pouch septum after ileal pouch-anal anastomosis for ulcerative colitis. Tech Coloproctol. 2009;13:183.
- Remzi FH, Aytac E, Ashburn J, et al: Transabdominal Redo Ileal Pouch Surgery for Failed Restorative Proctocolectomy: Lessons Learned Over 500 Patients. Ann Surg. 2015 Oct;262(4):675-82.
- Pellino G, Selvaggi F: Outcomes of Salvage Surgery for Ileal Pouch Complications and Dysfunctions. The Experience of a Referral Centre and Review of Literature DOI: http://dx.doi.org/10.1093/ecco-jcc/jjv066.
- Lightner AL, Dattani S, Dozois EJ, et al: Pouch excision: indications and outcomes. Colorectal Dis. 2017 doi: 10.1111/codi.13673.
- Hueting WE, E Buskens, I van der Tweel, HG Gooszen, and CJ van Laarhoven. Results and complications after ileal pouch anal anastomosis: a meta-analysis of 43 observational studies comprising 9,317 patients. https://www.ncbi.nlm.nih.gov/pubmedhealth/PMH0022531
- Fazio VW, Tekkis PP, Remzi F, et al. Quantification of risk for pouch failure following ileal pouch anal anastomosis surgery. Ann Surg 2003;238:605–614.
- GRAZIANO A, COLLIA AVILA K, CORAGLIO M. Complicaciones del Pouch. Enciclopedia Cirugía Digestiva. F. Galindo y colab. www.sacd.org.ar 2012 Tomo III-353, pág. 1-16.
- Fonkalsrud EW, Bustorff-Silva J. Reconstruction for chronic dysfunction of ileoanal pouches. Ann Surg 1999; 229: 197-204.
- Sagar PM, Dozois RR, Wolff BG, Kelly KA. Disconnection, pouch revision and reconnection of the ileal pouch-anal anastomosis. Br J Surg 1996; 83: 1401-1405.
- Herbst F, Sielezneff I, Nicholls RJ. Salvage surgery for ileal pouch outlet obstruction. Br J Surg 1996; 83: 368-371.
- Fazio VW, wu JS, Lavery IC: Repeat heal Pouch-Anal Anastomosis to Salvage Septic Complications of Pelvic Pouches. Clinical Outcome and Quality of Life Assessment. Annals of Surgery 1998;228(4):588-597.
- Olagunju A, Ogunbiya OA, Korsgen S, et al: Pouch salvatage long term outcome. Dis Colon Rectum 1997;40:548-552.
- O’Kelly TJ, Merrett NJ, Mortensen TC, et al. Pouch-vaginal fístula after restorative proctocolectomy: aetiology and management. Br J Surg 1994;81:1374-1375
- Baixauli J1, Delaney CP, Wu JS, Remzi FH, Lavery IC, Fazio VW. Functional outcome and quality of life after repeat ileal pouch-anal anastomosis for complications of ileoanal surgery.Dis Colon Rectum. 2004 Jan;47(1):2-11. Epub 2004 Jan 2.
- Faucheron, J.L., Risse, O., Letoublon, C. A new ileal pouch salvage technique. Dis Colon Rectum. 2001;44:1891–1894.
- Dehni N, Cunningham C, Parc R: Use of a jejunal pouch with ileal interposition in salvage surgery after restorative proctocolectomy. Dis Colon Rectum. 1998 Dec;41(12):1587-9.
- Loriau, J., Benoist, S., Panis, Y. et al, Salvage of ileal pouch-anal anastomosis by a reversed jejunal segment. Surgery. 2005;137:111–113.
- Cheynel N, Rat P, Diane B, et al: Anatomical basis for the interposition of a gastric pouch between the ileum and the anus after total proctocolectomy. Surg Radiol Anat (2003) 25: 95–98.
- Ortega-Deballon P, Cheynel N, Di- Giacomo G, et al: interposition of a gastric pouch between ileum and anus after proctocolectomy: long-term results in 3 patients. Surgery 2009;145(5):568-72.
- Tekkis PP, Heriot AG, Smith JJ, et al: Long-term results of abdominal salvage surgery following restorative proctocolectomy. Br J Surg. 2006 Feb;93(2):231-7.
- Koltun WA, Schoetz DJ Jr, Roberts PL, et al: Indeterminate colitis predisposes to perineal complications after ileal pouch-anal anastomosis. Dis Colon Rectum. 1991 Oct;34(10):857-60.
- Yu CS, Pemberton JH, Larson D. Ileal pouch-anal anastomosis in patients with indeterminate colitis: long-term results. Dis Colon Rectum 2000;43:1487–1496.
- Delaney CP, Remzi FH, Gramlich T, Dadvand B, Fazio VW. Equivalent function, quality of life and pouch survival rates after ileal pouch-anal anastomosis for indeterminate and ulcerative colitis. Ann Surg 2002;236:43–48.
- Pezim ME, Pemberton JH, Beart RW, et al: Outcome of indeterminant colitis following ilea pouch anastomosis. Dis Colon Rectum 1989;32(8):653-658.
- Atkinson KG, Owen DA, Wankling G. Restorative proctocolectomy and indeterminate colitis. Am J Surg 1994; 167: 516–8.
- Foley EF, Schoetz DJ Jr, Roberts PL et al. Rediversion after ileal pouch-anal anastomosis. Causes of failures and predictors of subsequent pouch salvage. Dis. Colon Rectum 1995; 38; 793– 798.
- McIntyre PB, Pemberton JH, Wolff BG, et al. Indeterminate colitis: long-term outcome in patients after ileal pouch-anal anastomosis. Dis Colon Rectum 1995; 38: 51–4.
- Marcello PW, Schoetz DJ Jr, Roberts PL, et al. Evolu- tionary changes in the pathologic diagnosis after the ileoanal pouch procedure. Dis Colon Rectum 1997;40:263–9.
- Dayton MT, Larsen KR, Christiansen DD. Similar functional results and complications after ileal pouch-anal anastomosis in patients with indeterminate vs ulcerative colitis. Arch Surg 2002; 137:690–4, discussion 4–5.
- Rudolph WG, Uthoff SM, M.D.,* Tracy L. McAuliffe TL: Indeterminate Colitis The Real Story. Colon Rectum 2002;45:1528–1534.
- Gramlich T, Delaney CP, Lynch AC, Remzi FH, Fazio VW. Pathological subgroups may predict complications but not late failure after ileal pouch-anal anastomosis for indeterminate colitis. Colorectal Dis. 2003; 5; 315–319.
- Pishori T, Dinnewitzer A, Zmora O et al. Outcome of patients with indeterminate colitis undergoing a double-stapled ileal pouch-anal anastomosis. Dis. Colon Rectum. 2004; 47; 717– 721.
- Brown CJ, Maclean AR, Cohen Z, Macrae HM, O’Connor BI, McLeod RS. Crohn’s disease and indeterminate colitis and the ileal pouch-anal anastomosis: outcomes and patterns of failure. Dis. Colon Rectum 2005; 48; 1542–1549.
- Murrell ZA, Melmed GY, Ippoliti A, et al: A prospective evaluation of the long-term outcome of ileal pouch-anal anastomosis in patients with inflammatory bowel disease-unclassified and indeterminate colitis. Dis Colon Rectum. 2009 May;52(5):872-8.
- Zaghiyan K, Kamiński JP, Barmparas G,et al: De novo Crohn’s Disease after Ileal Pouch-Anal Anastomosis for Ulcerative Colitis and Inflammatory Bowel Disease Unclassified: Long-Term Follow-Up of a Prospective Inflammatory Bowel Disease Registry. Am Surg. 2016 Oct;82(10):977-981.
- Korsgen S, Keighley MR. Causes of failure and life expectancy of the ileoanal pouch. Int J Colorectal Dis. 1997;12:4–8.