CAPÍTULO 9
Indicaciones quirúrgicas electivas
Las indicaciones quirúrgicas electivas son la enfermedad refractaria al tratamiento médico, el retraso del crecimiento en niños, la displasia - cáncer (denominadas también indicaciones obligatorias) y la presencia de manifestaciones extraintestinales: pioderma gangrenoso, eritema nodoso, artritis periférica y la uveítis que pueden remitir luego de la colectomía,1,2 siendo más frecuente la persistencia de síntomas crónicos refractarios a pesar del tratamiento médico máximo, lo que conlleva a debilidad física y disfunción psicosocial o a las complicaciones de los efectos secundarios de las mismas.2,3
9.1 INDICACIONES
9.1.1 Displasia - cáncer
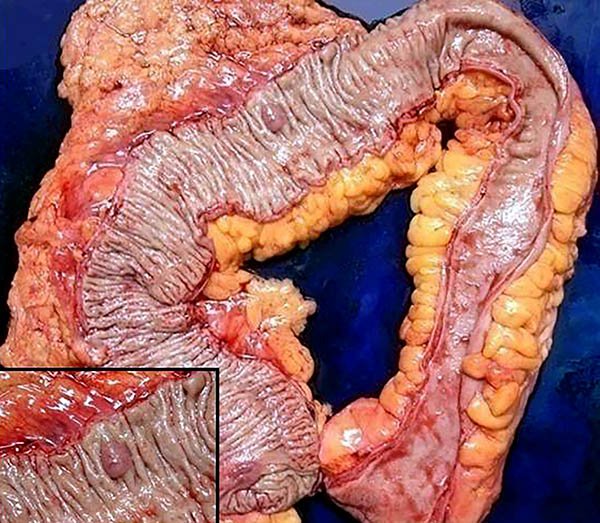
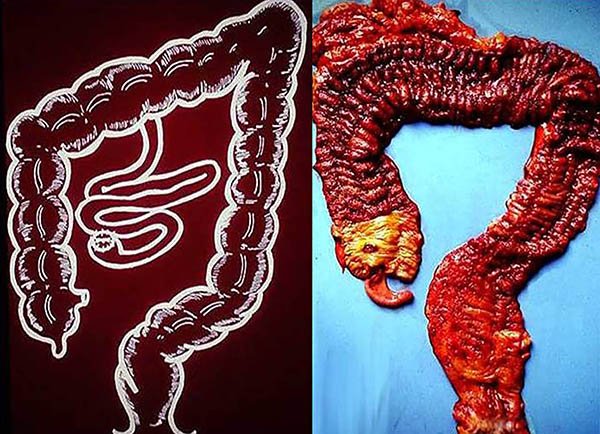
La incidencia global de cáncer colorrectal (CCR) en CU se considera aumentada en la mayoría de las series,4,5 llegando al 5%.1,7 en nuestra experiencia el CCR se presento en el 1% de los pacientes registrados (7% de los operados)8 (fotos 57,58). Aunque estudios poblacionales muestran que en los años recientes habría una disminución del riesgo de CCR en este grupo; encontrando tasas de incidencia anual del 0,06 al 1%.9-16
Los individuos con CU presentan una posibilidad de 1,5 a 6 veces mayor que la población general de desarrollar un cáncer de colon.17-19 Esta complicación es rara durante los primeros años de evolución, aumentando después de los 10 años un 20% con cada década transcurrida según algunos autores.7,20,21 Otros como Eaden22 y cols. encuentran un riesgo acumulativo de 2,1% a 10 años, 8,5% a los 20 años y de 17,8% a los 30. Son factores de riesgo: la extensión de la enfermedad, la pancolitis presenta un mayor riesgo que las formas izquierdas (6,3% vs. 1%),3,8,12,18,21,23 el tiempo de evolución (aumenta luego de los 10 años en pancolitis), edad de comienzo temprano, la concomitancia de colangitis esclerosante primaria. Tabibian y cols.24 informan que los pacientes con esta concomitancia tienen un riesgo del 70% de desarrollar CCR y los antecedentes familiares de CCR.
Foto 57: Pieza de colectomía con hallazgo de adenocarcinoma.
Foto 58: Piezas de colectomía con cáncer.
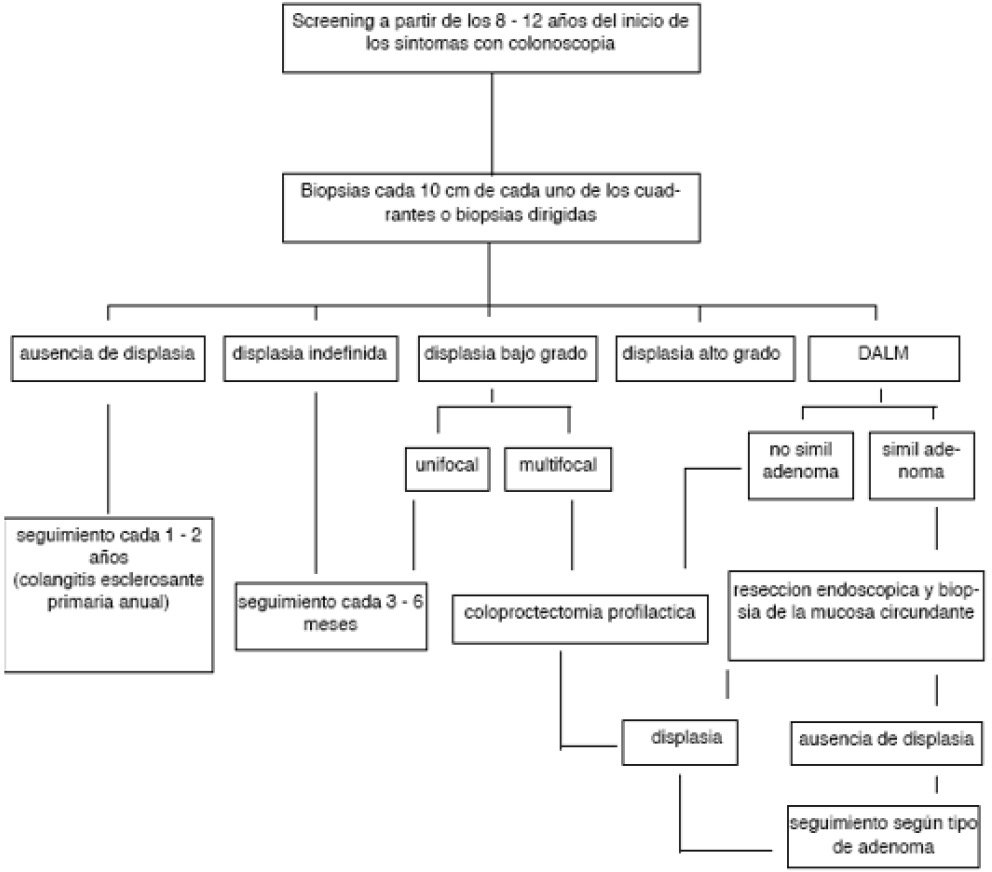
A diferencia del cáncer esporádico, aquí existe una secuencia de displasia cáncer por lo cual la pesquisa se realizara en forma anual o bienal en busca de displasia con colonoscopias, a partir de los 8-10 años del comienzo de la enfermedad en las pancolitis y a partir de los 15 años en las formas izquierdas y en la enfermedad de Crohn, con toma de biopsia de cada uno de los cuatro cuadrantes cada 10 cm, en caso de hallar estenosis o masas deben ser también biopsiadas, recordando que estas endoscopias deben ser siempre efectuadas fuera de los episodios agudos. En la actualidad la utilización de cromoendoscopia y de endomicroscopia podría servir para realizar biopsias dirigidas.15,19,25-28 Por otro lado las guías británicas subdividen a estos pacientes en 3 grupos:
- Bajo riesgo: CU o EC extensa en remisión, colitis izquierda con inflamación o EC con afectación menor al 50% de la superficie. Seguimiento colonoscopia cada 5 años.
- Riesgo intermedio: CU o Crohn extensa con actividad endoscópica o histológica leve, pólipos post inflamatorios, historia de CCR en un familiar de 1er grado mayor a 50 años. Control cada 3 años.
- Riesgo alto: CU o Crohn con actividad endoscópica y o histológica moderada a severa, colangitis esclerosante primaria, estenosis colónica o displasia de cualquier grado en los últimos 5 años, historia de CCR en un familiar de primer grado menor de 50 años. Control anual.
La displasia puede ocurrir en mucosa plana con apariencia endoscópica normal o puede desarrollarse como una lesión asociada a lesión o masa (DALM), o también denominadas masas adenoma like (ALM), la cual puede ser indistinguible de un adenoma esporádico en la mucosa sana o curada.6,17,29 Estas DALM o ALM actualmente se subdividen en lesiones elevadas con displasia en adenoma like (tipo adenomas) o no adenoma like (placas, estricturas, nódulos irregulares, etc.), los cuales suelen ser difíciles de remover por endoscopia.17
Los CCR en CU suelen ser múltiples y planos. Histológicamente son coloideos, mucinosos y pobremente diferenciados.8,21,30,31 Pueden ser de mal pronóstico por las dificultades para realizar un diagnóstico temprano ya que pacientes y médicos confunden los síntomas de una agudización con los originados por la neoplasia, por este motivo la sobrevida a los 5 años no suele superar el 18%. Esto refuerza y justifica la pesquisa lo cual nos permite realizar un diagnóstico temprano en un porcentaje mayor de pacientes. Graziano y cols.,8 en una serie del año 2008, encuentra un 63% de lesiones tempranas (lo cual se debió en gran parte al estricto seguimiento de la enfermedad que se lleva a cabo por el grupo de inflamatorias).
En cuanto a la displasia las estrategias dependerán si son lesiones que se asemejan a adenomas o no, de la presencia o no de displasia en el área circundante, del grado de displasia y de la presencia de estenosis.
En la displasia de alto grado es indiscutible la indicación de colectomía21,32-34 al igual que en el caso de la displasia de bajo grado multifocal,26,35 mientras que las de bajo grado o indefinidas algunos autores sugieren control endoscópico luego de 6 meses (Esquema 1). Recalcamos la necesidad de que los resultados anatomopatologicos sean corroborados por al menos otro patólogo con experiencia en enfermedades inflamatorias.28
En el caso de lesiones elevadas tipo pólipos dentro del área de colitis se deberá realizar la polipectomía con biopsia de los cuatro cuadrantes subyacentes, si la polipectomía es completa y no existe displasia en el área circundante se realiza control endoscopio a los 6 meses. Si esta lesión no es resecable por endoscopia o no es simil adenoma, o la mucosa adyacente presenta displasia es aconsejable la colectomía.17,36-38
En caso de lesiones similares a adenomas en áreas NO coliticas el manejo es el mismo que en los adenomas esporádicos.
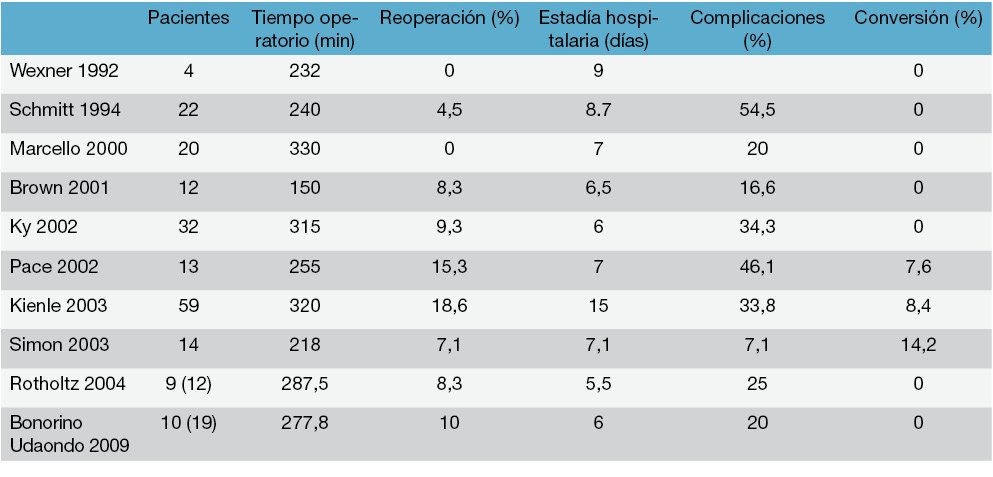
A diferencia de la cirugía de urgencia estos pacientes suelen llegar en mejor estado general por lo cual podremos indicar más fuertemente el abordaje laparoscópico, el cual en los últimos años, en grupos entrenados se ha ido convirtiendo en la vía de elección tabla 28.
En el caso de estenosis se deben tomar múltiples biopsias, en caso de displasia de alto grado la colectomía esta indicada, también se debe considerar la cirugía si la estenosis no permite el paso del endoscopio.
Esquema 1: Manejo de la displasia en enfermedad inflamatoria.
9.1.2 Forma invalidante o enfermedad intratable
Es una de las causas más frecuentes de cirugía, su definición no es precisa, pero implica la incapacidad para desenvolverse productivamente debido a frecuentes exacerbaciones, debilidad crónica, múltiples hospitalizaciones y efectos secundarios intolerables del tratamiento farmacológico, pacientes corticoideo dependientes o fracaso de la terapia médica que le impiden al paciente tener una calidad de vida aceptable.2-4,42 Fraise y Graziano1 resumen esto en “cuando los períodos de enfermedad superan a los de salud”. En nuestra experiencia esta fue la indicación más frecuente correspondiendo al 47,53% del total de los pacientes operados y el 80,6% de las indicaciones electivas.
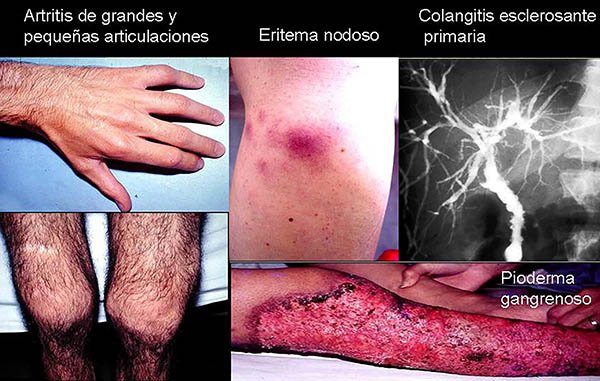
Las manifestaciones extraintestinales (foto 59) se presentan en alrededor del 35% de los pacientes y la actividad en algunas de ellas se relaciona con la de la enfermedad,38 siendo estas las que responden al realizar la colectomía. Entre ellas encontramos la epiescleritis, el eritema nodoso, las ulceraciones aftoides y algunas artropatías.3,43-44 Otras tienen un curso independiente de la enfermedad: espondilitis anquilosante y sacroileítis; la uveítis y la colangitis esclerosante primaria. El pioderma gangrenoso es considerado por algunos autores como independiente38 y por otros como relacionado a la actividad de la enfermedad.3,43,44
Otra indicación es el retardo de crecimiento en los niños causado por los efectos adversos de los corticoides que aceleran la fusión de las epífisis y provocan también retardo en la madurez sexual, sumado a la desnutrición propia de la enfermedad.3,44,45,46 Datos actuales sostienen que la cirugía es al menos tan beneficiosa como el tratamiento con inmunosupresores para alcanzar un estado de crecimiento aceptable.47-49
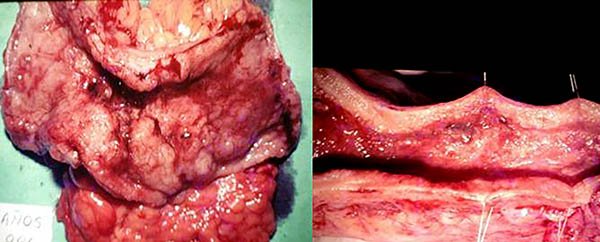
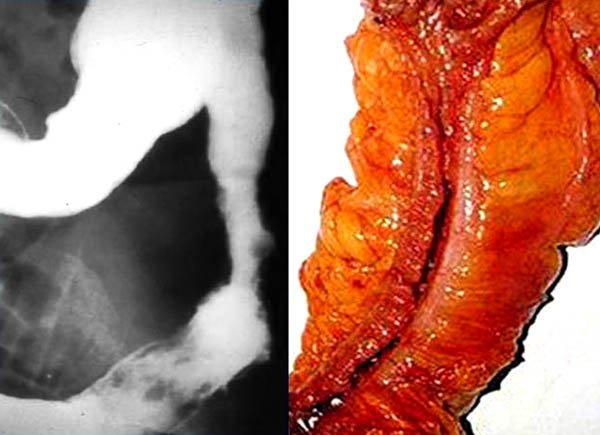
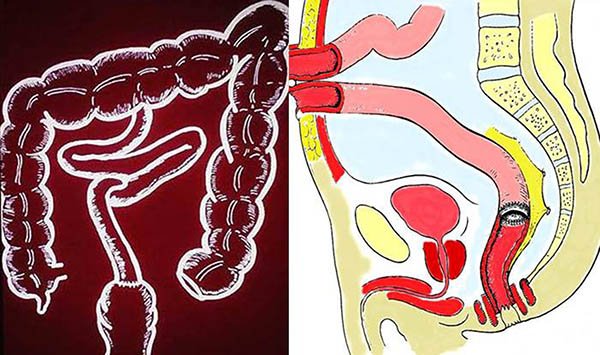
Las estenosis sintomáticas o aquellas en donde no puede descartarse una neoplasia y en los casos de microcolon, la conducta adecuada es la cirugía43,50,51 (foto 60). Una rara indicación de colectomía y esplenectomía es la anemia hemolítica masiva que no responde al tratamiento médico.43,50
Foto 59: Manifestaciones extracolónicas de las EII.
Foto 60: Colon por enema y pieza de una estenosis colonica en CU.
9.2 ALTERNATIVAS QUIRÚRGICAS
A diferencia de la cirugía en la urgencia donde lo que prima es salvar la vida del paciente, aquí uno buscara resecar el órgano enfermo preservando, de ser posible, las estructuras anatómicas para luego realizar la cirugía reconstructiva y obtener bajo indices de morbimortalidad. Estos pacientes suelen llegar en mejor estado general por lo cual podremos indicar más fuertemente el abordaje laparoscópico, el cual en los últimos años en grupos entrenados se ha ido convirtiendo en la vía de elección tabla 28.
Es importante destacar que siempre que se indique una conducta quirúrgica, se debe informar al paciente sobre todas las opciones, los resultados, los beneficios y las complicaciones de modo tal que el enfermo tenga la oportunidad de elegir la mejor operación para su edad y estilo de vida.
Tabla 28: Resultados de cirugía laparoscópica en colitis ulcerosa
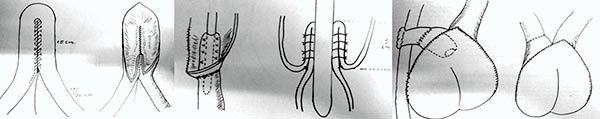
9.2.1 Coloproctectomía total con ileostomía a lo Brooke (definitiva) (foto 61)
La coloproctectomía con ileostomía definitiva fue la técnica de elección para la colitis ulcerosa por muchos años, antes del advenimiento del reservorio íleal con anastomosis ileoanal, por ser una técnica segura y curativa. En la actualidad tiene indicaciones limitadas tales como: pacientes con severas complicaciones perineales (poco frecuente en la CU), coexistencia de alteraciones en la continencia, asociación de cáncer de recto supraanal o cuando el paciente decide no someterse a una coloproctectomía restauradora.1-3,42 La misma puede realizarse por un abordaje convencional o laparoscópico.
Una vez resecado el colon se procederá a la proctectomía. La disección del recto en caso de ausencia de displasia o cáncer podrá realizarse por fuera de la fascia propia del recto (resección total del mesorrecto),51 o ser cercana a la pared rectal para evitar la lesión de los nervios simpáticos cuando ellos cruzan el promontorio sacro, lo cual podría causar fallas en la eyaculación en hombres; mientras que la lesión de los nervios parasimpáticos a nivel de los ligamentos laterales del recto puede causar impotencia y vejiga neurogénica. Por estos motivos algunos autores como Bennis y Graziano5,52 prefieren la disección cercana a la pared.
La disección perineal se realiza en el plano interesfintérico evitando el daño de los nervios en el área de las vesículas seminales, y produce una herida perineal menor que permite un cierre primario con disminución de la posibilidad de formar senos perineales, excepto en el cáncer de recto bajo en el cual se debe realizar la técnica standard de amputación abomino perineal.1,2,51
En el sitio posible de implantación de la ileostomía que fuera marcado previo a la cirugía y en diferentes decúbitos, se realiza una incisión circular de piel de aproximadamente 1,5 cm., recordando que el diámetro de la misma tiende a aumentar quedando una base demasiado amplia para el ostoma. Si existiera tejido celular subcutáneo importante se debe resecar en forma de cono con base en la piel. El plano aponeurótico se incide en forma de cruz, divulsionando el músculo recto anterior del abdomen y abriendo el peritoneo, el calibre del túnel será aproximadamente el diámetro de dos dedos.
El mesenterio del íleon terminal es resecado parcialmente respetando la arcada vascular y se exterioriza de forma aséptica, protegido o cerrado, con una sutura mecánica. El intestino debe sobresalir aproximadamente 5 cm. del nivel de la piel, para que al evertirlo quede una ostomía de 2,5 cm. Se cierra el borde libre del mesenterio desde el orificio en la pared abdominal contra el peritoneo parietal en una extensión de 10 - 15 cm en dirección cefálica. El objeto de esta sutura es elaborar un tabique que impida el pasaje o cabalgamiento de las asas yeyuno-ileales sobre el meso proximal al íleon exteriorizado, gesto que actualmente en el abordaje laparoscópico nosotros obviamos. Otra conducta posible es realizar la misma maniobra en forma extraperitoneal evitando así futuras herniaciones. No existen evidencias claras que estas conductas sean de verdadera utilidad.45
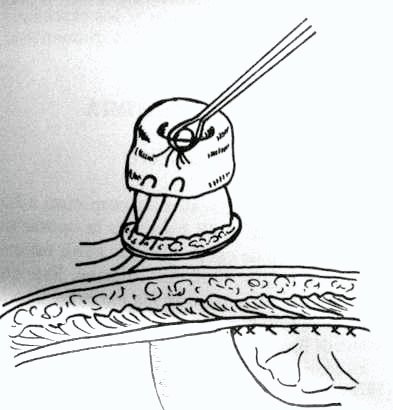
Una vez cerrada la pared abdominal se procede a madurar el ostoma, se puede escarificar con electrobisturí la superficie serosa para provocar una mejor adhesión (serosa sobre serosa). La eversión se realiza con una sutura continua o con puntos separados que toman la dermis, la serosa de la pared intestinal y la totalidad del borde del íleoníleon)45,53 (dibujo 10).
Las complicaciones están relacionadas con la cirugía en si misma (oclusión intestinal, hernias perineales, infección del lecho perineal, retraso de cicatrización del perine, disfunción sexual o urinaria e infertilidad) o con la ostomia siendo la estenosis y el prolapso las más frecuentes.3,42 Al no haber anastomosis intra cavidad se han reportado menos complicaciones que en la proctocolectomía restaurativa (26% vs 52%).51-54
Foto 61: Esquema y pieza de coloproctectomía con ileostomía definitiva.
Dibujo 10: Ileostomía a lo Brooke y fijación del mesenterio al parietocolico.
9.2.2 Coloproctectomía total con ileostomía a lo Kock (definitiva)
La ileostomía continente a lo Kock fue introducida en los 60 pero nunca alcanzo una gran popularidad. Puede ser una alternativa a la operación anterior en aquellos pacientes que no toleran el efluente continuo de material ileal, siendo sus contraindicaciones la enfermedad de Crohn, alteraciones psiquiátricas, terapia esteroidea prolongada, cáncer avanzado y obesidad.1
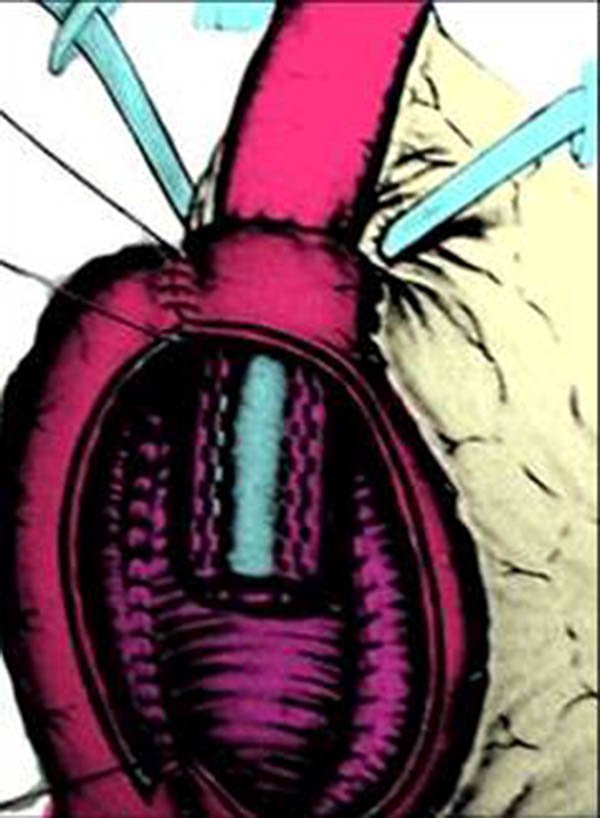
En el año 1969 Nils Kock ideó este procedimiento en el cual se crea un reservorio de intestino delgado con una invaginacion de íleon terminal que conforma una válvula pezón con el objeto de controlar la salida del contenido intestinal a través de la ileostomía5,46,55-57 (dibujos 11 y 12).
Se utilizan 45-60 cm de íleon distal que se dispone en forma de U invertida realizando una sutura entero-entérica seromuscular. Se incide en forma longitudinal en el borde antimesentérico de las dos asas adosadas, teniendo la precaución de que el corte se prolongue más sobre el asa aferente. Se completa con una sutura continua de la pared posterior. A continuación se realiza la válvula “pezón” invaginando 5 cm del asa eferente hacia la cavidad de la futura bolsa. Se toman con puntos ambas paredes telescopadas evitando atrapar la pared contralateral por medio de una bujía de Hegar introducida en la luz. Se termina con una sutura en dos planos completando la pared anterior de la bolsa, la que se fija a la pared abdominal. La ileostomía se evierte aproximadamente 1,5 cm. El contenido de la bolsa se podrá evacuar solamente por medio de una sonda colocada a través de la ileostomía que sobrepase la válvula.46,55,56,58 Actualmente la confección de la bolsa se puede realizar con suturas mecánicas.
Estos reservorios son propensos a fallar por complicaciones o por deslizamiento de la válvula pezón, presentando altas tasas de reoperaciones lo cual puede suceder hasta en un 50% de los casos.1,5 Otras complicaciones observadas son pouchitis (7-30%), sangrado, isquemia, necrosis de la válvula y fístulas.46,58,59 En cuanto a las tasas de fallos varian de 5% a 40% y la necesidad de revisión del reservorio del 11% al 72% siendo la principal causa en la mayoría de los casos problemas con la válvula.60
A pesar de esto algunos autores la ven como una alternativa viable ya que existen varios trabajos que informan una excelente calidad de vida con una imagen corporal prácticamente normal.61-66
En un intento por disminuir la principal complicación: tendencia que presenta la válvula a deslizarse o intususceptarse por los movimientos propios del intestino, se fueron ideando modificaciones algunas probadas en animales67-69 y otras realizadas en pacientes. Inicialmente se fija la válvula mediante puntos a ambas asas de intestino,70 luego su usaron suturas mecánicas para estabilizar la válvula.71,72
Diversos autores añaden para disminuir esta complicación algún acto complementario como:
- El uso de agentes esclerosantes entre las serosas,
- la escarificación de las serosas,
- disecar cuidadosamente el peritoneo del mesenterio para confeccionar la válvula,
- afinar el mesenterio si este es grueso,
- colocar suturas en el fundus del reservorio en el conducto de salida,
- uso de mallas tipo collar alrededor del asa eferente (efectivo pero abandonada por la formación de fístulas).73-75
- Uso de dispositivos de cierre magnéticos tipo MACLET.75
- Uso de un segmento fascial a través del mesenterio.68,70,75
En cuanto a la configuración existen tres tipos que son usados más asiduamente en la actualidad:
- Reservorio en S: con suturas mecánicas introducido por Fazio que utiliza 3 asas de intestino delgado (15 cm por asa más 15 a 20 cm para el asa eferente el cual es intususceptada para formar la válvula).
- Reservorio isosperistaltico de Barnett: La bolsa está compuesta por dos asas, con la extremidad aferente utilizada para construir la válvula pezón por intususcepción isoperistáltica (dirección del peristaltismo hacia la bolsa). El asa residual se envuelve alrededor de la válvula del pezón y el intestino proximal se une al fondo de la bolsa para reanudar la continuidad intestinal. Esta modificación fue diseñada para reducir la incidencia de deslizamiento de válvulas y formación de fístulas. Es una bolsa complicada para construir y las modificaciones de válvulas con fijación mediante sutura mecánicas a la pared del reservorio, han limitado su necesidad.51,76-78
En 1995 Mullen y cols.79 publican una experiencia múlticentrica sobre 510 pacientes a los que se le realizó esta técnica con tasas de desplazamiento de la válvula de 6,3%, fístulas de la válvula de 4,5%, fístulas del reservorio de 6,3% y una tasa de reoperaciones por complicaciones relacionadas al reservorio de 12,8%. - Reservorio en T: Consiste en aislar el segmento terminal del intestino delgado con su suministro de sangre como los utilizados en urología. El mecanismo de la válvula se crea mediante la incorporación de este segmento en un túnel revestido por la serosa de dos asas de intestino adosadas que forman el reservorio.76,80
En nuestro país solo encontramos una referencia nacional de Garriz quien había realizado un número pequeño de casos con resultados poco favorables.53,57
Dibujo 11: Ileostomía a lo Kock confección de la bolsa; confección de la válvula y bolsa adherida a la pared.
Dibujo 12: Variante con malla de la bolsa de Kock adaptado.
9.2.3 Colectomía total con ileorrectoanastomosis
La colectomía total con ileorrectoanastomosis fue la alternativa viable a la coloproctectomía con ileostomía definitiva en los años 50–60.81-84 Aylett y cols. fueron sus grandes defensores asociadandola a una ileostomía de protección (dibujo 13). La única contraindicación era la colitis fulminante, por lo cual la realizaba en más del 90% de los casos reportando excelentes resultados.81,82
En los años ´70-´80 encontramos algunos reportes de grupos que la continuaron utilizando electivamente, Khubchandani, en 1989 publica una tasa de fallos del 11%.83,85-87
Desde el advenimiento de la coloproctetomía con restauración del tránsito a través de reservorios, esta solo es utilizada en casos excepcionales cuando el recto no está comprometido por la enfermedad, lo cual ocurre entre el 1 y 2%, o en aquellos pacientes en que el cuadro sea sugestivo de una colitis indeterminada,3,46,58,59,88 que además no presenten displasia, que el recto sea distensible y que la continencia se encuentre conservada.2,3,58,90 Las principales razones por lo cual no es la cirugía de elección son las complicaciones que pueden desarrollarse en forma temprana como: la dehiscencia de la anastomosis con riesgo de peritonitis y el desarrollo de fístulas o tardiamentente que el recto remanente se inflame dando lugar a un mal funcionamiento, persistencia de la sintomatología o estenosis (fallos de la ileorrectoanastomosis del 12% al 53% con seguimientos de 3 años),5 el riesgo de malignización del mismo (0-8%),2,3,5,42,88 la reagudización de las manifestaciones extracolónicas y el desarrollo de compromiso perineal.91
En nuestra experiencia la hemos realizado en 9 casos, siendo las indicaciones: cáncer de colon avanzado y en los raros casos de pacientes con recto sano.
Por otro lado las guías ECCO sugieren que a las pacientes mujeres en edad fértil se le plantee dentro de las opciones la colectomía total, y la colectomía total con ileorrectoanastomosis por no alterar la fertilidad.63,88,89
Dibujo 13: Colectomía total con ileorrectoanastomosis con y sin ileostomía de protección.
9.2.4 Coloproctectomía con reservorio ileal y anastomosis ileo anal
En la actualidad esta es la cirugía de elección en la colitis ulcerosa lo que amerita que se le dedique un capítulo.
BIBLIOGRAFÍA
- Graziano A, Ramirez Rojas PA, Collia Avila, K: Rectocolitis Ulcerosa Inespecifica: Tratamiento Quirúrgico. III 351.
- Millan Scheiding M, Rodriguez Moranta F, Kreisler Moreno E, et al: Estado actual del tratamiento quirúrgico electivo de la colitis ulcerosa. Revision sistematica. Cir Esp 2012;90(9):548-557.
- Ross H, Steele, SR, Varma M, et al: Practice Parameters for the Surgical Treatment of Ulcerative Colitis. Dis Colon Rectum 2014; 57: 5–22.
- Kühn F, Klar E: Surgical Principles in the Treatment of Ulcerative Colitis. Viszeralmedizin 2015;31:246–250.
- Bennis M, Tiret E: Surgical management of ulcerative colitis. Langenbecks Arch Surg (2012) 397:11–17
- Graziano A. Colitis Ulcerosa. En Cirugía de Michans.(Eds.)Ferraína P., Oría A. Edit. “El Ateneo “. 1997,830-837.
- Goligher John: Cirugía del ano, recto y colon. 2aedición. 1987. Colitis ulcerosa, complicaciones. 22: 811-813.
- Graziano A, Coraglio M, Masciangioli G, et al: Colitis ulcerosa y cáncer. Una asociación problemática. Rev. Argent. Cirug., 2008; 95 (3-4): 111-119.
- Lakatos l, mester G, erdelyi Z, et al. Risk factors for ulcerative colitis-associated colorectal cancer in a hungarian cohort of patients with ulcerative colitis: results of a population based study. Inflamm Bowel Dis. 2006;12:205–211.
- Bernstein CN, Blanchard JF, Kliewer E, Wajda A. Cancer risk in patients with inflammatory bowel disease: a population-based study. Cancer. 2001;91:854–862.
- Ransohoff DF.: Colon cancer in ulcerative colitis. Gastroenterology 1988; 94: 1089-1091.
- Sebastian S, Hernández V, Myrelid P, et al: Colorectal cancer in inflammatory bowel disease: Results of the 3rd ECCO pathogenesis scientific workshop (I). Journal of Crohn’s and Colitis (2014) 8, 5–18.
- Jess T, Simonsen J, Jørgensen KT, Vestergaard Pedersen BV, et al: Decreasing Risk of Colorectal Cancer in Patients With Inflammatory. Bowel Disease Over 30 Years. Gastroenterology 2012;143:375-381.
- Cannon J: Colorectal Neoplasia and Inflammatory Bowel Disease. Surg Clin N Am 95 (2015) 1261–1269.
- Choi CHR, Rutter MD, Askari A, et al: Forty-Year Analysis of Colonoscopic Surveillance Program for Neoplasia in Ulcerative Colitis: An Updated Overview. Am J Gastroenterol 2015; 110:1022–1034.
- AGA Technical Review on the Diagnosis and Management of Colorectal Neoplasia in Inflammatory Bowel Disease. GASTROENTEROLOGY 2010;138:746–774.
- Wanders LK, Dekker E, Pullens B, et al: Cancer Risk After Resection of Polypoid Dysplasia in Patients With Longstanding Ulcerative Colitis: A Meta-analysis. Clinical Gastroenterology and Hepatology 2014;12:756–764.
- Mattar MC, Lough D, Pishvaian MJ, et al: Current Management of Inflammatory Bowel Disease and Colorectal Cancer. Gastrointest Cancer Res 2011;4:53–61.
- Gaidos JKJ, Bickston SJ: How to Optimize Colon Cancer Surveillance in Inflammatory Bowel Disease Patients. Inflamm Bowel Dis 2016;22:1219–1230.
- Kowenter JA, Ahlman H, Hulten:.Cancer risk in extensive ulcerative colitis. Ann Surg 1978; 188:824-8.
- Muto T: Dysplasia and carcinoma in inflammatory bowel disease. Colorectal disease in 1999 vol 3, Cleveland clinic.
- Eaden JA, Abrams KR, Mayberry Jf. the risk of colorectal can- cer in ulcerative colitis: a metaanalysis. Gut. 2001;48:526–535.
- Dobbins Wo III.: Dysplasia anad malignancy in inflammatory bowel disease. Ann Rev Med 35: 33-48,1984.
- Tabibian JH, Moradkhani A, Topazian MD: Colorectal cancer surveillance in primary sclerosing cholangitis and inflammatory bowel disease. Annals of hepatology 2015;14(4):556-566.
- Neumann H, Vieth M, Langne C, et al: Cancer risk in IBD: How to diagnose and how to manage DALM and ALM. World J Gastroenterol 2011 July 21; 17(27): 3184-3191.
- Bae SI, Kim YS: Colon Cancer Screening and Surveillance in Inflammatory Bowel Disease. Clin Endosc 2014;47:509-515.
- Baistrocchi H. La videocolonoscopia en las enfermedades inflamatorias del recto y colon. Rev Argent Coloproct 2015;26(3):100-14.
- Gualdrini: Pesquisa de cancer colorrectal. Rev Argent Cir 2015;26(3):100-147. Rev Argent Coloproct 2016;27(1):115-124.
- Gentilini L, Coscia M, Laureti S, et al: Surgery in presence of dysplasia in IBD. Ann. Ital. Chir., 2011 82: 37-40.
- Glotzer D: Cirugìa de la enfermedad inflamatoria intestinal. Indicaciones y tipos. Clin Gastroenterológica 1981;8(2):151-171.
- Jain SK, Pepperconrn MA: Inflammatory bowel disea- se anad colon cancer: Areview. Dig Dis 1997; 15:243-52.
- Petras R. Interpretating dysplasia in inflammatory bowel disease. Clevelan clinic Florida 16th annual Colorectal Disease Symposium. 2005.
- Ridell RH.: Dysplasia en la enfermedad inflamatoria intes- tinal. Clin Gastroenterològica 8(2):225-245, 1981.
- Ridell RH, Goldman H, Ransohoff DF y colab.: Dysplasia in inflammatory bowel disease: standardized classi- fication with provisional clinical applications. Hum Pathol 1983; 14:931-68.
- Odze RD, Farraye FA, Hecht JL, Hornick JL: Long term follow up after polypectomy treatment for adeno- ma-like dysplastic lesion in ulcerative colitis. Clin Gastroente- rol & Hepatol. 2004;2:534-41.
- Cairns SR, Scholefield JH, Steele RJ, et al. Guidelines for colorectal cancer screening and surveillance in moderate and high risk groups (update from 2002). Gut 2010;59:666–689.
- National Institute for Health and Clinical Excellence. Colonoscopic surveillance for prevention of colorectal cancer in people with ul- cerative colitis, Crohn’s disease or adenomas. Available at: http:// www.nice.org.uk/guidance/CG118. Accessed January 5,2010.
- Van Assche G, Dignass A, Bokemeyer B, et al. Second Euro- pean evidence-based consensus on the diagnosis and man- agement of ulcerative colitis part 3: special situations. J Crohns Colitis 2013;7:1–33.
- Rozenbajgier C, Ruck P, Jenss H, et al: Filiform polyposis: A case report describing clinical, morphological, and immunohistochemical findings. Clin Investig 1992;70:520-528.
- Velayos FS, Loftus EV Jr, Jess T, et al. Predictive and protective factors associated with colorectal cancer in ulcerative colitis: a case-control study. Gastroenterology.2006;130:1941–1949.
- Rutter MD, Saunders B, Wilkinson KH, et al. Cancer surveillance in longstanding ulcerative colitis: endoscopic appearances help predict can- cer risk. Gut. 2004;53:1813-1816.
- Cohen JL, Strong SA, Hyman NH, et al: Practice Parameters for the Surgical Treatment of Ulcerative Colitis. Dis Colon Rectum 2005; 48: 1997–2009.
- Heppel J: surgical management of inflammatory bowel di- sease-I. Uptodate 2004.
- Lavery I: Nonenteric complications of inflammatory bowel disease. Seminars Colon & Rectal Surgery. 1990;1(3): 183-185.
- Beart RW. Surgical management of chronic ulcerative coli- tis. Seminars in Colon & Rectal Surgery, 1990; 1(3): 186-194
- Jagelman D: Surgical alternative for ulcerative colitis. Medical clinics of North-Am, 1990;74(1):155-167.
- Berger M, Gribetz D, Korelitz BI. Growth retardation in chil- dren with ulcerative colitis: the effect of medical and surgical therapy. Pediatrics. 1975;55:459–467.
- Griffiths AM. Growth retardation in early-onset inflammatory bowel disease: should we monitor and treat these patients dif- ferently? Dig Dis. 2009;27:404–411.
- Heuschkel R, Salvestrini C, Beattie RM, Hildebrand H, Walters t, Griffiths a. Guidelines for the management of growth failure in childhood inflammatory bowel disease. Inflamm Bowel Dis. 2008;14:839–849.
- Becker JM. Surgical therapy for ulcerative colitis and Crohn’s disease. Gastroenterol Clin North Am 1999; 28:371.
- Bohl JL, Sobba K: Indications and Options for Surgery in Ulcerative Colitis. Surg Clin N Am 95 (2015) 1211–1232.
- Graziano A; Seoane A; Lumi, C, y cols. Anastomosis ileoanal con reservorio ileal en J. Técnica y resultados a corto plazo. Rev Arg. Ciru51g. 1989; 12:56-69.
- Fraise M, Graziano A: Ileostomías. En Patología del Intestino delgado Crosetti E, Boerr L, Bai J (Eds). Ed. Científica Interamericana. 1987:369-381.
- Camilleri-Brennan J, Munro A, Steele RJ. Does an ileoanal pouch offer a better quality of life than a permanent ileos- tomy for patients with ulcerative colitis? J Gastrointest Surg. 2003;7:814–819.
- Kock NG, Myrvold HE, Nilsso LO: Progress report on the continet ileostomy. World J Surg 1980; 4:143-148.
- Kock N, Brevinge H y colab. : Continent ileostomy. The present tecnique and long term results. Ann. Chir.Gynae- col.1986;75(2) :63-70.
- Garriz R, Santangelo H, Fernández Baloni, Fajre M: Ileostomía continente de Kock Rev Arg Cirug. 1977;33:132-137.
- Tuckson W. B. Surgical Treatment for Ulcerative Colitis. Core Subjets, Ame. Soc. Of Col & Rec. Sur., 2001, 47-54.
- McLeod RS.: Chronic ulcerative colitis: Traditional surgical techniques. Surg Clin North Am 1993;73(5):891
- Aytac E, Ashburn J, Dietz DW: Is There Still a Role for Continent Ileostomy in the Surgical Treatment of Inflammatory Bowel Disease? Inflamm Bowel Dis 2014;20(12):2519-2525.
- Castillo E, Thomassie LM, Whitlow CB, et al. Continent ileostomy: Current experience. Dis Colon Rectum. 2005;48:1263-8.380.
- Ecker KW, Haberer M, Feifel G. Conversion of the failing ileoa- nal pouch to reservoir-ileostomy rather than to ileostomy alone. Dis Colon Rectum. 1996;39:977-80.
- Dignass A, Lindsay JO, Sturm A, et al: Second European evidence-based consensus on the diagnosis and management of ulcerative colitis Part 2: Current management (Spanish version). http://dx.doi.org/10.1016/j.rgmx.2014.10.007.
- Borjesson L, Oresland T, Hulten L. The failed pelvic pouch: Conversion to a continent ileostomy. Tech Coloproctol. 2004;8:102-5.
- Litle VR, Barbour S, Schrock TR, et al. The continent ileostomy: Long-term durability and patient satisfaction. J Gastrointest Surg. 1999;3:625-32.
- Nessar G, Fazio VW, Tekkis P, et al. Long-term outcome and quality of life after continent ileostomy. Dis Colon Rectum. 2006;49:336-44.
- Orangio GR, Bronsther B, Abrams M, et al: A new type of continent ileostomy. Results of an animal study. Dis Colon Rectum. 1984 Apr;27(4):238-43.
- Bokey LE, Hayward PJ, Johnson SE, et al: Experiments in the development of a continent ileostomy: a simplified technique without a reservoir in dogs. Surgery. 1981 Sep;90(3):459-63.
- Fendel EH, Fazio VW: Construction of a continent ileostomy using a porcine aortic valve. A preliminary report. Dis Colon Rectum. 1982 Jan-Feb;25(1):21-3.
- Fazio VW, Tjandra JJ. Technique for nipple valve fixation to prevent valve slippage in continent ileostomy. Dis Colon Rectum 1992; 35: 1177-1179.
- Steichen FM, Loubeau J-M, Stremple JF. The continent ileal reservoir. Surgical Rounds 1978; 10-18.
- Nessar G, Wu JS: Evolution of continent ileostomy. World J Gastroenterol 2012 July 21; 18(27): 3479-3482.
- Hultén L, Svaninger G. Facts about the Kock continent il- eostomy. Dis Colon Rectum 1984; 27: 553-557.
- Thompson JS, Williams SM. Fistula following continent ileostomy. Dis Colon Rectum 1984; 27: 193-195.
- Corman ML: Ulcerative colitis. https://books.google.com.ar/books?isbn=0781740436
- Beck DE: Continent Ileostomy: Current Status. Clin Colon Rectal Surg 2008;21:62–70.
- Barnett WO. Improving the continent ileostomy. J Miss State Med Assoc 1983;24:31–34.
- Barnett WO. Modified techniques for improving the continent ileostomy. Am Surg 1984;50:66–69.
- Mullen P, Behrens D, Chalmers T, et al: Barnett continent intestinal reservoir. Multicenter experience with an alternative to the Brooke ileostomy. Dis Colon Rectum. 1995 Jun;38(6):573-82.
- Kaiser AM, Stein JP, Beart RW Jr.: T-pouch: a new valve design for a continent ileostomy. Dis Colon Rectum. 2002 Mar;45(3):411-5.
- Aylett SO: Three hundred cases of diffuse ulcerosa colitis treated by total colectomy and ileorectal anastomosis British Med Journal 1966:i1001-1005.
- Aylett SO: Ucerative colitis. Ileorectal anastomosis 1952-1968. Proceedings of the Royal Society of Medicicine 1971;64,967-971.
- Juviler, Hyman N: Ulceratie colitis: the fate of the retained rectum. Clinics Colon Rectal Surg 2004;17(1):29-34.
- Baker WNW: The results of ileorectalanastomosis at St Mark’s Hospital from 1953 to 1968. Gut 1970;11:225-239.
- Khubchandani IT, Sandfort MR, Rosen L, et l: Current status of ileorectal anastomosis for inflammatory bowel disease. Dis Colon Rectum. 1989 May;32(5):400-3.
- Johnson WR, Hughes ES, McDermott FT, et al: The outcome of patients with ulcerative colitis managed by subtotal colectomy. Surg Gynecol Obstet. 1986 May;162(5):421-5.
- Khubchandani IT, Trimpi HD, Sheets JA, et al: Ileorectal anastomosis for ulcerative and Crohn’s colitis. Am J Surg. 1978 Jun;135(6):751-6.
- Baik SH, Kim WH: A Comprehensive Review of Inflammatory Bowel Disease Focusing on Surgical Management. J Korean Soc Coloproctol 2012;28(3):121-131,
- Moreira AdL, Lavery IC: Ileorectal Anastomosis and Proctocolectomy with End Ileostomy for Ulcerative Colitis. Clin Colon Rectal Surg 2010;23:269–273.
- Tonelli F, Di Martino C, Giudici F: Could Total Colectomy with Ileorectal Anastomosis Be an Alternative to Total Proctocolectomy with Ileal Pouch-Anal Anastomosis in Selected Ulcerative Colitis Patients? Gastroenterology Research and Practice Volume 2016, http://dx.doi.org/10.1155/2016/5832743.
- Graziano A: Bosisio O, Romero Montes JC y cols.: Evolución y destino del recto después de la colectomía por rectocolitis ulcerosa inespecífica. Prensa Med Arg, 1984 71:626.
- Wexner SD, Johansen OB: Laparoscopy total abdominal colectomy. A prospective trial. Dis Colon Rectum 1992;35(7):651-10.
- Does laparoscopic assited iela pouch anal anastomosis reduced the lenght of hospitalization? Int J Colorectal Dis 1994;9(3):134-7.
- Marcello PW, Milson JW, Wong SK, et al: Laparoscopic proctocolectomy case matched comparative study with open restorative proctocolectomy. Dis colon Rectum 2000;43(5):604-8.
- Brown SR, Eu KW, Seow Choen F: Consecutive series of laparoscopic assisted vs minilaparotomy restorative proctocolectomy. Dis Colon Rectum 2001;44(3):397-400.
- Ky AJ, Sonoda T, Milsom JW: One stage laparoscopic restorative proctocolectomy: an alternative to the convencional approach? Dis Colon Rectum 2002;45(2):207-10.
- Pace DE, Seshadri PA, Chiasson PM, et al: Early experience with laparoscopic ileal pouch anal anastomosis for ulcerative colitis. Surg Laparosc Endosc Percutan Tech 2002;12(5):337-41.
- Kienle P, Weitz J, Benner A, et al: Laparoscopically assisted colectomy abd ileal pouch procedure with and without protective ileostomy. Surg Endosc 2003;17(5):716-20.
- Simon T, Orangio G, Ambroze W, et al: Laparoscopic assisted bowel resection in pediatric adolecent inflammatory bowel disease: laparoscpic bowel resetion in children. Dis Colon Rectum 2003;46(1):1325-31.