CAPÍTULO 6
Enfermedad de Crohn perineal
La afectación perianal es una de las formas de presentación de la enfermedad de Crohn más agresiva e invalidante, pudiendo ocurrir en un 3.8 al 80% de los pacientes,1-7 debiéndose esta amplia variación a los distintos criterios de inclusión utilizados y al tiempo de seguimiento de las distintas series. Cuando todas las manifestaciones perianales son incluidas, su incidencia se eleva al igual que lo que sucede con las series con un seguimiento más prolongado. Su prevalencia se incrementa cuanto más distal es la afectación luminal:
- la forma ileal única se asocia con alrededor de un 12% de afectación perianal,
- la enfermedad ileocólica en un 15%,
- la colónica en un 41%
- y la rectal en alrededor del 92%.6,7
Si este último está afectado la evolución de la enfermedad perianal es peor. En los primeros 37 casos publicados por nuestra institución en el año 1980, cuando la afectación era colorrectal el 81,2% presentaba lesiones perianales, el 57,1% en las formas ileocólicas y el 100% en los casos en las proctitis.8 En la última revisión (año 2016) de los pacientes que consultaron a coloproctología el 80% presentaba afectación colorrectal, el 7,58% en íleony 12,42% ileocecal.
La localización rectal, junto a la necesidad inicial de corticoides y a la edad de comienzo (antes de los 40 años), es considerada por algunos autores un factor de riesgo para el desarrollo de una evolución tórpida.4 Lakatos y cols.9 en concordancia con Tarrant y cols.,10 encuentran que la presencia de enfermedad perianal se asocia con un incremento del riesgo 3 a 4 veces mayor.
Las lesiones que se pueden encontrar son: plicomas (40–70%, son hallazgos frecuentes en la población general y pueden o no estar relacionados con la enfermedad de Crohn), hemorroides (7%), fisuras (19%), úlceras (12%), estenosis anorrectales (34% ano; 50% en recto), abscesos, fístulas perianales y fístulas recto vaginales. Siendo los síntomas más frecuentes: dolor, ardor, sangrado, secreción purulenta, incontinencia de materia fecal.7
Todas estas manifestaciones perianales pueden aparecer como debut de la enfermedad en aproximadamente el 5% de los casos, incluso precediendo en varios años a la localización intestinal.
Otras características que refuerzan el carácter agresivo de esta localización son su gran tendencia a la recurrencia, con tasas de recaídas del 35 al 59% a los dos años; la necesidad de cirugía en el 80% de los casos y la necesidad de una proctectomía en el 20% de los pacientes.
Existen diversas clasificaciones relacionadas a la enfermedad perianal, algunas de las cuales solo agrupan las lesiones careciendo de valor para el seguimiento de los tratamientos realizados, y otras toman en cuenta las distintas manifestaciones y su clínica.
Dentro de las primeras podemos encontrar la clasificación de Buchmann - Alexander Williams,11,12 la cual divide a la afección perianal en:
- Lesiones de piel: maceración, erosión, ulceración y plicomas.
- Lesiones del canal anal: fisuras, úlceras y estenosis.
- Fístulas: bajas, altas y rectovaginales.
Dentro de las segundas encontramos la clasificación de Cardiff1,13,14 la cual toma en cuenta la presencia de ulceraciones, fístulas/abscesos y las estricturas, dándole a cada ítem un valor de acuerdo al grado de severidad clínica (0: no está presente, 1: lesiones de buen pronóstico, 2: lesiones asociadas a mal pronóstico) (Tabla 13). Y el índice de actividad de enfermedad perianal PDAI – Perianal Disease Activity Index, elaborado por Irving y colaboradores en 1995.15 Este índice evalúa la morbilidad de la enfermedad perianal, tomando en cuenta 5 categorías: presencia de secreción, dolor, restricción en la actividad diaria, tipo de enfermedad perianal y el grado de induración. Cada categoría tiene un puntaje de 0 a 5; un score alto se asocia a una enfermedad más severa.15,16 Si bien el corte para ver si una respuesta fue clínicamente significativa no ha sido determinado, se puede utilizar para comparar los índices de actividad previos posteriores al tratamiento. Por otro lado, se sugiere que el corte para considerar enfermedad perianal activa sea un puntaje mayor a 412 (Tabla 14).
Pikarsky y cols.,17 en el año 2002, proponen una clasificación -la cual no está formalmente validada- que incluye la presencia de abscesos, fístulas, úlceras anales, fisuras, estenosis, incontinencia y enfermedad luminal concomitante, para evaluar y predecir los resultados del tratamiento quirúrgico (Tabla 15). Un puntaje de 15 o menos se asocia en dicho trabajo a buenos resultados postquirúrgicos, mientras que un puntaje de 20 o más se asoció a malos resultados.
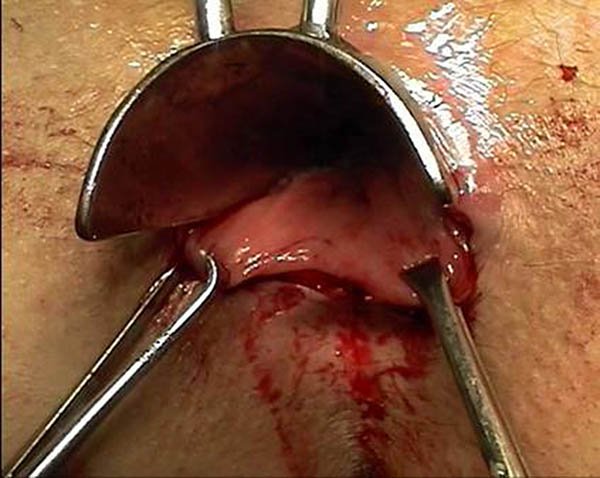
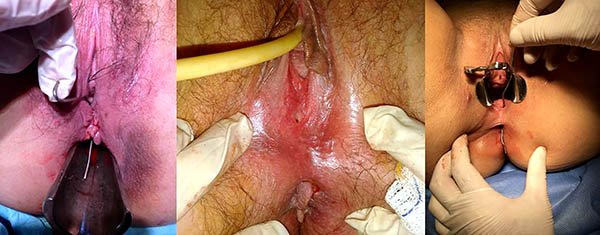
Plicomas (foto 28)
Los plicomas están presentes en el 371 al 70% de los pacientes con enfermedad de Crohn, pudiendo variar en: tamaño, forma y consistencia.7 Generalmente se asocian a linfedema o fisuras recurrentes y fístulas. Debido a que la enfermedad luminal cursa generalmente con diarrea, estos suelen inflamarse, endurecerse y provocar dolor.
Bonheur y cols.18 clasifican a los plicomas en dos tipos:1,14
Tipo 1: son los típicos hallados relacionados a la enfermedad de Crohn, son grandes, edematosos, cianóticos y duros. Se relacionan con el linfedema secundario a la obstrucción linfática y usualmente coexisten con inflamación intestinal. Su resección quirúrgica debe ser evitada.
Tipo 2: llamado en orejas de elefante, son planos anchos o estrechos, blandos e indoloros.
Estas lesiones si bien son persistentes, su sintomatología mejora al mejorar la diarrea y las lesiones asociadas. La escisión quirúrgica debe evitarse a menos que interfieran con la higiene o sean persistentemente sintomáticos, ya que es bien conocido que la enfermedad de Crohn se asocia a retardo en la cicatrización.7,14,19,20 También se ha relacionado a la cirugía de estas lesiones con mayores chances de infección, úlceras y desarrollo de fístulas.21
|
Ulceracion (U) |
Fístula o absceso (F) |
Estricturas (E) |
|
0 ausente 1 fisuras superficiales a. posterior y o anterior b. lateral c. con gruesos plicomas 2 úlceras cavitadas a. en canal anal b. en recto bajo c. con extensión a la piel perineal (agresiva ulceración) |
0 ausente 1 baja o superficial a. perianal b. anovulvar o anoescrotal c. interesfinterico d. anovaginal 2 altas a. supraelevador b. alta directa (anorrectal) c. alta compleja d. rectovaginal e. ileoperineal |
0 ausente 1 estrictura reversible a. en conducto anal - espasmo b. en recto bajo - membranosas c. espasmo con severo dolor sin sepsis 2 estricturas irreversibles a. estenosis anal b. estrictura extrarrectal |
Clasificación subsidiaria
|
A: asociada a condiciones anales |
P: enfermedad intestinal proximal |
D: Actividad de la enfermedad (en las lesiones anales) |
|
0 ausente 1 hemorroides 2 patología maligna 3 otras lesiones (especificar) |
0 ausente 1 enfermedad rectal continua 2 colon con recto sano 3 intestino delgado 4 investigación incompleta |
1 activa 2 inactiva 3 no concluyente |
Tabla 13: Clasificación de Cardiff de la enfermedad de Crohn perianal
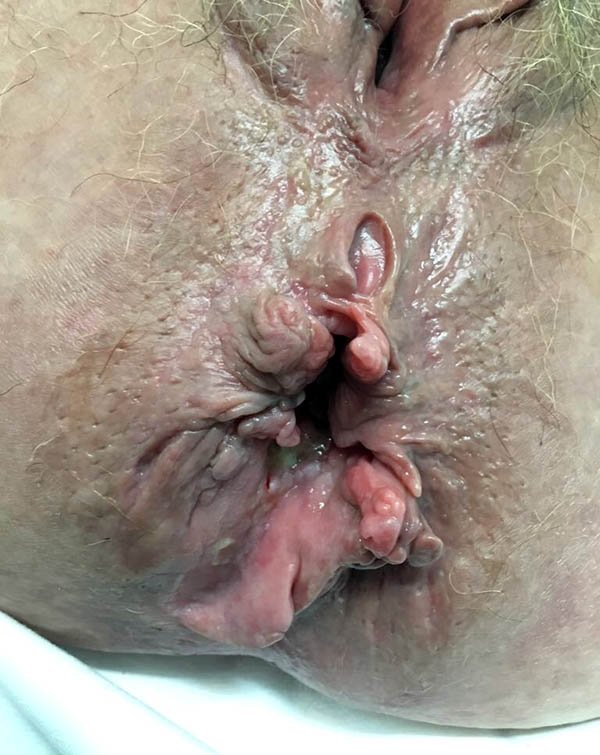
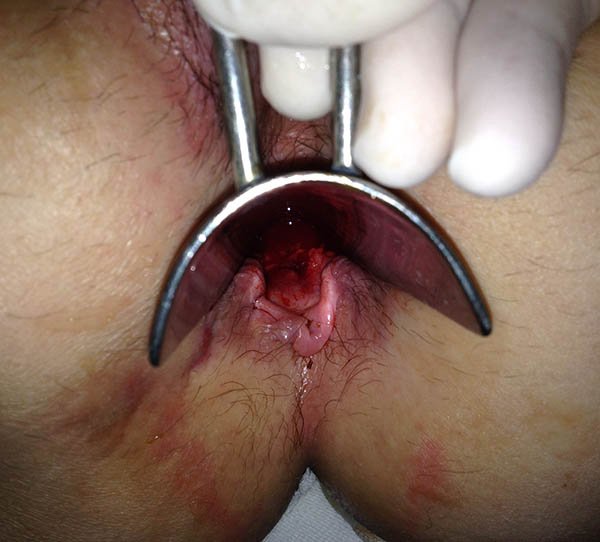
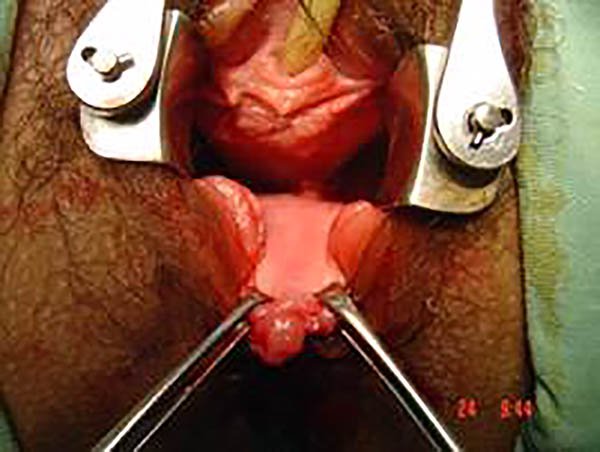
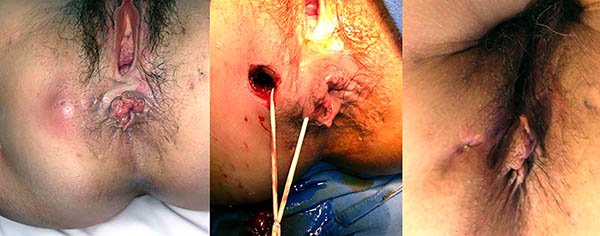
Foto 28: Periné por enfermedad de Crohn, donde se observan plicomas y ulcera.
Hemorroides
Las hemorroides son poco frecuentes en la enfermedad de Crohn y cuando se desarrollan suelen ser sintomáticas. La incidencia es de alrededor del 7%.2 La mayoría de los autores sugieren evitar el tratamiento quirúrgico e indican tratamientos locales con esteroides o pomadas anestésicas.1,2,14 Cuando el tratamiento médico falla, diversos autores han comunicado buenos resultados con la hemorroidectomía especialmente en aquellos con recto sano y enfermedad inactiva.2 Otra alternativa, en aquellas hemorroides internas sangrantes con recto sano, es la ligadura elástica.2,14,22
|
Secreción - ausencia de secreción - mínima secreción mucosa - moderada secreción mucosa o purulenta - secreción substancial - grosera perdida fecal |
0 1 2 3 4 |
|
Dolor / restricción de las actividades - ausencia de restricción en la actividad - moderado disconfort pero sin restricción - moderado disconfort con alguna limitación de sus actividades - marcado disconfort con marcada limitación - severo dolor con severa limitación |
0 1 2 3 4 |
|
Restricción de la actividad sexual - ausencia de restricción de en la actividad sexual - ligera restricción de la actividad sexual - moderada limitacion - marcada limitacion - incapacidad para mantener actividad sexual |
0 1 2 3 4 |
|
Tipo de enfermedad perianal - ausencia de enfermedad perianal - fisura anal o herida mucosa - < de 3 fístulas perianales - > de 3 fístulas perianales - Ulceraciones anales, fístulas con importante daño de la piel |
0 1 2 3 4 |
|
Grado de Induración - ausencia de induración - mínima induración - moderada induración - sustancial induración - masas fluctuantes / abscesos |
0 1 2 3 4 |
Tabla 14: Indice de actividad de enfermedad perianal.
Foto 29: Periné por enfermedad de Crohn donde se observa ulcera anal.
|
Tipo de lesión |
Puntaje |
|
Absceso no 1er absceso /absceso simple 1er absceso / abscesos múltiples 1er recurrencia de absceso simple o múltiples Múltiple recurrencia de absceso simple o múltiples Máximo puntaje de abscesos |
0 1 3 4 5 8 |
|
Fístula no Fístula de corto tiempo (menos de 30 días) FístulaFístula de largo tiempo (mas de 30 dias) FístulaFístula persistente postquirurgica FístulaFístula recurrente FístulaFístulas múltiples FístulaFístula rectovaginal o rectouretral FístulaFístula rectovaginal o rectouretral recurrente Máximo puntaje de fístulafístulas |
0 1 2 3 3 3 4 6 14 |
|
Úlcera y Fisura no Úlcera/fisura de corto tiempo Ulcera/fisura de largo tiempo Fisura/úlcera simple Fisura/úlcera multiple Máximo puntaje de fisura/úlcera |
0 1 2 1 2 4 |
|
Estenosis no Estenosis de corto tiempo Estenosis de largo tiempo Estenosis recurrente Máximo puntaje de estenosis |
0 1 2 4 6 |
|
Incontinencia no Score de incontinencia 1 a 6 Score de incontinencia de 7 a 14 Score de incontinencia mayor a 14 Máximo puntaje de incontinencia |
0 1 3 5 5 |
|
Enfermedad luminal (recto, colon, delgado) no Moderada Severa FístulaFístula activa Máximo puntaje de enfermedad luminal |
0,0,0 3,2,1 4,3,2 4,3,2 18 |
Tabla 15: Indice de actividad de Pikarsky y cols.
Fisura y úlceras (foto 29 y 30)
Las fisuras se presentan en un 19-30%7,23 de los pacientes con enfermedad de Crohn, Wolff y cols. en un trabajo con 26 años de seguimiento, encontraron una incidencia del 35%, mientras que Lockhart Mummery reporto un 51%.2 Estas suelen ser excéntricas en más del 20% de los casos, por lo general indoloras sin hipertonía esfinteriana. Para otros autores el dolor aparece en el 40 al 85%,1,7 pudiendo ser múltiples o amplias y profundas, con bordes cortados a pico, cuyo fondo es el esfínter interno y pueden encontrarse asociadas plicomas gigantes. El tratamiento de primera línea es médico y no difiere del efectuado para las fisuras comunes (nitroglicerina, diltiazem, toxina botulínica), obteniendo tasas de curación del 60%21 al 80%.7 Cuando son sintomáticas, el recto se encuentra sano y no mejoran con tratamiento médico la cirugía está indicada, la esfinterotomía lateral interna en particular presenta tasas de éxitos en el 88% de los casos.14,19
Se ha descripto que la cirugía puede complicarse con infección del lecho, heridas que no cicatrizan, estenosis o llevar a la incontinencia y a proctectomía.14 La cicatrización de las fisuras, al igual que con el resto de las manifestaciones perianales, dependerá de la actividad intestinal.
Las úlceras son lesiones más profundas, involucran el esfínter, sobrepasan la línea pectínea hacia el recto y son dolorosas.
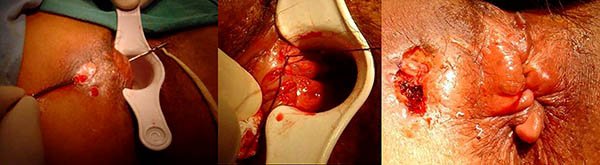
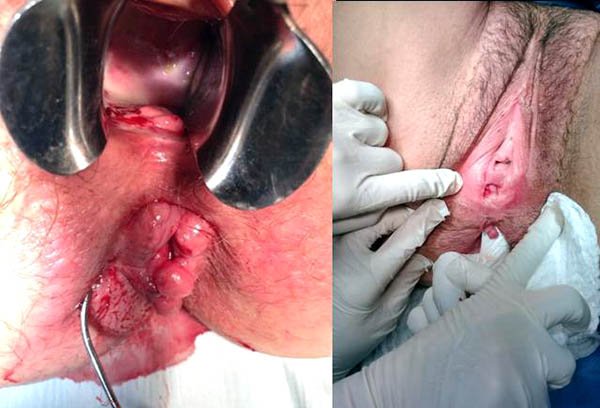
Estenosis anorrectales (foto 31)
Las estenosis anorrectales se presentan en el 7 al 22%23,24 de los pacientes adultos con enfermedad de Crohn, siendo considerado por varios autores como un predictor de mala evolución23,25 y de alto riesgo para la necesidad de un ostoma o una proctectomía. En un estudio Linares y cols.23 encontró que el 50% de las estricturas se hallaban en recto y el 34% en el ano.
La estenosis resulta de la inflamación circunferencial del recto o del ano o de la resolución de la misma en respuesta al tratamiento médico; los abscesos crónicos, las fístulas y las úlceras provocan también estenosis. Su ubicación más frecuente es a nivel del anillo anorrectal. Se han descripto tres variedades:14
- Estricturas cortas, anulares de menos de 2º cm de longitud, constituyendo una deformación diafragmática.
- Estenosis tubulares largas.
- Estricturas atróficas secundarias a defuncionalización.
Las estenosis suelen ser inicialmente asintomáticas, pero luego pueden presentar urgencia defecatoria, incontinencia, tenesmo y dificultad para evacuar. Cuando la sintomatología es leve se puede usar medicación tópica con corticoides, 5-ASA y/o metronidazol oral. Si persisten sintomáticas las dilataciones, con bujías o balones, repetidas pueden ser una solución sobre todo en las lesiones diafragmáticas, requiriendo múltiples dilataciones en el 30-40% de los casos.26 Lee y cols. Describen, en el año 2015, para estenosis anorrectales, la realización de estricturoplastias transanales tipo Heinecke Mikulicz en 15 pacientes (7 con estenosis por enfermedad de Crohn) de los cuales 6 persistían sin estenosis (media de seguimiento de 21 meses).26
Si la fibrosis adquiere aspecto tubular comprometiendo el recto, se asocia a fístulas que involucran gran masa del esfínter con o sin incontinencia la proctectomía, es necesaria en más de un 43% de los pacientes.7,14
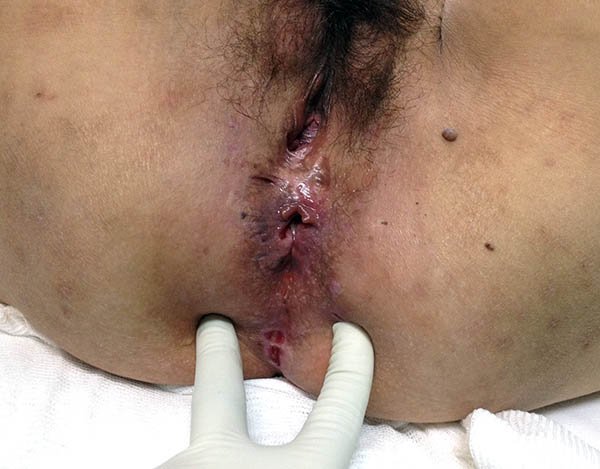
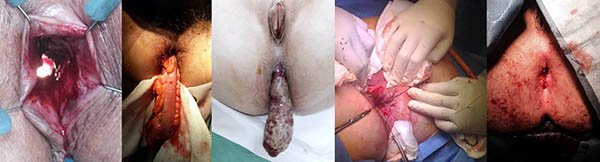
Foto 30: Periné por enfermedad de Crohn donde se observa fisura.
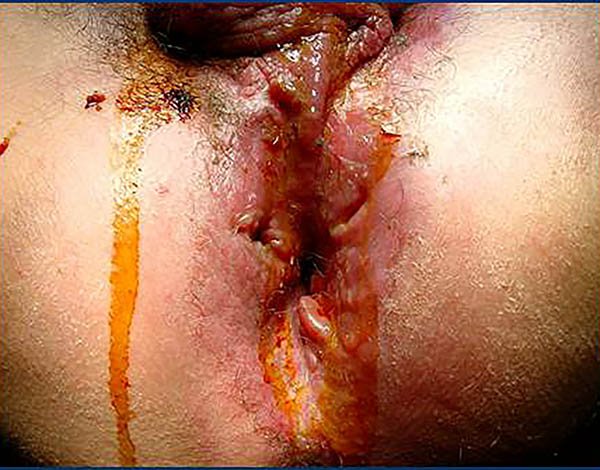
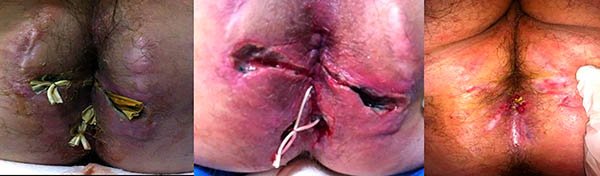
Foto 31: Periné por enfermedad de Crohn donde se observan estenosis y fístula.
6.1 FÍSTULAS Y ABSCESOS
La enfermedad fistulizante perianal (EFP) se presenta en el 17 al 43% de los pacientes3,5,27,28 y es considerada, por varios autores, como un fenotipo distinto.3,29 En nuestra primer publicación el 27% de los pacientes presentaban esta localización.
La forma fistulizante perianal puede presentarse como una manifestación inicial de la enfermedad de Crohn en alrededor del 10% de los casos,4,7 y debe diferenciarse de la hidrosadenitis, la tuberculosis perianal, tumores fistulizantes y quistes sacrococcigeos (foto 32).
Existen dos teorías acerca de la patogénesis de las fístulas, una de ellas sugiere que se originan en una inflación inicial del recto, asociada a úlceras que se profundizan o transforman en fístulas penetrantes. La segunda teoría sugiere que se originan en abscesos glandulares que penetran en el espacio interesfintérico y luego progresan.4,23
Diversos factores intervienen en su génesis, entre ellos microbiológicos, genéticos e inmunológicos. En relación a lo genético se han postulado diversos genes involucrados pero aún con reportes controvertidos. Kankan y cols.30 han hallado una fuerte asociación con variantes en el gen IBD5, Zoeten23 y Eglinton29 hallaron asociaciones con otros genes como: OCTN, IRGM y TNF. Mientras que Kanaan y cols.30 al igual que Kaur y cols.,31 no pudieron encontrar variaciones genéticas en CARD 15/NOD2, IL 23r OCTN1 o IGR que puedan identificar pacientes en riesgo de desarrollar enfermedad fistulizante perianal.
El hábito tabáquico es considerado un factor de riesgo para la enfermedad de Crohn perineal ya que se asocia a un inicio más temprano de la enfermedad, a mayor número de exacerbaciones y a una disminución de la eficacia del infliximab. Su cese por más de un año ha demostrado mejorar el pronóstico, por lo cual dejar de fumar esta formalmente indicado en la enfermedad de Crohn.30,32,33
Entre los otros factores también se involucra al género: aunque algunos autores sugieren un mayor riesgo de enfermedad perianal en hombres, trabajos de Schwartz y Kanaan30,34 no encontraron diferencias. Sucede lo mismo con la edad de diagnóstico sugiriendo algunos autores, como Schwartz, que una de edad de comienzo temprana se correlacionaría con una enfermedad más agresiva.34
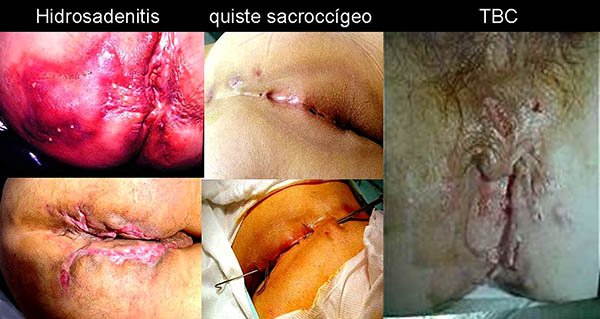
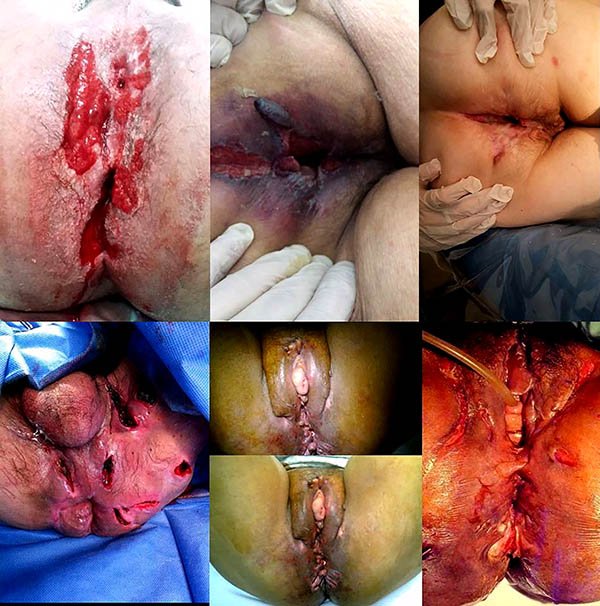
Foto 32: Fotos de diagnósticos diferenciales de enfermedad de Crohn perianal.
Abscesos
El absceso anorrectal es la principal causa de dolor en el paciente con afectación perianal, el 78% suelen ser abscesos simples, mientras que el 22% son complejos y en herradura. Su prevalencia es de alrededor del 50%14-60%.5 Los abscesos perineales podrán ser de acuerdo a su relación con el esfínter anal interno y los músculos elevadores: perianales, isquiorrectales, submucosos, interesfintéricos y pelvirrectales o supraelevadores.14,23
Generalmente, el diagnóstico es clínico, se presentan con tumoración fluctuante, rubor y edema, acompañado o no de fiebre y o mal estado general. Contrariamente a lo que ocurre en los abscesos idiopáticos, donde solo el examen físico y la clínica son suficientes para realizar el diagnóstico de certeza, en aquellos asociados a enfermedad de Crohn es necesario, muchas veces, realizar una resonancia magnética de pelvis o una ecografía endorrectal.
Una vez realizado el diagnóstico, el paciente debe ser sometido a un drenaje del absceso, con incisiones lo más cercana al ano posible. Si se identifica el orificio interno se procederá a fistulotomía, en caso de no involucrar esfínteres o a la colocación de un sedal flojo o a modo de drenaje si lo hiciere. En estos casos al drenaje se le asocia tratamiento antibiótico con ciprofloxacina y/o metronidazol.
Fístulas
Una fístula es definida como una conexión entre dos superficies epiteliales. En cuanto a su clasificación existen diversas y muchas de ellas preceden al conocimiento de su asociación a la enfermedad de Crohn. Históricamente la primera clasificación data de 1934. Milligan y Morgan categorizaron a las fístulas en aquellas que entraban en el conducto anal por arriba o por debajo del anillo anorrectal (definido anatómicamente por el músculo puborrectal, y la zona cefálica de los esfínteres), basados en observaciones de incontinencia postoperatoria.35
Parks clasifica a las fístulas en 4 tipos de acuerdo a su relación con los esfínteres: interesfinterianas, transesfinterianas, supraesfinterianas, extraesfinterianas. Algunos autores incluyen en esta clasificación a las fístulas superficiales:
- Fístulas submucosas o subcutáneas, también llamadas fistuletas.
- Fístulas Interesfintéricas: el trayecto fistuloso se encuentra en el espacio interesfiteriano.
- Fístulas Transesfinterianas: El trayecto se dirige desde el orificio interno, situado en la línea dentada, atraviesa los esfínteres interno y externo hacia la fosa isquiorectal. La mayoría de ellas no son complicadas ya que solo atraviesan la porción superficial del esfínter externo.
- Fístulas Supraesfinterianas: en ellas el trayecto pasa por encima del haz puborrectal, luego de surgir como una fístula interesfinteriana, se abre hacia la fosa isquiorrectal y se dirige hacia la piel perianal.
- Fístulas Extraesfinterianas: En este caso el trayecto se dirige desde el recto, atravesando el plano de los músculos elevadores para dirigirse a la piel perianal por vía del espacio isquiorrectal.
En el año 2003 una revisión técnica de la American Gastroenterological Association (AGA) propuso una clasificación empírica en simples y complejas.22 Simples: son aquellas fístulas que involucran escasa o nula cantidad de músculo esfintérico, son bajas por debajo de la línea de las criptas (superficiales o fistuletas, interesfinteriana baja y transesfinteriana baja). Sin signos de abscesos, estenosis anorrectales, proctitis ni conexión a vagina o vejiga (foto 34).
Complejas: interesfinterianas altas, transesfinterianas altas, extraesfinterianas, supraesfinterianas, aquellas con múltiples orificios externos con abscesos, las fístulas rectovaginales y la presencia de estenosis anorrectales con proctitis.
En cuanto a la presencia de múltiples orificios externos, debemos hacer la salvedad que en algunos casos estos trayectos son solo subcutáneos y con un único orificio interno, en este caso su resolución es simple.
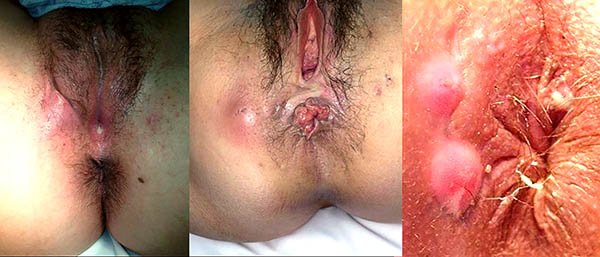
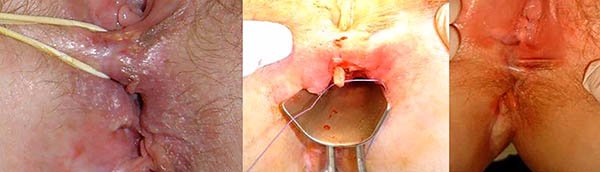
Foto 33: Periné por enfermedad de Crohn donde se observan abscesos.
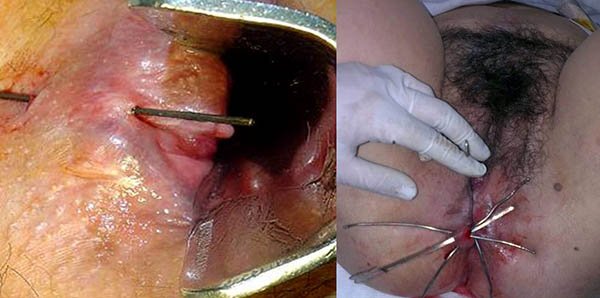
Foto 34: periné por enfermedad de Crohn donde se observan fistuletas o fistulas superficiales (con escasa o nula afectación esfinteriana).
6.1.1 Diagnóstico
El examen bajo anestesia es considerado el “gold standart” en el diagnóstico de la enfermedad de Crohn fistulizante perianal cuando es realizado por cirujanos coloproctólogos experimentados, aumentando su sensibilidad al 100% para determinar los trayectos fistulosos, cuando se lo asocia a un método por imágenes como la ecografía endoanal o la resonancia magnética nuclear. Un estudio de Schwartz y colaboradores encontró que si se efectúa ecografía endoanal o resonancia magnética nuclear y examen bajo anestesia, el porcentaje de éxitos para determinar los trayectos fistulosos asciende al 100% cuando se asocian, y del 90% si solo se efectúa el examen bajo anestesia.
El European Crohn’s and Colitis Organization recomienda en fístulas complejas realizar el examen bajo anestesia sin otro estudio cuando no se disponga o exista contraindicación para realizar una resonancia magnética.36
Durante el examen se puede identificar el orificio interno mediante la utilización de un gancho o estilete curvo, que permita enganchar el mismo o mediante la instilación de agua oxigenada o azul de metileno a través del orificio externo y la visualización de su emergencia en el orificio interno. El curso de los trayectos debe identificarse usando sondas suavemente colocadas en los mismos. En aquellos casos en que se disponga de un ecógrafo endorrectal y de un especialista entrenado, la ecografía intraoperatoria es una excelente opción.
Debe incluirse en el examen la rectoscopia, la cual nos permitirá evaluar la presencia de o no de proctitis, dato esencial para determinar la mejor estrategia; y la inspección perineal, ya que es posible que el proceso fistuloso involucre la vagina o el escroto.35,37
Siempre se deben tomar biopsias de tejido, aunque no siempre el estudio histológico ratifique el diagnóstico. Se debe completar el estudio del paciente con una colonoscopía, una endoscopia digestiva alta y con estudio del intestino delgado (tránsito de intestino delgado, entero tomografía o entero resonancia, o endocápsula).
Métodos auxiliares de diagnóstico (Tabla 16)
Fistulografía
Tiene un rol limitado en la evaluación de las fístulas anales,36,37-39 es un método impreciso para detectar el orificio interno y delinear trayectos secundarios en la gran mayoría de los casos. Podría ser usada en la evaluación de las fístulas recurrentes, particularmente cuando el procedimiento quirúrgico previo falló en identificar el orificio interno o cuando se sospecha de una fístula con conexión hacia otro órgano como por ejemplo la vejiga, sigmoides, etc. Se han reportado tasas de éxito en un rango de 16 a 50%,7 y falsos positivos en el 10%.40
Tabla 16: Clasificación de Van Assche basada en RMN
|
Parámetros |
Puntaje |
|
Número de tractos fistulosos - Ninguno - Simple y no ramificado - Simple y ramificado - Múltiple |
0 1 2 3 |
|
Localización - Extra o interesfinteriano - Transesfinteriano - Supraesfinteriano |
1 2 3 |
|
Extensión - Infraelevadora - Supraelevadora |
1 2 |
|
Hiperintensidad T2 - Ausente - Media - Pronunciada |
0 4 8 |
|
Colecciones (cavidades > 3 mm de diámetro) - Ausente - Presente |
0 4 |
|
Afectación de la pared rectal - Normal - Engrosamiento |
0 2 |
Tabla 17: Sensibilidad y especificidad de los distintos métodos por imágenes en enfermedad de CrOhn perianal fistulizante. 31,40
|
Estudio |
Sensibilidad |
Especificidad |
|
Resonancia magnetica |
87-96% |
69-80% |
|
Ecografia endoanal |
43-87% |
43-97.5% |
|
Ecografia transperineal |
84,9 |
36 |
|
Fístulografia |
16% |
|
|
Entero tomografia |
50-77 |
88 |
Ultrasonografía anorrectal (foto 35)
La ecografía endoanal nos brinda una excelente imagen de las estructuras anatómicas, es capaz de detectar con precisión los defectos esfinterianos y los abscesos anales, motivo por el que resulta de gran valor en el caso de proctalgias o abscesos no sospechados clínicamente41 y nos puede ayudar a delinear exactamente el trayecto fistuloso, identificar la pared rectal, tejidos perirrectales y los músculos esfintéricos. Si bien tiene la desventaja de ser operador dependiente, es un método económico, no invasivo, bien tolerado y fácil de realizar en manos entrenadas.
Justamente su aplicación en centros de referencia, realizado por personas entrenadas, puede ser equivalente al uso de la resonancia magnética reportandose una exactitud del 56 al 100%.38
Entre las desventajas encontramos que no puede ser realizado en pacientes con estenosis anal o dolor agudo (excepto que se la realice en quirófano como parte del examen bajo anestesia), distingue difícilmente los trayectos fistulosos del tejido cicatrizal, aunque esto puede ser minimizado con la instilación del agua oxigenada por el trayecto fistuloso.41 Otro inconveniente es su dificultad para delimitar topográficamente fístulas supra o extraesfinterianas.41
La ultrasonografía transperineal tiene grandes limitaciones para detectar y clasificar las lesiones profundas, algunos autores como Maconi y cols.42 encuentran ventajas en la detección de fístulas anovaginales y rectovaginales como así también en fístulas superficiales, en particular considerando que se puede realizar junto al examen bajo anestesia o junto al examen clínico.43
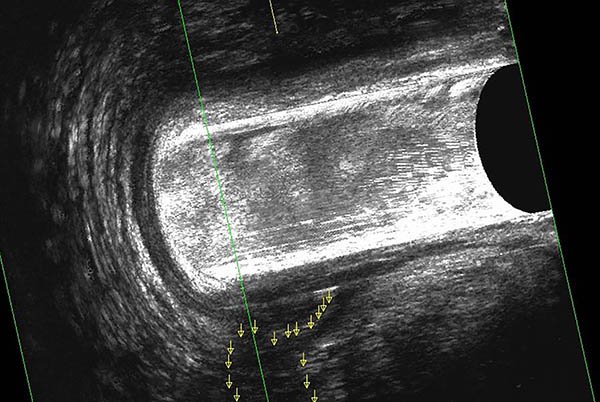
Foto 35: Ecografía endoanal donde se observa absceso.
Resonancia magnética (foto 36)
Gecse y colaboradores35 consideran a la RM como el gold standard dentro de los estudios por imágenes para evaluar el Crohn perineal,36,44 mientras que Garros45 y colaboradores sugieren ser cautelosos en su utilización y siempre asociarla a un optimo examen clínico. La exactitud diagnóstica reportada fue del 76 al 100%. Publicaciones recientes demuestran tasas de concordancia entre las imágenes y los hallazgos operatorios de 85.7% para la presencia del trayecto primario y orificio interno, 91.4% para el sitio de las extensiones secundarias o abscesos, 94.3% para detectar trayectos en herradura y 80% para la ubicación del orificio interno. La RM también permitiría identificar abscesos silentes y la presencia de inflamación luminal.
El uso de imágenes multiplanares mejoraría la capacidad para determinar la anatomía de la fístula y su relación con los planos quirúrgicos.44 Además, los tractos extraesfintéricos pueden ser evidenciados y el tejido cicatrizal se puede distinguir del inflamatorio.
Si bien la RM es considerada el estudio por imágenes de elección en la enfermedad fistulizante, algunos autores como Garros y cols.45 alertan sobre su baja sensibilidad para el diagnóstico de la enfermedad perianal no fistulizante. Estos autores encontraron un fallo del 95% para ver úlceras superficiales (20/21 pacientes) y 87% de fallos en ver ulceraciones severas (13/15 pacientes). Contrariamente Tutein Nolthenius y cols.46 han encontrado una buena correlación entre las imágenes de RM y las endoscopias en proctitis.
Van Assche y colaboradores38 han elaborado un score basado en los hallazgos de la RM relacionados con la extensión de la fístula (complejidad, extensión supraelevadora, relación con los esfínteres) y la presencia de inflamación (hiperintensidad en T2, presencia de cavidades o abscesos, afectación de la pared rectal) (tabla ). Otra clasificación basada en los hallazgos de la RM, es la clasificación del Hospital Unviersitario St James que puede ser asociada al resultado postquirúrgico, siendo de fácil resolución los grado 1 y 2, de resolución compleja con gran riesgo de incontinencia los grados 3 y 4, y el grado 5 con gran riesgo de sepsis pélvica. Esta consiste en 5 grados correlacionados con la clasificación de Parks:
- Grado 1: fístula superficial lineal y fístula interesfintérica.
- Grado 2: fístula superficial lineal y fístula interesfintérica con absceso o tracto secundario.
- Grado 3: fístula transesfinteriana.
- Grado 4: fístula transesfinteriana con absceso o tracto secundario.
- Grado 5: fístula supra o transelevadora.
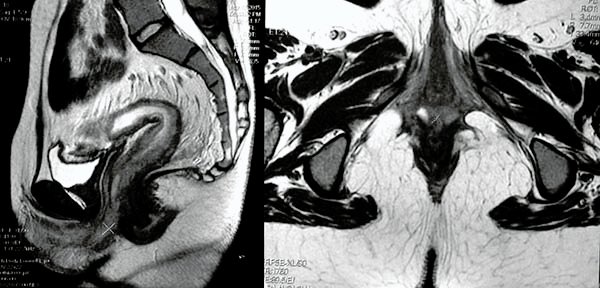
Foto 36: RM donde se observan marcada por la cruz colección.
6.1.2 Tratamiento
El tratamiento de la forma fistulizante perianal (EFP) tiene por objetivo tratar los síntomas y las complicaciones con el fin de mejorar la calidad de vida de estos pacientes.
El correcto diagnóstico e individualización de las características de la/s fístula/s es esencial para el manejo de las mismas (tipo de fístula, extensión, relación con la masa esfinteriana y las estructuras perineales y la presencia o no de colecciones concomitantes). Aquellos pacientes asintomáticos u oligosintomáticos no requieren ningún tratamiento específico, mientras que aquellos que son sintomáticos requieren un abordaje multidisciplinario.
Un pilar importante en la resolución de la EFP es la evaluación de la enfermedad luminal y su tratamiento si la hubiere. En el caso de proctitis el tratamiento médico incluye enemas tópicos de esteroides, enemas con 5-ASA o supositorios y esteroides sistémicos, agentes immunosupresores e inmunomoduladors (infliximab y adalimubab). Se han descripto cierre de los tractos fistulosos pero la suspensión de la medicación implica la recaída de la enfermedad perianal. El uso de metronidazol oral y/o ciprofloxacina puede ser eficaz en fístulas que no están asociadas con un absceso (recalcamos que un absceso que ha sido diagnosticado debe ser drenado a la brevedad).
La elección de la opción quirúrgica más adecuada dependerá de la complejidad de la fístula y de la existencia o no de enfermedad rectal activa.
Para evaluar la respuesta al tratamiento existen diversos índices. Uno de ellos es la clasificación que propone cuantificar la curación de la fístula mediante la valoración del drenaje de la fístula (FDA) – fístula drainage assessment: la presencia de salida de pus luego de la compresión indica actividad, la ausencia de drenaje es considerada como remisión. La respuesta clínica es definida como una disminución del 50% o más en el número de trayectos que drenan. Si luego de la compresión se comprueba que no hay salida de pus, la fístula se considera cerrada. Este último punto es controvertido debido a que entras cosas las imágenes de resonancia magnética han demostrado la presencia de tractos fistulosos aun en ausencia de secreción.28,47
Otro es el Índice de Actividad de Enfermedad de Crohn Perianal PDAI – Perianal Disease Activity Index y los basados en los hallazgos de la resonancia magnética.
Tratamiento quirúrgico
El tratamiento quirúrgico es un gran desafío por: la alteración en la calidad de vida en los pacientes que presentan esta localización, su tendencia a la recidiva, el riesgo de incontinencia relacionado a las lesiones generadas por la misma enfermedad cuando involucra y destruye los esfínteres o como secuela del tratamiento instaurado y el riesgo de ostomía temporaria o definitiva.
En aquellos pacientes con recto sano tenemos diversas alternativas que van desde los colgajos a la inyección de células madre, mientras que el gran desafío es el tratamiento de las fístulas en pacientes con recto enfermo. Aquí en los últimos años el tratamiento combinado de agentes biológicos y utilización de sedal de drenaje (por un periodo de más de 6 semanas), es el método de elección en pacientes con recto afectado o en aquellos casos en que se sospeche mal pronóstico. Estudios recientes reportan cierre de las fístulas durante la terapia de inducción con infliximab en el 24 al 78% de los pacientes, con respuestas en los cursos subsecuentes entre el 25 y el 100%.48
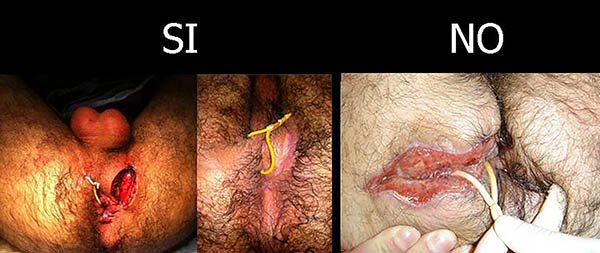
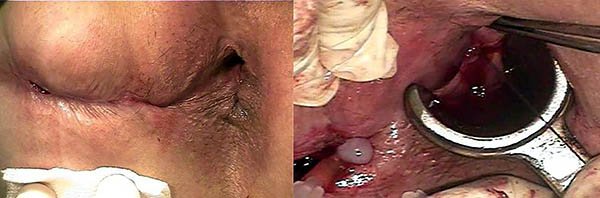
En estos casos el sedal se debe colocar en el trayecto a través de los orificios interno y externo, pero sin realizar la sección de la piel y del tejido celular subcutáneo hasta el esfínter (foto 37).
Como sucede en las fístulas bajas idiopáticas con escasa o nula afectación esfinteriana, la fistulotomía presenta éxitos que varían del 56 al 100% con mínimo riesgo de trastornos en la continencia (6% de incontinencia).5,48
Foto 37: Manera correcta e incorrecta de colocar un sedal en la EC.
Colgajos
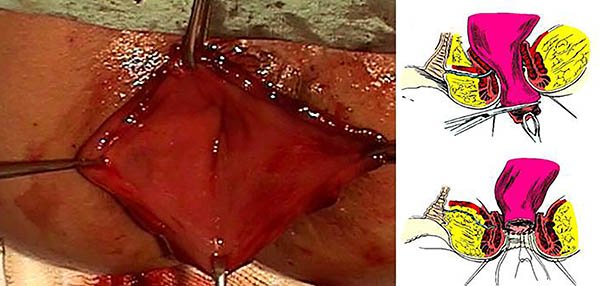
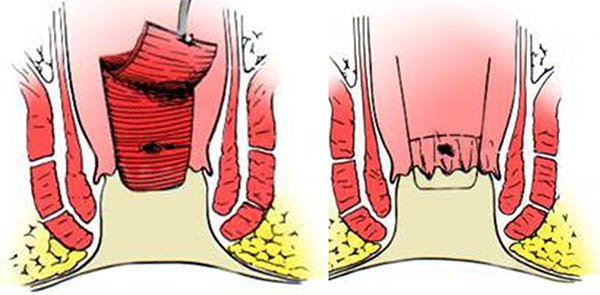
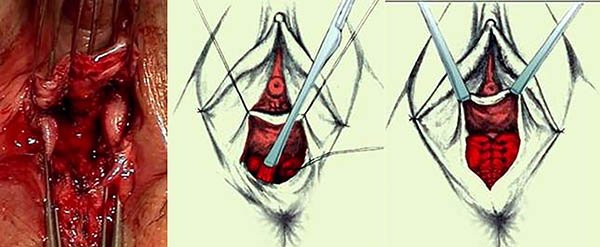
Una alternativa viable para el manejo de las fístulas complejas es la utilización de colgajos de mucosa rectal, en estos casos el recto debe estar libre de enfermedad y no debe haber infección activa.
Los colgajos pueden ser mucosos o mucomusculares de espesor completo de pared (foto 38). Se deben movilizar al menos hasta 6 cm de la línea de las criptas y la base debe ser el doble del largo del extremo cefálico. El borde en que se encuentra el orificio interno debe ser resecado y el colgajo suturado sin tensión cubriendo el orificio interno en el músculo. Los beneficios de este procedimiento consisten en evitar una herida cutánea y debido a una menor manipulación esfinteriana, un menor riesgo de incontinencia. Los resultados a corto plazo con colgajos varían del 64 al 75%.48 La tasa de éxito a largo plazo varía de 25- 64%37,49 y se han descripto recidivas hasta de un 57%.49
Soltani y cols.50 en una revisión sistemática del año 2010 sobre 35 estudios, que incluyeron 1654 pacientes a los cuales se le realizaron colgajos, encuentra que la tasa de éxitos con esta técnica en pacientes con fístulas por enfermedad de Crohn era del 64%, mientras que en aquellos pacientes sin esta enfermedad la tasa de éxito fue del 81%, y las tasas de incontinencia fueron de 9,4 y 13,2% respectivamente.
Los colgajos circunferenciales son utilizados en los casos de estenosis con resultados aceptables, aunque los trabajos presentan un bajo número de pacientes (foto 39).
Como se dijo anteriormente, para realizar un colgajo no debe existir proctitis, van Hagen y cols. han descripto la utilización de colgajos en pacientes tratados previamente con agentes biológicos con resultados promisorios.37
Foto 38: Descenso parcial.
Foto 39: Descenso circunferencial.
Tratamiento video asistido de la fístula anal - VAAFT
Este abordaje mínimamente invasivo consiste en la visualización del trayecto fistuloso principal y el orificio interno bajo visión directa mediante un fistoloscopio, se cauteriza o se curetea el trayecto, se cierran los labios del orificio interno mediante una sutura mecánica y se refuerza el cierre con la colocación de cianoacrilato.51,52 Los primeros estudios excluían de las indicaciones a la enfermedad de Crohn.53,54
Schwandner,55 en el año 2013, publica los resultados iniciales del tratamiento VAAFT en 13 pacientes con enfermedad de Crohn, encontrando una tasa de curación promisoria del 85%, aunque concuerdan con que más estudios son necesarios. Este autor en lugar de cerrar el orificio interno con una sutura mecánica, realiza el cierre del defecto en el esfínter interno con una sutura absorbible y luego lo cubre con un flap de avance.
Mizrahi y cols.56 encuentran tasas de éxito del 59,6% (con un seguimiento de 40 meses) tanto para Crohn como para fístulas idiopáticas con mayores tasas de recurrencias en las primeras (57,1% versus 33.3%), tasas similares a las publicadas por Sonoda.57
Ligadura del trayecto fistuloso interesfinterico LIFT
En el año 2007 Rojanasakul y cols. describieron la ligadura del trayecto fistuloso interesfintérico como una opción en el manejo de las fístulas complejas.58 Esta técnica consiste en identificar el tracto fistuloso en el espacio interesfintérico cuando este se ha convertido en un tubo fibrótico con tejido de granulación, dividirlo y ligarlo en ambos extremos de sección. El procedimiento se basa en el cierre del orificio interno y la remoción de parte del tejido infectado por un abordaje interesfintérico y curetaje del trayecto distal.58-60
Tanto Rojanasakul como Bleier excluyeron los pacientes con fístulas por enfermedad de Crohn, obteniendo el primero una tasa de éxito del 94%; mientras que Bleier y cols. obtuvieron solo un 54%, pero ambos refieren tasas de incontinencia postoperatoria de cero. En series que excluyen pacientes con enfermedad de Crohn58,60 o el número de estos pacientes es mínimo,59 las tasas de éxito varían del 54 al 94%.
Estudios posteriores con inclusión de pacientes con fístulas por enfermedad de Crohn, encuentran tasas moderadas de curación (56%-67%).35,51 Gingold y cols. obtuvieron una tasa de curación del 67% con un año de seguimiento.28,37
En nuestra experiencia es muy difícil encontrar el paciente adecuado para realizar esta cirugía, ya que usualmente nuestros casos se presentan con periné acartonados, con perdida de la anatomía quirúrgica, deformado por cicatrices y fístulas asociadas a ulceraciones y o fisura.
Adhesivo de fibrina (foto 40)
Se utiliza en el tratamiento de las fístulas perianales desde la década del 90, con tasas de éxito variable (10-78%).61 El adhesivo de fibrina forma al mezclar sus dos componentes (fibrinógeno y trombina) un coágulo, el cual sella el trayecto fistuloso y actuaría como andamiaje para el crecimiento de fibroblastos y el depósito de la red de colágeno. Este coágulo también mejoraría la curación de los tejidos promoviendo la angiogénesis.37,61-63
Previa a la colocación del adhesivo se debe curetear el trayecto fistuloso. Es de vital importancia que no exista infección. El mismo puede ser colocado en una sola intervención, o luego de que se trate el trayecto mediante la colocación de un sedal flojo.64
Debido a su baja tasa de complicaciones y sus tasas variables de éxito, algunos autores como Grimaud (tasa de remisión del 36% versus 16% con placebo),63 sugieren su utilización mientras otros como Damin y colaboradores concluyen que su uso de rutina en las fístulas complejas no se encuentra indicado.37
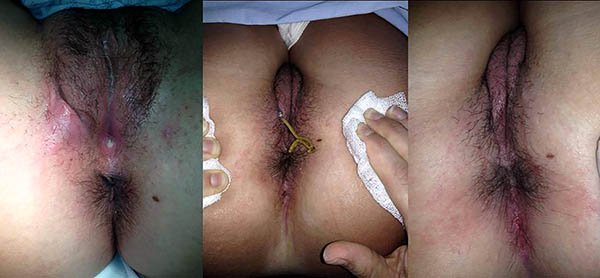
Foto 40: Colocación de adhesivo de fibrina.
Tapón de matriz acelular anal (plug) (foto 41)
El tapón de matriz acelular es un compuesto liofilizado derivado de la submucosa del intestino delgado porcino que actúa como una matriz que permite el crecimiento de fibroblastos del huésped promoviendo la curación y reparando el daño.
Al igual que lo que sucede con el adhesivo de fibrina, el principal atractivo para su utilización es que es un procedimiento mínimamente invasivo que no afecta al aparato esfinteriano por lo cual no altera la continencia.
Su colocación puede realizarse en una o dos etapas. El procedimiento quirúrgico comienza con la identificación del trayecto fistuloso y el curetaje del mismo colocando luego el dispositivo (en una etapa). En el caso de realizarlo en dos etapas luego de localizar el trayecto fistuloso se coloca un sedal flojo, posteriormente cuando se observa la ausencia de infección se procede a la colocación del plug. El Gazzaz y cols. lo colocan luego de 6 u 8 semanas.65
Previo a posicionar el tapón en el trayecto se procede a hidratarlo en solución salina por 3-5 minutos, luego se lo coloca desde el orificio interno hacia el externo, quedando el extremo más grueso en lado interno, el cual se procede a anclar y tapar con puntos reabsorvibles. El exceso que sale por el orificio externo es recortado.
Si bien las tasas de curaciones reportadas en la literatura varían del 9,1 al 88% con seguimientos de 6 a 15 meses.35,61,66 La mayoría de los autores refieren bajas tasas de éxito. El Gazzaz65 obtiene pobres resultados de curación en pacientes con fístulas por enfermedad de Crohn (9,1%) asociado a un aumento de las complicaciones sépticas. O’ Connor y colaboradores encuentra en pacientes con enfermedad de Crohn una tasa de curación de solo el 15,4%.67 Ellis y colaboradores, en un análisis univariado, encuentran a la enfermedad de Crohn como uno de los factores predictivos de fallo del tratamiento con plug anal de las fístulas complejas.66
O’Riordan y colaboradores68 realizaron, en el año 2012, una revisión sistemática de 20 estudios que incluían el uso de plug anal en fístulas con y sin enfermedad de Crohn, encontrando tasas de curación de alrededor del 54% en ambos grupos.
Debido a que se describieron problemas de fijación con el plug anal, se realizó una modificación, tratando de mejorar la misma mediante el agradado en el extremo interno de un disco circular. Este disco es suturado al orificio interno y luego cubierto o no por un colgajo de mucosa y submucosa. Existen en la actualidad pocos trabajos que incluyan pacientes con enfermedad de Crohn, aunque los resultados son similares a los obtenidos con el plug anal.62
Foto 41: Colocación de plug anal.
Tratamientos basados en células madre
Existen pocas publicaciones sobre el uso de stem cells para el tratamientos de la enfermedad fistulizante perianal. Su uso se fundamenta en que estas células pueden regular la cascada inflamatoria, estas son activadas por el IFN en tejidos inflamados (fístula), y tienen la capacidad de suprimir la proliferación de la actividad linfocitaria y la producción de signos inflamatorios a través de la expresión de indoleamina 2,3 dioxigenasa. Estos efectos llevan a una eliminación de la actividad linfocitaria y de citoquinas pro inflamatoria, resultando en una cesación del dolor y en reparación de los tejidos.62,69-71
García Olmos lideró varios estudios, entre ellos uno de fase I y otro de fase II. En el primero realizó nueve implantes (tres fístulas rectovaginales, cinco fístulas enterocutáneas y una fístula perianal) en cinco pacientes con enfermedad de Crohn. Las dosis utilizadas variaron entre 6 y 30 millones por fístula. Después de ocho semanas, se observaron signos clínicos de respuesta completa en 6 de las fístulas en seguimiento (75%) con cierre completo del orificio externo y ausencia de supuración espontánea y a la presión.72
El ensayo en fase II, se trató de un estudio multicéntrico, abierto, aleatorizado y controlado, para evaluar la seguridad y eficacia de esta terapia en pacientes con fístula perianal compleja, asociado o no a enfermedad de Crohn. Este ensayo randomizo 49 pacientes (14 con enfermedad de Crohn), a un grupo se les realizó la inyección de adhesivo de fibrina solo y al otro grupo adhesivo de fibrina asociado a stem cells derivados de adipositos(ASCs), logrando la curación en el 18% de los pacientes del primer grupo y en el 71% del segundo grupo (adhesivo de fibrina asociado a ASCs) con una baja tasa de recurrencia (12%). El tratamiento consiste en el curetaje del trayecto fístuloso, cierre del orificio interno y la inyección de la solución de ASCs en la totalidad del trayecto fístuloso, con una dosis inicial de ASCs de 20 millones, y de no obtenerse curación a las 8 semanas se administraba una dosis adicional de 40 millones. Luego el tracto es sellado mediante la inyección de adhesivo de fibrina.73,74
Recientemente Panes y cols.75 publicaron un estudio de fase III, el cual randomizo 212 pacientes con enfermedad de Crohn fistulizante perianal refractarios al tratamiento en dos grupos, a uno se le inyectó placebo intralesional y al otro grupo 120 millones de Cx601 (células madres mesenquimáticas derivadas del tejido adiposo). El 53% de los pacientes con intención de tratamiento medicados con Cx601 obtuvó remisión clínica a las 24 semanas versus el 41% del grupo placebo. Estos autores no encontraron diferencias significativas, atribuyendo este hecho al tratamiento realizado sobre la fístula previamente a inyectar el placebo (curetaje de la fístula, drenaje y cierre del orificio interno), además de que el tratamiento concomitante con anti TNF o inmunomoduladores beneficio la respuesta de ambos grupos. Pero concluyen que el uso de Cx601 es seguro y efectivo en el tratamiento de las fístulas complejas por enfermedad de Crohn en aquellos pacientes que no respondieron al tratamiento médico.
Tratamiento con plasma rico en plaquetas
El plasma rico en plaquetas (PRP) consiste en una porción del plasma propio del paciente con una concentración plaquetaria y factores de crecimiento superiores a los basales obtenidos mediante centrifugación. Las plaquetas contienen en sus gránulos á proteínas (PDGF, FCT-â, IL-1, FADP, VEGF, ECGF, ostocalcina, osteonectina, fibrinógeno, fibronectina y trombos- pondina), que poseen múltiples acciones sobre la reparación tisular. Las plaquetas comienzan a secretar estas sustancias 10 minutos después de la formación del coágulo, y tras está liberación masiva las plaquetas sintetizan proteínas durante 5 días más, hasta que llegan al foco de crecimiento vascular los macrófagos, que asumen la regulación de la reparación tisular.76,77
Al igual que con los otros métodos, se debe en primer lugar localizar el trayecto fistuloso y el orificio interno. Se lava y curetea el trayecto, se reseca el orificio interno y se aplica el PRP, cerrando posteriormente el OI76,78 con puntos o con la confección de un colgajo.77
Moreno Serrano y cols. obtienen tasas de éxito para el tratamiento de fístulas complejas, excluyendo enfermedad de Crohn, superior a un 60%.
Gottgens y cols.79 publican el primer reporte de PRP asociado a colgajo de avance mucoso en pacientes con fístulas por enfermedad de Crohn con resultados promisorios, aunque con un número de pacientes pequeños y un seguimiento a mediano plazo (10 pacientes, con un seguimiento promedio de 23,3 meses). La tasa de curación fue del 70% al año con una recaida del 10%. Otros autores también, con un número pequeño de pacientes y en un intento por mejorar los resultados en enfermedad de Crohn, combinan el PRP con células madre y colgajos (solo 5 pacientes con un seguimiento de 1 año, todos curados).80
Tabla 18: Principios generales del tratamiento de la enfermedad de Crohn perianal
- tratamiento personalizado (Mayberry)
- abordaje interdisciplinario (Mayberry)
- establecer si hay afectación intestinal y/o rectal, y tratarla si la hubiere
- tipicar el tipo de lesión perianal
- evitar grandes heridas perineales
- abordaje conservador en coexistencia de enfermedad rectal
- evitar complicaciones
- preservación de la función esfinteriana
Tabla 19: resumen del tratamiento de las lesiones perianales
|
Tipo de lesión |
Con proctitis (tratamiento de la proctitis) |
Sin proctitis |
|
Plicomas Fisura anal Abscesos Estenosis FístulaFístulas simples asintomáticas FístulaFístulas simples sintomáticas FístulaFístulas rectovaginal |
no resecar tratamiento médico drenaje dilatación digital / bujías / balón tratamiento de la proctitis c/s sedal tratamiento de la proctitis c/s sedal sedal c/s ostomia |
resecar solo si dificultan la higiene esfinterotomia casos seleccionados drenaje dilatación digital / bujías / balón fistulotomia colgajos colgajos |
Tabla 20: Resumen de las tasas de éxito con los distintos tratamientos
|
|
fístulas complejas |
fístulas por crohn |
|
LIFT |
54 - 94% |
56 - 67% |
|
Colgajos |
81% |
25 - 80% |
|
adhesivos de fibrina |
|
14 - 63% |
|
plug |
34,6- 87% |
9.6 - 88% |
|
Tratamiento con células |
50% |
53 – 71% |
|
Tratamiento con biológicos |
|
36.3 – 66.6% |
Colocación local de agentes biologicos - Infliximab / adalimumab
Poggioli y colaboradores81 describen la inyección local de Infliximab en la fístula, para evitar los efectos adversos sistémicos de este agente biológico en aquellos pacientes en los cuales esta contraindicado el tratamiento sistémico, hallando un cierre completo de la fístula en el 67% de los casos luego de 3 a 12 infusiones (10 de 15 pacientes tratados), con un seguimiento de 3 a 30 meses (18,2).82 El procedimiento comienza con un exhaustivo examen bajo anestesia, localización del trayecto y del orificio interno, el curetaje del trayecto y la exclusión de cualquier tipo de colección purulenta. Se procede luego a una inyección de 15 a 21 mg de infliximab (diluida en 10 a 14 ml de solución de glucosa al 5%), circunferencialmente al orificio interno y luego en la pared del tracto de la fístula hasta el orificio externo.
Lichtiger83 publica su experiencia con nueve pacientes con enfermedad perianal leve a moderada refractaria, tratados con una inyección circunferencial e intrafístula de infliximab a cero, cuatro y siete semanas. Observando curación completa en el 50% de los pacientes dentro de tres semanas, 33% presentaron respuesta parcial y 17% no tuvieron respuesta.
Posteriormente Poggioli y cols.81 aplicaron localmente adalimumab con igual técnica, obteniendo resultados preliminares prometedores, al igual que Tonelli y cols.84 por lo cual el adalimumab podría ser un tratamiento alternativo para aquellos pacientes que no responden al infliximab, ya sea sistémico o administrado localmente.82
Oxigeno hiperbático (OH)
Consiste en exponer al paciente en una cámara con oxígeno al 100% con mayor presión (2ATM), aumentando la oxigenación de los tejidos y promueve incrementos en las presiones parciales plasmáticas de O2, optimizando la proliferación de fibroblastos y de células killers de la sangre.85-87 Es sabido que el O2 promueve la curación en heridas crónicas y su utilización el tratamiento del pioderma gangrenoso es exitoso.
Algunos autores86,88-91 sugieren su uso como una opción adyuvante en pacientes con enfermedad refractaria con resultados favorables.
No existen estudios controlados que avalen su utilización solo o asociado a tratamiento médico o quirúrgico en enfermedad de Crohn perianal, aunque publicaciones con un número reducido de pacientes, como las citadas previamente, muestran su eficacia en la remisión de la enfermedad fistulosa perianal en pacientes.37,87,92,93
Procedimientos con Láser
Ablación con CO2: existen pocos reportes sobre la utilización del láser en fístulas perianales por enfermedad de Crohn. El método se basa en la puesta a plano de los trayectos superficiales y la ablación del trayecto principal que involucra esfínter con CO2 láser, con la posterior colocación de un sedal flojo.94-96 Su uso es controvertido y no parece aportar beneficios.
FiLaC: Giamundo y colaboradores62,97 describen el cierre primario del trayecto fistuloso mediante el uso de energía láser, emitida por una fibra radial conectada a un láser diodo (FiLaC TM), con tasas de éxito del 71% aunque con un número pequeño de pacientes incluidos. Wilhelm y cols.98 obtienen una tasa de éxito en el tratamiento de las fístulas criptogénicas del 81,8% (en 11 pacientes con una media de seguimiento de 7,4 meses) asociando al tratamiento con láser la confección de un colgajo.
Clipado del orificio interno de la fístula
Este método consiste en la colocación de un clip de nitinol a nivel del orificio interno (OI) fistuloso, este clip produce una compresión constante a nivel del OI manteniéndolo cerrado. Fueron publicados escasos trabajos con un número bajo de pacientes, entre los que se incluían individuos con fístulas por enfermedad de Crohn con tasas de curación del 1299 al 70%.100
Recientemente, en el año 2016, Prosst y Joos101 presentan un trabajo que incluyo 96 pacientes a los cuales se les efectuaron 100 procedimientos, de ellos 11 presentaban fístulas perianales por enfermedad inflamatoria intestinal (8 Crohn y 3 colitis ulcerosa), obteniendo en este grupo una tasa de éxito del 45%.
En nuestra experiencia sobre 227 evaluados en la Unidad de Coloproctología, entre el año 2014 y 2016, 176 presentaron afectación perianal, en la mayor parte de los casos asosciada a afección colorrectal. En muy pocos casos el recto se encontraba sano, razón por la cual en el 35% realizamos tratamiento combinado (retirando al 20% el sedal con resultados a corto plazo prometedores) y en el 42% drenajes de abscesos. Solo se realizaron 4 flaps de avance mucoso con buenos resultados, 6 colocaciones de plug con resultados dispares (tiempo de seguimiento aún escaso), 2 LIFT los cuales fallaron.
BIBLIOGRAFÍA
- Safar B, Dana Sands D: Perianal Crohn’s Disease. Clin Colon Rectal Surg 2007;20:282–293.
- D’Ugo S, Franceschilli L, Cadeddu F, et al: Medical and surgical treatment of haemorrhoids and anal fissure in Crohn’s disease: a critical appraisal. BMC Gastroenterology 2013, 13:47.
- Alli Akintale L, Pruthvi P, Hadi N, et al: Race and fistulizing perianal Crohn’s disease. Clin Gastroenterol 2015;49(3):e21-e22.
- Ruffolo C, Citton M, Scarpa M, et al: Perianal Crohn’s disease: Is there something new?. World J Gastroenterol 2011;17(15):1939-1946.
- Pellino G, Selvaggi F: Surgical treatment of perianal fistulizing Crohn’s Disease.
- Van Assche 2 G, Dignass A Reinish W, et al: The second European evidence based consensus on the diagnosis and management of Crohn’s disease: special situations. J Crohns Colitis, 2010;4:63-101.
- Lewis RT, Maron DJ: Anorectal Crohn’s Disease. Surg Clin N Am 2010;90:83-97.
- Graziano A, Terg R, Kesner L, et al: Ileocolitis granulomatosa. Nuestra experiencia. Actas 3er Congreso Nacional de Proctologia del Interior 1980:62-66.
- Lakatos PT, Czegledi Z, Szamosi T, et al: Perianal disease, small bowel disease, smoking, prior steroid or early azthioprime/biological therapy and predictors of disease behavior change in patients with Crohn’s disease. World J Gastroenterol 2009;15(28):3504-3510.
- Tarrant KM, Barclay ML, Frampton CM, et al: Perianal disease predicts changes in Crohn’s disease phenotype-results of a population-based study of inflammatory bowel disease phenotype.Am J Gastroenterol. 2008 Dec;103(12):3082-93.
- Buchmann P, Alexander-Williams J: Calssification of perianal Crohn’s disease. Clin Gastroenterol,1980;9(2):323-30.
- Gecse K, Sebastian S, de Hertogh G, et al: Results of the fifth Scientific worship of the Ecco (II): Clinicak aspects of perianal fistulising Crohn’s disease - the unmet need. Doi:10.1093/ecco-jcc/jjw039.
- Hughes LE. Clinical classification of perianal Crohn’s disease. Dis Colon Rectum 1992;35:928–932.
- Graziano A, Gualdrini UA: Enfermedad de Crohn perianal. Enfermedades quirurgicas de la region anal. Ed. Akadia.1997.
- Irving EJ, et al: Usual Therapy improves perianal Crohn’s Disease as measured by a new disease activity index. Mc Master IBD Study Group. J Clin Gastroenterol 1995;20(1):27-3.
- Sostegni B, Daperno M, Lavagna A, et al: Review: monitoring Crohn’s disease activity. Aliment Pharmacol Ther 2003;17(2):11-17.
- Pikarsky AJ, Gervaz P, Wexner SD, et al: Perianal Crohn disease: a new scoring system to evaluate and predict outcome of surgical intervention. Arch Surg 2002;137(7):774-7.
- Bonheur JL, Braunstein J, Korelitz BI, et al. Anal skin tags in inflammatory bowel disease: new observations and a clinical review. Inflamm Bowel Dis 2008;14:1236–9.
- Juncadella AC, Alame AM, Sands LR, et al: Perianal Crohn’s disease: a review. Posgrad Med 2015;127(3):266-272.
- Toh JWT, Steward P, Richard MJFX, et al: Indications and surgical options for samll bowel, large bowel and perianal Crohn’s disease. Wordl J Gastroenterol 2016;22(40):8892-8904.
- Keighley MR, Allan RN: Current status and influence of operation on perianal Crohn’s disease. Int J Colorectal Dis 1986;1:104-7.
- Sandborn WJ, Fazio VW, Feagan BG, et al. AGA technical review on perianal Crohn’s disease. Gastroenterology 2003;125(5):1508–30.
- Zoeten EF, Pasternak BA, Mattei P, et al: Diagnosis and treatment of perianal Crohn disease: NASPGHAN clinical report and consensus statement. JPGN 2013;57(3):401-411.
- Mirón Pozo, B.; González Puga, C.; Garde Lecumberri, C, et al: Puesta al día en enfermedad de Crohn perianal. Cir. Andal. 2013; 24: 29-38.
- Fields S, Rosainz L, Korelitz BI, et al. Rectal strictures in Crohn’s disease and coexisting perirectal complications. Inflamm Bowel Dis 2008;14:29–31.
- Lee SW, Niec R, Melnitcchout N, et al: Transanal anorectal stricturoplasty using the Heinecke Mickulicz principle: a novel technique. Colorectal Disease 2015;18:101-105.
- Hvas CL, Dahlerup JF, Jacobsen BA, et al: Diagnosis and treatment of fistulizing Crohn’s disease. Dan Med Bull 2011;58(10):c4338.
- Marzo M, Felice C, Pugliese D, et al: Management of perianal fístulas in Crohn’s disease: an up to date review. World J Gastroenterol 2015;21(5):1394-1403.
- Eglinton TW, Roberts R, Pearson J, et al: Clinical and genetic risk factors for perianal Crohn’s disease in a population based cohort. Am J Gastroenterol 2012;107:589-596.
- Kanaan, Ahmad, Bilchuk et al: Perianal Crohn’s disease predictive factors and genotype phenotype correlations. Dig Surg 2012;29:107-114.
- Kaur M, Panikkath D, Yan X, et al: Perianal Crohn’s Disease is associated with distal colonic disease, structuring disease behavior, IBD associated serologies and genetic variation in the JAK STAT pathway. Inflamm Bowel Dis 2016;22(4):862-869.
- Lawrence IC, Murray K, Batman B, et al: Crohn’s disease and smoking: Is it ever too late to quit? Journal Crohn’s and Colitis 2013;7:e665-e671.
- Ueno F, Matsui T, Matsumoto T, et al: Evidence based clinical practice guidelines for Crohn’s disease integrates with formal consensus of expert in Japan. J Gastroenterol 2013;48:31-72.
- Schwartz DA, Loftus EV Jr, Tremaine WJ, et al: The natural history of fistulizing Crohn’s disease in Olmsted County, Minnesota. Gastroenterology. 2002 Apr;122(4):875-80.
- Gecse KB, Bemelman W, Kamm MA, et al: A global consensus on the classification, diagnosis and multidisciplinary treatment of perianal fistulising Crohn’s disease. Gut 2014;63:1381-1392.
- Caprilli R, Gassull MA, Escher JC, et al: European evidence based consensus on diagnosis and management of Crohn’s disease: special situations. Gut 2006;55:i36-i58.
- Geltzeiler CB, Wiegghard N, Tsikitis VL: Recent developments in the surgical management of perianal fístula for Crohn’s disease. Ann Gastroenterol 2014;27:320-330.
- Van Assche G, Vanbeckevoort D, Bielen D, et al: Magnetic resoanance imaging of the effects of infliximab on perianal fistulizing Crohn’s disease. Am J gastroenterol 2003;98(2):322-9.
- Khaikin M, Chowers Y, Zmora O: Perianal cron’s Disease. IMAJ 2007;9:163-168.
- Chidi VN, Schwartz DA: Imaging of perianal fistulizing Crohn’s disease. Expert Rev Gastroenterol Hepatol. 2015 doi10.1586/17474124.2015.1031110.
- de la Portilla F, Alos R, Solana A y cols.: Utilidad de la ecografia anorrectal en la enfermedad de Crohn perianal. Cir Esp 2001;69:459-462.
- Maconi G, Tonolini M, Michela Monteleone M, et al: Transperineal Perineal Ultrasound Versus Magnetic Resonance Imaging In the Assessment of Perianal Crohn’s Disease. Inflamm Bowel Dis 2013;19:2737–2743.
- Zbar AP, Armitage NC: Complex perirectal sepsis: clinical classification and imaging. Tech Coloproctol (2006) 10:83–93.
- Lo Re G, Tudisca C Vernuccio F, et al: MR imaging of perianal fístulas in Crohn’s disease: sensitivity and specificity of STIR sequences. Radiol med 2016;121:243-251.
- Garros A, Siproudhis L, Tchoundjeu B, et al: Magnetic resonance imaging and clinical assessments for perianal Crohn’s disease: gain and limits. Dig and Liver Dis 2014;46:1072-76.
- Tutein Nolthenius CJ, Bipat S, Mearadji B, et al: MRI characteristics of proctitis in Crohn’s disease on perianal MRI. Abdm Radiol 2016;41:1918-1930.
- Losco A, Vigano C, Conte D, et al: Assessing the activity of perianal Crohn’s disease: Comparison of clinical indices and computer assisted anal ultrasound. Inflamm Bowel Dis 2009;15(5):742-749.
- Steele SR, Kumar R, Feingold DL, et al: Practice parameters for the management of perianal abscess and fístula in ano. Dis Colon Rectum2011;54(12):1465-74.
- Wiese DM, Schawrtz DA: Managing perianal Crohn’s disease. Curr Gastroenterol Rep 2012;14:153-161.
- Soltani A, Kaiser AM: Endorectal advancement flap for cryptoglandular or Crohn’s fístula in ano. Dis Colon Rectum 2010;53:486-490.
- Hermann J, Eder P, Banasiewicz T, et al: Current management of anal fístulas in Crohn’s disease. Prz Gastroenterol 2015;10(2):83-88.
- Sordo Mejia R, Gaertner WB: Multidisciplinary and evidence-based management of fistulizing perianal Crohn’s disease World J Gastrointest Pathophysiol. 2014 Aug 15; 5(3): 239–251.
- Meinero P, Mori L: Video assisted anal fístula treatment (VAAFT): a novel sphincter saving procedure for treating complex anal fístulas. Tech Coloproctol 2011;15:417-422.
- Kochhar G, Saha S, Andley M, et al: Video assisted anal fístula treatment. JSLS 2014;18(3);1-5
- Schwandner O: Video assisted anal fístula treatment (VAAFT) combined with advancement flap repair in Crohn’s disease. Tech Coloproctol 2013;17:221-225.
- Mizrahi N, Wexner SD, Zmora O et al: Endorectal advancement flap: are there predictors of failure? Dis Colon Rectum 2002;45:1616–1621.
- Sonoda T, Hull T, Piedmonte MR, Fazio VW: Outcomes of primary repair of anorectal and rectovaginal fístulas using the endorectal advancement flap. Dis Colon Rectum 2002;45:1622–1628.
- Bleier JIS, Moloo H, Goldberg SM: Ligation of the Intersphincteric Fístula Tract: An Effective New Technique for Complex Fístulas. Dis Colon Rectum 2010; 53: 43–46.
- Abcarian AM, Estrada JJ, Park J, et al: Ligation of Intersphincteric Fístula Tract: Early Results of a Pilot Study. Dis Colon Rectum 2012; 55: 778–782.
- Schanwani A, Nor MN, Amri N: Ligation of the intersphinteric fístula tract (LIFT): a sphinter saving technique for fístula in ano. Dis Colon Rectum 2010;53(1):39-42.
- Yantorno M, Ricart E: Alternativas terapéuticas en la enfermedad de Crohn fistulizante perianal: fibrin glue y tapón de matriz acelular. Enfermedad Inflamatoria Intestinal 2011:10(3):207-209.
- Limura E, Giordano P: Modern management of anal fístula. World J Gastroenterol 2015;21(1):12-20.
- Grimaud JC, Munoz Bongrand N, Siproudhis l, et al: Fibrin glue is effective healing perianal fístulas in patients with Crohn’s disease. Gastroenterology 2010;138:2275-2281.
- de Paredes V, Safa Far H, Zeitoun JD, et al: Seton drainage and fibrin glue injection for coplex anal fístulas. Colorectal Dis 2010;12:459-463.
- El Gazzaz G, Zutshi M, Hull T: A retrospective review of chronic anal fístulae treated by anal fístulae plug. Colorectal Dis 2010;12:442-447.
- Ellis CN, Rostas JW, Greiner FG: Long term outcomes with the use of bioprosthetic plugs for the management of complex anal fístula. Dis Colon Rectum 2010:53:798-802.
- O’Connor LM, Champagne BJ, Ferguson MA, et al: Efficacy of anal fístulae plug in closure of Crohn’s anorrectal fístulae. Dis Colon Rectum 2006;46:1569-73.
- O’Riordan JM, Datta I, Johnston C, et al: A systematic review of the anal fístula plug for patients with Crohn’s and non Crohn’s related fístula in ano. Dis Colon Rectum 2012;55:351-358.
- Martinez Montiel MP, Gomez Gomez GJ, Flores AI: Therapy with stem cells in inflammatory bowel disease. World J Gastroenterol 2014;20(5):1211-1227.
- Taxonera C, Garcia Olmo D: Celulas madre en las fístulas perianales asociadas a la enfermedad de Crohn. Enfermedad Inflamatoria Intestinal 2010;9(2):67-71.
- Molendijk, I: Mesenchymal stromal cell therapy for Crohn’s disease: from perianal fistulizing disease to experimental colitis.http://hdl.handle.net/1887/38545. 2016.
- Sanz-Baro R, García-Arranz M, Guadalajara H, et al: First-in-Human Case Study: Pregnancy in Women With Crohn’s Perianal Fístula Treated With Adipose-Derived Stem Cells: A Safety Study. Stem Cells Transl Med. 2015 Jun;4(6):598-602.
- Herreros M.D, Garcia-Arranz M, Guadalajara H, et al: Autologous Expanded Adipose-Derived StemCells for the Treatment of Complex Cryptoglandular Perianal Fístulas: A Phase III Randomized Clinical Trial (FATT 1: Fístula Advanced Therapy Trial 1) and Long-term Evaluation. Dis Colon Rectum 2012; 55: 762–772.
- Keshaw H, Foong KS, Forbes A, et al: Perianal fístulae in Crohn’s disease: current and future approaches to treatment. Inflamm Bowel Dis 2010;16:870-880.
- Panés J, García-Olmo D, Van Assche G, et al: Expanded allogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianal fístulas in Crohn’s disease: a phase 3 randomised, double-blind controlled trial. Lancet 2016; 388: 1281–90.
- Moreno Serrano A, García Díaz JJ, Ferrer Márquez M, et al: Empleo de plasma autólogo rico en plaquetas en el tratamiento de fístulas perianales complejas. Rev Esp Enferm Dig 2016;108(3):123-128.
- van der Hagen S. J., Baeten C. G., Soeters P. B., et al: Autologous platelet-derived growth factors (platelet-rich plasma) as an adjunct to mucosal advancement flap in high cryptoglandular perianal fístulae: a pilot study. Colorectal Disease 2011;13, 215–218.
- Perez Lara FJ, Moreno Serrano S, Ulecia Moreno J, et al: Platelet rich fibrin sealing as a treatment for complex perianal fístulas: a multicenter study. J Gastrointest Surg 2015;19:360-368
- Gottgens K. W. A, Smeets RR, StassenL. P. S, et al: Treatment of Crohn’s disease-related high perianal fístulas combining the mucosa advancement flap with platelet-rich plasma: a pilot study. Tech Coloproctol (2015) 19:455–459.
- Wainstein C, Quera R, Krongberg U, et al: Mesenchymal stem cells and plateled rich plasma in the treatment of patients with perianal Crohn’s disease. Int J Dis 2016;31:725-726.
- Poggioli G, Laureti S, Pierangeli F, et al: Local Injection of Infliximab for the Treatment of Perianal Crohn’s Disease.Dis Colon Rectum 2005; 48: 768–774.
- Poggioli G, Laureti S, Pierangeli F, et al: Local Injection of Adalimumab for Perianal Crohn’s Disease: Better Than Infliximab?. Inflamm Bowel Dis Volume 16(10).
- Lichtiger S. Healing of perianal fístulae by local injection of antibody to TNF. Gastroenterology 2001;120(Suppl): A3154.
- Tonelli F, Giudici F, Asteria CR: Effectiveness and safety of local adalimumab injection in patients with fistulizing perianal Crohn’s disease: a pilot study.Dis Colon Rectum. 2012;55(8):870-5.
- Noyer Cm, Brandt LJ: Hyperbaric Oxygen therapy for perianeal Crohn’s disease. Am Coll Gastroenterology 1999;94(2):318-32122.
- Iezzi LE, Feitosa MR, MedeirosBA, et al: Crohn’s disease and hyperbaric oxygen therapy. Acta Cirúrgica Brasileira - Vol. 26 (Suppl. 2) 2011:129–132.
- Rossignol DA: Hyperbaric oxygen treatment for inflammatory bowel disease: a systematic review and analysis. Medical Gas Research 2012, 2:6.
- Colombel JF, Mathieu D, Bouault JM, Lesage X. Hyperbaric oxygenation in severe perineal Crohn’s disease. Dis Colon Rectum. 1995;38:609-14.
- Takeshima F, Makiyama K, Doi T. Hyperbaric oxygen as adjunct therapy for crohn’s intractable enteric ulcer. Am J Gastroenterol. 1999;94:3374-5.
- Lavy A, Weisz G, Adir Y, Ramon Y, Melamed Y, Eidelman S; Hyperbaric oxygen for perianal Crohn’s disease. J Clin Gastroenterol. 1994;19:202-5.
- Agrawal G, Borody T, Turner R, et al: Combining infliximab, anti-MAP and hyperbaric oxygen therapy for resistant fistulizing Crohn’s disease. Future Sci. OA (2015) FSO77.
- Dulai PS, Gleeson MW, Taylor D, et al: Systematic review: the safety and efficacy of hyperbaric oxygen therapy for inflammatory bowel disease.Aliment Pharmacol Ther 2014; 39: 1266–1275.
- Hinojosa del Val J, Alos Company R: Afectación perianal en la enfermedad inflamatoria crónica intestinal. Seccion III. Capitulo 26.
- Moy J, Bodzin J: Carbon dioxide laser ablation of perianal fístulas in patients with Crohn’s disease: experience with 27 patients. Am J Surg 2006;191:424-427.
- Miron Pozzo B, Gonzalez Puga C, Garde Lecumberri C, et al: Puesta al dia en enfermedad de Crohn. Cir Andal 2013:24:29-38.
- Bodzin J: Laser ablation of complex perianal fístulas preserves continence and is rectum sparing. Am Surg 1998;64(7):627-633.
- Giamundo P, Geraci M, Tibaldi L, et al: Closure of fístula in ano with laser FiLaC TM an effective novel sphinter saving procedure for complex disease. Colorectal Dis 2014;16(2):110-5.
- Wilhelm A: A new technique for sphincter preserving anal fístula repair using a novel radial emitting laser probe. Tech Coloproctol 2011;15:445-449.
- Gautier M, Godeberge P, Ganansia R, et al: Easy clip to treat anal fístula tract: a word of caution. Int J Colorectal Dis 2015;30:621-624.
- Mennigen R, Laukotter M, Senninger N, et al: The OTSC proctology clip system for the closure of refractory anal fístula. Tech Coloproctol 2015;19:241-246.
- Prosst Rl, Joos Ak: Short term outcomes of a novel endoscopic clipping device for closure of the interna, opening in 100 anorectal fístula. Tech Coloproctol 2016;20:753-75
6.2 Fístulas rectovaginales (FRV)
La enfermedad de Crohn es la segunda causa de fístulas rectovaginales, siendo la primera causa el trauma obstétrico. Se clasifican por su relación con el complejo esfinteriano en altas (supra o extraesfinteriana) y bajas (inter- o transesfinteriana). Las fístulas bajas transversales al esfínter anal se denominan más apropiadamente fístula anovaginal.
Estas últimas junto a las ano perineales, son la manifestación mas común del Crohn perineal.1 Ocurren en el 3.3 – 25% de las mujeres con esta patología y se originan, generalmente, a nivel de la línea de las criptas, siendo mayormente bajas o ano vulvares1-4 (fotos 42 y 43).
Varios autores consideran a la enfermedad de Crohn como un factor de mala respuesta tanto al tratamiento médico como quirúrgico, con mayor riesgo de requerir una proctectomía.5
Los síntomas incluyen dispaurenia, dolor perineal, irritación vaginal, dificultad para la higiene, que pueden llevar a infecciones genitourinarias recurrentes. Estos se pueden ver exacerbados si existe una enfermedad intestinal activa (diarrea).5,6
En cuanto al tratamiento en aquellas fístulas asintomáticas, la observación o el tratamiento médico es una opción viable (grado de recomendación fuerte, basado en evidencia de baja calidad).8 Para las fístulas sintomáticas si bien existen trabajos que sugieren el uso de antibióticos y corticoides para su curación, estos presentan altas tasas de recidivas en el seguimiento a largo plazo con una baja tasa de control de los síntomas.
En los últimos años han sido publicados varios trabajos que informan tasas de cierre de fístulas rectovaginales en pacientes con enfermedad de Crohn con el uso de Infliximab a corto plazo que llegan al 78%;8 aunque con el seguimiento a largo plazo estas cifran caen al 14 al 47%.6 Miheller y cols.,9 observaron tasas de respuesta más altas en pacientes que recibieron tratamiento concomitante con inmunosupresores. En el estudio ACCENT II,10,11 los autores evaluaron el efecto del infliximab en pacientes con FVR secundaria a EC. Veinticinco pacientes recibieron infusiones de infliximab en las semanas 0,2 y 6. Los respondedores iniciales (aquellos que mostraron una reducción del 50% en su fístula en las primeras diez semanas) fueron luego asignados al azar para continuar recibiendo infliximab o placebo. A las 54 semanas de seguimiento, el 44% de los respondedores iniciales curaron sus fístulas.
Foto 42: Periné por enfermedad de Crohn, donde se observan fístulas rectovaginales o anovulvares.
Foto 43: Periné por enfermedad de Crohn donde se observan fístulas rectovaginales.
El Departamento de cirugía colorrectal de la Cleveland Clinic recomienda terapia con agentes biológicos (infliximab) como tratamiento inicial, cuando los tejidos circundantes están inflamados o ulcerados de tal manera que cualquier intento de cierre quirúrgico fallará.5
El tratamiento quirúrgico dependerá de la altura de la fístula (localización anatómica), del número y complejidad de los trayectos, del grado de afectación rectal (extensión de la actividad inflamatoria intestinal local), de la enfermedad activa en el resto del tracto digestivo y de la experiencia del cirujano; existiendo varias opciones quirúrgicas. Un dato importante a tener en cuenta en estas mujeres es la integridad del esfínter anal. Los métodos de reparación local incluyen las técnicas transperineal, transvaginal y transanal (con o sin movilización transabdominal). Las tasas de recidivas varían del 25 al 50%.5,6
Al igual que en las fístulas perianales el tratamiento multidisciplinario en etapas es de elección. Un aspecto importante de la reparación de la FVR es el drenaje inicial de la sepsis perianal antes de considerar el cierre quirúrgico. A menudo, se requiere el uso de drenaje flojos para un control adecuado de la sepsis. La adición de antibióticos también puede beneficiar a pacientes.
En ausencia de infección y bajo control estricto del proctólogo se comienza con tratamiento médico. En presencia de infección, el drenaje y la colocación de un sedal flojo es la regla. Ruffolo y colaboradores12 en una serie de 52 pacientes con FRV por enfermedad de Crohn obtuvieron buenos resultados. Posteriormente Topstad y cols.13 y Roumeguere y cols.14 observaron respuesta global de 70.6% a corto plazo con tratamiento combinado, concluyendo que la respuesta a corto plazo es mejor que la terapia médica sola.
6.2.1 Tipo de cirugías
Fistulotomía
Las fístulas bajas y superficiales (anovaginales) pueden ser puestas a plano en casos muy seleccionados con una tasa de curación exitosa.5
Colgajos ano cutáneos
Es rara su utilización, pudiendo estar indicada en pacientes en los se la FRV se asocia a una estenosis anal. La técnica consiste en movilizar una isla de piel y tejido subcutáneo desde el margen y avanzar este colgajo hacia el conducto para cubrir la FVR. Este procedimiento sólo es posible si la piel anal es blanda y flexible, lo que no es común en los pacientes con CD perianal. Hesterberg et al. informó una tasa de curación del 70% en la mediana de seguimiento de 18 meses con esta técnica.5
Abordajes transrectales
Algunos autores, entre los cuales nos incluimos, creen que la reparación de la FVR desde el lado de alta presión - recto, es más beneficiosa.
Flaps (colgajo de avance) (dibujo 8)
Una de las técnicas más utilizada es el colgajo de avance mucoso, condicionado a la ausencia de enfermedad rectal y en fístulas bajas con porcentajes de éxito entre un 40-92%.5,7,15-17 La recidiva puede coincidir con una reactivación de la enfermedad local o distante llevando a la proctectomía en un 20–50% de los casos. Esta técnica está contraindicada en mujeres con ulceración extensa o rigidez del conducto anal, así como en mujeres con un defecto anterior del esfínter. La técnica consiste en una incisión distal a la abertura de la fístula en el conducto anal, se disecciona mucosa, submucosa y muscular hacia cefálico, avanzando 4-5 cm con suficiente movilización para que no exista tensión en la sutura, se cierra el orificio en el músculo con sutura reabsorbible. Luego se corta el extremo distal del colgajo que contiene el orificio fistuloso y se sutura al borde de sección previo.
Varios autores han descriptos éxitos con esta técnica, entre ellos Kodner y cols. lograron 71% de curación después de la reparación inicial con flaps en 24 pacientes con FRV por enfermedad de Crohn.5
Dibujo 8: Descenso mucoso rectal adaptado.
Flap de avance rectal circunferencial en manguito
En pacientes con recto sano un avance tubular de mucosa, removiendo toda la zona afectada, puede realizarse con tasas de éxito del 60%. El colgajo rectal de avance retira todo el tejido enfermo del conducto anal y permite descender un manguito de tejido rectal sano que se sutura a la línea neodentada. A partir de la línea dentada se realiza una resección de la mucosa y submucosa del conducto en forma de circunferencia. La disección progresa cefálicamente hasta que se alcanza suficiente movilidad, para que el recto pueda avanzar dentro del manguito del esfínter interno hasta la línea neodentada sin tensión, previo cierre del orificio fistuloso. El borde distal del colgajo tejido se reseca. Algunos autores sugieren el uso de una ostomía de protección.18
Abordajes trans perineal
Episio proctotomía
Implica la realización de una fistulotomía y la creación de un defecto similar a un desgarro de cuarto grado. Se debrida el tejido de granulación y se identifican los esfínteres. Se realiza una superposición esfinteriana y se cierran la mucosa rectal y vaginal. El-Gazzaz y cols. informaron que 8 mujeres a las que se les realizó una episioproctotomía obtuvieron una tasa de curación del 71,4%.5
Reparación transperineal transversal (foto 44)
Se realiza una incisión transversalmente a través del cuerpo perineal para reparar la FVR, disecando en forma cefálica hasta el trayecto fistuloso, el cual se secciona. Se movilizan la pared rectal anterior y la posterior de la vagina resecando los orificios y se suturan, se completa con una plástica del músculo elevador. Athanasiadis y cols.19 reportan una tasa de éxito de 70%.
Foto 44: Foto y dibujo de abordaje transperineal.
Abordaje transvaginal
Colgajo de avance vaginal (foto 45)
Esta técnica consiste en tallar un colgajo de pared vaginal, los orificios rectales y vaginales de la fístula son identificados y cerrados con suturas absorbibles, y el músculo elevador del ano se aproxima en la línea media. Se reseca el extremo distal del colgajo en el cual esta el orificio y se sutura luego a la piel perineal.
Sher y cols. 20 revisaron su experiencia con 14 colgajos de avance vaginal asociado a ostomía para RVF en el contexto de EC, encontrando cierre de la misma en 13/14 pacientes.
Bauer y colaboradores informan tasas de curación del 92,3% con la confección de una ostomía asociada a un abordaje transvaginal.
Foto 45: Colgajo de vagina.
Abordaje transabdominal
Anastomosis coloanal o descenso transanal (pull through) (foto 46)
Puede ser una opción en aquellos casos, en que para evitar una proctectomía, se plantea realizar un descenso circunferencial pero es imposible realizarlo sin tensión.
Esto se puede hacer con dos técnicas, realizando si es factible una anastomosis coloanal o un descenso transanal a lo Turnbull-Cutait. Después de la movilización rectal completa, el colon se pasa a través del ano. Si las condiciones locales en el ano son satisfactorias, se realiza inmediatamente una anastomosis coloanal con sutura manual, en caso contrario se debe considerar una anastomosis coloanal diferida. El colon descendido a través del ano se fija con puntos de sutura y se deja controlando su vitalidad por el término de 7 - 10 días momento en que se reseca la gárgola, fijándola nuevamente con puntos separados de sutura. Está maduración tardía permite que la porción del intestino en el canal anal se adhiera a la superficie desnudada y selle antes de la resección. El-Gazzaz y cols. 21 informaron una tasa de curación del 57,1% con esta técnica.
Foto 46: Secuencia de las etapas del descenso en distintos pacientes. Disección pélvicacon denudación de la mucosa rectal, extracción transanal, isquemia de la colostomía perineal, fijación en quirófano del colon descendido.
Otras reparaciones
Interposición de tejidos
Se han descrito técnicas de interposición de tejidos (recto anterior del abdomen, glúteo, músculo gracilis o colgajo de grasa pediculado bulbocavernosa) o de materiales biológicos (mallas reabsorvibles) con resultados diversos. El objetivo de la interposición es colocar un tejido sano y bien vascularizado (en el caso del tejido muscular) o un material sintético entre las paredes rectal y vaginal actuando como refuerzo.6,22 En el estudio de Lefevre, se obtuvo un 80% de cierre después de un seguimiento mediano de 28 meses, aunque a pesar de la curación, la calidad de vida postoperatoria y la actividad sexual permanecieron alteradas.6
Adhesivo de fibrina
El tratamiento con Adhesivos de fibrina puede también ser aplicado en fístulas rectovaginales, Venkatesh reporta un 75% de éxito en 8 pacientes, mientras que de Paredes y colaboradores refiere una tasa de éxito pobre, sobre todo en fístulas con trayectos cortos. Dato asimilable a otras series que informan tasas de éxito menores al 25%.23,24
Materiales bioprotésicos (foto 47)
El plug es una opción técnicamente factible para cerrar la FVR, pero los datos sobre su uso en enfermedad de Crohn son limitados. Varios estudios han mostrado resultados alentadores pero con un número pequeño de pacientes incluidos y un seguimiento a corto plazo (Schwandner 78% de cierre - 9 paciente; O’Connor 2 pacientes).17,25 Una revisión de la Cleveland Clinic sobre 49 procedimientos de colocación de material bioprotésico en 33 pacientes (13 EC con 2 RVF) informo una tasa de fracaso del 84,6% para las fístulas asociadas a EC (incluyendo RVF).
Foto 47: Colocación de plug anal.
Ostomías derivativas
El uso de ostomías desfuncionalizantes es controvertido, es bien conocido por todos que las ostomías mejoraran las condiciones locales pero raramente inducen al cierre espontáneo de las fístulas, asociado esto a que la reconstitución del transito recrudece la enfermedad. Algunos autores sugieren su utilización para mejorar los resultados tanto del tratamiento médico como de los colgajos,26 mientras que otros como en la Cleveland Clinic se recomienda la construcción de un ostoma proximal cuando se trata de: reoperaciones, reparaciones técnicamente difíciles y condiciones subóptimas del tejido.
Proctectomía
Las pacientes con una afección colónica extensa o una afectación anorrectal severa pueden no ser candidatos para una reparación definitiva y la proctectomía se recomienda como su paso inicial en el tratamiento. Debemos tener en cuenta que luego de la proctectomía puede observarse un retraso en la cicatrización de la herida perineal y el potencial desarrollo senos perineales crónicos en el 50% de los pacientes.
Han sido descriptas otras técnicas quirúrgicas tales como el uso de stem cells 5,6 y el abordaje combinado con laparoscopia27 (aunque con un número muy pequeño de pacientes y un seguimiento a corto plazo, de las cuales habrá que esperar nuevos reportes para evaluar su utilidad.
BIBLIOGRAFÍA
- Nielsen OH, Rogler G, Hahnloser D, et al: Diagnosis and management of fistulizing Crohn’s disease. Gastroenterol and Hepatol 2009;6(2):92-106.
- Strong S: Perianal Crohn’s disease. Seminars in Pediactric Surg 2007;16:185-193.
- Lo Re G, Tudisca C Vernuccio F, et al: MR imaging of perianal fístulas in Crohn’s disease: sensitivity and specificity of STIR sequences. Radiol med 2016;121:243-251.
- Kaimakliotis P, Simillis C, Harbord M, et al: A Systematic Review Assessing Medical Treatment for Rectovaginal and Enterovesical Fístulae in Crohn’s Disease. Clin Gastroenterol 2016;50:714–721.
- Valente MA, Hull TL: Contemporary surgical management of rectovaginal fístula in Crohn’s disease. World J Gastrointest Pathophysiol 2014 November 15; 5(4): 487-495.
- Zhu YF, Tao GQ, Zhou N, et al: Current treatment of rectovaginal fístula in Crohn’s disease. World J Gastroenterol 2011 February 28; 17(8): 963-967.
- Steele SR, Kumar R, Feingold DL, et al: Practice parameters for the management of perianal abscess and fístula in ano. Dis Colon Rectum2011;54(12):1465-74.
- Parsi MA, Lashner BA, Achkar JP, et al; Type of fístula determines response to infliximab in patients with fistulous Crohn’s disease. Am J Gastroenterol. 2004 Mar;99(3):445-9.
- Miheller P, Lakatos PL, Horvath G, et al. Efficacy and safety of infliximab induction therapy in Crohn’s Disease in Central Europea Hungarian nationwide observational study. BMC Gastroenterol. 2009;9:66.
- Sands BE, Blank MA, Patel K, van Deventer SJ. Long-term treatment of rectovaginal fístulas in Crohn’s disease: re- sponse to infliximab in the ACCENT II Study. Clin Gastroen- terol Hepatol 2004; 2: 912-920
- El Gazzaz G, Zutshi M, Hull T: A retrospective review of chronic anal fístulae treated by anal fístulae plug. Colorectal Dis 2010;12:442-447.
- Ruffolo C, Penninckx F, Van Assche G, et al: Outcome of surgery for rectovaginal fístula due to Crohn’s disease. Br J Surg 2009;96:1190-1195.
- Topstad DR, Panaccione R, Heine JA, et al. Combined seton placement, infliximab infusion, and maintenance immunosup- pressives improve healing rate in fistulizing anorectal Crohn’s disease: a single center experience. Dis Colon Rectum. 2003;46: 577–583.
- Roumeguere P, Bouchard D, Pigot F, et al. Combined approach with infliximab, surgery, and methotrexate in severe fistulizing anoperineal crohn’s disease: results from a prospec- tive study. Inflamm Bowel Dis. 2011;17:69–76.
- Graziano A, Gualdrini UA: Enfermedad de Crohn perianal. Enfermedades quirurgicas de la region anal. Ed. Akadia.1997.
- Witheford et al: Practice parameters for the treatment of perianal abscess and fístula in ano. Dis Colon Rectum 2005;1337-1341.
- Schwandner O: Video assisted anal fístula treatment (VAAFT) combined with advancement flap repair in Crohn’s disease. Tech Coloproctol 2013;17:221-225.
- Marchesa P, Hull TL, Fazio VW. Advancement sleeve flaps for treatment of severe perianal Crohn’s disease. Br J Surg 1998; 85: 1695-1698 [PMID: 9876077].
- Athanasiadis S, Yazigi R, Köhler A, Helmes C. Recovery rates and functional results after repair for rectovaginal fístula in Crohn’s disease: a comparison of different techniques. Int J Colorectal Dis 2007; 22: 1051-1060.
- Sher ME, Bauer JJ, Gelernt I. Surgical repair of rectovaginal fístulas in patients with Crohn’s disease: transvaginal approach. Dis Colon Rectum 1991; 34: 641-648.
- El-Gazzaz G, Hull T, Mignanelli E, Hammel J, Gurland B, Zutshi M. Analysis of function and predictors of failure in women undergoing repair of Crohn’s related rectovaginal fístula. J Gastrointest Surg 2010; 14: 824-829.
- Nosti PA, Stahl TJ, Sokol AI:Surgical repair of rectovaginal fístulas in patients with Crohn’s disease. European Journal of Obstetrics & Gynecology and Reproductive Biology 171 (2013) 166–170.
- de Paredes V, Safa Far H, Zeitoun JD, et al: Seton drainage and fibrin glue injection for coplex anal fístulas. Colorectal Dis 2010;12:459-463.
- Buchmann P, Alexander-Williams J: Calssification of perianal Crohn’s disease. Clin Gastroenterol,1980;9(2):323-30.
- O’Connor LM, Champagne BJ, Ferguson MA, et al: Efficacy of anal fístulae plug in closure of Crohn’s anorrectal fístulae. Dis Colon Rectum 2006;46:1569-73.
- Chung Ch S, Lee DK, George BD, et al: Clinical Outcome of a Rectovaginal Fístula in Crohn’s Disease. J Korean Soc Coloproctol 2007:23(1):11-15.
- Matsuzawa F, Homma S, Yoshida T, et al: Successful treatment of rectovaginal fístula and rectal stenosis due to perianal Crohn’s disease by dual-port laparoscopic abdominoperineal resection: a report of two cases. Surgical Case Reports (2016) 2:83.
6.3 Tratamiento combinado
Los resultados del tratamiento médico de la enfermedad de Crohn han cambiado mucho en los últimos tiempos, debido a las nuevas drogas como los anti TNF alfa y los anticuerpos anti integrinas como el natalizumab y el vedolizumab, y los anticuerpos monoclonales anti intereukina -12 e interleukina -23 (ustakinumab), han logrado inducir y mantener la remisión de la enfermedad por mas tiempo incluso en la enfermedad fistulizante perianal,1,2 aunque después de la cesación del tratamiento se han descrito altas tasas de recaídas. Por su lado la cirugía sola se asocia a grados variables de eficacia (con tasas de recaídas del 25 al 50%). La mayoría de los autores sugiere el tratamiento combinado (cirugía- agentes biológicos) para el tratamiento de la enfermedad perianal3-14 (fotos 48 - 50).
Mucho se ha discutido sobre los beneficios de estas drogas, el estudio ECCO-EpiCom concluye que: las tasas de cirugía y hospitalización fueron comparables a las cohortes, basadas en la población de las décadas pasadas y que el curso de la enfermedad fue similar a pesar de un tratamiento más temprano y agresivo con inmunomoduladores, pero el seguimiento de esta cohorte podrá revelar si la diferencia en el régimen de tratamiento cambiará el curso natural de la enfermedad y los fenotipos en el tiempo o simplemente postergará la cirugía.14
Un estudio de Coscia y cols.15 encuentra que en aquellos pacientes sometidos a tratamiento combinado, este se asocio a una reducción del riesgo de un ostoma permanente en pacientes con colitis extensa de Crohn y afectación anorrectal, encontrando en la etapa pre drogas biológicas una tasa del 60,8% de ostomas definitivos versus un 19,2% con el tratamiento conjunto; aunque esté estudio tiene importantes limitaciones por el escaso número de pacientes incluídos y por ser retrospectivo. Yassin y cols.,10 en una revisión sistemática de 24 pacientes, concluyen que una combinación de tratamientos quirúrgicos con terapia médica (inmunomoduladores anti-TNF-a), puede tener efectos beneficiosos adicionales sobre la curación de fístulas perianales en pacientes con enfermedad de Crohn, en comparación con la cirugía o terapia médica en forma única (cuadro 1).
Foto 48: Secuencia de tratamiento combinado con cierre de fístula.
Foto 49: Secuencia de tratamiento combinado, retiro de sedal y colocación de plug anal.
Foto 50: Secuencia de tratamiento combinado, se cambian sedales múltiples mal colocados por único en hora 6 control posterior a 4 los 4 meses con IFX.
Varios trabajos sugieren que la utilización en forma temprana de estos agentes biológicos se asoció a mejores resultados.4,5,16,17 Magro y cols.4 encuentran, en un estudio sobre 754 pacientes con diferentes localizaciones de enfermedad de Crohn, que ni la cirugía ni la inmunosupresión temprana pueden prevenir la aparición de eventos incapacitantes en pacientes con EC; pero que los inmunosupresores como primera terapia, son eficaces en la prevención de futuras cirugías, siendo su eficiencia más alta con un inicio más temprano, mientras que los que fueron operados más tempranamente tenían una mayor tendencia a ser reoperados.
Estudios que evaluaron la eficacia del infliximab combinado con la cirugía de fístula perianal en el contexto de enfermedad de Crohn han mostrado tasas de cicatrización de entre 25% y 90% y una tasa de cierre de fístula rectovaginal de 0-60%.5 La mayoría de los estudios están limitados por pequeños números y un seguimiento relativamente corto.
El-Gazzaz y cols.5 realizaron el análisis de dos grupos de pacientes (n=218) con un seguimiento de 3,2 +/- 3 años. Un grupo fue sometido a cirugía (n=117) y otro a agentes biológicos (Infliximab o adalimumab, n=101), en el grupo de cirugía el 64,1% no obtuvo mejoría ni curación, el 26,5% se curo y el 9,4% necesito nuevas cirugías, requiriendo proctectomía un 12%, mientras que en el grupo combinado el 36,6% no obtuvó mejoría ni curación y el 34,7% obtuvo mejoría (ambos p=0.001). No encontrando diferencias significativas ni en la tasas de curación ni en la necesidad de proctectomía. Al año solo el 50% continuaban siendo respondedores.
Roumegue`re,18 en 34 pacientes, encontró con el tratamiento combinado una respuesta completa del 75% en la semana 14; a los 18 meses el 84% continuaba con respuesta perineal, del subgrupo con fístulas rectovaginales solo el 33% mantuvo la respuesta. La tasa de recaída global en este trabajo fue de 10%.
Por su parte dos de los trabajos mas citados en la literatura encuentran mejores resultados con el tratamiento combinado con infliximab. Present y cols.1 realizaron un ensayo controlado aleatorio, encontrando que el tratamiento con infliximab llevó a un 46% de cierre completo de las fístulas perianales (significativamente mejor que el placebo). En el estudio ACCENT II, Sands y cols.2 evaluaron la curación de las fístulas rectovaginales después del tratamiento de inducción con infliximab. Todos los respondedores fueron asignados al azar a infliximab de mantenimiento o placebo. La tasa de respuesta inicial fue del 64%. Entre los respondedores, el cierre de la fístula rectovaginal se mantuvo durante más tiempo en el tratamiento con infliximab que el placebo (46 vs. 33 semanas).
Un gran desafío en el tratamiento combinado es saber cuando retirar el sedal, no debiendo ser tan rápido como para que el proceso infeccioso recidive (absceso) ni tan tardío que el trayecto fistuloso se consolide. La mayoría de los autores sugieren entre 3 semanas y 3 meses, estandarizandolo entre la segunda y la tercera infusión de infliximab, considerando que este paso es seguro y efectivo cuando se realiza 1 mes después de iniciar el tratamiento.16,18,19 Bor y cols.16 al igual que Bouguen y cols.,7 y Hotokezaka y cols.9 refieren haber tenido que mantener el sedal en algunos pacientes por alrededor de 1 año o más.
Con respecto a esto Regueiro y Mardini20 retiraron los sedales dentro de los 3 meses de la tercera dosis de IFX con una recurrencia en el 44%, pero el grupo de estudio era demasiado pequeño (9 pacientes) por lo que los resultados no fueron significativos. Tanaka y cols.,21 en 25 pacientes, 14 a los que se le retiro después de tres dosis iniciales de IFX y 11 a los que se les retiro después de cinco ciclos de infusiones de mantenimiento encontraron mejoría en los síntomas perianales y la calidad de vida en general de todos los pacientes.
Otro punto importante respecto de los agentes anti TNF, es que se han reportado una falta de respuesta primaria hasta en un tercio de los pacientes, además de aquellos pacientes que luego de responder pierden la respuesta.3
BIBLIOGRAFÍA
- Present Hh, Paul Rutgeerts P, Stephan Targan S, et al: infliximab for the treatment of fístulas in patients with crohn’s disease. N Engl J Med 1999;340:1398-405.
- Sands BE, Blank MA, Patel K, et al: Long-term Treatment of Rectovaginal Fístulas in Crohn’s Disease: Response to Infliximab in the ACCENT II Study. Clinical Gastroenterology and Hepatology 2004;2:912–920.
- Brandse JF, Peters ChP, MD, Gecse KB, et al: Effects of Infliximab Retreatment After Consecutive Discontinuation of Infliximab and Adalimumab in Refractory Crohn’s Disease. Inflamm Bowel Dis 2014;20:251–258.
- Magro F, Dias CC, Coelho R, et al: Impact of Early Surgery and Immunosuppression on Crohn’s Disease Disabling Outcomes. Inflamm Bowel Dis 2017;23:289–297.
- El-Gazzaz G, Hull T, Church JM: Biological immunomodulators improve the healing rate in surgically treated perianal Crohn’s fístulas. Colorectal Disease, 2012;14, 1217–1223.
- Yang BL, Chen YG, Gu YF, et al: Long-term outcome of infliximab combined with surgery for perianal fistulizing Crohn’s disease. World J Gastroenterol 2015 February 28; 21(8): 2475-248.
- Bouguen G, Siproudhis L, Gizard E, et al: Long-term Outcome of Perianal Fistulizing Crohn’s Disease Treated With Infliximab. Clinical Gastroenterology and Hepatology 2013;11:975–981.
- Kotze PG, Albuquerque IC, Moreira AdL, et al: perianal complete remission with combined therapy (seton placement and anti-tnf agents) in crohn’s disease: a Brazilian multicenter observational study. Arq Gastroenterol 2014;51(4):283-289.
- Hotokezaka M, Ikeda T, Uchiyama S, et al: Results of seton drainage and infliximab infusion for complex anal Crohn’s disease. Hepato Gastroentrology 2011;58:1189-1192.
- Yassin NA, Askari A, WarusavitarneJ, et al: Systematic review: the combined surgical and medical treatment of fistulising perianal Crohn’s disease. Aliment Pharmacol Ther 2014; 40: 741–749.
- Haennig A, Staumont G, Lepage B, et al: The results of seton drainage combined with anti-TNFa therapy for anal fístula in Crohn’s disease. Colorectal Disease 2014;17:311–319.
- Sciaudone G, Di Stazio C, Limongelli P, et al. Treatment of complex perianal fístulas in Crohn disease: infliximab, surgery or combined approach. Can J Surg 2010; 53: 299–304.
- Hukkinen M, Pakarinen MP, Piekkala M, et al: Treatment of complex perianal fístulas with seton and infliximab in adolescents with Crohn’s disease. Journal of Crohn’s and Colitis (2014) 8, 756–762.
- Burisch J, Pedersen N, Cukovic-Cavka S, et al: Initial Disease Course and Treatment in an Inflammatory Bowel Disease Inception Cohort in Europe: The ECCO-EpiCom Cohort. Inflamm Bowel Dis 2014;20:36–46.
- Coscia M, Gentilini L, Laureti S, et al: Risk of permanent stoma in extensive Crohn’s colitis: the impact of biological drugs. Colorectal Disease 2013; 15, 1115–1122.
- BOR R, FARKAS K, BÁLINT A, et al: Efficacy of combined anti-TNF-alpha and surgical therapy in perianal and enterocutaneous fistulizing Crohn’s disease – clinical observations from a tertiary Eastern European center. Scandinavian Journal of Gastroenterology. 2015; 50: 182–187.
- Duff S, Sagar M, Rao M, et al: Infliximab and surgical treatment of complex anal Crohn’s disease. Colorectal Disease 2011;14, 972–976.
- Roumegue`re P, Bouchard D, Pigot F, et al: Combined Approach with Infliximab, Surgery, and Methotrexate in Severe Fistulizing Anoperineal Crohn’s Disease: Results from a Prospective Study. Inflamm Bowel Dis 2011; 17(1):69-76.
- Antakia R, Shorthouse AJ, Robinson K, et al: Combined modality treatment for complex fístulating perianal Crohn’s disease. Colorectal Disease 2012;15, 210–216.
- Regueiro M, Mardini H. Treatment of perianal fistulizing Crohn’s disease with infliximab alone or as an adjunct to exam under anesthesia with seton placement. Inflamm Bowel Dis 2003; 9: 98–103.
- Tanaka S, Matsuo K, Sasaki T et al. Clinical advantages of combined setoff placement and infliximab maintenance therapy for perianal fistulizing Crohn’s disease: when and how were the seton drains removed? Hepatogastroenterology 2010; 57: 3–7.
6.4 OSTOMIAS
La realización de una ostomía en enfermedad de Crohn tiene lugar, generalmente, como un intento para mejorar la calidad de vida (por ejemplo: las fístulas rectovaginales), como protección en cirugía reconstructiva, o como una ostomía permanente (por ejemplo: proctectomía). La confección de una ostomía en lo que respecta a la enfermedad de Crohn perianal, solo ha demostrado mejorar el cuadro local, al evitar el paso de materia fecal; siendo ineficaz para el tratamiento definitivo y en algunos casos también para evitar la progresión de la enfermedad.1 Hvas y cols.2 refieren que la chance de remisión de los síntomas es del 40% o menos en estos pacientes.
Son usualmente utilizadas en casos de complicaciones infecciosas severas refractarias tales como celulitis, abscesos recurrentes e infecciones con destrucción de tejidos profundos, o severa afectación rectal. Datos de múltiples estudios actuales revelan que la frecuencia de cierre de un ostoma temporario es decepcionante incluso en la era del tratamiento biológico.3,4 Gu y cols.3 encontraron que uno de los factores más importantes que influyen en la reversión del ostoma, fue la afectación rectal sincrónica (cuanto más distal, peor el pronóstico), otro factor fue la enfermedad aguda fistulizante. Mientras que la utilización de agentes anti-TNF no se asociaron con un aumento de la probabilidad de cierre del ostoma, siendo la tasa de cierre del 22% consistente con las tasas reportadas por otros autores (entre el 20 y el 47%). El uso de ostomas en la colitis por Crohn y la enfermedad perianal podía alcanzar al 95%, en era previa a la utilización de los agentes biológicos y la posibilidad de recanalizar a estos pacientes era muy baja.5 Coscia y cols.6 reportaron una menor necesidad de ostomas definitivos en colitis con el uso de agentes biológicos.
Regimbeau et al. observaron 17 pacientes que se sometieron a derivación fecal para EC anoperineal durante un período de 18 años, y encontraron que la presencia de lesiones rectales era el único factor predictivo de mal resultado.7
Otros factores relacionados con la persistencia del ostoma informados en la literatura incluyen: estenosis anal8 y fístula rectovaginal.9,10
La probabilidad de cerrar el ostoma en pacientes con EC perianal está determinado por características agresivas de la enfermedad, la afectación distal en especial la presencia de proctitis y el comportamiento fistulizante que requiere una colocación múltiple de sedales.
Varios autores han observado que la concomitancia con enfermedad de Crohn colorrectal activa, la sepsis anal persistente, el antecedente de una ostomía desfuncionalizante, la incontinencia fecal y la estenosis anorrectal, son factores predictivos para la necesidad de una ostomía permanente (31-49%).2,11-13
El riesgo de proctectomía en pacientes con enfermedad perianal severa varía del 5 al 20%,11,13-15 asociándose este procedimiento a un 25–50% de complicaciones de la herida perineal. La resección del recto de elección debe realizarse con una disección interesfintérica con tratamiento adecuado de los trayectos fistulosos, que deben ser cureteados y puestos a plano para facilitar su drenaje.
En nuestra experiencia en los ultimos 15 años 1/3 (3,3%) de los pacientes que fueron sometidos a cirugía por Crohn colorrectal (81 individuos), requirieron una coloproctectomía o la proctectomía (como segundo tiempo de una colectomía) la mayoria de ellos por concomitancia con enfermedad perianal severa (fotos 51).
En pacientes con enfermedad perianal la proctectomía con colostomía terminal suele ser inefectiva resultando en una temprana recurrencia, necesitando en la mayoría de los casos completar la colectomía; por esta razón es de elección la coloproctectomía con ileostomía definitiva.16
Foto 51: Periné por enfermedad de Crohn donde se observa afectación severa del mismo.
BIBLIOGRAFÍA
- Mennigen R, Heptner B, Senninger N, et al: Temporary Fecal Diversion in the Management of Colorectal and Perianal Crohn’s Disease. Gastroenterology Research and Practice 2015,1-5.
- Hvas CL, Dahlerup JF, Jacobsen BA, et al: Diagnosis and treatment of fistulizing Crohn’s disease. Dan Med Bull 2011;58(10):c4338.
- Gu J, Valente MA, Remzi FH, et al: Factors affecting the fate of faecal diversion in patients with perianal Crohn’s disease. Colorectal Disease, 2014;17:66–72.
- Seifarth C, Kreis ME, Gröne J: Indications and Specific Surgical Techniques in Crohn’s Disease. Viszeralmedizin 2015;31:273–279.
- Marti Gallostra M, Myrelid P, Mortensen N, et al: The role of a defunctioning stoma for scolonic and perianal Crohn’s disease in the biological era. ScanJ Gastroenterol 2016 DOI 10.1080/00365521.2016.1205127.
- Coscia M, Gentilini L, Laureti S, et al: Risk of permanent stoma in extensive Crohn’s colitis: the impact of biological drug. Colorectal Dis 2013;15:1115-1122.
- Régimbeau JM, Panis Y, Marteau P, et al: Surgical treatment of anoperineal Crohn’s disease: can abdominoperineal resection be predicted? J Am Coll Surg. 1999 Aug;189(2):171-6.
- Galandiuk S, Kimberling J, Al-Mishlab TG, Stromberg AJ. Perianal Crohn disease: predictors of need for permanent diversion. Ann Surg 2005; 241: 796–801; discussion 801–2.
- Yamamoto T, Allan RN, Keighley MR. Effect of fecal diversion alone on perianal Crohn’s disease. World J Surg 2000; 24: 1258–62; discussion 62–3.
- Mueller MH, Geis M, Glatzle J et al. Risk of fecal diversion in complicated perianal Crohn’s disease. J Gastrointest Surg 2007; 11: 529–37.
- Pellino G, Selvaggi F: Surgical treatment of perianal fistulizing Crohn’s Disease The Scientific World Journal 2014. http://dx.doi.org/10.1155/2014/146281
- Zoeten EF, Pasternak BA, Mattei P, et al: Diagnosis and treatment of perianal Crohn disease: NASPGHAN clinical report and consensus statement. JPGN 2013;57(3):401-411.
- Steele SR, Kumar R, Feingold DL, et al: Practice parameters for the management of perianal abscess and fístula in ano. Dis Colon Rectum2011;54(12):1465-74.
- Lewis RT, Maron DJ: Anorectal Crohn’s Disease. Surg Clin N Am 2010;90:83-97.
- Strong S: Perianal Crohn’s disease. Seminars in Pediactric Surg 2007;16:185-193.
- Van Overstraeten AB, Wolthuis AM, Vermeire S, et al: Intersphinteric proctectomy with end colostomy for anorrectal Crohn’s disease results in early and severe proximal colonic recurrence. J Crohn’s and Colitis 2013;7:e227-231.