CAPÍTULO 5
Enfermedad de Crohn colorrectal
La afectación colorrectal no escapa a los resultados del tratamiento médico quirúrgico de otras localizaciones siendo no curativo y con altas tasas de recidivas, por lo cual la cirugía solo se reserva para solucionar las complicaciones.1,2 Existen grandes controversias sobre cuando es el momento quirúrgico adecuado, nosotros como cirujanos y en una lucha interdisciplinaria bregamos por que los pacientes no sean operados cuando todos los tratamientos médicos fallaron y el paciente se encuentra en tal mal estado que la morbi mortalidad del tratamiento quirúrgico es desmesurada. En concordancia con esto, Graziano y cols.3 (1980), hacen referencia a un grupo de 37 pacientes, 23 de los cuales (62%) requirieron cirugía, de ellos aquellos sometidos a un tratamiento médico más prolongado presentaron mayor morbi mortalidad, siendo menor la mortalidad en las cirugías resectivas que en aquellas que no lo fueron.
En la era pre-utilización de agentes biológicos, el porcentaje de pacientes con enfermedad de Crohn colónica que recurrían luego de una cirugía variaba de un 40 a mas del 90%;4,5 con el advenimiento de los mismos estas cifras a cinco años parecen haber disminuido variando de un 18% a 64%, aunque aún se desconoce el riesgo a largo tiempo.5
5.1 INDICACIONES QUIRÚRGICAS URGENTES
Son la obstrucción, perforación, peritonitis, hemorragia y abscesos, mientras que estos pueden ser drenados por vía percutánea, las demás complicaciones requieren cirugía. La técnica a emplear depende de los hallazgos operatorios y puede variar desde la resección con abocamiento de cabos o solo ostomías descompresivas.
Ileítis terminal
Se puede presentar como un cuadro de apendicitis aguda y es un hallazgo en la laparoscopia o laparotomía. El apéndice es normal y el íleon se encuentra engrosado y congestionado, el meso aumentado de espesor y con adenopatías. Si el ciego no está indurado, se puede realizar la apendectomía.2 La resección del íleon no esta indicada excepto que el paciente refiera síntomas obstructivos, el intestino delgado proximal se encuentre dilatado y con la pared intestinal inflamada.6
Obstrucción intestinal aguda
Los cuadros de oclusión intestinal por enfermedad de Crohn estenosante colónica suelen caracterizarse por episodios subagudos repetitivos, que ceden con reposo digestivo y aumento de las dosis de corticoides. Las estenosis colónicas son más frecuentes en los pacientes con colitis ulcerosa (5% al 17%)7 que en los que padecen enfermedad de Crohn. En este último grupo, esta complicación se presenta en el 5 al 12%.7,8 Durante el episodio agudo la cirugía podría estar indicada si al cuadro de oclusión se suman signos de infección, si coexiste una masa abdominal, si la recuperación es prolongada y los intervalos entre crisis son cortos, la presencia de alteración del estado general tal como la presencia de malnutrición o anemia, la concomitancia de fístulas internas o externas, pacientes que no toleran la medicación y alteraciones en la calidad de vida.
La conducta quirúrgica dependerá de la localización de la lesión, el largo de la misma, la asociación de múltiples estenosis; del estado general y de las condiciones locales. El uso de estricturoplastias a nivel colónico si bien ha sido descripto para estenosis cortas es controvertido.7,9 Se pueden realizar ostomías si el estado del paciente no permite la resección, la realización de un bypass esta reducida solo a aquellos pacientes en que asociado a las estenosis se observa la presencia de una masa de difícil resección (por el riesgo de dejar in situ lesiones con riesgo de malignizar y a las cuales no se pueda acceder en endoscopias posteriores de pesquisa).
Una vez remitido el cuadro existen controversias acerca de la resolución quirúrgica electiva. Algunos autores indican la cirugía cuando el paciente debe continuar con esteroides luego del ataque agudo, si la recurrencia ocurre a pesar de una adecuada medicación y/o ante la sospecha de malignidad.
Existen informes acerca del uso de stents colónicos en cuadros obstructivos agudos como paso previo a la resección con anastomosis primaria.1,10,11 Karstensen y cols.12 encuentran, luego de tratar 6 pacientes con estenosis por enfermedad de Crohn, que el uso de stent biodegradables se asociaba a una tasa de éxito clínico inaceptable y a un frecuente mal funcionamiento del stent, aunque datos previos eran prometedores con tasas de éxito clínico que iban desde 70% a 83%.
Perforación libre
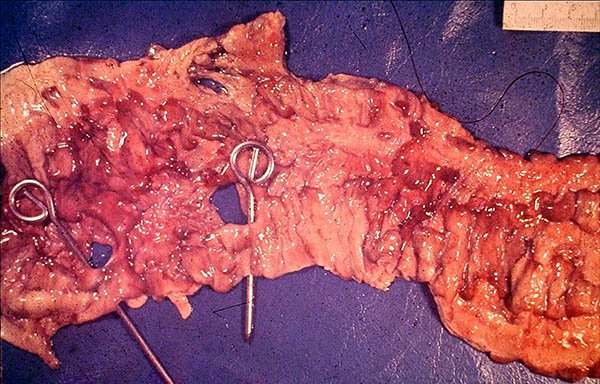
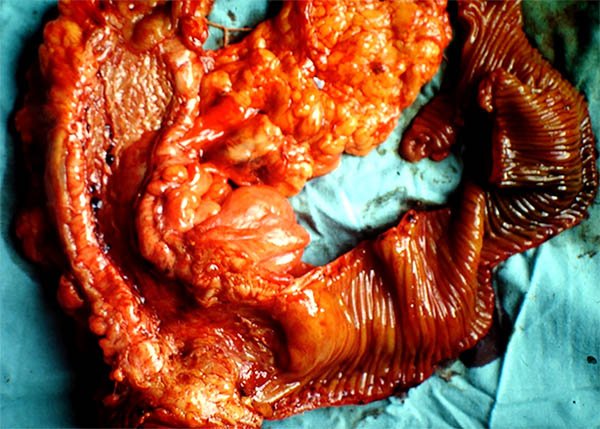
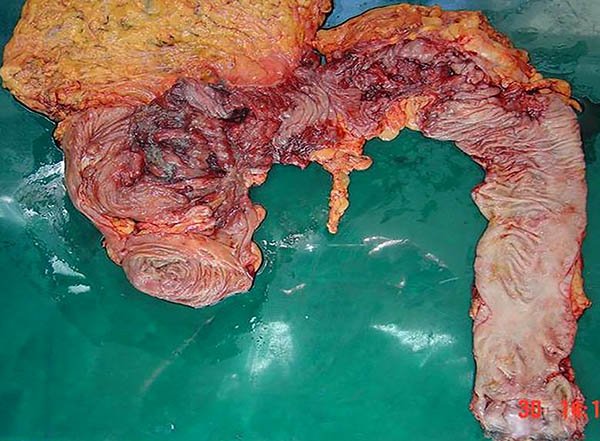
Los pacientes con enfermedad de Crohn pueden requerir cirugía por perforaciones libres en cavidad, ellas pueden ser a punto de partida del intestino delgado o el colon presentándose con una incidencia del 1 al 16%.13 La perforación colónica es una rara indicación de cirugía con una incidencia del 1 al 3%14,15 puede ocurrir de novo, ser secundaria a megacolon tóxico o proximal a una obstrucción (foto 18).
La conducta quirúrgica adecuada es la laparotomía, colectomía subtotal (CST) con ileostomía terminal y fístula mucosa, la cual esta especialmente indicada en pacientes que presentan peritonitis fecal, inestabilidad hemodinámica, malnutrición severa, uso crónico de corticoides o biológicos o retraso del tratamiento.1,9,13,14 Algunos autores realizan resección del segmento perforado con abocamiento de cabos mientras otras sugieren en evaluar la resección y anastomosis con una ostomia de protección.13
Foto 18: Pieza de colectomía con múltiples perforaciones.
Entre otros factores que se deben tener en cuenta para realizar una ostomía de protección o terminal, se encuentra la presencia de proctitits o enfermedad perianal concomitante, incontinencia, extensión de la enfermedad colónica y localización de la anastomosis.9
En caso de severa inestabilidad una opción a tener en cuenta es la laparotomía lavado y abocamiento de la perforación, para en un segundo tiempo con el paciente estable completar la cirugía.
Abscesos intraabdominales
Los abscesos abdominales o pélvicos ocurren en un 10 a 30% de los pacientes con enfermedad de Crohn.2 Dependiendo de su localización los abscesos pueden ser: interasas, pélvico, enteroparietal, intramesentérico, retroperitoneal o abscesos del músculo psoas.
Los abscesos intraadominales de existir una ventana que permita una vía de acceso segura deben ser drenados en forma percutánea, este gesto junto a terapia antibiótica es el tratamiento de elección, ya que presenta una baja tasa de complicaciones asociadas a un aceptable porcentaje de éxitos que alcanza al 70%1,14,16 (23-78%).13 En muchos casos el drenaje percutáneo permite contemporizar al paciente, sacándolo de la sepsis y otorgándole al equipo médico tiempo para mejorar el estado general del paciente; permitiendo disminuir todas las complicaciones postoperatorias, la necesidad de un ostoma temporal de derivación y haciendo factible utilizar un abordaje laparoscópico.9,17-25 Tzivanakis y cols.26 describen que la presencia de un absceso en el momento de la cirugía duplica el riesgo de complicaciones postoperatorias anastomóticas (14% versus 6%).
Algunos autores como Zhang27 han encontrado que es justamente la sepsis intra abdominal un factor de peor pronóstico postoperatorio.
En aquellos abscesos menores de 3 cm el tratamiento antibiótico como única opción puede ser valido.13,14,17
Al igual que lo que sucede con abscesos de otra etiología, la necesidad de una cirugía resectiva posterior es controversial, ya que la enfermedad intratable o el absceso recurrente ocurren en al menos el 30% de estos pacientes dentro de un año 1. Nguyen y cols.28 en un reciente metaanálisis de 9 estudios (603 pacientes), encuentra que la probabilidad de resolverlos es tres veces menor cuando se utiliza solo este tratamiento (OR 3.44, IC del 95%: 1.80-6.58, P <0.001).
En los casos en que el drenaje percutáneo no es factible o falla, o existen con abscesos recurrentes o fístulas residuales el drenaje quirúrgico por laparotomía o laparoscopía, con o sin resección del segmento afectado, y anastomosis de ser factible es la regla.14 Strong y cols.29 encuentran como factores asociados a fallos del abordaje mini invasivo: el tratamiento concomitante con corticoides, la enfermedad colónica, los abscesos grandes, multiloculados y o multifocales.
Algunos autores sostienen que los abscesos del psoas y los de la vaina del recto, si bien son menos frecuentes, son más difíciles de controlar localmente. En una revisión retrospectiva de 13 pacientes con absceso de pared abdominal tratados con drenaje percutáneo y/o abierto, todos requirieron resección del segmento enfermo, incluso después de un drenaje exitoso.1
Los abscesos interasas raramente pueden ser drenados por vía percutánea por carecer de una ventana segura para su punción.
Los intramesentéricos surgen de la enfermedad penetrante. En el colon o rectosigma, estos abscesos pueden ser tratados mediante un drenaje externo asociado a una colostomía terminal, y así diferir la resección para cuando el proceso séptico y las condiciones locales mejoren.
Colitis y megacolon tóxico
La colitis tóxica con o sin megacolon es una complicación potencialmente fatal, que se observa raramente en la enfermedad de Crohn. El cuadro agudo de colitis y el megacolon tóxico (dilatación segmentaria o total del colon asociado a un cuadro tóxico sistémico) (Tabla 1)31 por enfermedad de Crohn es similar al que podemos ver en la colitis ulcerosa al igual que su tratamiento.
Hemorragia
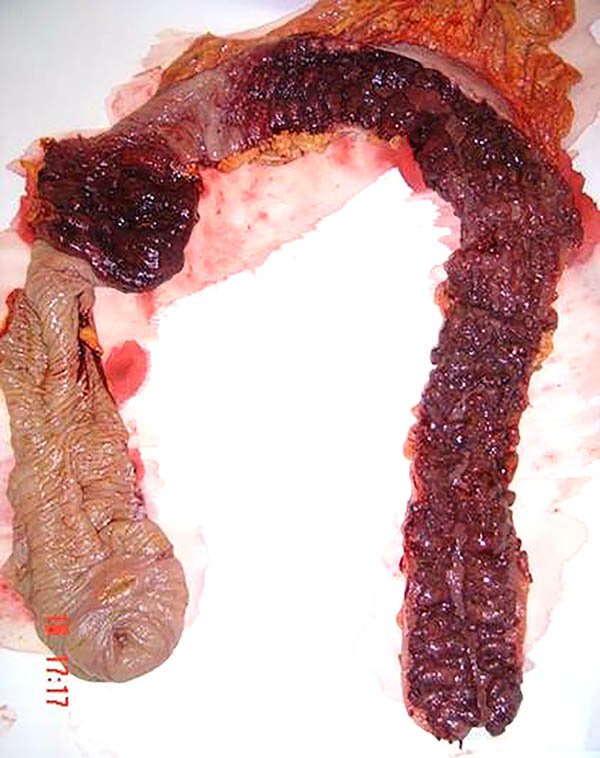
Es de rara observación, se presenta en el 0,9 al 13% de los pacientes por lo cual se deben excluir otras etiologías.2,13 Ocurre con mayor frecuencia en la enfermedad colónica difusa debida a la penetración de ulceraciones profundas en la pared que horadan los vasos8,29 (foto 19).
El tratamiento deberá seguir los algoritmos de la hemorragia digestiva baja, pudiendo ser controlados mediante técnicas radiológicas o endoscópicas intervencionistas cuando no es una hemorragia difusa. Primero se debe estabilizar al paciente y detectar el sitio de sangrado, de elección mediante una endoscopia y o una angio-tomografía lo cual de detectar el sangrado permite su tratamiento mini invasivo.
|
Malnutrición |
|
Hipoalbuminemia |
|
Anemia |
|
Tratamiento preoperatorio con corticoides |
|
Hábito tabaquico |
|
Tratamiento preoperatorio con inmunosupresores y o agentes biológicos |
Tabla 11: Factores de riesgo modificables
Foto 19: Pieza de colectomía resecada por enfermedad de Crohn colónica cuya indicación fue hemorragia masiva.
La posibilidad de re sangrado en estos pacientes es de cerca del 40%, porcentaje que puede ser reducido mediante el uso de agentes biológicos.13,14
El tratamiento quirúrgico se encuentra indicado si el paciente permanece inestable, ante la presencia de sangrado persistente que pone en riesgo la vida, si re sangra del mismo sitio o si requiere continuas transfusiones. La colectomía subtotal es la operación de elección, en el raro caso de que el recto participe se deberá realizar una coloproctectomía.2,13,25
5.2 INDICACIONES ELECTIVAS
Incluye aquellas indicaciones que no ponen en riesgo la vida del paciente en el corto plazo, pero que transforman a la enfermedad en una patología invalidante e incluye: las fístulas, el cáncer, la uropatía obstructiva, el retardo en el crecimiento en los niños y el fracaso del tratamiento médico. La elección de la técnica dependerá de la localización de la enfermedad y de la presencia de complicaciones.
En general, los esteroides son ineficaces en el 20 al 30 por ciento de los pacientes, y del 20 al 45 por ciento de los respondedores iniciales recaerán con la disminución o suspensión de los corticoides.14
Debe recordarse que:2,9,25
- La cirugía no es curativa y lo que se busca alcanzar es atenuar los síntomas y mejorar la calidad de vida.
- La enfermedad asintomática no debe ser operada (a menos que exista riesgo de cáncer).
- Un 40 a un 70% de los pacientes requieren por lo menos una segunda operación dentro de los 10 años.
- Las incisiones deben ser medianas para dejar lugar para futuras ostomías.
- Las grandes resecciones no impiden ni disminuyen el número de recidivas.
- El intestino no afectado por la enfermedad puede estar involucrado con adherencias inflamatorias o en fístulas internas.
- La división del mesenterio puede ser dificultosa (debido a su engrosamiento y fragilidad).
- Los márgenes de resección deben ser conservadores (2 cm).
- El tratamiento quirúrgico puede asociase a complicaciones postoperatorias como el síndrome de intestino corto (cuando el intestino delgado se encuentra afectado) y fístulas anastomóticas.
- La cirugía disminuye la necesidad de utilizar drogas terapéuticas con la consiguiente disminución de sus efectos adversos.
Es importante enfatizar que en los casos en los que esta indicada la cirugía en forma electiva, el equipo interviniente tiene tiempo para cambiar aquellos factores que se relacionan con una mayor morbilidad postoperatoria y que son modificables32,41 (Tabla 12).
Falla del tratamiento médico
Se define la falla del tratamiento médico como una falta o escasa respuesta a la terapia médica adecuada, o la presencia de los efectos adversos relacionados con la dosis y el tiempo de duración. Antes de iniciarlo, se debe informar al paciente sobre los resultados esperados y las posibles complicaciones generadas por estas drogas, así como los criterios criterios objetivos que se tomaran como respuesta de la enfermedad y el tiempo prudente para alcanzarlos. Cuando todo tratamiento médico apropiado ha fallado, la cirugía se encuentra indicada.
Fístulas
Las fístulas colónicas se presentan con una incidencia del 16%2 pudiendo comunicarse con la vejiga, vagina, intestino delgado, uréter, duodeno, estómago y útero entre otros.29,42
El tratamiento consistirá en la resección quirúrgica del segmento afecto o de todo el colon con cierre del orificio fistuloso en el órgano vecino, si este no se encuentra afectado por la enfermedad.
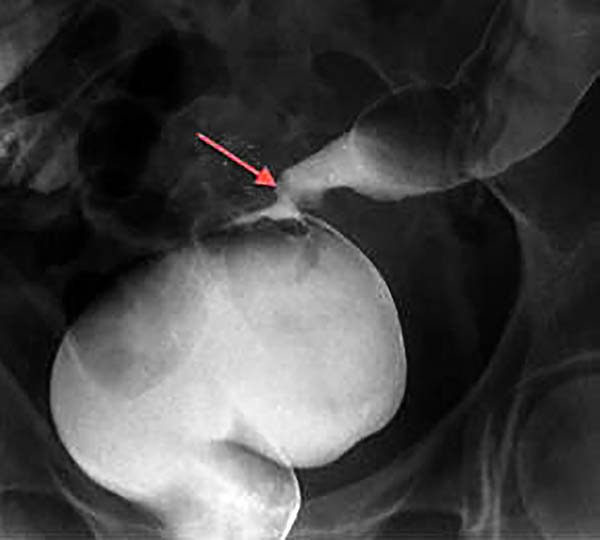
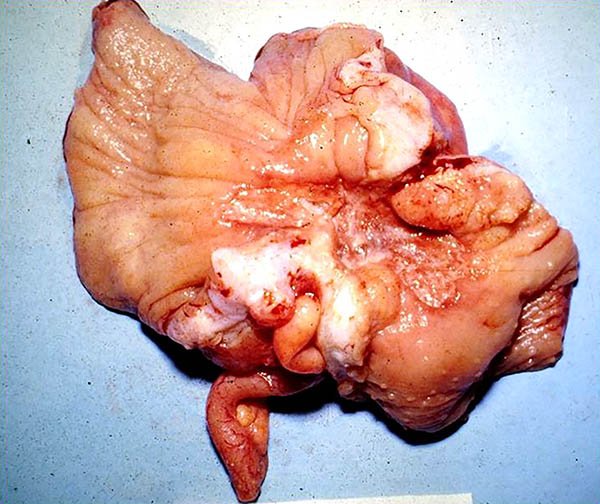
Estenosis (fotos 20-22)
La tasa de estenosis colónica varía del 5 al 12%, pudiendo ser asiento de carcinomas.2,43,44 Los signos y síntomas no difieren de los de las estenosis malignas.
Se pueden clasificar como lesiones inflamatorias o fibroestenóticas, aunque esto es un proceso dinámico, pudiendo coexistir ambos tipos a lo largo del intestino. La diferenciación entre ambas es importante para determinar el tratamiento apropiado. Si bien las primeras pueden tener una buena respuesta con el tratamiento médico, algunos autores como Bharadwaj45 sostienen que si bien la terapia biológica puede reducir el riesgo de formación de estenosis al inducir curación de la inflamación de la mucosa, también puede promover la formación de nuevas estenosis a partir de la rápida cicatrización de la mucosa o empeorar las existentes. Con respecto a esto último los análisis no ajustados de los datos del registro TREAT32 y del ensayo ACCENT I,46 sugieren una mayor probabilidad de estenosis después del tratamiento con infliximab (IFX), el análisis multivariado ajustado mostró que el desarrollo de las mismas se asoció sólo con la gravedad, la duración, la localización (íleo) de la enfermedad de Crohn y el uso de corticosteroides.
Las estenosis fibróticas serán de resorte quirúrgico. Otras indicaciones de cirugía son la falta de respuesta al tratamiento, las estenosis en pacientes con mas de 10 años de evolución o pacientes en las cuales estas lesiones no pueden ser estudiadas con colonoscopía y biopsias por ser infranqueables, impidiendo descartar una neoplasia.2,13
|
Toxicidad sistémica (mínimo 3 criterios) - fiebre > 38.6 - taquicardia > 100 latidos por minuto - leucocitosis > 10.500/mm3 - anemia con hematocrito < 60% |
|
Al menos uno de los siguientes criterios - deshidratación - alteraciones del estado de la conciencia - trastornos hidroelectroliticos - hipotensión 1. trastornos psíquicos |
Tabla 12: Criterios Jalan
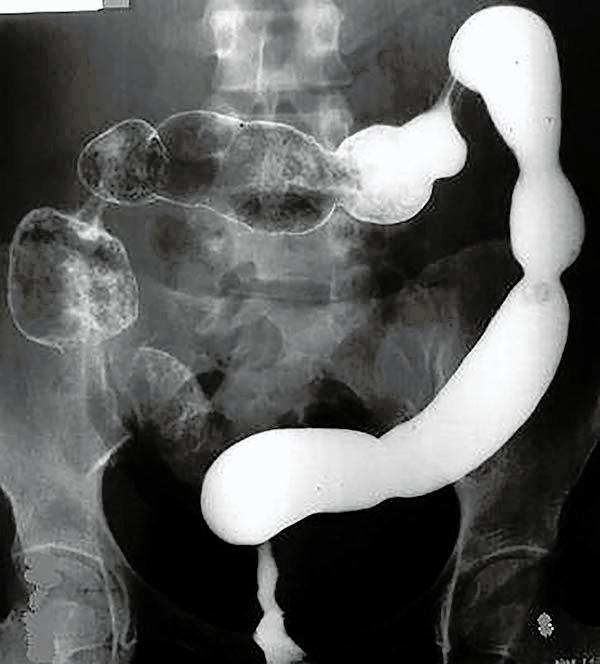
Foto 20: Colon por enema que muestra múltiples estenosis colónicas.
La dilatación con balón es una alternativa probada en las estenosis de delgado, pero también puede ser utilizada en las estenosis colónicas43 especialmente aquellas a las cuales se puede acceder fácilmente, cortas - menores de 5 cm, sin úlceras profundas ni fístulas, y las secundarias a estenosis de anastomosis. Generalmente, se utilizan balones de 10-20 mm, aunque no existen protocolos estandarizados acerca de atmósferas utilizadas, tiempo de mantener insuflado el balón y número de sesiones de dilataciones. La tasa de éxitos descriptas con esta técnica llegan a un 4025-97%, con recurrencias del 36 al 56% a los 5 años,13,47 siendo las complicaciones más frecuentes la hemorragia, la perforación y la sepsis con un rango de 5 a 18%.48
Hassan y cols.48 realizaron una revisión retrospectiva de 13 estudios, en las cuales la mayoría de las estenosis fueron de anastomosis ileocolónicas, encontraron un éxito del 58% al final del seguimiento (promedio 33 meses) con una tasa de complicaciones mayores del 2%. La meta-regresión mostró que una longitud de estenosis de 4 cm o menos se asoció con un mejor resultado (p <0,028).
Morar y cols.49 en otra revisión de 25 estudios, que no solo incluían estenosis colónicas, hallan una tasa de respuesta sintomática del 70,2% a corto plazo, aunque la largo plazo el 75% de los pacientes requirió cirugía.
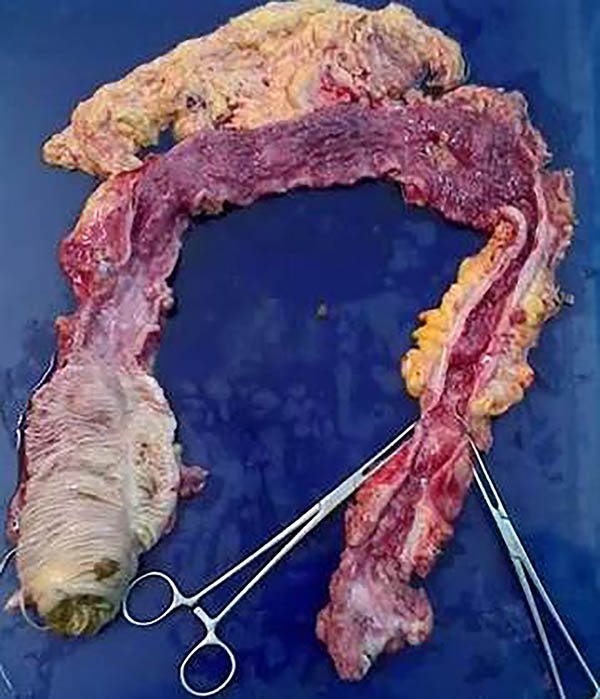
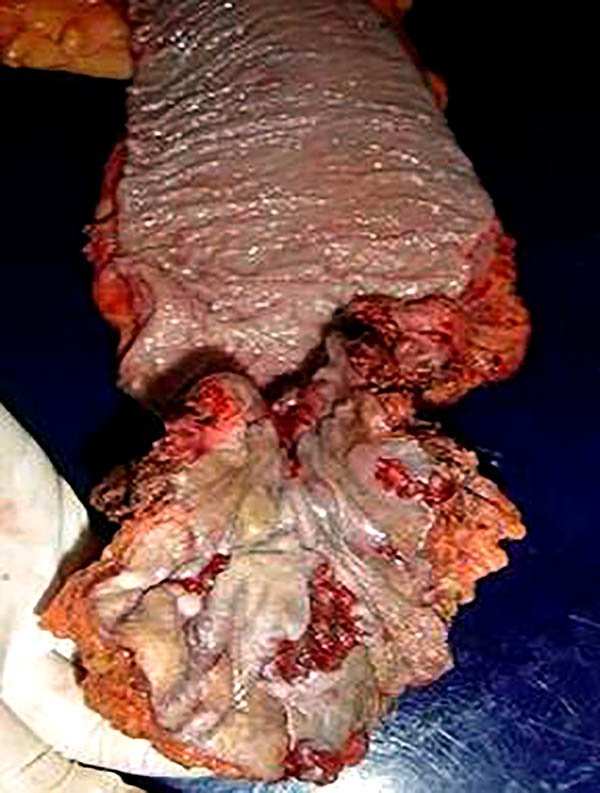
Foto 21: Pieza de colectomía con múltiples estenosis.
Foto 22: Colon por enema que muestra estenosis de sigma.
Si bien se ha descripto el uso de estricturoplastias en estenosis colónicas cortas con tasas similares de recidivas y complicaciones,50 su uso es controvertido, principalmente por el riesgo de ser neoplásicas (7%), por lo cual la mayoría de los autores la contraindican.7,9,13,14) También existen reportes47 de utilización de stent en cuadros no oclusivos con resultados favorables, pero con un seguimiento a muy corto plazo, lo cual no lo hace aun una técnica indicable.
Retardo del crecimiento en niños
Ocurre en un 10-40% de los niños con enfermedad de Crohn,2,13 caracterizándose por una disminución del desarrollo pondoestatural, retardo en el desarrollo óseo y falta de madurez sexual.
El tratamiento de estos pacientes debe ser temprano en busca de disminuir la inflamación mucosa mediante el tratamiento médico, el quirúrgico y el soporte nutricional adecuado. El tratamiento quirúrgico esta indicado cuando la enfermedad esta claramente localizada y muestra beneficios en la rápida recuperación del crecimiento y psicológicos.13,25,29,51
Uropatía obstructiva
La uropatía obstructiva es una complicación que suele ocurrir en el contexto de una enfermedad muy activa, el uréter se comprime por un íleon terminal inflamado, ciego o colon sigmoide o puede ser envuelto por un flemón.
El diagnóstico se realiza principalmente por tomografía computarizada. Los síntomas suelen mejorar con la instauración del tratamiento médico en el 87% de los casos.2 La colocación de catéteres doble J debe ser el primer gesto en aquellos pacientes con estados inflamatorios intra abdominales complicados, hasta que se pueda instaurar un tratamiento adecuado o el proceso inflamatorio se resuelva.52,53 La ureterolisis raramente es necesaria.
En un estudio Fazio8 refiere haber encontrado uropatía obstructiva en el 4,7% de los pacientes a los cuales se les realizó pielografía. Mientras que Ben Ami54 y cols., refieren que esta eventualidad puede ocurrir hasta en un 6% de los pacientes con enfermedad de Crohn, siendo más común del lado derecho.
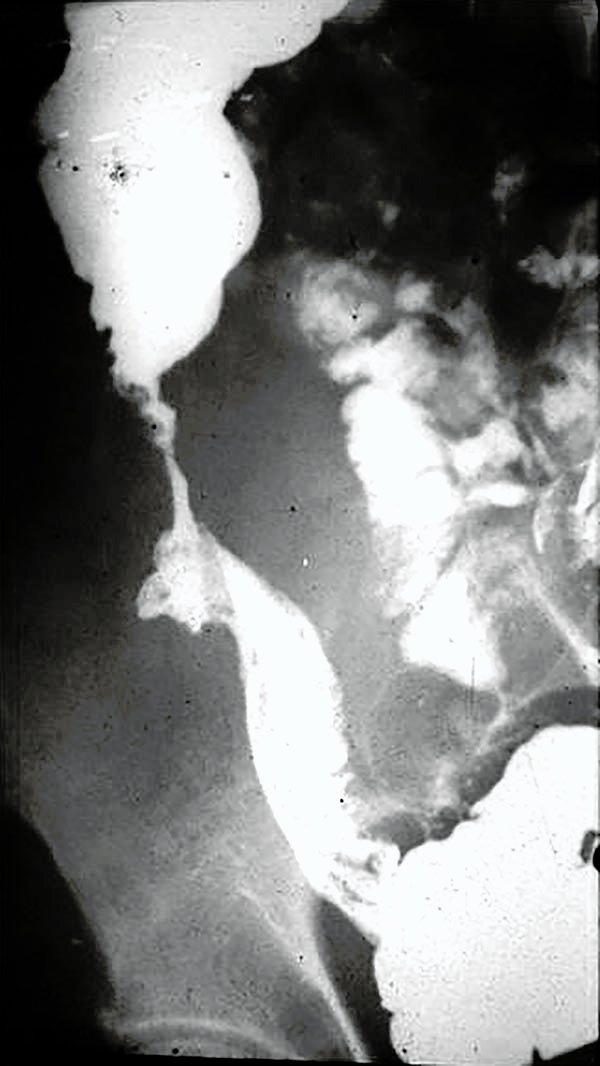
Forma ileocólica (Fotos 23-25)
La localización más común de la enfermedad de Crohn es la región ileocólica, presentándose aproximadamente en un 40 a 55% de los pacientes.55-57 El tratamiento quirúrgico de las complicaciones esta indicado ante la presencia de absceso, fístula, perforación, sangrado, obstrucción o fracaso del tratamiento médico.
Cuando la enfermedad de Crohn ileocecal afecta un máximo 40 cm de intestino en una forma inflamatoria sin síntomas de obstrucción, el tratamiento médico con corticoides tiene buenas respuestas requiriendo, sin embargo, una cirugía posterior en la mayoría de los casos. En cambio cuando hay afectación ileocecal con síntomas claramente obstructivos el tratamiento es la cirugía.6
La resección debe ser económica, limitándose al sector ileal y al ciego si este está comprometido, restaurando la continuidad intestinal con una ileoascendoanastomosis o ileotransversoanastomosis si el ascendente está involucrado, tratando de separar la sutura del duodeno interponiendo epiplón en prevención de una futura recidiva y una fístula, en caso de dudosa viabilidad de la anastomosis, desnutrición, anemia, mal estado general se puede confeccionar con una ileostomía de protección o realizar el abocamiento en caño de escopeta. El abordaje puede ser laparoscópico o abierto ya que ambos presentan resultados comparables a corto plazo (tasas de infección de la herida, fuga anastomótica y absceso intra abdominal cuando se realiza en forma electiva).13,58
El by pass, el cual fuera por varios años la técnica de elección para esta ubicación en la actualidad, solo esta reservada para aquellos casos con gran componente inflamatorio retroperitoneal donde la resección implica un severo riesgo para las estructuras vasculares y el uréter, debido a que se deja in situ la enfermedad con el consiguiente riesgo de malignización, sangrado y desarrollo de fístulas. En estos casos, una vez remitido el cuadro inflamatorio deberá intentarse la resección quirúrgica.14,57,59
En un esfuerzo por disminuir las recurrencias a nivel de la anastomosis ileocólica, se ha descripto la creación de una válvula pezón mediante la telescopaje del íleo neo-terminal por varios centímetros en el colon, con el fin de evitar el reflujo de materia fecal hacia el íleon. Bakkevold61 ha reportado una serie de 59 pacientes sometidos a esta operación, con un 24% de recidiva clínica y un 16% de quirúrgica a los 5 años, lo que se compara favorablemente con las series publicadas para la anastomosis estándar, aunque no se han realizado estudios randomizados y los trabajos62,63 presentan un número pequeño que no permite sacar conclusiones importantes.
Las recurrencias en las anastomosis son comunes y difíciles de prevenir. Se ha descripto que tanto la resección quirúrgica como la dilatación endoscópica con balón, son opciones de tratamiento para las estenosis de la anastomosis ileocolónica por recidiva de la enfermedad. Li y cols.,63 han realizado un trabajo sobre 194 pacientes de los cuales a 114 se le realizó cirugía directa y a 80 cirugía luego de dilataciones endoscópicas, encontrando en el primer grupo menor tasa de necesidad de ostomias y de complicaciones, tales como infección del sitio quirúrgico.
También en este tipo de estenosis se ha descripto el uso de stent con las mismas limitaciones que lo relatado en los párrafos precedentes.64
Cáncer (fotos 26 y 27)
El riesgo de cáncer colorrectal asociado a enfermedad de Crohn colorrectal es de 2 a 3 veces mas que en la población general, influyendo los mismos factores que en la colitis ulcerosa,66-71 siendo el tratamiento el mismo según los distintos hallazgos excepto que en este grupo la coloproctectomia con reservorio ileal no esta indicada.
En caso de hallar displasia de alto grado multifocal o asociada a lesión o masa no similar a un adenoma, la coloproctectomía con ileostomía definitiva67 previa revisión de la anatomía patológica, debe ser considerada fuertemente ya que resecciones segmentarias se asocian a 14-40% de lesiones metacrónicas.13 Si el recto se encuentra sano la colectomía con ileorrectoanastomosis es una opción viable,13 informando al paciente que debe realizar un estricto seguimiento endoscópico posterior. En aquellos casos en que la displasia se asemeje a lesiones adenomatosas y en ausencia de displasia circundante, la resección endoscópica y el manejo como si fuera un adenoma es lo adecuado.
Si bien varios autores han encontrado un aumento del riesgo relativo de cáncer colorrectal en pacientes con enfermedad de Crohn (1,5 - 5.6%). Entre ellos Ekbon y cols.2 sobre 1655 seguidos a 30 años, observaron un riesgo relativo de cáncer de 1 para la limitada al íleon terminal, 1.2 para la ileocolitis y de 5,6 para la enfermedad de Crohn colónica, dependiendo de la extensión de la enfermedad, del tiempo de evolución y de la edad del diagnóstico, no relacionándose con el sexo. Y Canavan y cols.,73 en un metaanálisis, informaron un riesgo relativo (RR) de cáncer de colon en estos paciente de 4,5 (IC del 95%, 1,3-4,9).
Foto 23: Imagen contrastada de afección ileocolica.
Foto 24: Pieza de resección de afectación ileocolica.
Otros autores sugieren una disminución de dicho riesgo.74 Una publicación danesa75 estudió el riesgo de cáncer colorrectal en una cohorte nacional de 47.374 pacientes con EII en un período de 30 años, encontrando que el riesgo de CRC no difirió de la población general. En concordancia Jess y cols.76 en un metaanálisis, encuentra que el RR de desarrollar cáncer colorrectal en este grupo vario 0,9 y 2,2; considerando por ello que el riesgo seria mucho menor que lo publicado en estudios anteriores. En nuestro caso en los últimos15 años solo hallamos 4 cánceres en un total de 82 pacientes operados por Crohn colorrectal (4.8%).
5.3 ALTERNATIVAS QUIRÚRGICAS
Las cirugías realizadas en la enfermedad de Crohn colorrectal dependen de su extensión y de la presencia de afectación perianal e incluyen a la coloproctectomía con ileostomía terminal, colectomía total con ileorrectoanastomosis, colectomía subtotal con ileostomía y cierre del muñón a lo Hartmann, colectomía subtotal con abocamiento de cabos (ileostomía terminal y fístula mucosa), resecciones segmentarias e ileostomías derivativas y en casos muy seleccionados coloproctectomía con reservorio ileal.2,77
Foto 25: Pieza de resección por afectación ileocolica tumoral.
Foto 26: Pieza de coloproctectomía por enfermedad de Crohn + cáncer.
5.3.1 Opciones quirúrgicas e indicaciones
Coloproctectomía con ileostomía definitiva
En los pacientes que presentan pancolitis, dos o más segmentos colónicos enfermos asociado afectación rectal y/o perineal severa, o en aquellos con o sin incontinencia anal, la coloproctectomía con ileostomía terminal (definitiva) es la técnica que debe realizarse.2,14,58,77 La misma puede efectuarse en un tiempo o luego de una colectomía subtotal de urgencia.
La proctectomía, de ser posible, debe ser realizada en forma interesfinteriana ya que al producir una menor herida perineal cura más fácilmente, obteniendo mejores tasas de cierre de la brecha perineal.1,13 Las tasas de fallo de cierre de esta herida oscilan del 23 al 78,9%.78-84 Entre los factores involucrados en el desarrollo de este retardo de la cicatrización se encuentran la presencia de sepsis perianal preoperatoria y/o enfermedad fistulizante perianal, la contaminación fecal intraoperatoria y otro factor que se ha relacionado como de mal pronóstico para el cierre del periné, es la presencia de estenosis rectales.85
Foto 27: Pieza de coloproctectomía por EC asociada a adenocarcinoma fistulosizado.
Una variante técnica para dejar un menor lecho cruento perineal, es la realización de una resección rectal anterior baja con cierre del recto a nivel de la línea de las criptas86 mediante una sutura mecánica, esta técnica al preservar el ano presenta una mayor incidencia de síntomas perianales, razón por la cual la mayoría de los autores la contraindican. Se han publicado varias opciones para resolver esta complicación desde simples tratamientos médicos o quirúrgicos, hasta el desplazamiento de músculos como recto interno, recto mayor del abdomen y glúteo mayor.85,87
En los últimos años se ha descripto la utilización de un dispositivo de cierre asistido por vacío (VAC®), para disminuir el tiempo hasta la cicatrización de heridas y aumentar la formación de tejido de granulación. Este utiliza presión subatmosférica para aumentar tanto el suministro de sangre como la formación de matriz, mientras se elimina activamente el fluido y el residuo de los sedimentos. La angiogénesis se produce rápidamente en el área presurizada mejorando el flujo de sangre, y la contracción de la herida ocurre rápidamente secundaria a la succión que aproxima activamente los bordes. El dispositivo se aplica cortando una esponja a un tamaño ligeramente más pequeño que la herida, se coloca el tubo de succión sobre la esponja y se cubre con films adhesivos para crear un área sellada que cubra la herida.88 Luego se lo conecta a una bomba de aspiración portátil. Existen reportes con escaso número de pacientes con lecho cruentos post proctectomía por enfermedad de Crohn con resultados alentadores.89
A pesar de resecar todo el colon y el recto, el paciente no se encuentra libre de recidivas, pudiendo aparecer en el intestino delgado con tasas que oscilan entre el 3 al 46% a 10 años de seguimiento.90-93
Coloproctectomía con pouch ileal
La coloproctectomía con reservorio ileal y anastomosis ileoanal fue formalmente contraindicada en los pacientes con enfermedad de Crohn por presentar tasas altas de morbilidad y fallas del 20 al 44%.78,94-96 Entre estas series, Marcello y cols.78 sobre 24 pacientes encontraron una recurrencia de 62% con un 38% de fallas. Otros informes sugieren que un 12%-29% de los pacientes con enfermedad de Crohn requieren extirpación de la bolsa 5 años, ascendiendo a un 45%-57% a los 10 años.77,97-100
Existen múltiples publicaciones acerca de la utilización del reservorio ileal en enfermedad de Crohn, la mayoría confeccionados en pacientes con diagnóstico de colitis indeterminada o colitis ulcerosa, que luego del estudio de la pieza completa o por su evolución se categorizaron como Enfermedad de Crohn. Wagner - Bartak y cols.101 refieren que esto sucede entre el 3,5 y el 9% de los pacientes sometidos a una coloproctectomía con repertorio ilegal.101,102
La enfermedad de Crohn en el reservorio dependerá de la forma clínica pudiendo presentarse con fístulas, abscesos, senos residuales, pouchitis severa y o estenosis.101-103 Ocurre en el 2,7 al 13%103 de las bolsas ileales y puede ocurrir porque el reservorio se realizó en un paciente con diagnóstico de enfermedad de Crohn colorrectal sin afectación del delgado ni perianal, en pacientes con diagnóstico de colitis ulcerosa o colitis indeterminada, en la cual la revisión de la pieza informa Crohn u originarse de novo semanas o años después de la cirugía y con un informe histopatológico que no evidencia Crohn. La presencia en la pieza quirúrgica de hipertrofia neural es descripta por varios autores como un signo pronóstico de desarrollo de Crohn en el reservorio.103
En cuanto a la tasa de fallos, los resultados son controvertidos, la mayoría sugiere que no se comparen los resultados de esta cirugía en pacientes con Crohn con las realizadas en colitis ulcerosa ya que son entidades distintas, reforzando el hecho de la alta tasa de recidivas con cualquiera de las otras técnicas de reconstrucción del tránsito.
Hay un pequeño, pero creciente cuerpo de evidencia para apoyar el uso altamente selectivo de esta cirugía en pacientes con EC conocido, sin afectación del intestino delgado ni historia de enfermedad perianal,13,104-106 obteniendo tasas de persistencia del reservorio ileal a 5 años del 85%.
Regimbeau y cols.105 realizaron coloproctectomía total con reservorio ileal y anastomosis ileoanal a 41 pacientes con enfermedad de Crohn aislada en el colon y el recto, 24 de ellos con diagnóstico preoperatorio, encontrando luego de 10 años de seguimiento tasas complicaciones del 35% y de escisión de la bolsa del 10%.
Melton y cols., de la Cleveland Clínic,106 evaluaron el resultado de la coloproctectomía con reservorio ileal en Crohn en relación con el momento del diagnóstico. Se evaluaron 104 pacientes divididos en tres grupos: aquellos en los cuales el diagnóstico de Crohn fue antes del pouch (intencional) en el 20 (10%), aquellos en que el diagnóstico se realizó por la histopatología postoperatoria (incidental) en 97 (47%) y aquellos en los que el diagnóstico fue realizado de manera retrasada, mediana 36 meses después de la cirugía en 87 (43%). La tasa general de retención de bolsas a 10 años fue del 71%, siendo de 85% en el grupo intencional, 87% en el incidental y de 53% en el grupo de diagnóstico tardío. En el análisis multi variante, la pérdida de bolsas se asoció con un diagnóstico tardío, la presencia de fístula pouch-vaginal y sepsis pélvica (P ≥ 0,0001). Concluyendo que los pacientes cuidadosamente seleccionados con enfermedad de Crohn que se someten a una proctocolectomía restauradora primaria con bolsa ileal y anastomosis ileoanal, tienen una baja pérdida de bolsas y resultados funcionales favorables al igual que aquellos con diagnóstico histológico inmediato. Datos similares fueron hallados por otros autores tanto para enfermedad de Crohn107 como para colitis indeterminada,108 aunque con menor número de pacientes.
Si bien nuestro equipo adhiere a la contraindicación de realizar un reservorio ileal en pacientes con enfermedad de Crohn, en los últimos años en un subconjunto cuidadosamente seleccionado de pacientes jóvenes con enfermedad limitada al colon y recto, sin enfermedad perianal, función adecuada del esfínter y la total información y aceptación por parte del paciente de las complicaciones y el riesgo de falla del pouch, vemos posible la realización de esta técnica, hecho que fue factible solo en un caso.
Colectomía total con ileorrectoanastomosis (IRA)
Los pacientes con enfermedad colónica extensa pero con escasa o nula afectación del recto y continencia fecal conservada, en ausencia de sepsis anoperineal activa y con una adecuada compliance rectal son candidatos a una colectomía total con ileorrectoanastomosis.2,9 Aquellos que presentan dos o más segmentos colónicos afectados, también son candidatos a colectomía total con IRA ya que este subgrupo se asocia a mayor riesgo de recurrencia cuando se realizan colectomías segmentarias.1,13 Algunos autores como Strong9 sugieren evaluar la compliance rectal previamente mediante una manometría, ya que los pacientes que presentan una tolerancia máxima de volumen rectal <150 ml, no presentan buenos resultados funcionales. La misma puede ser realizada con anastomosis primaria con o sin protección, o como segundo paso luego de una colectomía subtotal con abocamiento de cabos por un cuadro agudo. El riesgo de dehiscencia en los casos de anastomosis primaria asciende al 17%.109
Pastore y cols. de la Clínica Mayo110 encuentran en un trabajo sobre 42 pacientes sometidos a esta cirugía, que la mayoría (73,8%) tenían una ileorrectoanastomosis en funcionamiento 5 años con una mejora significativa en la calidad de vida, aunque el sexo femenino y la edad menor o igual a 36 años se asociaron a una menor probabilidad de éxitos.
La recurrencia de enfermedad con esta técnica es alta. Existen series que informan tasas de recidivas del 64 al 83%42,111-113 con reoperaciones que alcanzan el 50%.
Si bien, tanto la tasa de recaída como la necesidad de reoperaciones son elevadas, el paciente tendrá una mejor calidad de vida hasta que la recaída no pueda ser manejada médicamente. En un estudio francés113 el tratamiento profiláctico con 5- aminosalicilato fue un factor asociado a la preservación rectal a largo plazo. El advenimiento de los agentes biológicos es prometedor en este campo.
Colectomía total con ileostomía con preservación del recto
Esta cirugía está indicada principalmente en aquellos pacientes que presentan un recto sano, pero el enfermo no es apto para una anastomosis o en aquellos en que debe ser resecado pero la proctectomía no es oportuna como sucede en las indicaciones de urgencia ya sea por la presencia de un megacolon tóxico o una colitis tóxica.1,7,13,58
Un punto importante de esta técnica es el manejo del muñón rectal. El mismo de estar afectado en la urgencia suele ser fiable por lo cual algunos autores entre los cuales nos incluimos preferimos dejarlo exteriorizado como una fístula mucosa ya que esto representa un menor riesgo de sepsis pélvica.13,14,58,77
Esta cirugía al no resecar el recto conlleva un alto riesgo de requerir una proctectomía posterior, ya sea por recidiva de la enfermedad o por el riesgo de desarrollar cáncer en el muñón remanente.7
Resecciones segmentarias
Las resecciones segmentarias se encuentran indicadas cuando existe solo un segmento colónico afectado,1,58 la principal indicación es la forma ileocólica de la cual ya nos hemos ocupado en párrafos precedentes. Los resultados de la resecciones segmentarias versus colectomía total encuentran la principal diferencia en las recurrencias a corto plazo, ya que la morbi mortalidad es similar al igual que las recurrencias a largo plazo.
Las tasas de recaídas varían del 33 al 62% cuando se realizan estas resecciones.114
Ostomías
Actualmente el uso de ileostomía o colostomía es excepcional, se realiza en pacientes graves con mal estado general, con enfermedades concomitantes o como derivación ante una anastomosis dudosa. Cuando existe una perforación conocida la resección colónica está indicada.
5.3.2 Cirugía laparoscópica en Crohn de colon
Si bien múltiples trabajos han demostrado que no existen diferencias en cuanto a los resultados entre el abordaje convencional y laparoscópico en la enfermedad de Crohn.115,116 este último representa un gran desafío debido a su naturaleza inflamatoria, transmural y recidivante. La presencia de inflamación activa, infiltración y friabilidad del mesenterio, presencia de fístulas y adherencias e inmunosupresión concomitante, pueden complicar significativamente el procedimiento. Por estos motivos creemos que este abordaje debe estar reservado para cirujanos entrenados en el manejo de la enfermedad de Crohn y en este abordaje. Especial cuidado se deberá poner en el manejo y sección del meso, el cual por estar engrosado a veces requiere de la utilización de ligaduras o clipado.
Esta vía se encuentra contraindicada en caso de peritonitis difusa, obstrucción aguda con dilatación de intestino delgado, historia de laparotomías previas con conocimiento de adherencias densas intraabdominales, coagulopatía no corregible al momento de la operación e hipertensión portal con varices intraabdominales.
Entre las diferencias a favor de esta se encuentra una menor incidencia de complicaciones asociadas a la pared abdominal, un más rápido reintegro al trabajo y una diferencia estadísticamente significativa en los resultados cosméticos. El alto riesgo de recurrencia quirúrgica es una razón más para preservar la integridad de la pared abdominal, beneficio del abordaje laparoscópico al que se suma que podría inducir menos adherencias.117
En cirugía colorrectal y en especial en las enfermedades inflamatorias intestinales, la extracción de la pieza a través de orificios naturales no ha cobrado mucha relevancia debido, entre otras cosas, a la dificultad de extraer piezas de gran tamaño.118-121
Lo que usualmente se realiza es la extracción de la pieza a través del sitio donde posteriormente se emplazara la ostomía, siempre que esto no implique que por el tamaño del espécimen se deban realizar grandes incisiones, por el riesgo de eventraciones periostomicas, en especial en aquellos casos de ostomas definitivos. Cuando el paciente es sometido a una coloproctectomía con ileostomía definitiva la pieza se extrae por la herida perineal.
Una variante técnica del abordaje laparoscópico es el abordaje combinado por técnicas endoscópicas transanales (TEM o TAMIS). Liyanage y cols.122 han realizado los primeros reportes con esta técnica en colitis ulcerosa. Por nuestra experiencia consideramos que estos abordajes son de utilidad especialmente en pacientes varones longilíneos u obesos con pelvis estrechas.
BIBLIOGRAFÍA
- Surlin V, Copaescu C,Saftoiu A: An Update to Surgical Management of Inflammatory Bowel Diseases, 2012 http://dx.doi.org/10.5772/53057
- Graziano A, Ramirez Rojas PA, Collia Avila, K: Enfermedad de Crohn de Colon III 355.
- Graziano A, Terg R, Kesner L, et al: Ileocolitis granulomatosa. Nuestra experiencia.Actas 3er Congreso de Cirugía del Interior. 1980;62-66.
- Peng QH, Wang YF, He MQ, et al: Clinical literature review of 1858 Crohn’s disease cases requiring surgery in China.World J Gastroenterol 2015 April 21; 21(15): 4735-4743.
- Geltzeiler CB, Hart KD, Lu KC, et al: Trends in the Surgical Management of Crohn’s Disease. J Gastrointest Surg (2015) 19:1862–1868.
- Dignass A, Van Assche G, Lindsay JO, et al: The second European evidence-based consensus on the diagnosis and management of Crohn’s disease: Current management. Journal of Crohn’s and Colitis (2010) 4, 28–62.
- Harb WJ: Crohn’s Disease of the Colon, Rectum, and Anus. Surg Clin N Am 95 (2015) 1195–1210.
- Fazio VW. Indications and Strategies for the surgery of Crohn’s Disease. Seminars in colon and Rectal Surgery. 1994, 5(3):174-192.
- Strong SA: Surgery for Crohn’s Disease.
- Wada H, Mochizuki Y, Takazoe M, et al: A case of perforation and fístula formation resulting from metallic stent for sigmoid colon stricture in Crohn’s disease. Tech Coloproctol. 2005 Apr;9(1):53-6.
- Rejchrt S, Kopacova M, Brozik J, et al: Biodegradable stents for the treatment of benign stenoses of the small and large intestines. Endoscopy. 2011 Oct;43(10):911-7.
- Karstensen JG, Christensen KR, Brynskov J: Biodegradable stents for the treatment of bowel strictures in Crohn’s disease: technical results and challenges. Endoscopy International Open 2016; 04: E296–E300.
- Strong S, Steele SR, Boutrous M, et al: Clinical practice guidelines for the surgical management of Crohn’s disease. Dis Colon Rectum 2015;58:1021-1036.
- Strong SA, Koltun WA, Hyman NH. et al: Practice Parameters for the Surgical Management of Crohn’s Disease. Dis Colon Rectum 2007; 50: 1735–1746.
- Bundred Nj, Dixon Jm, Lumsdem Ab, y cols.: Free perforations Crohn's colitis: a ten years review. Dis Col Rectum 1985;28:35-37.
- Lichtenstein GR, Hanauer SB, Sandborn WJ, et al: Management of Crohn’s Disease in Adults. Am J Gastroenterol advance online publication, 6 January 2009; doi:10.1038/ajg.2008.168.
- Patel KV, Darakhshan AA, Griffin N, et al: Patient optimization for surgery relating to Crohn’s disease. Nature reviews gastroenterology & hepatology 2016;13:707-719.
- READ TE: Management of intraabdominal abscesses in Crohn's disease. Clinics in colon and rectal Surg 2001;14:129-134.
- Regimbeau Jm, Panis Y, Marteau P y colab.: Surgical treatment of anoperineal Crohn's disease: can abdominoperineal resection be predicted?. J Am Coll Sur 1999;189:171-76.
- Regimbeau Jm, Panis, Y, Bouhnik Y y colab.: Long term results of ileal pouch anal anastomosis for Crohn's colitis. Dis Colon Rectum 2000;43:A24.
- Richards Me, Rickert Rr, Nance Fc: Crohn’s Disease associated carcinoma: A poorly recognized complication of inflammatory bowel dissease. Ann Surg 1989;209:764.
- Robert Jr, Sachar Db, Greentein Aj, y colab.: Se- vere gastrointestinal hemorrhage for Crohn's disease. Ann Surg 1991; 213:207-11.
- Sachar Db, Andrews Ha, Farmer Rg, y colab.: Propose classifications of patients subgroups in Crohn's disease. Working team report. Gastroenterol in 1992;5:141-54.
- Ahai A, Belair M, Gianfelice D, y colab: Percutaneous drainage of intraabdominal abscess in Crohn's disease short and long term outcome. Am J Gastroenterol 1996;92:275-78.
- Ueno F, Matsui T, Matsumoto T, et al: Evidence-based clinical practice guidelines for Crohn’s disease, integrated with formal consensus of experts in Japan. J Gastroenterol (2013) 48:31–72.
- Tzivanakis, A. et al. Influence of risk factors on the safety of ileocolic anastomosis in Crohn’s disease surgery. Dis. Colon Rectum 55, 558–562 (2012).
- Zhang T, Yang J, Ding CH, et al: Preoperative Intra-abdominal Sepsis, Not Penetrating Behavior Itself, Is Associated With Worse Postoperative Outcome After Bowel Resection for Crohn Disease A Retrospective Cohort Study. Medicine 2015;94 (45):1-8.
- Nguyen, D. L., Nguyen, E. T. & Bechtold, M. L. Outcomes of initial medical compared with surgical strategies in the management of intra-abdominal abscesses in patients with Crohn’s disease: a meta- analysis. Eur. J. Gastroenterol. Hepatol. 27, 235–241 (2015).
- STRONG SA, FAZIO VW: Crohn’s Disease of the colon, rectum, and anus Surgical Clinics of North America 1993;73:933-962.
- Graziano A, Ramirez Rojas PA: Megacolon tóxico. Libro Abdomen agudo de origen colonico. Hequera Jorge Latif Alberto. Akadia 2005.
- Jalan KN et al. An experience of ulcerative colitis. I. Toxic dilatation in 55 cases. Gastroenterology 1969; 57: 68- 82.
- Lichtenstein GR, Feagan BG, Cohen RD, et al. Serious infection and mortality in patients with Crohn’s disease: more than 5 years of follow-up in the TREATTM registry. Am J Gastroenterol 2012; 107(9):1409–1422.
- Colombel JF, Loftus EV Jr, Tremaine WJ, et al. Early postoperative complications are not increased in patients with Crohn’s disease treated perioperatively with infliximab or immunosuppressive therapy. Am J Gastroenterol 2004;99(5):878–883.
- Indar AA, Young-Fadok TM, Heppell J, Efron JE. Effect of perioper- ative immunosuppressive medication on early outcome in Crohn’s disease patients. World J Surg 2009;33(5):1049–1052.
- Nickerson TP, Merchea A: Perioperative Considerations in Crohn Disease and Ulcerative Colitis. Clin Colon Rectal Surg 2016;29:80–84.
- Canedo J, Lee SH, Pinto R, Murad-Regadas S, Rosen L, Wexner SD. Surgical resection in Crohn’s disease: is immunosuppressive medication associated with higher postoperative infection rates? Colorectal Dis 2011;13(11):1294–1298.
- Kunitake H, Hodin R, Shellito PC, Sands BE, Korzenik J, Bordeianou L. Perioperative treatment with infliximab in patients with Crohn’s disease and ulcerative colitis is not associated with an increased rate of postoperative complications. J Gastrointest Surg 2008;12(10):1730–1736, discussion 1736–1737.
- Marchal L, D’Haens G, Van Assche G, et al. The risk of post- operative complications associated with infliximab therapy for Crohn’s disease: a controlled cohort study. Aliment Pharmacol Ther 2004;19(7):749–754.
- Nasir BS, Dozois EJ, Cima RR, et al. Perioperative anti-tumor necrosis factor therapy does not increase the rate of early postoperative complications in Crohn’s disease. J Gastrointest Surg 2010; 14(12):1859–1865, discussion 1865–1866.
- Waterman M, Xu W, Dinani A, et al. Preoperative biological therapy and short-term outcomes of abdominal surgery in patients with inflammatory bowel disease. Gut 2013;62(3): 387–394.
- Myrelid P, Marti-Gallostra M, Ashraf S, et al. Complications in surgery for Crohn’s disease after preoperative antitumour necrosis factor therapy. Br J Surg 2014;101(5):539–545.
- Chevalier Jm, Jones Dj, Reteller, y cols.: Colectomy and ileorectal anastomosis in patients with Crohn's dise- ase. Br J Surg 1994,81:1379-81.
- Neumann H, Neurath MF, Atreya R: Endoscopic Therapy in Inflammatory Bowel Diseases. Viszeralmedizin 2015;31:280–286.
- Chang GW, Wong JM, Tung ChCh, et al: Intestinal Stricture in Crohn’s Disease. Intest Res 2015;13(1):19-26.
- Bharadwaj S , Fleshner P, Shen: Therapeutic Armamentarium for Stricturing Crohn’s Disease: Medical Versus Endoscopic Versus Surgical Approaches. Inflamm Bowel Dis 2015;21:2194–2213.
- Hanauer SB, Feagan BG, Lichtenstein GR, et al: Maintenan43ce infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet. 2002 May 4;359(9317):1541-9.
- Loras C, Pérez-Roldan F, Gornals JB, et al: Endoscopic treatment with self-expanding metal stents for Crohn’s disease strictures. Aliment Pharmacol Ther 2012; 36: 833–839.
- Hassan C, Zullo A, De Francesco V, et al: Systematic review: Endoscopic dilatation in Crohn’s disease. Aliment Pharmacol Ther. 2007 Dec;26(11-12):1457-64.
- Morar PS, Faiz O, Warusavitarne J, et al: Systematic review with meta-analysis: endoscopic balloon dilatation for Crohn’s disease strictures. Aliment Pharmacol Ther 2015; 42: 1137–1148.
- Broering DC, Eisenberger CF, Koch A, et al. Strictureplasty for large bowel stenosis in Crohn’s disease: quality of life after surgical therapy. Int J Colorectal Dis 2001;16:81–7.
- Mayberry JF, Lobo A, Ford AC, et al: NICE clinical guideline (CG152): the management of Crohn’s disease in adults, children and young people. Aliment Pharmacol Ther 2013; 37: 195–203.
- Kane S: Urogenital Complications of Crohn’s Disease. Am J Gastroenterol 2006;101:S640–S643.
- Angelberger S, Fink KG, Schima W, et al: Complications in Crohn’s disease: right sided ureteric stenosis and hydronephrosis. Inflamm Bowel Dis 2007;13(8):1056-57.
- Ben Ami H, Genesin Y, Behar DM, et al: Diagnosis and treatment of urinary tract complication in Crohn’s disease: an experience over 15 years. Can J Gastroenterol 2002;16:225-229.
- Connelly TM, Messaris E: Predictors of recurrence of Crohn’s disease after ileocolectomy: A review. World J Gastroenterol 2014 October 21; 20(39): 14393-14406.
- Farmer Rg, Hawk Wa, Turnbull Rb Indications for surgery in Crohn’s disease. Gastroenterology 1976;71:245-50.
- Farmer Rg, Hawk Wa, Turmbull Rb: Clinical pat- terns in Crohn's disease: a statistical study of 615 cases. Gas- troenterol 1975; 68:627-35.
- Seifarth C, Kreis ME, Gröne J: Indications and Specific Surgical Techniques in Crohn’s Disease. Viszeralmedizin 2015;31:273–279.
- HULL TL: Surgical management of Crohn's disease. Core subjects 1999:15-22.
- Bakkevold KE. Construction of an ileocolic neosphincter—Nipple valve anastomosis for prevention of postoperative recurrence of Crohn’s disease in the neoterminal ileum after ileocecal or ileocolic resection: A long-term follow-up study. Journal of Crohn’s and Colitis. 2009;3(3):183–188.
- Bakkevold KE: Nipple valve anastomosis for preventing recurrence of Crohn disease in the neoterminal ileum after ileocolic resection. A prospective pilot study. Scand J Gastroenterol. 2000 Mar;35(3):293-9.
- Smedh K, Olaison G, Sjödahl R: Ileocolic nipple valve anastomosis for preventing recurrence of surgically treated Crohn’s disease. Long-term follow-up of six patients.Dis Colon Rectum. 1990 Nov;33(11):987-90.
- Li Y, Stocchi L, Shen B, et al: Salvage surgery after failure of endoscopic balloon dilatation versus surgery first for ileocolonic anastomotic stricture due to recurrent Crohn’s disease. Br J Surg. 2015 Oct;102(11):1418-25; discussion 1425.
- Branche J, Attar G Vernier-Mas- souille, Bulois P, et al: Extractible self-expandable metal stent in the treat- ment of Crohn’s disease anastomotic strictures. Endoscopy 2012; 44: E325–E326.
- Tabibian JH, Moradkhani A, Topazian MD: Colorectal cancer surveillance in primary sclerosing cholangitis and inflammatory bowel disease. Annals of hepatology, 2015; 14 (4): 564-566.
- Collins PD: Strategies for Detecting Colon Cancer and Dysplasia in Patients with Inflammatory Bowel Disease. nflamm Bowel Dis 2013;19:860–863.
- Connelly TM, Koltun WA: The surgical treatment of inflammatory bowel disease‐associated dysplasia. Expert Rev. Gastroenterol. Hepatol. 7(4), 307–322 (2013).
- AGA Technical Review on the Diagnosis and Management of Colorectal Neoplasia in Inflammatory Bowel Disease. Gastroenterology 2010;138:746–774.
- Sebastian S, Hernández V, Pär Myrelid P, et al: Colorectal cancer in inflammatory bowel disease: Results of the 3rd ECCO pathogenesis scientific workshop (I). Journal of Crohn’s and Colitis (2014) 8, 5–18.
- Mattar MC, Lough D, Pishvaian MJ, et al: Current Management of Inflammatory Bowel Disease and Colorectal Cancer. Gastrointest Cancer Res2011; 4:53–61.
- Althumairi AA, Lazarev MG, Gearhart SL: Inflammatory bowel disease associated neoplasia: A surgeon’s perspective. World J Gastroenterol 2016 January 21; 22(3): 961-973.
- Gaidos JKJ, Bickston SJ: How to Optimize Colon Cancer Surveillance in Inflammatory Bowel Disease Patients. Inflamm Bowel Dis 2016;22:1219–1230.
- Canavan C, Abrams KR, Mayberry J. Meta-analysis: colorectal and small bowel cancer risk in patients with Crohn’s disease. Aliment Pharmacol Ther. 2006;23:1097–1104.
- Andersen NN, Jess T: Has the risk of colorectal cancer in inflammatory bowel disease decreased?. World J Gastroenterol 2013 November 21; 19(43): 7561-7568.
- Jess T, Jsimonsen J, Jørgensen Kt, Et al: Decreasing Risk of Colorectal Cancer in Patients
- Jess T, Gamborg M, Matzen P, et al. Increased risk of intestinal cancer in Crohn’s disease: a meta-analysis of population-based cohort studies. Am J Gastroenterol 2005;100:2724 –2729.
- Martin ST, Vogel JD: Restorative Procedures in Colonic Crohn Disease. Clin Colon Rectal Surg 2013;26:100–105.
- Marcello Pw: Large bowel Crohn's disease. Clinics in colon and rectal surgery 2001;14(2):159-165.
- Corman ML, Veidenheimer MC, Coller JA, Ross VH. Perineal wound healing after proctectomy for inflammatory bowel disease. Dis Colon Rectum 1978;21:155–159.
- Yamamoto T, Bain I, Allan RN, Keighley MRB. Persistent perineal sinus after proctocolectomy for Crohn’s disease. Dis Colon Rectum 1999;42:96–101.
- Keighley MR, Allan RN. Current status and influence of operation on perianal Crohn’s disease. Int J Colorectal Dis 1986;1:104–107.
- De Dombal FT, Burton I, Goligher JC. The early and late results of surgical treatment for Crohn’s disease. Br J Surg 1971;58:805–815.
- Ritchie JK. Ileostomy and excisional surgery for chronic inflammatory disease of the colon: a survey of one hospital region. Gut 1971;12:528–540.
- Irvin TT, Goligher JC. A controlled clinical trial of three different methods of perineal wound management following excision of the rectum. Br J Surg 1975;62:287–297.
- Genua JC, Vivas DA: Management of Nonhealing Perineal Wounds. Clin Colon Rectal Surg 2007;20:322–328.
- Neumann PA, Rijcken E, et al: Minimally invasive surgery for inflammatory bowel disease: Review of current developments and future perspectives. World J Gastrointest Pharmacol Ther 2016 May 6; 7(2): 217-226.
- Carr Rd, Beynon J, Maw A, y cols.: How to avoid a perieneal sinus after proctectomy for Crohn's disease: immediate pelviperienal reconstruction. Colorectal disease 2001;3(2):42-46.
- Schaffzin DM, Douglas JM, Stahl TJ , et al: Vacuum-Assisted Closure of Complex Perineal Wounds. Dis Colon Rectum 2004; 47: 1745–1748.
- Cresti S, Ouaïssi M, Igor SielezneffI, et al: Advantage of vacuum assisted closure on healing of wound associated with omentoplasty after abdominoperineal excision: a case report. World Journal of Surgical Oncology 2008, 6:136.
- van Overstraeten AdB, Wolthuis AM, Vermeire S: Intersphincteric proctectomy with end-colostomy for anorectal Crohn’s disease results in early and severe proximal colonic recurrence. Journal of Crohn’s and Colitis (2013) 7, e227–e231.
- Goligher Jc: Surgical treatament of Crohn's disease af- fecting mainly or enterely the large bowel. World J Surg 1988;12:186-190.
- Scammel Be,Andrews H, Allan Rn y colab.: Results of proctocolectomy for Crohn's disease. Br J Surg 1987;74:671-4.
- Yamamoto T, Allan Rn, Keighley Mrb: Audit of single stage proctocolectomy for Crohn's disease: postoperatrive complications and recurrence. Dis Colon Rectum 2000;43:249-256.
- Marcello Pw, Schoetz Dj, Roberts Pl: Evolutionary changes in the pathologic diagnosis following the ileoanal pouch procedure. Dis Colon Rectum 1997;40:40:653-657.
- Martinez Ramos D, Gilbert Gerez J, Escrig Sos J, et al: Ileal pouch anal anastomosis for Crohn’s disease. Current status. Cir Esp 2009;85(2):3-13.
- Phillips RKS: Ileal pouch anastomosis for Crohn’s disease. Gut 1998;43:303-308
- Sagar PM, Dozois RR, Wolff BG. Long-term results of ileal pouch-anal anastomosis in patients with Crohn’s disease. Dis Colon Rectum 1996;39:893–898.
- Mylonakis E, Allan RN, Keighley MR. How does pouch construction for a final diagnosis of Crohn’s disease compare with ileoproctostomy for established Crohn’s proctocolitis? Dis Colon Rectum 2001;44:1137–1142.
- Braveman JM, Schoetz DJ Jr, Marcello PW, et al. The fate of the ileal pouch in patients developing Crohn’s disease. Dis Colon Rectum 2004;47:1613–1619.
- Hartley JE, Fazio VW, Remzi FH, et al. Analysis of the out- come of ileal pouch-anal anastomosis in patients with Crohn’s disease. Dis Colon Rectum 2004;47:1808–1815.
- Wagner - Bartak NA, Levine MS, Rubesin SE, et al: Crohn’s disease in the ileal pouch after total colectomy for ulcerative colitis: findings on pouch enema in six patients. AJR 2005;184:1843-1847.
- Tremaine WJ: Crohn’s disease of the ileal pouch 16 years after proctocolectomy for ulcerative colitis. Clinica Gastroenterology and hematology 2011;9:198-201.
- Shen B: Diagnosis and management of postoperative ileal pouch disorders. Clin Colon Rectal Surg 2010;23:259-268.
- Panis Y, Poupard B, Nemeth J, Lavergne A, Hautefeuille P, Valleur P. Ileal pouch/anal anastomosis for Crohn’s disease. Lancet 1996;347 (9005):854–857.
- Regimbeau JM, Panis Y, Pocard M, et al. Long-term results of ileal pouch-anal anastomosis for colorectal Crohn’s disease. Dis Colon Rectum 2001;44:769–778.
- Melton GB, Fazio VW, Kriran RP, et al: Long term outcome with ileal pouch-anal anastomosis in patients with Crohn’s disease: pouch retention and implications of delayed diagnosis. Ann Surg 2008;248:608-616.
- Le Q, Melmed G, Dubinsky M, et al: Surgical Outcome of Ileal Pouch—Anal Anastomosis When Used Intentionally for Well-Defined Crohn’s Disease. Inflamm Bowel Dis. 2013 January ;19(1): 30–36.
- Jackson KL, Stocchi L, Duraes L, et al: Long-Term Outcomes in Indeterminate Colitis Patients Undergoing Ileal Pouch-Anal Anastomosis: Function, Quality of Life, and Complications. J Gastrointest Surg (2017) 21:56–61.
- Cooper Jc, Jones D, Willlians Ns: Outcome of colectomy and ileorectal nastomosis in Crohn's disease. Ann R Coll Surg Engl 1986;68:279-282.
- Pastore RL, Wolff BG, Hodge D. Total abdominal colectomy and ileorectal anastomosis for inflammatory bowel disease. Dis Colon Rectum 1997;40(12):1455–1464.
- Ambrose Ns, Keighley Mrb, Alexander Wi- Llians J y cols.: Clinical impact of colectomy and ileorectal anastomosis in the management of Crohn's disease. Gut 1984;25:223-227.
- Frileux P, Bordy G, Attal E: The defuntioned rectum in Crohn's disease: retain or remove? Colorectal Disease 2001;3(2):29-32.
- Cattan P, Bonhomme N, Panis Y, et al. Fate of the rectum in patients undergoing total colectomy for Crohn’s disease. Br J Surg 2002; 89(4):454–459.
- Lee JL, MD, Yu ChS, Lim SB, et al: Surgical Treatment of Crohn Colitis Involving More Than 2 Colonic Segments Long-Term Outcomes From a Single Institution. Medicine 95(22):e3793.
- Kotze PG, Abou-Rejaile VR, Folchini de Barcelos I, et al: Complications after intestinal resection in Crohn’s disease: laparoscopic versus conventional approach. J COLOPROCTOL. 2013;33(3):139–144.
- Borycka-Kiciak K, Dib N, Janaszek L, Et Al: Laparoscopically Assisted Ileo-Colonic Resection In Patients With Crohn’s Disease – Preliminary Report. Polskiprzegląd Chirurgiczny 2013, 85(9):505–510.
- Spinelli A, Sacchi M, Bazzi P, et al: Laparoscopic Surgery for Recurrent Crohn’s Disease. Gastroenterology Research and Practice Volume 2012, Article ID 381017, 6 pages doi:10.1155/2012/381017.
- Gardenbroek TJ, Eshuis EJ, van Acker GJ, Tanis PJ, Bemelman WA. Alternative specimen extraction techniques after laparoscopic emergency colectomy in inflammatory bowel disease. Surg Endosc 2012; 26: 408-412 [PMID: 21909858 DOI: 10.1007/ s00464-011-1888-6].
- Eshuis EJ, Voermans RP, Stokkers PC, van Berge Henegouwen MI, Fockens P, Bemelman WA. Laparoscopic resection with transcolonic specimen extraction for ileocaecal Crohn’s disease. Br J Surg 2010; 97: 569-574 [PMID: 20155789 DOI: 10.1002/bjs.6932].
- Larson DW, Dozois E, Sandborn WJ, Cima R. Total laparoscopic proctocolectomy with Brooke ileostomy: a novel incisionless surgical treatment for patients with ulcerative colitis. Surg Endosc 2005; 19: 1284-1287 [PMID: 16132322 DOI: 10.1007/s00464-004- 8245-y].
- Wexner SD. Restorative proctectomy with colon pouch-anal anastomosis by laparoscopic transanal pull-through: an available option for low rectal cancer? Surg Endosc 2007; 21: 1679 [PMID: 17593441 DOI: 10.1007/s00464-007-9438-y].
- Liyanage C, Ramwell A, Harris GJ, Levy BF, Simson JN. Transanal endoscopic microsurgery: a new technique for completion proctectomy. Colorectal Dis 2013; 15: e542-e54.