CAPÍTULO 4
Enfermedad de Crohn de intestino delgado
La enfermedad de Crohn afecta al intestino delgado en forma aislada en alrededor del 30-35%1-3 de los casos, ascendiendo a un 60% cuando se combina con otras ubicaciones,1,3 siendo la localización más frecuente la región ileocecal,4 en nuestro caso solo el 9% de los pacientes presentan esta ubicación. Un alto porcentaje de los pacientes requerirá una cirugía dentro de los 10 años (80%)4,5 solo con intenciones paliativas, de los cuales alrededor de un 12% la necesitaran dentro del primer año de diagnóstico. A esto se asocia una alta tendencia a la recidiva que a diferencia de lo que puede suceder en el colon donde resecciones amplias no traen grandes complicaciones, aquí este hecho podrá alterar la capacidad absortiva, llevando en algunos casos a un síndrome de intestino corto.
Los síntomas dependerán de la forma predominante, pudiendo presentarse con diarrea, suboclusión u oclusión intestinal, colecciones intraabdominales, fístulas internas o externas, cuadros de abdomen agudo inflamatorio y o síndrome anémico.
El estudio del intestino delgado fue un gran problema hasta hace algunos años ya que las endoscopias altas y bajas dejaban la zona media sin estudiar. Con el advenimiento de la entereroscopia doble balón, la endocapsula, la ecografía,6 enterotomografía y la enterorresonancia han permitido realizar un mejor diagnóstico de esta zona, pudiendo además la enteroscopia ser terapéutica.7-9 El transito de intestino delgado continua siendo de gran utilidad en el estudio de estos pacientes (foto 7).
Entre los hallazgos que caracterizan a la enfermedad de Crohn activa en las imágenes de tomografía podemos encontrar: el engrosamiento de la pared intestinal, la estratificación mural (por edema intramural observable en la enfermedad activa), el signo del peine causado por los vasa recta ingurgitados (signo específico de enfermedad clínicamente avanzada, activa y extensa) y la grasa perientérica de mayor densidad. Los cambios crónicos se asocian a estenosis fibróticas y depósitos de grasa submucosa en la pared intestinal (foto 8-11).
Las características de inflamación intestinal activa que se pueden observar en las resonancias magnéticas incluyen el engrosamiento de la pared intestinal, hiperintensidad de la pared en las imágenes en T2 e hiperrefuerzo en las imágenes con contraste T1. Las características mesentéricas incluyen linfadenopatía, vasa recta congestionada o signo de peine, infiltración fibrótica, fístulas y abscesos. La resonancia podría diferenciar entre la inflamación activa y la fibrosis crónica dentro de los segmentos involucrados. Los hallazgos asociados con la fibrosis mural crónica incluyen la hipotensidad T2 de la pared intestinal y la ausencia de realce en la pared intestinal.3 El contraste con gadolinio produce un refuerzo de la pared intestinal considerado por algunos autores el único criterio de la resonancia de actividad de la enfermedad ya que refleja la vascularización de la pared y la permeabilidad de los vasos, que aumenta en la inflamación activa.8
Las indicaciones quirúrgicas son las mismas que en la forma colónica: hemorragia (la angiografía o angiotomografía preoperatoria puede ser diagnóstica y terapéutica), oclusión intestinal, fístulas sintomáticas, perforación, abscesos, duda de malignidad, fallo del tratamiento médico, córtico dependencia y retardo del crecimiento en niños, y al igual que en las demás localizaciones es de elección optimizar al paciente antes de la intervención.10
4.1 INDICACIONES QUIRÚRGICAS
4.1.1 Forma penetrante
Estos pacientes se presentan con abscesos, fístulas y raramente perforación libre. Aproximadamente entre el 10% y el 30%11,12 de los pacientes con enfermedad de Crohn, desarrollarán espontáneamente un absceso abdominal o pélvico durante el curso de su enfermedad, los cuales se producen como resultado de la inflamación transmural y la micro perforación del intestino afectado. En la gran mayoría de los casos los segmentos mas frecuentemente involucrados son el íleon terminal y región ileocecal.12
Es de elección, el drenaje percutáneo de los mismos asociado a tratamiento antibiótico siempre que exista una ventana que permita su acceso en forma segura. Luego de mejorar el estado general y séptico del paciente. la mayoría de los autores sugieren la resección quirúrgica del segmento afectado debido a que el intestino enfermo resulta en una fístula persistente y un absceso recurrente4,12 aunque otros autores13,14 sugieren que puede ser el tratamiento definitivo; entre ellos Clancy y cols.15 quienes encuentran en un metaanálisis de 6 estudios que incluyó 333 pacientes que el drenaje percutáneo como tratamiento evito la cirugía en un 30% de los casos.
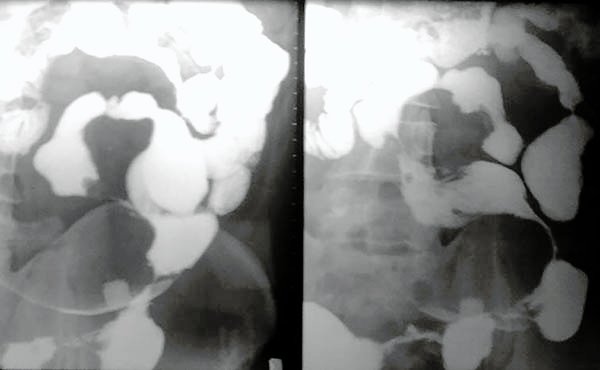
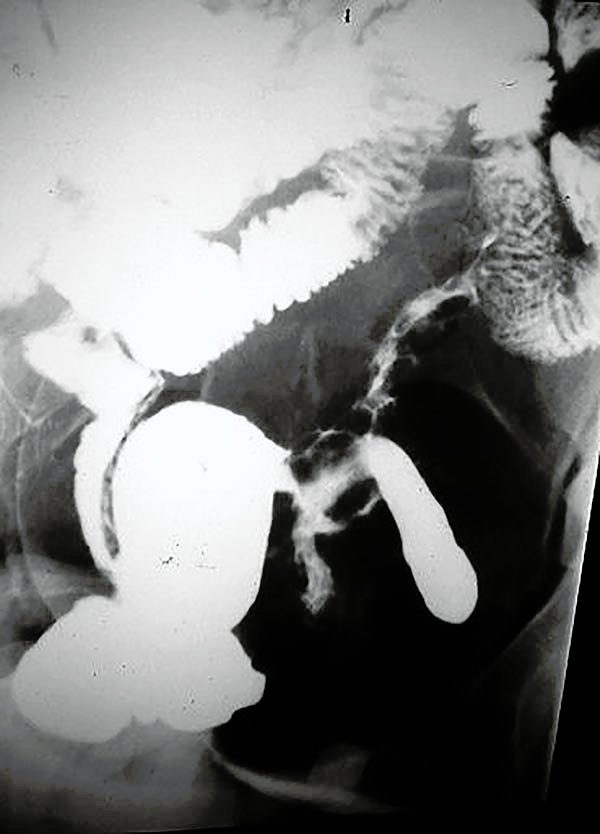
Foto 7: transito delgado con múltiples estenosis.
Foto 8: Tránsito de intestino delgado con estenosis larga.
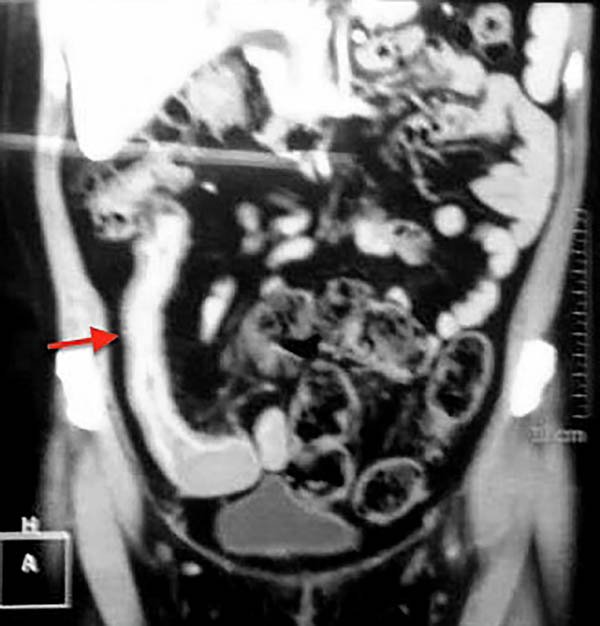
Foto 9: Enterotomografía que muestra estenosis larga de delgado.
Foto 10: Vista lateral de la misma estenosis larga de delgado por enterotomografía.
Foto 11:Vista coronal de enterotomografía que muestra el engrosamiento parietal en el sitio de la estenosis.
He y cols.16 en un metaanálisis que incluyo 9 estudios (513 pacientes) con abscesos intraabdominales espontáneos relacionados con EC encontraron que la tasa global de complicaciones fue significativamente mayor en los pacientes sometidos a cirugía inicial en comparación con aquellos sometidos a drenaje percutáneo inicial (OR) = 0,58; Intervalo de confianza del 95% (IC), 0,35-0,96; P = 0,03]. En el análisis de subgrupos, el drenaje percutáneo se asoció con una reducción significativa en la complicación global (OR = 0,44, IC del 95%, 0,23-0,83, P = 0,01) en comparación con la cirugía inicial y el riesgo de abscesos recurrentes fue mayor en los pacientes sometidos solo al drenaje percutáneo.
Las fístulas en la enfermedad de Crohn pueden ser externas (entero cutáneas) o internas (con otros órganos), estas últimas se pueden establecer entre el intestino delgado y la vejiga, la vagina, estomago, duodeno, el colon y otras asas de delgado17,18 (foto 12). En caso de ser asintomáticas, especialmente en ausencia de diarrea, cuadros malabsortivos o infecciones a repetición la cirugía puede no ser necesaria.
Las fístulas enteroentéricas se observan en 1/3 de los pacientes, siendo generalmente asintomáticas, por lo tanto no suelen ser de indicación quirúrgica por si mismas: en caso de ser sintomáticas la resección es la regla.19
Las fístulas enterovesicales afectan al 2-8% de los pacientes,17 pueden originarse por la inflamación transmural del intestino delgado o ser secundaria a una complicación postoperatoria. Los pacientes suelen presentar neumaturia, disuria e infecciones urinarias a repetición. La conducta quirúrgica adecuada es la resección del segmento intestinal enfermo y el cierre del orificio vesical.20
Las fístulas enterovaginales se dan principalmente en pacientes que han sido histerectomizadas. El segmento de intestino delgado mas frecuentemente afectado es el íleoníleon terminal.
Las fístulas enterocutáneas en su gran mayoría son postoperatorias20 debidas a lesiones inadvertidas o dehiscencias de suturas. El 3017 - 75%20 se cierran con tratamiento conservador, con reposo digestivo y nutrición parenteral, el cual incluye ostomías desfuncionalizantes en algunas ocasiones. En caso de no cerrar la resección del segmento fistulizado debe realizarse.
Las fístulas primarias se deben a enfermedad del intestino delgado y excepto que exista riesgo de síndrome de intestino corto o graves comorbilidades la resección quirúrgica es la regla. Si bien los trabajos ACCENT I21 y ACCENT II22 informan que utilizaron eficazmente infliximab para el tratamiento de la enfermedad de Crohn penetrante, estos no realizaron un análisis particular de los pacientes con fístulas de intestino delgado por lo cual los resultados no pueden ser concluyentes.
La perforación libre intestinal, es una indicación quirúrgica de urgencia, en estos casos esta indicado la resección del segmento perforado con o sin anastomosis primaria, dependiendo del estado general del paciente. En pacientes con inestabilidad hemodinámica severa el abocamiento de la perforación puede ser una opción.
4.1.2 Obstrucción intestinal
La obstrucción intestinal es la indicación más común de cirugía en pacientes con esta localización, pudiendo responder el cuadro obstructivo a la presencia de enfermedad luminal activa, estenosis fibrosas, compresión extramural por el flemón inflamatorio, adherencias postoperatorias y/o malignidad.12,23 La prevalencia de estenosis de intestino delgado es del 20-40%.24,25
Antes de indicar un tratamiento quirúrgico se deben determinar, de ser posible, las causas a través de los estudios por imágenes, estando contraindicada la utilización de endocápsula si se sospecha estenosis por el riesgo de que quede retenida. Entre estos la enterotomografía presenta una sensibilidad para diagnosticar estenosis del intestino delgado de 85-93% y especificidad del 100%,26-30 mientras que la enterorresonancia por su parte tiene la ventaja de no utilizar radiación ionizante, pero se asocia a un mayor costo; esta última tiene una alta precisión diagnóstica para la enfermedad de Crohn (sensibilidad 78% y especificidad 85%), para estenosis la sensibilidad oscila entre el 75% y el 100%, con una especificidad del 91 al 100%.7,26,17
Mucho se discute sobre la terapéutica de las estructuras cortas y bien localizadas, en las cuales el tratamiento quirúrgico tiene excelentes resultados, por lo cual algunos autores sugieren no dejar a la cirugía como última opción.31
Foto 12: Tránsito de intestino delgado que muestra fístula entero cólica.
Si la disminución de calibre se debe a enfermedad luminal activa, el tratamiento médico suele asociarse a respuestas favorables, mientras que en la forma fibroestenosante, donde las estructuras se han consolidado la conducta es quirurgica aunque se ha descripto el manejo endoscópico de las mismas (dilatación con balón); no existe aun evidencia clara sobre el uso de inyecciones intra lesionales post dilatación.
La dilatación endoscópica parece ser una técnica segura con tasas de éxito de 75 al 95%, cuando se utiliza como definición de éxito lograr el paso del endoscopio32 y del 47 al 80% cuando el éxito es lograr evitar la cirugía.1,25,32-35 En una revisión sistemática de Arulanandan y cols.,1 sobre 1812 pacientes con enfermedad de Crohn de los cuales solo el 4% presentaba estenosis de intestino delgado, encontraron que el 70% del total de los pacientes sometidos a dilatación evitaron la cirugía, pero destacan la necesidad de que no exista inflamación activa.
Las principales aplicaciones de la dilatación son las estenosis cortas (menores de 4 cm) y aisladas al alcance de un colonoscopio, como las secundarias a estenosis de las anastomosis ileocólicas.5,11,25,33,35
Contrariamente cuando una estenosis se asocia a una fístula interna, obstrucción del intestino delgado, dilatación intestinal > 3 cm o flemón inflamatorio o absceso, la dilatación esta contraindicada y se consideran estenosis de alto riesgo, que usualmente requieren cirugía.
Hassan y cols.33 realizaron una revisión de 13 estudios en los que se efectuaron 353 dilataciones en 347 pacientes, siendo la indicación mas frecuente las estenosis localizadas a nivel de la anastomosis ileocólica (66%), el resto se ubicaron 7% en íleon neoterminal, 6% a nivel de la válvula íleocecal y 4% en el íleon. La dilatación endoscópica tuvo éxito en evitar la cirugía hasta el final del seguimiento en 112 (67%) pacientes con una o mas dilataciones, concluyendo los autores que apoyan firmemente su uso para tratar las estenosis pareciéndoles inaceptable no ofrecerla como alternativa a la cirugía. Aunque en este estudio se evaluaron todas las estenosis en general y no en particular por localización. Endo y cols.,25 en el año 2013, presenta resultados similares a largo plazo.
Cuando las dilataciones endoscópicas han fallado o no tienen indicación, una conducta quirúrgica debe ser tomada ya sea a través de resecciones intestinales (fotos 13 y 14) o estricturoplastias. Estas últimas surgen como resultado de que los cirujanos se volvieran mas conservadores, siguiendo las pautas que fueran descripta al inicio del capítulo de tratamiento quirúrgico y que Fazio y cols.36 ( bien subrayaran en el año 1989):
- tratar la complicación específica,
- hacer la operación lo más segura posible,
- realizar el número mínimo de anastomosis, conservar el intestino y evitar la resección intestinal innecesaria,
- no realizar anastomosis cuando se presenta una sepsis grave, y
- no dejar segmentos intestinales estenosados.
Fueron utilizadas por primera vez en estenosis ileales secundarias a enfermedad de Crohn ileal por Lee y Papaioannu2,31,36,37,38 y posteriormente por Alexander-Williams y Haynes39 como un enfoque conservador.31,36,38 Se ha descripto que esta técnica es segura con un morbilidad global entre el 12 y el 18%, siendo las complicaciones más frecuentes los abscesos, fístulas y dehiscencias. Entre sus indicaciones encontramos el compromiso yeyuno ileal difuso con estenosis cortas (< 20-25 cm) únicas o múltiples, pacientes con riesgo de síndrome de intestino corto por resecciones anteriores, estenosis de anastomosis ileocólicas y reestenosis de estricturoplastias.2 Debemos recordar que al utilizar esta técnica el segmento enfermo no se reseca por lo cual se deben tomar biopsias para descartar una neoplasia de intestino delgado (Tabla 9).
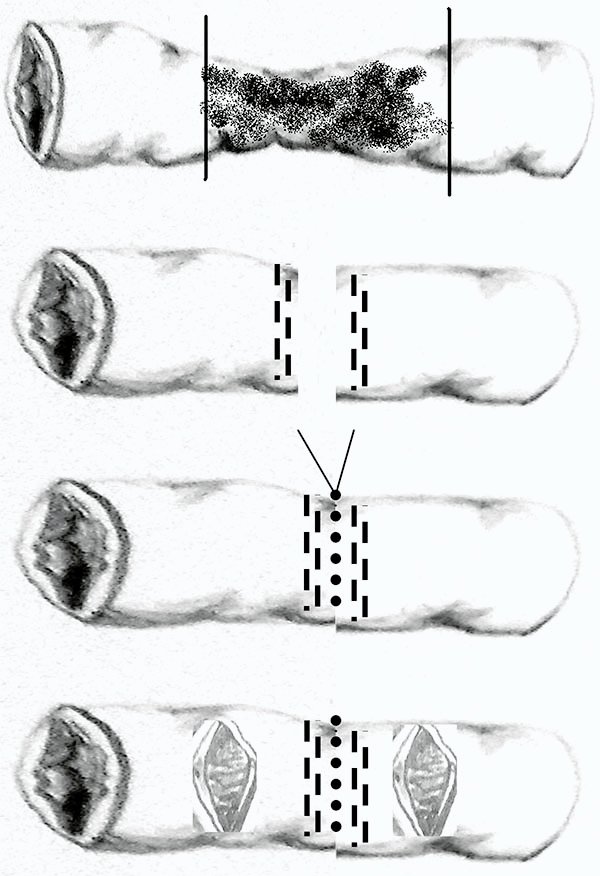
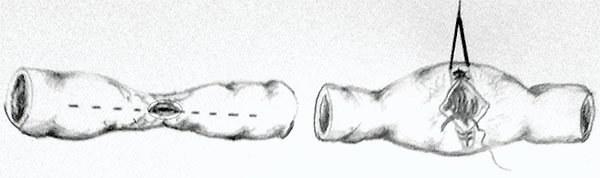
Las técnicas de estricturoplastias más utilizadas son las descritas por Heinecke-Mikulicz para el tratamiento de estenosis de menos de 10 cm de longitud, y la técnica de Finney que se utiliza para estenosis de hasta 20 cm de largo. En el procedimiento de Mickulicz se realiza una incisión longitudinal antimesentérica lineal que luego se cierra transversalmente (foto 15). En el de Finney el intestino se pliega primero en una U, luego se realiza una incisión lineal longitudinal en cada asa y se cierra con una anastomosis latero lateral manual o mecánica40-44 (foto 16).
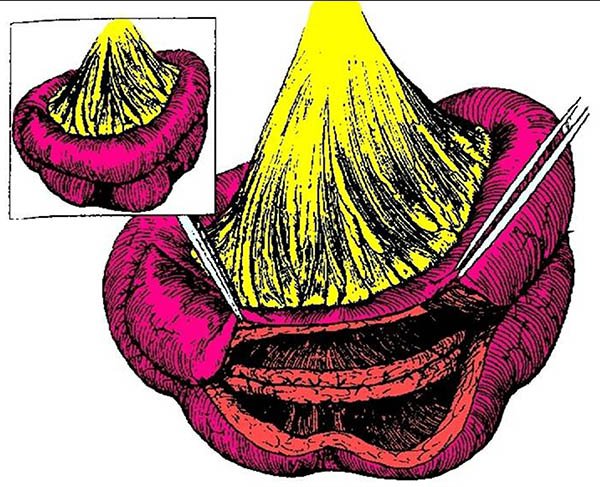
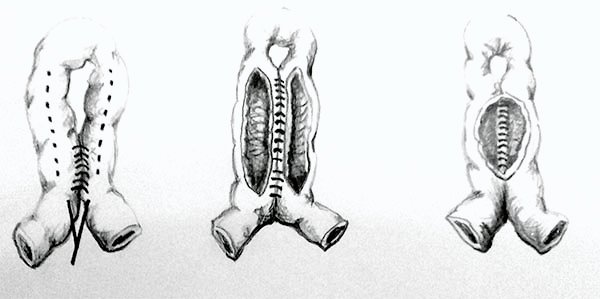
Para aquellas más largas (mayor de 30 cm)38 Michelassi ha descripto una estricturoplastia que lleva su nombre, esta se utiliza principalmente para estricturas recurrentes y en pacientes con lesiones largas y cortas alternas, o en aquellos en los cuales una nueva resección pueda resultar en un intestino corto (dibujo 1). En esta técnica el segmento enfermo se anastomosa en forma laterolateral a un segmento no afectado. En primer lugar se secciona el mesenterio correspondiente al asa de intestino delgado enfermo y luego se secciona el asa entre clamps atraumáticos. Luego se moviliza el asa proximal sobre el distal lado a lado, asegurando que las zonas estenóticas de un asa queden adyacentes al área dilatada de la otra. Las dos asas luego son suturadas en dos planos en forma laterolateral, teniendo especial cuidado en no dejar asas ciegas en los extremos.
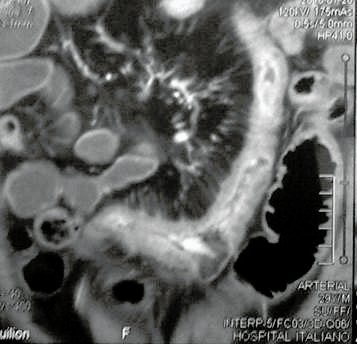
Foto 13: Estudio por imágenes que muestra estensosis larga de intestino delgado por enfermedad de Crohn.
Foto 14: Pieza de resección por estenosis larga de intestino delgado.
Foto 15: Esquema y fotos de estricturoplastia a lo Heinecke Mickulicz. Apertura longitudinal y cierre transversal a nivel del sitio de la estenosis.
Michelassi refuerza que esta no es una anastomosis latero lateral común, sino que se debe tomar en cuenta los siguientes detalles técnicos:
- al realizar la transección del intestino y el mesenterio, se debe seleccionar un punto de modo que el deslizamiento subsiguiente de las asas intestinales facilite que las áreas estenóticas opuestas en un asa concuerden con áreas dilatadas en la adyacente (de no hacerlo la anastomosis resultante podrá tener una conformación en reloj de arena o en cuentas de rosario, por la presencia de uno o múltiples puntos estrechos),
- evitar el uso de suturas mecánicas porque no pueden compensar el espesor diferente de la pared intestinal,
- el corte en V de los extremos crea una estrituroplastia sin asas ciegas en los extremos (se realiza un corte en pico de pato en ambas asas y los extremos intestinales quedan suturados para evitando asas ciegas).
La resección como se ha descripto en el capítulo de enfermedad de Crohn colorrectal continua siendo la primera elección en la forma ileocecal localizada.11,31
|
INDICACIONES - múltiples estenosis en distintos segmentos alejados (compromiso difuso yeyunoileal) - resecciones intestinales previas - pacientes con intestino corto - estenosis sin fístulas ni flemones - estenosis de anastomosis ileocolicas |
|
CONTRAINDICACIONES - desnutrición - perforación intestinal - múltiples estenosis en un segmento corto |
Tabla 9: Indicaciones y contraindicaciones de las estricturoplastias
En un esfuerzo por disminuir las recidivas en las anastomosis post resección de intestino delgado o ileocecales, Kono y cols.45,46 describieron la anastomosis Kono S, la cual consiste en la resección del segmento afectado y la realización de una anastomosis manual termino-terminal. El intestino delgado enfermo es identificado, movilizado y seccionado con una sutura mecánica líneal. Luego se suturan los dos extremos con las líneas de grapas con puntos separados para formar una columna de soporte que impida la distorsión de la anastomosis en caso de recurrencia, luego se realiza una enterotomía longitudinal antimesentérica en ambas asas, a no más de 1 cm de distancia del cierre con la sutura mecánica, y se realiza la anastomosis entre ambas asas transversalmente en dos planos, creando una boca amplia de 7-8 cm (dibujo 2). Los primeros resultados publicados por Katsuno y cols. fueron promisorios, 30 pacientes fueron sometidos a este procedimiento con un seguimiento promedio de 35 meses, encontrando recurrencia endoscópica en 69,2% de los casos pero 0 recurrencia quirúrgica. Posteriormente, el mismo autor publica,, en el año 2016, una sobrevida libre de recurrencia quirúrgica a 5 y 10 años del 98,6%.47
Foto 16: Esquema y fotos de estricturoplastia a lo Finney.
Dibujo 1: Estricturoplastia de Michelassi adaptado.
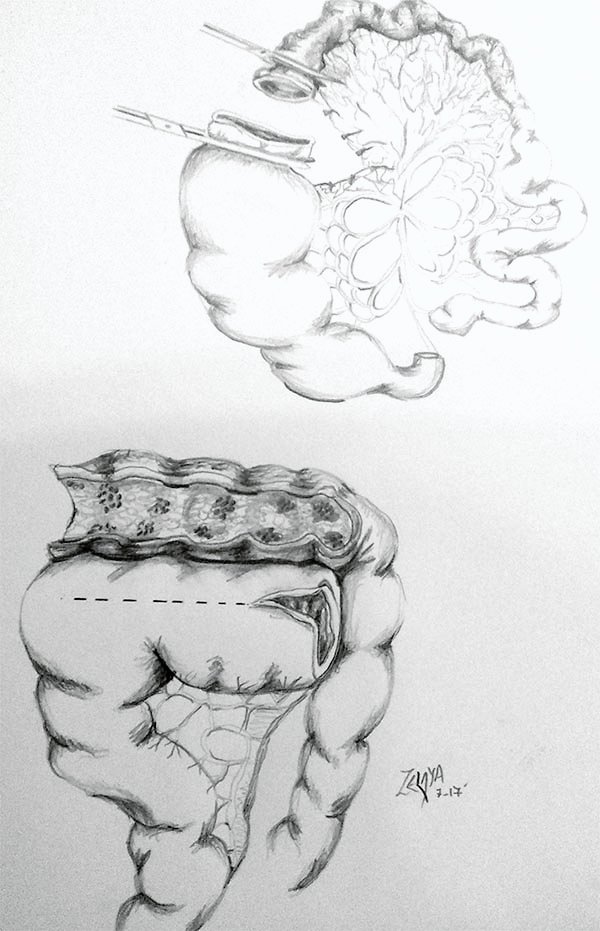
Es importante destacar que más allá de la elección de una técnica resectiva o de una estricturoplastia, todo el delgado debe ser evaluado intraoperatoriamente, aunque los nuevos métodos por imágenes nos dan una buena aproximación a la realidad de cuales son los segmentos estenosados. Se debe palpar todo el delgado para en busca de engrosamiento parietal y disminución de la luz; entre los métodos que se pueden utilizar para evaluar la presencia de estenosis que son mas difíciles de visualizar, encontramos el uso de un balón de Fogarty insuflado a 2 cm de diámetro, sondas Foley,2,40 utilización de una bola de acero de 20 mm de diámetro,48-50 los cuales deben ser introducidos a través de la incisión de la estricturoplastia o por los extremos de la resección, haciendo progresar hacia distal y proximal de manera tal que en aquellos lugares donde no progrese se realizara otra estricturoplastia (foto 17).
Dibujo 2: Kono S anastomosis (adaptado).
Dibujo 3: Estricturoplastia de Judd.
Dibujo 4: Estricturoplastia de Moskel y cols.
Dibujo 5: Estricturoplastia de Jaboulay.

Foto 17: Evaluación del intestino delgado en busca de estenosis con sonda de Foley.
Las estricturoplastias descriptas en los párrafos precedentes son las que se utilizan mas frecuentemente en la actualidad, existen otras técnicas para estenosis cortas (< 10 cm) tales como Judd (utilizada para pacientes con estenosis corta asociada a un orificio fistuloso) (dibujo 3) y Moskel Walske Neumayer (en lugar de una incisión lineal longitudinal, se realiza una incisión en forma de Y que se cierra transversalmente aumentando el calibre) (dibujo 4); para estenosis medianas (10 - 25 cm) tales como Jaboulay (variante de la estricturoplastia a lo Finney, en la cual la anastomosis se realiza sobre asa relativamente sana que no incluye el sitio de la estenosis)(dibujo 5) .
|
|
|
n* |
tipo de estricturoplastias |
complicaciones % |
recurrencia % |
seguimiento promedio (meses) |
|
Fazio |
1989 |
225 |
199 HM 26 Finney |
16 |
|
|
|
Fazio |
1993 |
452 |
405 HM 47 Finney |
23 |
24% |
36 |
|
Serra |
1995 |
154 |
145 HM 9 Finney |
19 |
40 |
54 |
|
Stebbling |
1996 |
241 |
|
4 |
36 |
49.5 |
|
Ozuner |
1996 |
698 |
617 HM 81 Finney |
|
28 |
42 |
|
Hurst |
1998 |
109 |
90 HM 6 Finney 13 LL isoperistaltica |
12 |
22 |
38 |
|
Yamamoto |
1999 |
285 |
236 HM 49 Finney |
18 |
54 |
90 |
|
Tonelli |
2000 |
174 |
156 HM 16 Finney 2 Jaboulay |
7 |
44 |
50 |
|
Michelassi |
2000 |
21 |
21 Michelassi |
4,7 tempranas |
- |
48 |
|
Dietz |
2001 |
1124 |
|
18 |
37 |
90 |
|
Futami |
2005 |
293 |
235 HM 22 Finney 35 Jaboulay 1 LL isoperistaltica |
10 |
43.7 |
80 |
|
Fearnhead |
2006 |
479 |
|
23 |
- |
85 |
|
Rotholtz |
2006 |
93 |
85 HM 8 Finney |
11,7% tempranas 3,9% tardias |
21,4% |
3,6 años |
|
Fazio |
2016 |
91 |
91 LL isoperistaltica |
|
44,58 |
55,46 |
*n: número de estricturoplastias. HM: Heinecke Mikulicz. LL: latero lateral. Pablo Adelino Narbona, Manuel Ignacio Olmos, Ignacio Vazquez, Nicolás Ignacio Carranza, Rafael Martínez Gallino, Guillermo José Allende
Tabla 10: Estricturoplastias: complicaciones y recurrencia
Para los segmentos largos mayores de 25 cm también existen otras variantes técnicas:
Dentro de las variaciones de la de Michelassi encontramos la estricturoplastia de Poggioli,51 se realiza una anastomosis laterolateral entre zona enferma y sana, seccionando el intestino al inicio del segmento estenótico y luego suturando el segmento enfermo con el sano lo, cual permitiría evitar la estenosis de los extremos que Poggioli y cols. observaron en la estricturoplastia de Michelassi) (dibujo 6), la variante de la estricturoplastia laterolateral isoperistaltica sobre la válvula ileocecal52 se utiliza para estenosis del íleon terminal, se divide en la zona media del segmento afectado, deslizando y suturando luego el segmento más proximal sobre la válvula ileocecal (dibujo 7). Debido a que en los primeros casos se observaron estenosis Sasaki53 propuso una variante en la cual se le realiza en los extremos un cierre a lo Heinecke Mickulicz.
Dibujo 6: Estricturoplastia tipo Poggioli (adaptado).
Dibujo 7: Anastomosis isoperistaltica latero lateral adaptado.
Estricturoplastia de Hotokezaka (estricturoplastia laterolateral asociada a resección intestinal con posterior anastomosis término terminal).
En relación a la obstrucción intestinal causada por neoplasias su diagnóstico preoperatorio, suele ser difícil y se debe sospechar ante una exacerbación repentina de los síntomas en una enfermedad quiescente de larga data (más de 8 años de diagnóstico), especialmente en pacientes que hayan presentado previamente displasia en el íleon.54 El adenocarcinoma de intestino delgado se puede presentar en el 0,3 al 1,6 de los pacientes con EC (incidencia 20 - 60 veces mayor que en la población general),11,54,55 pudiendo ser multifocal y pobremente diferenciado. El diagnóstico intraoperatorio tampoco es fácil, por lo cual se deben tomar biopsias de todas las estenosis ya que la mayoría de las neoplasias son diagnosticadas incidentalmente por la patología.4 En caso de sospechar o confirmar la neoplasia se debe proceder a una resección oncológica.
Se debe destacar que independientemente de si se realizo una resección o una estricturoplastia, estos pacientes presentan recidivas que pueden sobrepasar el 30% con ambas.56 En la tabla 10 podemos observar que las tasas de complicaciones rondan entre el 4 y el 23%, mientras que las recidivas lo hacen desde un 21 a un 54%, definiendo los autores que las estricturosplastias son seguras y presentan buenos resultados.57-66
En cuanto al lugar de recaída de la enfermedad Tichansky y cols.67 encuentran que solo el 8% lo hace a nivel de la estricturoplastia, mientras que Futani y cols.65 encuentran un 20.4%. Otros como Stebbings66 encuentran que la recidiva fue en el sitio de la estricturoplastia solo en el 3,7% (9/241 estricturoplastias), hallando la mayoría de las recaídas en nuevos segmentos o por enfermedad perforante.
BIBLIOGRAFÍA
- Arulanandan A, Dulai PS, Singh S, et al: Systematc review of ballon assisted enteroscopy. World J Gastroenterol 2016;22(40):8999-9011.
- Rotholtz N, Bun M, Lencinas S, et al: Tratamiento quirurgico de la enfermedad de Crohn abdominal. MRINevA.LArgent. Cirug., 2006; 90 (5-6): 235-23454.
- Kim SH:Computed Tomography Enterography and Magnetic Resonance Enterography in the Diagnosis of Crohn’s Disease. Intest Res 2015;13(1):27-38.
- Maguire LH, Alavi K, Sudan R, et al: Surgical Considerations in the Treatment of Small Bowel Crohn’s Disease. J Gastrointest Surg (2017) 21:398–411.
- Rieder F, Zimmermann EM, Remzi FH: Crohn’s disease complicated by strictures: a systematic review. Gut 2013;62:1072–1084.
- Zhu CH, Ma X, Xue L, et al: Small intestine contrast ultrasonography for the detection and assessment of Crohn disease. A meta-analysis. Medicine 2016;95:31(e4235).
- Naganuma M, Hosoe N, Kanai T, et al: Recent trends in diagnostic techniques for inflammatory bowel disease. Korean J Intern Med 2015;30:271-278.
- Qi F, Jun S, Qi QY, et al: Utility of the diffusion-weighted imaging for activity evaluation in Crohn’s disease patients underwent magnetic resonance enterography. BMC Gastroenterology (2015) 15:12.
- Pennazio M, Spada C, Eliakim R, et al: Small-bowel capsule endoscopy and device-assisted enteroscopy for diagnosis and treatment of small- bowel disorders: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy 2015; 47: 352–376.
- Müller-Wille R, Iesalnieks I, Dornia C, et al: Influence of percutaneous abscess drainage on severe postoperative septic complications in patients with Crohn’s disease. Int J Colorectal Dis. 2011 Jun;26(6):769-74.
- Lewis RT, Maron DJ: Efficacy and Complications of Surgery for Crohn’s Disease. Gastroenterol Hepatol 2010;6(9):587-596.
- Richards RJ: Management of abdominal and pelvic abscess in Crohn’s disease. World J Gastrointest Endosc 2011 November 16; 3(11): 209-212.
- Bermejo F, Garrido E, Chaparro M, et al: Efficacy of different therapeutic options for spontaneous abdominal abscesses in Crohn’s disease: are antibiotics enough?. Inflamm Bowel Dis. 2012 Aug;18(8):1509-14.
- Gervais DA, Hahn PF, O’Neill MJ, Mueller PR. Percutane- ous abscess drainage in Crohn disease: technical success and short- and long-term outcomes during 14 years. Radiology 2002; 222: 645-651.
- Clancy C, Boland T, Deasy J, et al: A Meta-analysis of Percutaneous Drainage Versus Surgery as the Initial Treatment of Crohn’s Disease-related Intra-abdominal Abscess. J Crohns Colitis. 2016 Feb;10(2):202-8.
- He X, Lin X, Lian L, et al: Preoperative Percutaneous Drainage of Spontaneous Intra-Abdominal Abscess in Patients With Crohn’s Disease: A Meta-Analysis.J Clin Gastroenterol. 2015 Oct;49(9):e82-90
- Kane S: Urogenital Complications of Crohn’s Disease. Am J Gastroenterol 2006;101:S640–S643.
- Strong S, Steele SR, Boutrous M, et al: Clinical practice guidelines for the surgical management of Crohn’s disease. Dis colon Rectum 2015;58:1021-1036.
- Nielsen OH, Rogler G, Hahnloser D, et al: Diagnosis and management of fistulizing Crohn’s disease. Nat Clin Pract Gastroenterol Hepatol 2009;6(2):92-106.
- Hvas CL, Dahlerup JF, Jacobsen BA, et al: Diagnosis and tretametn f fistulizing Crohn’s disease. Dan Med Bull 2011;58(10):c4338.
- Present DH, Rutgeerts P, Targan S, et al. Infliximab for the treatment of fístulas in patients with Crohn’s disease. N Engl J Med. 1999;340:1398-1405.
- Sands BE, Anderson FH, Bernstein CN, et al. Infliximab maintenance therapy for fistulizing Crohn’s disease. N Engl J Med. 2004;350:876-885.
- Toh JWT, Steward P, Richard MJFX, et al: Indications and surgical options for samll bowel, large bowel and perianal Crohn’s disease. Wordl J Gastroenterol 2016;22(40):8892-8904.
- Katsanos KH, Tsianos VE, Maliouk M: et al: Obstruction and pseudo-obstruction in inflammatory bowel disease. ANNALS OF GASTROENTEROLOGY 2010, 23(4):243-256.
- Endo K, Takahashi S, Shiga H, et al: Short and long-term outcomes of endoscopic balloon dilatation for Crohn’s disease strictures. World J Gastroenterol 2013 January 7; 19(1): 86-91.
- Fiorino G, Bonifacio C, Peyrin-Biroulet L, et al. Prospective comparison of computed tomography enterography and magnetic resonance enterography for assessment of disease activity and complications in ileocolonic Crohn’s disease. Inflamm Bowel Dis 2011;17:1073–80.
- Fiorino G, Bonifacio C, Peyrin Biroulet L, et al: Preventing collateral damage in Crogn’s disease: the Lemann index. Journal of Crohn’s and Colitis 2016:495-500.
- Voderholzer WA, Beinhoelzl J, Rogalla P, et al. Small bowel involvement in Crohn’s disease: a prospective comparison of wireless capsule endoscopy and computed tomography enteroclysis. Gut 2005;54:369–73.
- Solem CA, Loftus EV Jr, Fletcher JG, et al. Small-bowel imaging in Crohn’s disease: a prospective, blinded, 4-way comparison trial. Gastrointest Endosc 2008;68:255–66.
- Turetschek K, Schober E, Wunderbaldinger P, et al. Findings at helical CT-enteroclysis in symptomatic patients with crohn disease: correlation with endoscopic and surgical findings. J Comput Assist Tomogr 2002;26:488–92.
- Botti F, Caprioli F, Pettinari D, et al: Surgery and diagnostic imaging in abdominal Crohn’s disease. J Ultrasound (2015) 18:3–17.
- Gasparetto m, Angriman I, Guariso G: The multidisciplinary health care team in the management of stenosis in Crohn’s disease. Journal of Multidisciplinary Healthcare 2015:8 167–179.
- HASSAN C, ZULLO A, DE FRANCESCO V, et al: Systematic review: endoscopic dilatation in Crohn’s disease. Aliment Pharmacol There 2007;26:1457–1464.
- Stienecker K, Gleichmann D, Neumayer U, et al: Long-term results of endoscopic balloon dilatation of lower gastroin- testinal tract strictures in Crohn’s disease: a prospective study. World J Gastroenterol. 2009;15(21):2623–2627.
- Chang ChW, Wong JM, Tung ChCh, et al: Intestinal Stricture in Crohn’s Disease. Intest Res 2015;13(1):19-26.
- Fazio VW, Galandiuk S, Jagelman DG, et al: Strictureplasty in Crohn’s Disease. Ann Surg 1989;210(5):621-625.
- Lee EC, Papaioannou N (1982) Minimal surgery for chronic obstruction in patients with extensive or universal Crohn’s dis- ease. Ann R Coll Surg Engl 64:229–233.
- Michelassi F, Hurst RD, Melis M, et al: Side-to-Side Isoperistaltic Strictureplasty in Extensive Crohn’s Disease. A Prospective Longitudinal Study. ANNALS OF SURGERY 2000;232(3):401–408.
- Alexander-Williams J, Haynes IG (1985) Conservative operations for Crohn’s disease of the small bowel. World J Surg 9:945–951.
- Brown CJ: Heineke-Mikulicz and Finney Strictureplasty in Crohn’s Disease. Operative Techniques in General Surgey. All rights reserved. doi:10.1053/j.optechgensurg.2007.03.002.
- Fazio VW, Tjandra JJ, Lavery IC, Church JM, Milsom JW, Oakley JR. Long-term follow-up of strictureplasty in Crohn’s disease. Dis Colon Rectum 1993;36:355–361.
- Chandra R, Moore JW: The Surgical Options and Management of Intestinal Crohn’s Disease. Indian J Surg (November–December 2011) 73(6):432–438.
- Hesham W, Kann BR: Strictureplasty. Clin Colon Rectal Surg 2013;26:80–83.
- Jobanputra S, Weiss EG: Strictureplasty. Clin Colon Rectal Surg 2007;20:294–302.
- Katsuno H, Maeda K, Hanai T, et al: Novel antimesenteric functional end-to-end handsewn (Kono-S) anastomoses for Crohn’s disease: a report of surgical procedure and short-term outcomes. Dig Surg. 2015;32(1):39-44.
- Fichera A, Zoccali M, Kono T: Antimesenteric functional end-to-end handsewn (Kono-S) anastomosis.J Gastrointest Surg. 2012 Jul;16(7):1412-6.
- Kono T, Fichera A, Maeda K, et al: Kono-S Anastomosis for Surgical Prophylaxis of Anastomotic Recurrence in Crohn’s Disease: an International Multicenter Study.J Gastrointest Surg. 2016 Apr;20(4):783-90.
- Luke D, Bowley D, Mortensen N: Calibration of the small bowel in stricture-forming small-bowel Crohn’s disease. Ann R Coll Surg Engl 2015; 97: 73–83.
- García-Granero E, Esclápez P, García-Armengol J, Espí A, Planelles J, Millán M, Lledó S. Simple technique for the intraoperative detection of Crohn’s stric- tures with a calibration sphere. Dis Colon Rectum 2000; 43: 1,168–1,170.
- Cundall JD, Rogers C. Detection of Crohn’s strictures – the use of an ‘Endo- Marble’. Ann R Coll Surg Engl 2001; 83: 172–173.
- Poggioli G, Laureti S, Pierangeli F, et al: A New Model of Strictureplasty for Multiple and Long Stenoses in Crohn’s Ileitis. Side-to-Side Diseased to Disease-Free Anastomosis.Colon Rectum 2003;46:127–130.
- van Overstraeten AdB, Vermeire S, Vanbeckevoort, et al: Modified Side-To-Side Isoperistaltic Strictureplasty over the Ileocaecal Valve: An Alternative to Ileocaecal Resection in Extensive Terminal Ileal Crohn’s Disease. Journal of Crohn’s and Colitis, 2016, 437–442.
- Sasaki I, Funayama Y, Naito H, et al: Extended strictureplasty for multiple short skipped strictures of Crohn’s disease. Dis Colon Rectum. 1996 Mar;39(3):342-4.
- Beaugerie L, Itzkowitz SH: Cancers Complicating Inflammatory Bowel Disease. N Engl J Med 2015;372:1441-52.
- Cannon J: Colorectal Neoplasia and Inflammatory Bowel Disease. Surg Clin N Am 95 (2015) 1261–1269.
- Reese GE, Prukayastha S, Tilmey HS, et al: Stricturoplasty vs resection in small bowel Crohn’s disease: an evaluation of short outcomes and recurrences. Colorectal Dis 2007;9:686-94.
- Serra J, Cohen Z, McLeod RS. Natural history of strictureplasty in Crohn’s disease: 9-year experience. Can J Surg 1995;38:481–485.
- Yamamoto T, Bain IM, Allan RN, Keighley MR. An audit of strictureplasty for small-bowel Crohn’s disease. Dis Colon Rectum 1999;42:797–803.
- Hurst RD, Michelassi MD. Strictureplasty for Crohn’s disease: techniques and long-term results. World J Surg 1998;22:359–363.
- Tonelli F, Ficari F. Strictureplasty in Crohn’s disease. Surgical option. Dis Colon Rectum 2000;43:920–926.
- Dietz DW, Laureti S, Strong SA, et al. Safety and longterm efficacy of stricture in 314 patients with obstructing small bowel Crohn’s disease. J Am Coll Surg 2001;192:330–337.
- Fearnhead NS, Chowdhury R, Box B, George BD, Jewell DP, Mortensen NJ. Long-term follow-up of strictureplasty for Crohn’s disease. Br J Surg 2006;93:475–482.
- Ozuner G, Fazio VW, Lavery IC, et al: Reoperative rates for Crohn’s disease following strictureplasty. Long-term analysis. Dis Colon Rectu57m. 1996 Nov;39(11):1199-203.
- Fazi M, Giudici F, Luceri C, et al: Long-term Results and Recurrence-Related Risk Factors for Crohn Disease in Patients Undergoing Side-to-Side Isoperistaltic Strictureplasty. JAMA Surg. 2016 May 1;151(5):452-60.
- Futami K, Arima S. Role of strictureplasty in surgical treatment of Crohn’s disease. J Gastroenterol 2005;40:35–39.
- Stebbing JF, Jewell DP, Kettlewell MG, et al: Recurrence and reoperation after strictureplasty for obstructive Crohn’s disease: long-term results [corrected]. Br J Surg. 1995 Nov;82(11):1471-4.
- Tichansky D, Cagir B, Yoo E, et al: Stricturoplasty for Crohn’s disease: meta analysis. Dis Colon Rectum 2000;43:911-9.