Enfermedad de Crohn
2.1 GENERALIDADES
Aunque existen varios reportes previos de ileítis crónica, la enfermedad de Crohn toma el nombre de quien la describiera en 1932 junto a Guinzburg y Oppenheimer como una ileítis regional.1,2 Su etiología es desconocida y se caracterizada por ser un proceso inflamatorio transmural, focal, asimétrico y ocasionalmente granulomatoso, que puede afectar todo el tracto digestivo desde la boca al ano, pero más comúnmente asienta en el intestino delgado, el colon (especialmente la región ileocecal) y la región perianal. Presenta dos picos de incidencia, uno a una edad temprana más comúnmente entre la segunda y tercera dedada de la vida, y otro entre los 50 y 70 años.3 Si bien es crónica cursa con remisiones y recaídas de síntomas, y signos tales como: dolor abdominal, diarrea, hematoquezia, fiebre, síntomas perianales y pérdida de peso, resultando en una reducción de la calidad de vida de los pacientes.4 Entre el 405 y el 90% de estos pacientes deberán ser sometidos a una cirugía (más del 70% a los 10 años) y aproximadamente 1/3 de ellos requerirá múltiples operariones.6-10
El objetivo, tanto del tratamiento médico como quirúrgico, NO es la curación, sino inducir al control de los síntomas, mejorar la calidad de vida, minimizar la toxicidad a corto y largo plazo, y disminuir las complicaciones tanto de la enfermedad como de los tratamientos realizados.
En cuanto a su tendencia recidivante la incidencia de recurrencias postoperatorias variara según la definición de la misma que se aplique, ya sea clínica, endoscópica, imagenológica o quirúrgica. Aproximadamente el 60-80% de los pacientes presentan recurrencia endoscópica al año de la resección; entre el 10-30% presentaran recidiva clínica al año y más del 60% durante la primer década; mientras que las quirúrgicas serán del 11-27% a los 5 años y del 30 al 49% a los 10 años.11,12 En nuestra experiencia, desde el año 2002 hasta principios del 2017, encontramos una recaída quirúrgica del 11,1% en Crohn colorrectal.
La enfermedad de Crohn puede ser clasificada según su forma de presentación en: inflamatoria, penetrante y estenosante. De acuerdo a estos patrones (B), la edad de diagnóstico (A) y su localización (L) se conforma la denominada clasificación de Montreal que luego fuera modificada -clasificación modificada de Viena - la cual agrega la localización en tracto digestivo superior y le da a la enfermedad perianal el carácter de modificador de cualquiera de las otras localizaciones (tabla 2)(figura 4). 13-14
Otra clasificación, aunque imperfecta, que se utiliza en la actualidad es el Índice de actividad de la EC (CDAI) (tabla 3); el cual nos permite tener una idea sobre la actividad de la misma. Esta toma en cuenta el número de deposiciones blandas o diarreicas, presencia de dolor o masa abdominal, alteración del estado general, necesidad de antidiarreicos, hematocrito, presencia de manifestaciones extraintestinales y pérdida de peso en los 7 días previos a la consulta,15-17 pero no toma en cuenta el dosaje de proteína C reactiva. Se considera una enfermedad leve cuando es < 150 y severa cuando es mayor a 450 puntos.
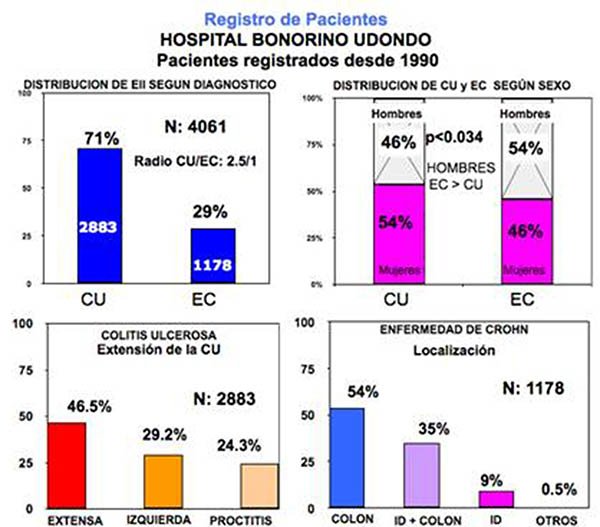
Figura 4: datos de localización de la Enfermedad de Crohn en nuestros pacientes. Datos cedidos por la dra. Alicia Sambuelli.
|
Edad al diagnóstico |
Localización |
Patrón evolutivo |
|
A1: ≤ 16 años |
L1: ileal |
B1: no obstructivo-no fistulizante (inflamatorio) |
|
A2: 17-40 años |
L2: cólica |
B2: obstructivo (fibroestenosante) |
|
A3: > 40 años |
L3: ileocólica |
B3: fistulizante |
|
|
L4: gastrointestinal alta (se añade a cualquiera de |
Añadir “p” a cualquiera de las anteriores si existe participación perianal |
Tabla 2: Clasificación de Montreal Modificada
|
|
|
descripción |
multiplicar × factor |
|
1. Número de heces líquidas o muy blandas |
|
suma de los 7 días |
x 2 |
|
2. Dolor abdominal |
no = 0, leve = 1, moderado = 2, grave = 3) |
suma de los 7 días |
x 5 |
|
3. Estado general |
bueno = 0, regular = 1, malo = 2, muy malo = 3, terrible = 4 |
suma de los 7 días |
x 7 |
|
4. Manifestaciones extraintestinales |
Artritis, artralgia, iritis uveítis, eritema nudoso, pioderma gangrenoso, aftas Fisura anal, fístula, absceso Otras fístulas Fiebre > |
suma de los 7 días |
x 20 |
|
5.Toma de antidiarreicos |
no = 0, sí = 1 |
suma de los 7 días |
x 30 |
|
6. Masa abdominal |
no = 0, dudosa = 2, sí = 5 |
suma de los 7 días |
x 10 |
|
7. Hematocrito |
varones: 47%- real del paciente mujeres: 43 - real de la paciente |
suma de los 7 días |
x 6 |
|
8. Peso corporal |
(1- (ideal/real)) x 100 |
suma de los 7 días |
x 1 |
Tabla 3: Cálculo del índice de actividad de la enfermedad de Crohn (Crohn’s Disease Activity Index [CDAI])
En el 2009, una revisión de la AGA - Americam Gastroenterological Association8 clasifico a los pacientes según el grado de severidad, basados en el CDAI. Se está en remisión sintomática (CDAI <150) cuando se encuentra asintomático o sin secuelas inflamatorias sintomáticas (personas que han respondido a terapia médica o quirúrgica y no tienen ninguna enfermedad activa residual). Los individuos que requieren el uso de corticoesteroides convencionales para lograr el bienestar clínico se dice que son “dependientes de esteroides” y no se consideran en remisión, ya que existe la posibilidad de que la medicación les produzca eventos adversos. Aquellos con enfermedad leve a moderada (CDAI 150-220) son ambulatorios y pueden tolerar la alimentación oral sin manifestaciones de deshidratación, toxicidad sistémica, dolor abdominal, masa dolorosa, obstrucción, o > 10% de pérdida de peso. Los que presentan una enfermedad de moderada a severa (CDAI 220-450) son los que no han respondido al tratamiento para la enfermedad leve a moderada, o muestran síntomas más prominentes. Los pacientes con enfermedad grave tienen un CDAI >450.
Otro índice de actividad que se utiliza en las distintas publicaciones es el de Harvey Bradshaw que consiste solo en parámetros clínicos (estado general, dolor y o masa abdominal, número de deposiciones líquidas por día y presencia de complicaciones o manifestaciones extraintestinales), un índice menor a 5 se considera remisión, 5 a 8 actividad media, de 8 a 16 actividad moderada y mayor a 16 enfermedad severa.18
2.2 INDICACIONES QUIRÚRGICAS
Las recomendaciones terapéuticas dependen de la localización, gravedad y complicaciones de la enfermedad y de los tratamientos instituidos. Los abordajes se individualizan según la respuesta sintomática y la tolerancia a la intervención médica. Los enfoques terapéuticos no son curativos y deben ser secuenciales para tratar la enfermedad aguda o inducir la remisión clínica y luego mantenerla.
Las indicaciones quirúrgicas en la enfermedad de Crohn surgen de sus complicaciones y tendrán como objetivos: resolver las mismas, restituir la salud, conservar la mayor parte de intestino delgado que sea posible, evitar una ostomía definitiva y mejorar la calidad de vida del paciente. El cirujano debe basar su estrategia en el logro de estos objetivos, siendo conservador o más agresivo de acuerdo a la presentación clínica o complicación, recordando que ninguna cirugía es curativa y que la recidiva será prácticamente ineludible.
El momento óptimo deberá ser consensuado con el equipo multidisciplinario y el paciente, teniendo en cuenta que un prolongado tratamiento médico fallido llevara a un aumento de las complicaciones postoperatorias. Se ha visto que las tasas de necesidad de cirugía no han variado mucho a pesar de la introducción de los agentes biológicos, por lo cual el dilema de cuando indicar la conducta quirúrgica continua vigente. Algunos autores proponen que en los pacientes con afectación de segmento corto estable con componente fibrótico, la cirugía sea indicada en forma temprana ya que puede producir la misma curación que se espera lograr con terapia médica agresiva asociada además a un intervalo libre de recurrencia más largo y con intervenciones menos agresivas y con menores tasas de complicaciones.19
La cirugía es obligatoria ante la presencia lesiones con displacía o neoplásicas, estenosis obstructivas, perforación, megacolon tóxico, hemorragia digestiva que no responde al tratamiento no quirúrgico, complicaciones supurativas o enfermedad médicamente intratable (Tabla 4).
2.3 CUIDADOS PREOPERATORIOS
Debemos recordar que la cirugía en la enfermedad de Crohn, no solo no es curativa sino que puede llevar a complicaciones severas tales como: el intestino corto, complicaciones sépticas y/o dehiscencias de suturas. Para disminuir los riesgos el cirujano debe planear el acto quirúrgico, modificando aquellos factores que puedan ser modificados tales como el estado nutricional, porcentaje de hemoglobina, habito tabáquico, tratamiento médico instaurado, presencia de colecciones o abscesos intraabdominales y conocer el estado del tracto gastrointestinal si el cuadro clínico lo permite, para tratar de resecar la menor cantidad posible de intestino delgado (tabla 5). En el caso de que se sospeche la necesidad ya sea de un ostoma temporal o definitivo, debe ser norma que esto se le informe al paciente y se marque previamente el lugar donde se localizara. De contar con ostomaterapeuta es de elección la consulta previa. La incorrecta ubicación de una ostomía, vecina a cicatrices, eminencias óseas o pliegues cutáneos, son factores que influencian negativamente el manejo de las mismas y la calidad de vida de los pacientes convirtiéndola en un problema.
La asociación entre desnutrición y mal resultado postoperatorio se informó por primera vez en 1936, se considera desnutrición severa a IMC <18,5 kg / m2, pérdida de peso no intencional superior al 10%, una reducción antropométrica o una disminución de fuerza de agarre. La hipoalbuminemia severa (<30 g / l), aunque no es un marcador directo del estado nutricional, se encuentra frecuentemente en asociación con desnutrición severa. La pérdida de peso > 10% se ha asociado como un factor de riesgo independiente para todas las complicaciones postoperatorias después de la cirugía abdominal, particularmente la sepsis intraabdominal.20-22
La hipoalbuminemia se asocia con inflamación activa, sepsis y desnutrición siendo un fuerte predictor de la morbimortalidad postoperatoria; <30 g/l de albuminemia es un factor de riesgo independiente para todas las complicaciones, incluidas las complicaciones sépticas y la hospitalización prolongada.9,21 Por lo tanto, lo ideal es llevar al paciente con al menos 30 g/l. La anemia también ha sido demostrada como un factor importante en el desarrollo de complicaciones postoperatorias. Se define como grave cuando el nivel de hemoglobina (Hb) <80 g/l, y moderada cuando la Hb> 80- <110 g/l.
Morar y cols.23 en un estudio sugieren que un nivel de albúmina <25 g/l y un bajo nivel de hemoglobina (Hb <13 g/l en hombres y <12 g/l en mujeres) aumentan significativamente el riesgo de complicaciones sépticas intraabdominales después de la resección ileocolónica para la enfermedad de Crohn, en comparación con un nivel de albúmina > 25 g/l (9% comparado con 2%, P = 0,04) y 15% en comparación con 5% para los pacientes sin anemia, P = 0,04.
|
Urgentes |
Electivas |
|
Brote grave refractario a tratamiento médico |
Fístulas |
|
Oclusión intestinal |
Enfermedad refractaria |
|
Megacolon tóxico. Perforación libre |
Brotes agudos graves pese a tratamiento adecuado de mantenimiento |
|
Hemorragia masiva |
Manifestaciones extraintestinales graves refractarias a tratamiento médico – Retraso del crecimiento en niños |
|
Sepsis. Absceso intrabdominal |
Displasia y cáncer |
|
|
Uropatía obstructiva |
Tabla 4: Indicaciones quirúrgicas en la Enfermedad de Crohn
|
Mal nutrición |
|
Hipoalbuminemia (<30g/l) |
|
Anemia < 8g/l |
|
Corticoterapia (>40 mg/dia) |
|
abscesos intraabdominal |
|
Tabaquismo |
Tabla 5: factores de riesgo para complicaciones sépticas
Los abscesos y flemones no tratados también se correlacionan con complicaciones postoperatorias, incluyendo septicemia grave, anomalías anastomóticas y aumento de la mortalidad postoperatoria, por lo tanto se encuentra indicado el drenaje por vía percutánea de ser posible.24,25
El tabaquismo está involucrado en el mal pronóstico de la enfermedad de Crohn. Morar y cols.23 sugieren que los no fumadores tienen un riesgo significativamente menor de complicaciones sépticas intraabdominales postoperatorias en comparación con los fumadores o ex fumadores (riesgo del 1% en los no fumadores comparado con el 12% en los fumadores o ex fumadores, P = 0,004). En los pacientes que deberán ser sometidos a cirugía se aconseja que dejen de fumar 8 semanas antes de la cirugía, si no fuera posible detenerse 4 semanas antes también es beneficioso.9
2.3.1 Manejo de la terapia médica
Muchos pacientes con enfermedad inflamatoria sometidos a cirugía están recibiendo tratamiento médico, por lo tanto debemos conocer los efectos que pueden tener sobre la morbimortalidad postoperatoria.
Corticosteroides: Algunos estudios sugieren que los esteroides preoperatorios aumentan los riesgos de todas las complicaciones postoperatorias, incluyendo la sepsis y las filtraciones anastomóticas, mientras que otros estudios no han identificado un aumento en su incidencia.26,27 Sin embargo, un metaanálisis de Subramanian28 sobre 11 estudios, describió un mayor riesgo de complicaciones (OR 1,46, IC del 95%: 1,05-2,03) e infecciones postoperatorias (OR1,74; IC del 95%: 1,11-2,71) asociadas al uso de esteroides, siendo mayor para los pacientes que recibieron una dosis de > 40 mg diarios. Lo ideal es suprimirlos 4 semanas antes de la cirugía, si esto no fuera posible su reducción continua siendo beneficiosa. Aunque no existe un umbral válido para definir la exposición a los esteroides que confiere un riesgo de sepsis postoperatoria, Tzivanakis y cols.25 identificaron un aumento del riesgo asociado con 10 o más mg diarios de prednisolona (o equivalente) durante 1 mes dentro de las 2 semanas de la cirugía. Mientras que para otros autores una dosis superior a 20 mg o equivalente aumenta significativamente el riesgo de complicaciones sépticas como infecciones del sitio quirúrgico, sepsis y fuga anastomótica.30,31
De igual manera Crohn Therapy, Resource, Evaluation, and Assessment Tool (TREAT) demostró mayores complicaciones infecciosas asociadas con el uso de glucocorticoides, independientemente de que el paciente fuera postoperatorio o no (OR 2,21) al igual que con el uso de infliximab.31-33
Inmunosupresores. Estudios retrospectivos respaldan la seguridad de la azatioprina, la mercaptopurina o el metotrexato en el período perioperatorio.26,29,33 Mientras que Myrelid34 en un estudio prospectivo informó un mayor riesgo de complicaciones sépticas abdominales en individuos con tiopurinas, dentro de las 6 semanas de la cirugía, que se sometieron a una anastomosis primaria (16% para tiopurinas versus 6% sin tratamiento con tiopurina, p <0,05). El riesgo de complicaciones sépticas se incrementó hasta el 24% si la terapia con tiopurina se asociaba con sepsis intraabdominal preoperatoria o anastomosis colo-colónica, pero sólo 4% cuando ninguno de estos factores de riesgo estaba presente (P = <0,001). Por estos motivos las tiopurinas y el metotrexato se deben retirar 7-14 días antes de la cirugía.9
Agentes biológicos. Existen controversias en cuanto al efecto de estos agentes en la morbimortalidad postoperatoria. Entre otros autores Alsaleh y cols.35 no han encontrado diferencias en el tiempo de la última dosis de infliximab y complicaciones postoperatorias.20,26,34,36-40
Se han realizado tres metaanálisis que demuestran que el uso de biológico dentro de las 12 semanas de la cirugía puede tener un efecto modesto en el aumento de las complicaciones postoperatorias, específicamente en las infecciones.41-43
En la mayoría de los estudios incluidos, los agentes biológicos se retiraron 8-12 semanas antes de la cirugía y se reiniciaron dentro de las 4 semanas de la cirugía, siendo esto una sugerencia actual.44
Los metaanálisis realizados por Billioud41 y Yang,43 evaluaron específicamente las complicaciones infecciosas postoperatorias, encontrando un pequeño aumento en las mismas en pacientes en terapia biológica antes de la cirugía.
Debido a estas controversias los equipos evaluaran la necesidad de suspender la medicación o disminuir la dosis en casos de los corticoides (situación a la cual adscribimos) o arriesgarse al posible incremento de las complicaciones.
2.3.2 Factores relacionados a la cirugía
Experiencia del grupo quirúrgico
Ha sido ampliamente demostrado que en cirugía colorrectal la experiencia del equipo quirúrgico es un factor determinante en la morbimortalidad postoperatoria. Un estudio sueco de base poblacional llevado a cabo por Nordenvall y cols.45 encuentra que la mortalidad 40 días después de la colectomía para la enfermedad de Crohn en pacientes mayores de 59 años fue del 6,2%. Dos tercios de las muertes ocurrieron en hospitales que realizaban menos de nueve colectomías debido a EII por año. De manera similar Kaplan46 y cols. hallan que las instituciones que realizan menos de 12 colectomías al año por colitis ulcerosa tuvieron una morbimortalidad marcadamente mayor que las instituciones que realizaron más de este número.
Operaciones de emergencia versus electivas
La cirugía de emergencia de la enfermedad de Crohn predispone a un aumento de la morbilidad, la necesidad de derivación fecal y una mayor duración de la estancia hospitalaria.9
Tipo de anastomosis
En cuanto al tipo anastomosis Dignass y cols.47(en el consenso del año 2010) al igual que otros autores48-50 sostienen que las anastomosis de boca amplia con sutura mecánica serían las preferidas, aunque existen controversias. Otros autores como Zubuchen y cols.51 no encuentran diferencias en anastomosis ileocólicas en cuanto a las complicaciones al igual que tampoco hallaron diferencias significativas entre anastomosis manual y mecánica las revisiones Cochrane.52,53
Un metaanálisis realizado por Similis y cols.49 sobre 8 estudios, del año 2007, que incluyo 661 pacientes a los cuales se les realizaron 712 anastomosis, de las cuales 383 fueron manuales termino terminales y el resto con otras configuraciones, la mayoría con sutura mecánica (latero lateral, termino - lateral y termino - terminal), encontraron una menor tasa de filtraciones en las realizadas con sutura mecánica y cuando compararon termino terminal versus latero-lateral en anastomosis ileocólicas, la tasa de filtraciones fue menor en el segundo grupo, no hallando diferencias en las tasas de recurrencia ni de reoperación. Aunque el análisis de alta calidad no encontró diferencias entre sutura manual y mecánica adjudicando esto último al bajo número de anastomosis con grapadora.
He y cols.,50 en otro metaanálisis que incluyo 396 anastomosis mecánicas latero-laterales y 425 anastomosis manuales termino-terminales en Crohn ileocecal, encuentran una menor tasa de complicaciones postoperatorias y de fugas anastomóticas, acompañados de una menor tasa de recurrencia en las anastomosis latero laterales con sutura mecánicas.
2.4 RECIDIVAS
En cuanto a las recaídas de la enfermedad mucho ha sido escrito, como precede en este capítulo el porcentaje dependerá de la definición que se emplee y del tiempo de seguimiento de las series.
Varios estudios han buscado factores potenciales de riesgo de recurrencia después de la cirugía. Se ha demostrado que el tabaquismo se asocia claramente con un mayor riesgo de desarrollar EC, con exacerbaciones de la enfermedad (brotes), peor progresión, mayor requerimientos de corticosteroides e inmunosupresores, mayor necesidad de cirugías intestinales iniciales y recurrentes, como así también con una disminución de la eficacia del tratamiento médico.14,54-60 Sutherland y cols.,61 en un trabajo del año 2007, encuentran que el riesgo de reoperación luego de la primer cirugía por EC, es significativamente mayor en los fumadores en comparación con los no fumadores (36% versus 20% a los 5 años y 70% versus 41% a los 10 años).
Otros factores involucrados en la recurrencia son: cirugía intestinal previa, comportamiento fistulizante de la enfermedad aunque el consenso europeo (ECCO 2016) no ha encontrado trabajos que respalden este hecho,62 localización perianal y resección extensa del intestino delgado.7,56,58
La afectación perianal es considerada por algunos autores como un factor independiente de recidiva así como también un marcador de un curso de la enfermedad más invalidante.11,63,64 Bernel y cols.63 encuentran que la enfermedad fistulizante perianal incrementa el RR (riesgo relativo) de recurrencia luego de la primer resección (RR1.4; 95% intervalo de confianza, 1.2-1.7).
Existen datos contradictorios para la edad de inicio de la enfermedad, sexo, duración de la enfermedad, márgenes de resección, o tipo de cirugía.7,62,65
En relación a los márgenes de resección comprometidos existen datos dispares Fazio y cols.66 en un estudio controlado que incluyó 131 pacientes, con un seguimiento promedio de 55,7 meses a lo cuales randomizó en dos grupos: grupo de resección proximal limitada (resección a 2 cm del borde macroscópicamente afectado) y el grupo de resección proximal amplia con sección a 12 cm de dicho sector, en ambos la sección distal fue a 5 cm del borde macroscópicamente comprometido. No encontrando diferencias significativas en lo relacionado a recidivas clínicas (25 limitado versus 16 extendido p=0,56) ni quirúrgicas (19 limitado versus 10 extendido).
Otros autores como Diederen y cols.65 encontraron en una cohorte de 122 niños que los márgenes comprometidos eran un factor de riesgo para recidiva. Estudios posteriores encuentran que la presencia de plexitis mioentérica se asocia a una más severa recurrencia endoscópica.67,68
En cuanto al tipo de anastomosis la mayoría de los reportes realizados en Crohn ileocecal no encuentran diferencias en las tasas de recidiva9,69-71 con los distintos tipos de anastomosis, aunque algunos autores como Zhu y cols.72 hallan una disminución de las recurrencias sintomáticas y endoscópicas.9,72 En los últimos años se ha descripto un nuevo tipo de anastomosis latero lateral (Kono - S) la cual parecería que presenta un menor número de recidivas quirúrgicas pero se aguardan estudios con mayor tiempo de seguimiento.9,71,73,74
Se han ensayado varias formas de terapia médica para prevenir la probabilidad de enfermedad de Crohn recurrente después del manejo quirúrgico, pero no ha surgido un régimen profiláctico claro de fármacos. En la actualidad la mayoría de los autores dividen a los pacientes en dos75,76 (tabla 6) o tres de grupos, de acuerdo al riesgo de recurrencia59,60 (tabla 7), para luego determinar la conducta a seguir.
La afectación ileocecal es considerada, por varios autores, como la indicación más frecuente de cirugía, y la recidiva de la enfermedad se da justamente a nivel de la anastomosis ileocólica o en el neo íleon terminal; por lo cual el control postoperatorio con ileocolonoscopía debe ser la regla.59 Rutgeerts y cols.77 establecieron un score endoscópico para categorizar a los pacientes con riesgo de recaídas clínicas o quirúrgicas (Tabla 8).
La terapia de primera línea, generalmente, consiste en los compuestos de ácido 5-aminosalicílico, que son ligeramente protectores, un metaanálisis llevado a cabo por Ford y cols., que incluyó 834 pacientes, muestra una reducción de las recaídas postoperatorias comparadas con el placebo o con el no tratamiento al igual que Singh,78 mientras que un metaanálisis de Rutgeerts y cols.79 sugiere que no son mejores que el placebo.
El uso de medicamentos inmunomoduladores produciría efectos potencialmente beneficiosos en pacientes postoperatorios con alto riesgo de recurrencia, lesiones endoscópicas observadas en el íleon neoterminal o síntomas relacionados con la enfermedad.18,80-82
Un nuevo paradigma de un enfoque “top down” para el tratamiento de la EC, en el que la cirugía y la institución temprana de terapia farmacológica inmunomoduladora y/o biológica ha sido sugerida por grandes ensayos.71 Este abordaje ha demostrado una mayor tasa de curación mucosa, una reducción en el uso de esteroides, tiempos de remisión más largos y una respuesta clínica más rápida que el enfoque tradicional.83-85 El infliximab mejora las tasas de recurrencia postoperatorias con resultados del 0 al 21% a los 3 años;59 en un estudio de Singh78 y cols., el infliximab, mostró ser la única droga utilizada como monoterapia útil para disminuir las recidivas postquirúrgicas. Park,18 por otro lado, en un metaanálisis de 7 estudios comparativos halla que los anti TNF reducen las recurrencias endoscópicas y clínicas comparadas con el placebo.
|
GRUPO DE RIESGO |
CARACTERISTICAS CLINICAS |
|
Bajo riesgo de recurrencia |
Adultos mayores de 50 años No fumadores Primer cirugía por enfermedad fibroestenotica de segmento corto Duración de la enfermedad de mas de 10 años |
|
Alto riesgo de recurrencia |
Pacientes jóvenes, menores de 30 años Fumadores 2 o mas cirugías por enfermedad fistulizante con o sin afectación perianal |
Tabla 6: Clasificación de grupos de riesgo de recurrencia75,76
|
GRUPO DE RIESGO |
CARACTERISTICAS CLINICAS |
|
Bajo riesgo de recurrencia |
Primer cirugía por estrictura corta de menos de 10 cm Duración de la enfermedad de mas de 10 años |
|
Riesgo moderado de recurrencia |
Primer cirugía en paciente con enfermedad de corta duración (menos de 10 años) y con un segmento enfermo mayor de 10 cm |
|
Alto riesgo de recurrencia |
Pacientes con enfermedad perforante o penetrante y/o Fumadores y/o Con antecedentes de cirugía previas |
Tabla 7: Clasificación de grupos de riesgo de recurrencia59,60
|
Score |
Características del neo íleoníleon terminal |
Riesgo de recurrencia a 3 años |
|
i0 |
Apariencia normal, sin inflamación endoscópica |
< 5% |
|
i1 |
< de 5 úlceras aftoides en el neo íleoníleon terminal |
< 5% |
|
i2 |
> de 5 úlceras aftoides con zonas de mucosa sana |
15 - 20% |
|
i3 |
ileitis aftoidea difusa con inflación difusa de la mucosa |
45% |
|
i4 |
Inflamación difusa con úlceras largas, nódulos y o estructuras |
> 90% |
Tabla 8: Clasificación de Ruggerts
Hashash y cols.59 al igual que Regueiro y cols.,58 sugieren para el grupo de bajo riesgo no realizar tratamiento médico postoperatorio con control endoscopio a los 6-12 meses, en caso de encontrar recurrencia endoscópica comenzar con tratamiento, para el riesgo moderado recomiendan comenzar con inmunomoduladores asociados o no a metronidazol y en caso de hallar recurrencia endoscópica evaluar cambiar a agentes biológicos.
En el grupo de alto riesgo, recomiendan tratamiento agresivo combinando agentes biológicos e inmunomoduladores. Si hallan recidiva endoscópica en los controles optimizar o intercambiar con otra medicación.
En concordancia con estos autores y para resumir, la AGA sugiere que todos los pacientes deben ser sometidos a ileocolonoscopía postoperatoria, y solo en pacientes de bajo riesgo el hallazgo endoscópico sea indicativo de tratamiento postoperatorio, en el resto de los pacientes sugieren profilaxis farmacológica temprana.75,76
BIBLIOGRAFÍA
- Kirsner JB: Historical origins of current IBD concepts. World J Gastroenterol. 200;7(2):175–184
- Crohn BB, Ginzburg L, Oppenheimer GD. Regional ileitis; a pathologic and clinical entity. Am J Med. 1952;13:583–590
- Martin ST, Vogel JD: Restorative Procedures in Colonic Crohn Disease. Clin Colon Rectal Surg 2013;26:100–105.
- HA F, Khalil H: Crohn’s disease: a clinical update. Ther Adv Gastroenterol 2015, Vol. 8(6) 352–359.
- Magro F, Dias CC, Coelho R, et al: Impact of Early Surgery and Immunosuppression on Crohn’s Disease Disabling Outcomes. Inflamm Bowel Dis 2017;23:289–297.
- Toh JWT, Steward P, Richard MJFX, et al: Indications and surgical options for samll bowel, large bowel and perianal Crohn’s disease. Wordl J Gastroenterol 2016;22(40):8892-8904.
- Van Assche G, Dignass A, Reinisch W, et al: The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Special situations. Journal of Crohn’s and Colitis (2010) 4, 63–101.
- Lichtenstein GR, Hanauer SB, Sandborn WJ, et al: Management of Crohn’s Disease in Adults. Am J Gastroenterol 2009;1-19.
- Patel KV, Darakshan AA, Griffin N, et al: Patient optimization for surgery relating to Crohn disease. Gastroenterology and hepatology 2016;13:707-719.
- Rotholtz N, Bun, M, Lencinas S, et al: Tratamietno quirurgico de la enfermedad de Crohn abdominal. Rev Argent Cirug, 2006;90(5-6):235-244.
- Han YM, Kim JW, Koh SJ, et al: Patients with perianal Crohn’s disease have poor disease outcomes after primary bowel resection. doi:10:111/jgh.13310.
- Boley N, Mortensen N, Jewell D: Preventing postoperative recurrence of Crohn’s disease. Br J Surg 1997:84:1493-1502.
- Silverberg MK, Satsangi J, Ahmad T, Arnott I, Bers- tein CN, Brant ST, et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a working party of the 2005 Montreal Word Congress of Gastroenterology. Can J Gastroenterol 2005; 19 (Suppl A); 5A-36A.
- Baumgart DC: The Diagnosis and Treatment of Crohn’s Disease and Ulcerative Colitis. Dtsch Arztebl Int 2009; 106(8): 123–33.
- Best WR, Becktel JM, Singleton JW, Kern F Jr. Development of a Crohn’s disease activity index. National Cooperative Crohn’s Disease Study. Gastroenterology 1976; 70: 439–44.
- Best WR: Predicting the Crohns Disease Activity Index From the Harvey-Bradshaw Index. Inflamm Bowel Dis 2006;12:304–310.
- Sostegni R, Daperno M, Scaglione N, et al: A. Review article: Crohn’s disease: monitoring disease activity. Aliment Pharmacol Ther 2003; 17 (Suppl. 2): 11–17.
- Park JJ, Yang Sk, Ye BD, et al: Second Korean guidelines for the management of Crhn’s disease. Intest Research 2017;15(1);38-67.
- Botti F, Caprioli F, Pettinari D, et al: Surgery and diagnostic imaging in abdominal Crohn’s disease. J Ultrasound (2015) 18:3–17.
- Nickerson TP, Merchea A: Perioperative considerations in Crohn Disease and Ulcerative Colitis. Clin Colon Rectal Surg 2016;29:80-84.
- Joksimovic V, karagjozov A, Jota G, et al: Risk factors for early postoperative complications after surgery for Crohn’s Disease. Acta Facultatis Medicae Naissensis, 2014;31(3):147-15.
- Geltzeiler CB, Hart KD, Lu KD, et al: Trends in the Surgical Management of Crohn’s Disease. J Gastrointest Surg (2015) 19:1862–1868.
- Morar, P. S. et al. Determining predictors for intra-abdominal septic complications following ileocolonic resection for Crohn’s disease-considerations in pre- operative and peri-operative optimisation techniques to improve outcome. J. Crohns Colitis 9, 483–491 (2015).
- Alves, A. et al. Risk factors for intra-abdominal septic complications after a first ileocecal resection for Crohn’s disease: a multivariate analysis in 161 consecutive patients. Dis. Colon Rectum 50, 331–336 (2007).
- Tzivanakis, A. et al. Influence of risk factors on the safety of ileocolic anastomosis in Crohn’s disease surgery. Dis. Colon Rectum 55, 558–562 (2012).
- Colombel, J. F. et al. Early postoperative complications are not increased in patients with Crohn’s disease treated perioperatively with infliximab or immunosuppressive therapy. Am. J. Gastroenterol. 99, 878–883 (2004).
- Indar AA, Young-Fadok TM, Heppell J, Efron JE. Effect of perioperative immunosuppressive medication on early outcome in Crohn’s disease patients. World J Surg 2009;33(5):1049–1052.
- Subramanian, V., Saxena, S., Kang, J. Y. & Pollok, R. C. Preoperative steroid use and risk of postoperative complications in patients with inflammatory bowel disease undergoing abdominal surgery. Am. J. Gastroenterol. 103, 2373–2381 (2008).
- Aberra, F. N. et al. Corticosteroids and immunomodulators: postoperative infectious complication risk in inflammatory bowel disease patients. Gastroenterology 125, 320–327 (2003).
- Yamamoto T, Allan RN, Keighley MR: Risk factors for intra-abdominal sepsis after surgery in Crohn’s disease. Dis Colon Rectum 2000;43:1141–1145.
- Lichtenstein GR, Feagan BG, Cohen RD, et al. Serious infection and mortality in patients with Crohn’s disease: more than 5 years of follow-up in the TREAT registry. Am J Gastroenterol 2012; 107(9):1409–1422.
- Lichtenstein GR, Feagan BG, Cohen RD, et al. Serious infections and mortality in association with therapies for Crohn’s disease: TREAT registry. Clin Gastroenterol Hepatol 2006;4(5):621–630.
- Mowat C, Cole A, Windsor A, et al: Guidelines for the management of inflammatory bowel disease in adults. Gut 2011;60:571e607.
- Myrelid, P. et al. Thiopurine therapy is associated with postoperative intra-abdominal septic complications in abdominal surgery for Crohn’s disease. Dis. Colon Rectum 52, 1387–1394 (2009).
- Alsaleh A, Gaidos JKJ, Kang L, et al: Timing of Last Preoperative Dose of Infliximab Does Not Increase Postoperative Complications in Inflammatory Bowel Disease Patients. Dig Dis Sci (2016) 61:2602–2607.
- Canedo J, Lee SH, Pinto R, Murad-Regadas S, Rosen L, Wexner SD. Surgical resection in Crohn’s disease: is immunosuppressive medication associated with higher postoperative infection rates? Colorectal Dis 2011;13(11):1294–1298.
- Kunitake H, Hodin R, Shellito PC, Sands BE, Korzenik J, Bordeianou L. Perioperative treatment with infliximab in patients with Crohn’s disease and ulcerative colitis is not associated with an increased rate of postoperative complications. J Gastrointest Surg 2008;12(10):1730–1736, discussion 1736–1737.
- Marchal L, D’Haens G, Van Assche G, et al. The risk of post- operative complications associated with infliximab therapy for Crohn’s disease: a controlled cohort study. Aliment Pharmacol Ther 2004;19(7):749–754.
- Nasir BS, Dozois EJ, Cima RR, et al. Perioperative anti-tumor necrosis factor therapy does not increase the rate of early postop- erative complications in Crohn’s disease. J Gastrointest Surg 2010; 14(12):1859–1865, discussion 1865–1866.
- Waterman M, Xu W, Dinani A, et al. Preoperative biological therapy and short-term outcomes of abdominal surgery in patients with inflammatory bowel disease. Gut 2013;62(3):387–394.
- Billioud, V. et al. Preoperative use of anti-TNF therapy and postoperative complications in inflammatory bowel diseases: a meta-analysis. J. Crohns Colitis 7, 853–867 (2013).
- Rosenfeld, G., Qian, H. & Bressler, B. The risks of post-operative complications following pre-operative infliximab therapy for Crohn’s disease in patients undergoing abdominal surgery: a systematic review and meta-analysis. J. Crohns Colitis 7, 868–877 (2013).
- Yang, Z. P., Hong, L., Wu, Q., Wu, K. C. & Fan, D. M. Preoperative infliximab use and postoperative complications in Crohn’s disease: a systematic review and meta-analysis. Int. J. Surg. 12, 224–230 (2014).
- Strong S, Steele SR, Boutrous M, et al: Clinical practice guidelines for the surgical management of Crohn’s disease. Dis Colon Rectum 2015;58:1021-1036
- Nordenvall, C., Ekbom, A., Bottai, M., et al: Mortality after total colectomy in 3084 atients with inflammatory bowel disease: a population-based cohort study. Aliment. Pharmacol. Ther. 40, 280–287 (2014).
- Kaplan, G. G. et al. Impact of hospital volume on postoperative morbidity and mortality following a colectomy for ulcerative colitis. Gastroenterology 134, 680–687 (2008).
- Dignass A, Van Assche G, Lindsay JO, et al: The second European evidence-based consensus on the diagnosis and management of Crohn’s disease: Current management. Journal of Crohn’s and Colitis (2010) 4, 28–62.
- Resegotti A, Astegiano M, Farina EC, et al: Side-to-side stapled anastomosis strongly reduces anastomotic leak rates in Crohn’s disease surgery. Dis Colon Rectum. 2005 Mar;48(3):464-8.
- Simillis C, Purkayastha S, Yamamoto T, Strong SA, Darzi AW, Tekkis PP. A meta-analysis comparing conventional end-to-end anastomosis vs. other anastomotic configurations after resection in Crohn’s disease. Dis Colon Rectum 2007;50(10):1674–87.
- He X, Chen Z, Huang J,et al: Stapled side-to-side anastomosis might be better than handsewn end-to-end anastomosis in ileocolic resection for Crohn’s disease: a meta-analysis. Dig Dis Sci. 2014 Jul;59(7):1544-51.
- Zurbuchen U, Kroesen AJ, Knebel P, et al: Complications after end-to-end vs. side-to-side anastomosis in ileocecal Crohn’s disease--early postoperative results from a randomized controlled multi-center trial (ISRCTN-45665492). Langenbecks Arch Surg. 2013 Mar;398(3):467-74.
- Neutzling CB, Lustosa SA, Proenca IM, et al: Stapled versus handsewn methods for colorectal anastomosis surgery. Cochrane Database Syst Rev. 2012 Feb 15;(2):CD003144.
- Choy PY, Bissett IP, Docherty JG, et al: Stapled versus handsewn methods for ileocolic anastomoses. Cochrane Database Syst Rev. 2011 Sep 7;(9):CD00432.
- Ryan WR, Allan RN, Yamamoto T, Keighley MR. Crohn’s disease patients who quit smoking have a reduced risk of reoperation for recurrence. Am J Surg. 2004;187:219–25.
- Parsi MA, Achkar JP, Richardson S, Katz J, Hammel JP, Lashner BA, et al. Predictors of response to infliximab in patients with Crohn’s disease. Gastroenterology. 2002;123:707-13.
- Lawrance IC, Murray K, Batman B, et al: Crohn’s disease and smoking: Is it ever too late to quit? Journal of Crohn’s and Colitis (2013) 7, e665–e671.
- Thia KT, Sandborn WJ, Harmsen WS, et al: Risk Factors Associated With Progression to Intestinal Complications of Crohn’s Disease in a Population-Based Cohort. Gastroenterology. 2010 October; 139(4): 1147–1155.
- Regueiro M, Schraut W, Baidoo L, et al: Infliximab Prevents Crohn’s Disease Recurrence After Ileal Resection. GASTROENTEROLOGY 2009;136:441–450.
- Hashash JG, Regueiro M: A Practical Approach to Preventing Postoperative Recurrence in Crohn’s Disease. Curr Gastroenterol Rep (2016) 18:25.
- Regueiro M, Strong AA, Ferrari L, et al: Postoperative Medical Management of Crohn’s Disease: Prevention and Surveillance Strategies. J Gastrointest Surg DOI 10.1007/s11605-016-3172-5.
- Sutherland LR, Ramcharan S, Bryant H, et al. Effect of cigarette smoking on recurrence of Crohn’s disease. Gastroenterology 1996;110:424– 431.
- Caprilli R, Gassull MA, Escher JC, et al: European evidence based consensus on the diagnosis and management of Crohn’s disease: special situations. Gut 2006;55;36-58.
- Bernell O, Lapidus A, Helers G: Risk factors for surgery and postoperative recurrence in Crohn’s disease. Ann Surg 2000;231:38-45.
- Beaugerie L, Seksik P, Nion Larmurier I, et al: Predictors of Crohn’s disease. Gastroenterolgy 2006;130:650-6.
- Diederen D, de Ridder L, van Rheenen P, et al: Complications and Disease Recurrence After Primary Ileocecal Resection in Pediatric Crohn’s Disease: A Multicenter Cohort Analysis. Inflamm Bowel Dis 2017;23:272–282.
- Fazio VW, Marchetti F, Church JM, et al: Effect of Resection Margins on the Recurrence of Crohn’s Disease in the Small Bowel. A Randomized Controlled Tria. Annal of Surg 1996;224(4):563-573.
- Ferrante M, de Hertogh G, Hlavaty T, et al. The value of myenteric plexitis to predict early postoperative Crohn’s disease recurrence. Gastroenterology. 2006;130:1595–1606.
- Misteli H, Koh CE, Wang LM, et al. Myenteric plexitis at the proximal resection margin is a predictive marker for surgical recurrence of ileocae- cal Crohn’s disease. Colorectal Dis. 2015;17:304–310.
- Scott NA, Sue-Ling HM, Hughes LE. Anastomotic configuration does not affect recurrence of Crohn’s disease after ileocolonic resection. Int J Colorectal Dis. 1995;10(2):67-9.
- McLeod RS, Wolff BG, Ross S, et al: Recurrence of Crohn’s disease after ileocolic resection is not affected by anastomotic type: results of a multicenter, randomized, controlled trial. Dis Colon Rectum. 2009 May;52(5):919-27.
- Connelly TM, Messaris E: Predictors of recurrence of Crohn’s disease after ileocolectomy: A review. World J Gastroenterol 2014 October 21; 20(39): 14393-14406.
- Zhu WM, Li Y, Yu C, Zhang W, et al: [Impact of anastomosis type on postoperative recurrence after bowel resection for Crohn disease]. Zhonghua Wei Chang Wai Ke Za Zhi. 2011 Mar;14(3):168-70.
- Kono T, Ashida T, Ebisawa Y, et al: A new antimesenteric functional end-to-end handsewn anastomosis: surgical prevention of anastomotic recurrence in Crohn’s disease. Dis Colon Rectum. 2011 May;54(5):586-92.
- Katsuno H, Maeda K, Hanai T, et al: Novel antimesenteric functional end-to-end handsewn (Kono-S) anastomoses for Crohn’s disease: a report of surgical procedure and short-term outcomes. Dig Surg. 2015;32(1):39-44.
- Regueiro M, Velayos F, Greer JB, et al: American Gastroenterological Association Intitute technical review on the management of Crohn’s disease after surgical resection. Gastoenterology 2017;152:277-95.
- Nguyen GC, Loftus Jr EV, Hirano I, et al: American Gastroenterological Association Institute Guidelines on the management of Crohn’s disease after surgical resection. Gastroenterology 2017;157:271-275.
- Rutgeerts P, Geboes K, Vantrappen G, et al: Predictability of the postoperative course of Crohn’s disease. Gastroenterology. 1990;99(4):956–63.
- Singh S, Garg SK, Pardi DS, et al: Comparative efficacy of pharmacologic interventions after surgery: a systematic review and network meta analysis. Gastroenterology 2015;148:4-76e2.
- Rutgeerts P. Strategies in the prevention of post-operative recurrence in Crohn’s disease. Best Pract Res Clin Gastroenterol 2003;17:63–73.
- Strong SA: Surgery for Crohn’s disease. Cap 42;584-600.
- Ardizzone S, Maconi G, Sampietro GM, et al. Azathioprine and mesalamine for prevention of relapse after conservative surgery for Crohn’s disease. Gastroenterology 2004;127:730–740.
- Hanauer SB, Korelitz BI, Rutgeerts P, et al. Postoperative maintenance of Crohn’s disease remission with 6-mercaptop- urine, mesalamine, or placebo: a 2-year trial. Gastroenterology 2004;127:723–729.
- Vuitton L, Koch S, Peyrin-Biroulet L.: Preventing postoperative recurrence in Crohn’s disease: what does the future hold? Drugs. 2013 Nov;73(16):1749-59.
- Chen QQ, Yan L, Wan J: Select A Suitable Treatment Strategy For Crohn’s Disease: Step-Up Or Top-Down. XCLI Journal 2014;13:111-122.
- Hirschmann S, Neurath MF: Top down approach to biological therapy of Crohn’s disease. Expert Op on Biological Theraphy 2017;17(3):285-293.
