Capítulo 8
CAPÍTULO 8
Programa Nacional para la prevención y detección temprana del cáncer colorrectal.
Instituto Nacional del Cáncer. Argentina
El Programa Nacional de prevención y detección temprana del cáncer colorrectal en Argentina se creó el 30 de diciembre de 2013 mediante la Resolución 2173 del Ministerio de Salud de la Nación,1 en base a la propuesta previa elaborada en 2012.2
El programa está fundamentado en las recomendaciones de la Organización Mundial de la Salud (OMS) para la planificación y ejecución de programas de control del cáncer que aconseja una planificación y una implementación de programas de control del cáncer de modo progresivo, en etapas, basándose en disponibilidad de recursos y necesidades regionales o locales.3,4 Además, sigue los lineamientos de las guías de garantía de calidad en diagnóstico y tratamiento del CCR de la Unión Europea para programas poblacionales organizados.5 Tiene el objetivo de implementar un programa costo-efectivo, accesible a toda la población, garantizando la calidad de las intervenciones y los procesos, con un registro completo de los datos que permita un monitoreo y evaluación permanentes.2
Objetivos generales del programa
- Disminuir la incidencia y mortalidad por cáncer colorrectal.
- Mejorar la calidad de vida.
Objetivos específicos del programa:
- Instalar el control del cáncer colorrectal como prioridad en la agenda de salud pública nacional.
- Promover la inclusión de programas de prevención y control del cáncer colorrectal en las diferentes jurisdicciones del país.
- Difundir y concientizar a la comunidad sobre las ventajas de la prevención y detección temprana del cáncer colorrectal.
- Fortalecer los recursos necesarios para su implementación y los métodos de diagnóstico y tratamiento del CCR.
- Mejorar los circuitos de consulta especializada, derivación, seguimiento y tratamiento de la enfermedad.
- Unificar criterios para el control, tratamiento y seguimiento de los grupos de mayor riesgo de cáncer colorrectal.
- Proponer la pesquisa del cáncer colorrectal en personas de riesgo promedio.
- Asegurar la accesibilidad de las acciones para la prevención, el diagnóstico temprano y el control de la enfermedad a toda la población.
- Lograr el apoyo y compromiso político con una financiación que permita garantizar su sustentabilidad en el tiempo.
- Promover la ampliación del programa en los otros sectores de salud (por ejemplo, seguridad social) para lograr el acceso a toda la población objetivo independientemente de su cobertura de salud.
- Favorecer la potenciación de las acciones mediante convenios de colaboración con asociaciones civiles, sociedades científicas y ONG con misiones y objetivos similares.
- Facilitar la formación y capacitación del recurso humano necesario en cada una de las etapas del programa y en el nivel de conducción.
- Asegurar las garantías de calidad de los componentes del programa y su sostenibilidad.
- Establecer un sistema de información estratégica que incluya la vigilancia epidemiológica, el monitoreo y la evaluación de la calidad y del impacto del programa.
- Garantizar la privacidad y protección de datos personales de acuerdo a la legislación vigente a toda la población participante.
- Favorecer la investigación y el desarrollo de adelantos en aspectos organizativos, prestación de servicios o nuevas tecnologías que permitan mejorar los resultados del programa.
FASES DE IMPLEMENTACIÓN DEL PROGRAMA
La Argentina presenta diferencias entre jurisdicciones, con realidades y prioridades de salud disímiles, donde los recursos económicos, tecnológicos y humanos disponibles son limitados en algunas provincias, lo que puede resultar una barrera para la implementación de un programa de pesquisa organizado.
Una evaluación de la carga de la enfermedad en cada región, su relevancia respecto de otros problemas de salud, la disponibilidad de recursos y las posibilidades de inversión en un programa a largo plazo son las claves para el diseño de un proyecto sostenible.
Parece razonable proponer una fase inicial, en las regiones de recursos limitados, donde se puedan desarrollar tareas de prevención y detección temprana, en general con los recursos existentes e incorporar, en una segunda etapa, las acciones que requieren la asignación de fondos adicionales.2,3
En un programa progresivo de detección temprana del CCR puede proponerse, en una primera fase,
el control de los grupos de mayor riesgo para avanzar, en una segunda etapa, en la implementación de un programa de pesquisa en la población general.
Esta propuesta de programa en etapas debe ser analizada cuidadosamente en cada jurisdicción (región, provincia, municipio) evaluando los datos epidemiológicos y demográficos, la cobertura de salud de la población, la tecnología disponible (colonoscopías) y los recursos humanos antes de definir las acciones respectivas.
En aquellas regiones o jurisdicciones donde la carga de la enfermedad lo justifique, donde existan los recursos suficientes y donde el compromiso y la voluntad política necesarios aseguren la sustentabilidad en el mediano y largo plazo, ambas fases podrían iniciarse conjuntamente.
La fase del programa dirigida a grupos de mayor riesgo de CCR permite limitar la pesquisa inicialmente a una población objetivo menor y, por ende, tener mayor eficacia en el control de estos grupos. El principal desafío de esta pesquisa selectiva es la identificación y la búsqueda activa de los grupos de mayor riesgo de manera factible y eficiente.
Esta fase tiene un beneficio limitado, ya que no incluye a las personas de riesgo promedio que representan la mayoría de los cánceres colorrectales y que deben ser incluidas en una segunda etapa o incluirse de inicio (donde sea factible) para lograr una significativa reducción de la incidencia y mortalidad del CCR.
El control de los grupos de riesgo aumentado se fundamenta en que, si bien existen recomendaciones de vigilancia y control para cada grupo en guías de práctica clínica publicadas, estas normativas no están reguladas dentro de un programa organizado que contemple la accesibilidad, la disponibilidad y la homogeneidad de las acciones con las evaluaciones y los controles necesarios.
Ante la ausencia de programas monitoreados, estas personas actualmente se vigilan de manera desigual, con criterios individuales, dependiendo de la formación y del interés del profesional, como ocurre en las pesquisas de tipo oportunista, sin registros ni evaluaciones.
El programa toma en cuenta que, ante las circunstancias de limitaciones de recursos ya señaladas, una estrategia en dos etapas puede ser necesaria: la inicial, destinada al control eficaz de los grupos de riesgo mayor de CCR, y una segunda, orientada a la población general de riesgo promedio.
PRIMERA FASE DEL PROGRAMA: PREVENCIÓN Y DETECCIÓN TEMPRANA DEL CCR EN GRUPOS DE RIESGO ELEVADO
Población objetivo de la primera fase: personas con riesgo aumentado de CCR por antecedentes familiares o personales (ver criterios de inclusión).
Objetivos específicos del Programa de prevención y detección temprana del CCR en grupos de riesgo:
- Detectar y concientizar a la población con riesgo aumentado de CCR (grupos de riesgo) para su adecuado control.
- Asegurar la accesibilidad del programa y ofrecer los estudios necesarios para el control y la vigilancia a toda la población con riesgo aumentado de CCR.
- Difundir y promover, en la población médica, las recomendaciones de control y vigilancia de los diferentes grupos de riesgo de CCR.
- Facilitar los procesos de pesquisa, tratamiento, control y seguimiento de las patologías diagnosticadas.
- Crear un registro centralizado de los grupos de riesgo y del programa en todos sus pasos.
- Establecer criterios de evaluación (indicadores) y monitoreo continuo del programa para garantizar la calidad de las acciones y procesos.
- Promover la publicación de los datos y un sistema de consulta y actualización permanente.
- Lograr el apoyo y compromiso político con una financiación que permita garantizar su sustentabilidad en el tiempo.
- Promover la inclusión del programa en los otros sectores de salud (por ej., seguridad social) para lograr el acceso a toda la población objetivo, independientemente de su cobertura de salud.
- Garantizar la confidencialidad, la libertad de elección y la protección de datos personales.
Criterios de inclusión de la primera fase
- Personas con antecedentes personales de pólipos adenomatosos o cáncer colorrectal
- Personas con antecedentes familiares de adenomas o cáncer colorrectal.
- Personas con antecedentes de poliposis adenomatosa familiar u otras poliposis colónicas.
- Personas con antecedentes de enfermedad inflamatoria intestinal.
- Personas que cumplan criterios clínicos de cáncer colorrectal hereditario no asociado a poliposis (síndrome de Lynch).
Criterios de exclusión de la primera fase
- Personas con riesgo promedio: se incluirán en la segunda fase del programa.
- Personas con síntomas: serán derivadas para los estudios de diagnóstico necesarios.
- Personas que voluntariamente no deseen efectuar los estudios aconsejados (registro).
Niveles de ejecución de la primera fase
El programa contempla tres niveles de ejecución: estos son orientativos; pueden modificarse adaptándose a los recursos y a las estructuras de salud locales.
Primer nivel del programa de prevención y detección temprana en personas con riesgo elevado:
En la captación de personas a riesgo, es fundamental la función de los agentes sanitarios, los promotores de salud y los médicos en general y otros agentes del área de atención primaria de la salud.
En este nivel del programa se detectarán e invitarán a participar a aquellas personas que cumplan criterios de inclusión mediante la información suministrada por: agentes sanitarios, promotores de salud, afiches y folletos en los centros de atención primaria de la salud (CAPS) y en hospitales, por comunicaciones en medios de difusión locales, participación de ONG o grupos sociales, por iniciativa de los médicos de atención primaria o en consultorios externos de hospitales, etc.
En este nivel se realizará:
- La detección de personas con riesgo mayor de cáncer colorrectal.
- Una consulta especializada de evaluación del riesgo (en caso de contar con la disponibilidad).
El consultorio de evaluación de riesgo de CCR puede funcionar en los mismos centros de salud (1° nivel del programa) o de preferencia en hospitales de referencia por área sanitaria (2° nivel) de acuerdo a las características, disponibilidad y capacitación del recurso humano. Debe ser llevado a cabo por profesionales médicos (clínicos, gastroenterólogos, etc.) que cuenten con la formación y la capacitación necesarias para analizar los antecedentes personales, evaluar los síntomas y la calidad de los exámenes diagnósticos.
Segundo nivel del programa de prevención y detección temprana en personas con riesgo elevado:
Representado por los consultorios de riesgo de CCR preferentemente dispuestos en los hospitales de referencia o también en Centros de Atención Primaria. La preferencia de su ubicación en los hospitales de referencia se aconseja para tener una relación más estrecha con los servicios de diagnóstico y tratamiento y optimizar la gestión de turnos.
Funciones del responsable del consultorio de evaluación de riesgo:
- El análisis del riesgo de la persona y su familia a través de una entrevista de evaluación de antecedentes familiares y personales.
- El registró en la base de datos del programa.
- La indicación de la recomendación personal y familiar de pesquisa de acuerdo al riesgo.
- La entrega, para la firma, del consentimiento informado previo a la realización del o los estudios solicitados.
- La derivación y la facilitación del acceso a los exámenes y eventuales tratamientos de acuerdo a un protocolo específico en el hospital de referencia regional.
- El seguimiento: recepción del estudio solicitado y recomendación de vigilancia posterior.
- La programación de un sistema de recordatorios para convocar a las personas que no completaron la recomendación inicial o deben repetir sus estudios.
- El envío sistemático periódico de los datos al registro regional.
- La consulta y la interacción permanentes con coordinadores regionales.
- Consentimiento informado: se brindará al participante toda la información necesaria sobre los objetivos de la pesquisa, beneficios, limitaciones (falsos positivos y negativos), riesgos y complicaciones de los métodos de estudio y tratamiento que puedan ser necesarios.
- Todas las recomendaciones de estudio y/o tratamiento o evaluación de las familias de las personas con riesgo mayor deben enmarcarse dentro de las normas éticas de confidencialidad, de libertad de elección y de protección de datos personales de acuerdo a la legislación vigente.
Tercer nivel del programa de prevención y detección temprana den personas con riesgo elevado: Centros de diagnóstico y tratamiento en hospitales regionales de referencia u hospitales centrales de la jurisdicción (de acuerdo a las características y disponibilidad locales del sistema de salud).
En este nivel se realizarán los exámenes y tratamientos necesarios para satisfacer las necesidades de los diferentes grupos de riesgo: endoscopías diagnósticas y terapéuticas, biología molecular, test genéticos, inmunohistoquímica, anatomía patológica, cirugías, etc. El algoritmo diagnóstico y terapéutico debe diseñarse previamente con un circuito de derivación preestablecido que dependerá de la estructura sanitaria regional.
Pueden utilizarse los navegadores para guiar al paciente a través del sistema de cuidados de salud, que los conectan con los servicios de diagnóstico y tratamiento. Los navegadores también vinculan a los pacientes con otros servicios dentro del hospital y en la comunidad, incluyendo servicios de nutrición, terapia física, psicología y grupos de apoyo.
Cuarto nivel del programa de prevención y detección temprana en personas con riesgo elevado (estructura de organización u organismo directivo compartida con la segunda fase del programa):
Existen diferentes opciones de estructura de organización que deben adaptarse a las realidades locales. Se puede utilizar un modelo centralizado (con un pequeño número de unidades de organización, que implica un número relativamente reducido de profesionales con alta dedicación de su actividad al programa) o un modelo descentralizado con mayor número de unidades, distribuidas por el territorio, más próximas a la población y con mayor número de profesionales involucrados, que, en general, tendrán una dedicación menor al programa.
El modelo más descentralizado permite aprovechar, en muchos casos, los recursos existentes en el sistema y acercar el programa a la población objetivo, pero presenta más dificultades para mantener la calidad y la homogeneidad del programa que un modelo más centralizado. En todos los casos es indispensable disponer de protocolos específicos de pesquisa, diagnóstico, tratamiento y seguimiento, además de un sistema de monitoreo y evaluación. La estructura y el sistema de organización dependerán del volumen de la población a servir y su distribución territorial.
Modelo de unidades de organización propuestas para el programa:
Estas unidades son las mismas a utilizar en la primera y en la segunda fase del programa.
Unidad de coordinación central (Instituto Nacional del Cáncer)
Funciones de la unidad de coordinación central:
- Coordinación general con las unidades jurisdiccionales/provinciales.
- Creación de un organismo consultor multidisciplinario de referentes de los grupos de riesgo.
- Garantizar la homogeneidad, la equidad y la accesibilidad de las prestaciones.
- Favorecer la eliminación de barreras que impidan el correcto funcionamiento del programa y su sostenibilidad.
- Promoción y enlace con otros profesionales y asociaciones o colaboraciones con asociaciones, sociedades científicas u ONG con objetivos y/o misiones similares para potenciar las acciones.
- Garantizar la calidad en los diferentes niveles y unidades del programa.
- Evaluación de costo-efectividad de las intervenciones propuestas.
- Elaboración del material informativo y divulgativo del programa para la población (cartas, folletos, afiches, carteles, página web, eventos de difusión, campañas, etc.).
- Gestionar los flujos de información en los diferentes niveles de comunicación con la población y otros profesionales acerca de los resultados del programa con publicación periódica de resultados.
- Crear un organigrama de tareas con responsables y plazos de ejecución.
- Elaborar guías nacionales de control de los grupos de riesgo, diagnóstico y tratamiento de las probables patologías diagnosticadas en el programa de acuerdo a la evidencia científica para todos los niveles del programa (conducción y ejecución).
- Reevaluación periódica de las recomendaciones ante la aparición de evidencias nuevas.
- Promover programas de educación continua y capacitación del recurso humano en las diferentes áreas del programa.
- Monitorear y evaluar el programa con indicadores de eficacia.
- Registro central de datos.
- Relaciones con los medios de comunicación.
- Lograr el apoyo y el compromiso político con una financiación que permita garantizar su sustentabilidad en el tiempo.
- Promover la ampliación del programa a los otros sectores de salud (por ejemplo, seguridad social) para asegurar el acceso a toda la población objetivo independientemente de su cobertura de salud.
- Garantizar la confidencialidad, la libertad de elección y la protección de datos personales de los participantes del programa.
Unidad de coordinación jurisdiccional o provincial
Para esta unidad es también fundamental el liderazgo, la capacitación, el conocimiento de la realidad sanitaria local y la capacidad de convocatoria y gestión para la formación de equipos multidisciplinarios incluyendo todas las áreas del sistema de salud.
Antes de la implementación del programa en la jurisdicción, debe hacerse una evaluación de la disponibilidad de recursos materiales y humanos, especialmente en lo referente a calificación, formación y grado de experiencia necesarios en cada uno de los niveles y unidades del programa en la provincia. Es importante el reconocimiento de los liderazgos y compromisos para la elección de los integrantes de los equipos, la identificación de los grupos de interés en relación con el programa para conseguir información, sugerencias y experiencia útil con el fin de elaborar el programa y minimizar la posibilidad de conflictos.
Debe cumplir funciones de coordinación provincial con estrecha interrelación con la unidad de coordinación central.
Funciones de la unidad de coordinación jurisdiccional o provincial
Comparte funciones similares con la coordinación central relacionadas con la situación, la realidad y las condiciones locales.
- Responsable del funcionamiento del programa en la jurisdicción.
- Creación de la estructura del programa en la jurisdicción: equipos multidisciplinarios, unidades de coordinación, etc., y una estructura para llegar a toda la población.
- Coordinación general entre las diferentes unidades del programa.
- Garantizar la homogeneidad y la equidad en la prestación.
- Promoción de asociaciones o colaboraciones con sociedades científicas, asociaciones de pacientes u ONG con objetivos y/o misiones similares para potenciar las acciones.
- Control de calidad en los diferentes niveles y unidades regionales.
- Gestionar los flujos de información en los diferentes niveles.
- Participar con la coordinación central en la elaboración del material informativo y divulgativo del programa (cartas, folletos, carteles, página web, etc.).
- Relaciones con los medios de comunicación.
- Establecer normas ético-legales. Consentimiento informado.
- Hacer cumplir las guías de diagnóstico y tratamiento.
- Lograr el apoyo y el compromiso político con una financiación que permita garantizar su sustentabilidad en el tiempo.
- Crear un organigrama de tareas con responsables y un calendario de ejecución.
- Promover la ampliación del programa a los otros sectores de salud (por ejemplo, seguridad social) para asegurar el acceso a toda la población objetivo independientemente de su cobertura de salud.
Unidad de coordinación hospitalaria
El coordinador de cada hospital está encargado de mantener una interrelación fluida con las áreas de atención primaria (1° nivel), las unidades de diagnóstico (endoscopía, anatomía patológica, biología molecular, etc.) y tratamiento (endoscopía, cirugía, oncología –3° nivel–) para asegurar el éxito del programa. Debe cooperar con el coordinador provincial en la formación de los equipos responsables de las funciones en el hospital, facilitar y eliminar las barreras en los procesos intrahospitalarios.
Se designarán tantas unidades como hospitales de referencia tenga el programa.
Las unidades o servicios de diagnóstico y tratamiento (dentro de cada hospital) se encargarán de coordinar y garantizar la calidad de los protocolos o guías de diagnóstico y tratamiento de las personas que participan del programa. Pueden colaborar en la gestión de la designación de navegadores que acompañen a las personas en los circuitos hospitalarios.
SEGUNDA FASE DEL PROGRAMA: PREVENCIÓN Y DETECCIÓN TEMPRANA DEL CCR EN POBLACIÓN GENERAL (RIESGO PROMEDIO)
Tomando en cuenta la evidencia científica, el relevamiento de recursos efectuado en el país y de acuerdo con las recomendaciones de garantías de calidad de la Comunidad Europea para sus países miembros, la estrategia más apropiada para la población general en nuestro país sería el test inmunoquímico de sangre oculta en materia fecal anual para una población objetivo constituida por las personas de ambos sexos entre 50 y 74 años.2,5
Esta decisión se apoya además en los resultados del estudio de costo-efectividad de las pruebas de tamizaje del cáncer colorrectal en la Argentina publicados recientemente.6
El estudio confirma la evidencia de la literatura internacional que afirma que el tamizaje del CCR es una intervención costo-efectiva y que tanto la estrategia basada en SOMFi anual como aquella centrada en colonoscopía cada diez años resultan ser altamente costo-efectivas cuando se comparan con la ausencia de tamizaje. Los autores además señalan que con presupuestos ajustados, la prueba de detección de SOMFi anual puede representar la alternativa más deseable a la hora de abordar la planificación financiera de un programa de prevención del CCR poblacional.6
En el programa pueden establecerse acuerdos adaptados a cada jurisdicción (provincia, municipio) que podrán variarse progresivamente, previa evaluación de la población objetivo local, la cobertura de salud (subsector público, obras sociales, etc.) y la disponibilidad de colonoscopía.
Las variaciones posibles son: convenir la realización de una o dos determinaciones del test inmunoquímico de sangre oculta en la población objetivo, lo que permite variar la sensibilidad y el número de colonoscopías necesarias. Por otro lado, y sin perder fuerza en la evidencia científica, puede ofrecerse un intervalo anual o bienal del test o incrementar progresivamente la población objetivo, iniciando con un rango más limitado (entre 50 y 64 años) en una primera etapa, para incluir en el mediano plazo, con la incorporación de mayores recursos, la población objetivo total de entre 50 y 74 años.5
Otra posibilidad, sin modificar la población objetivo, es el empleo del test inmunoquímico cuantitativo, utilizando equipamiento de lectura múltiple, que permite ajustar el punto de corte diagnóstico del sangrado a las normativas elegidas en el programa según la disponibilidad de colonoscopía.
Como se mencionó en el capítulo de revisión de la evidencia científica sobre métodos de pesquisa en población de riesgo promedio, para un programa poblacional organizado de pesquisa debe elegirse el método primario que sea accesible a toda la población objetivo, con evaluación previa de disponibilidad de colonoscopía complementaria necesaria para dicha elección y con las garantías de calidad adecuadas.
El test de sangre oculta en materia fecal (TSOMF) es un método de pesquisa para la población general que ha demostrado su rendimiento en la reducción de la mortalidad y en menor grado la incidencia de cáncer colorrectal. Estudios de costo-efectividad en el tamizaje del CCR demuestran que la SOMFi es una alternativa costo-efectiva y apoyan su utilización en programas de pesquisa para la población general entre 50 y 75 años.7-10 Como ya se mencionó, el estudio efectuado en Argentina se alinea con las publicaciones citadas aportando evidencia a la propuesta de esta estrategia de pesquisa en el país.6
El test inmunoquímico de sangre oculta en heces, si bien es más caro que el test de guayaco, requiere un procesamiento más rápido y un mantenimiento en frío de la muestra, ofrece importantes ventajas que lo transforman en el método más adecuado:
- No necesita restricción dietética.
- Cuenta con mayor aceptación, generando una tasa de participación más alta.
- Da menos falsos positivos y por ende, menor número de colonoscopías.
- Necesita un menor número de muestras de heces (una o dos).
- Tiene una mayor sensibilidad para detectar adenomas, adenomas avanzados o cáncer colorrectal.
- Posee una mayor especificidad.
- Permite regular un umbral de detección (en test cuantitativos) para encontrar el equilibrio más adecuado entre sensibilidad y especificidad (es decir, entre la tasa de detección, positividad de la prueba y recursos endoscópicos).
Método de pesquisa aconsejado: test inmunoquímico de sangre oculta en materia fecal anual o bienal con una o dos muestras (según acuerdo programático).
Población objetivo: población de ambos sexos entre 50 y 75 años.
A comienzos del programa, la población objetivo puede circunscribirse a un rango menor (50-64 años) para, luego, avanzar con la implementación en un rango mayor, dependiendo de los recursos disponibles. Esta decisión debe enmarcarse en el acuerdo programático previo por jurisdicción.
Criterios de inclusión:
- Personas con riesgo habitual o promedio de CCR.
- Personas que participen voluntariamente del programa.
- Personas sin síntomas que puedan relacionarse con patología colónica.
Criterios de exclusión:
- Personas pertenecientes a grupos de riesgo moderado y alto de cáncer colorrectal. Se incluyen en programa de alto riesgo.
- Personas con enfermedades graves y/o crónicas asociadas: en estos casos, de acuerdo a criterio médico, se analizará el riesgo-beneficio de la inclusión en la pesquisa.
- Personas que hayan realizado pruebas de pesquisa recientes, de adecuada calidad, que se encuentren dentro del período estipulado de cobertura del estudio (por ejemplo, colonoscopía dentro de los 10 años).
- Personas sintomáticas: serán derivadas para el examen diagnóstico aconsejado.
- Falta de consentimiento del individuo.
Si el test resulta positivo, se derivará al paciente dentro del circuito organizado para realizar la colonoscopía complementaria. Si hay disponibilidad de navegadores, debe asignarse para guiar a los pacientes y facilitar los circuitos necesarios dentro de los servicios de salud.
A aquellas personas cuyos test resultaron negativos se les recomendará un nuevo test al año o a los dos años (de acuerdo a características del programa).
Las lesiones no neoplásicas detectadas en la colonoscopía complementaria serán tratadas de acuerdo a los tratamientos habituales.
Las personas en las cuales se diagnostiquen lesiones colónicas polipoideas serán tratadas mediante polipectomia endoscópica.
Las lesiones polipoideas colónicas que no puedan resecarse por vía endoscópica o los cánceres colorrectales que se diagnostiquen serán derivados para tratamiento quirúrgico y/o oncológico.
Todos los pacientes que presenten lesiones colónicas serán controlados y se establecerá el seguimiento habitual de acuerdo a la patología.
Test de sangre oculta inmunoquímico a utilizar (según acuerdo programático): se puede utilizar el test cualitativo inmunoquímico de sangre oculta en materia fecal, el cual, mediante kit de detección inmediata visual, en general mediante tiras reactivas cromatográficas, detecta la presencia de sangre en materia fecal con un punto de corte fijo en el nivel de sangrado.
En general, los test de estas características detectan sangrados entre 50 y 100 ng/ml y son de fácil lectura visual.
Otra posibilidad es la utilización de test cuantitativos, en los que la utilización de instrumental de lectura permite ajustar el nivel de corte deseado a las normativas elegidas en el programa y la disponibilidad de recursos, ya que el nivel de corte menor, si bien aumenta la sensibilidad, produce un aumento también de la demanda de colonoscopías.
Esta última alternativa requiere la adquisición de aparatología específica, lo que incrementa el costo de la inversión inicial del programa, aunque disminuye el costo individual de las determinaciones.
Se deben tomar una o dos muestras de materia fecal; en este último caso, una muestra de cada deposición en días consecutivos. Si el paciente no tiene un hábito evacuatorio diario, debe tomar de las dos deposiciones consecutivas, guardar las muestras refrigeradas (temperatura entre 2 y 8 grados) y entregarlas dentro de los 7 días en un lugar a determinar. No son necesarias restricciones en la dieta ni suspensión de la medicación habitual.
Se considerará positivo el test cuando alguna de las muestras o ambas resulten positivas.
El test resultará negativo si ambas determinaciones son negativas.
El resultado es inadecuado o erróneo cuando: la muestra es insuficiente, no puede leerse con precisión, la recolección es incorrecta o hay postergación en la entrega más allá del tiempo estipulado. En estos casos debe repetirse la muestra siguiendo los pasos e indicaciones del paso inicial.
En el momento de recibir el resultado positivo, debe proporcionarse el turno para la colonoscopía diagnóstica complementaria dentro de un plazo, de ser posible menor a 30 días, con las instrucciones de preparación del intestino y la firma del consentimiento informado correspondiente.
La colonoscopía ofrecida debe cumplir con las recomendaciones de una de calidad disponible en este documento (ver en anexos las garantías de calidad en colonoscopía). Esta normativa es de fundamental importancia para garantizar un diagnóstico correcto.
Si en la colonoscopía hay hallazgos patológicos, se hará tratamiento y seguimiento individualizado por patología de acuerdo a las normativas ya descriptas previamente.
Si la colonoscopía no llega al ciego, se completará el estudio del colon con una colonografía mediante TAC (colonoscopía virtual) o una radiología de colon por enema con doble contraste (de acuerdo a disponibilidad).
Si todos los estudios colónicos posteriores a un test de sangre oculta positivo son negativos, se termina la pesquisa dentro del programa. Sin embargo, es aconsejable derivar a estas personas para una investigación del tubo digestivo superior (esófago, estómago e intestino delgado) aunque no se encuentre dentro de los objetivos del programa.
SISTEMA DE REGISTRO DEL PROGRAMA NACIONAL DE PREVENCIÓN Y DETECCIÓN TEMPRANA DEL CÁNCER COLORRECTAL
Programa Nacional cuenta con una herramienta informática que permite evaluar el desempeño de las actividades del programa, denominada SITAM (Sistema de información de tamizaje colorrectal).
Este programa registra a las personas que acceden a los procedimientos de tamizaje, diagnóstico y tratamiento y permite monitorear indicadores de calidad tales como los tiempos de cumplimiento de los procedimientos y elaborar estadísticas que describen las actividades de los servicios.
Este programa ya ha sido utilizado en los programas de control del cáncer cérvico-uterino y mama, permitiendo su ajuste para mejorar su eficiencia.
El Programa Nacional de prevención y detección temprana del cáncer colorrectal tiene entre sus objetivos el desarrollo e implementación de un sistema de información estratégica para el monitoeo y evaluación del programa a nivel nacional para lo cual desarrolló el Sistema de información para el tamizaje colorrectal (SITAM módulo colon, versión1.2)2,11 que permite:
- Llevar el registro de los procedimientos realizados por los servicios de salud, facilitando el seguimiento de las personas en las diferentes etapas del proceso de atención.
- Proveer a todos los efectores de información actualizada, comparable y con distintos grados de agregación, permitiendo el seguimiento de las personas y de las acciones de los servicios.
- Monitorear la calidad de las acciones realizadas en al marco del programa y su impacto en los indicadores sanitarios del CCR.
- Simplificar el intercambio entre los diferentes servicios y unidades de coordinación, permitiendo detectar barreras o dificultades e implementar mejoras. Su diseño cuenta con un formato accesible a los requerimientos del trabajo cotidiano, habilitando la posibilidad de búsqueda de pacientes y la generación de informes y estadísticas con la confección de informes diagnósticos de los diferentes procesos del programa.
Todos los datos de registro de las diferentes fases del programa e indicadores de detección y de rendimiento tempranos y a largo plazo que se muestran a continuación pueden ser registrados, evaluados y monitoreados en el SITAM colorrectal (se adjunta en anexo el manual del SITAM colon, versión 1.2).
Registro de datos de la primera fase del programa (grupos de riesgo aumentado)
Población objetivo: son las personas con riesgo aumentado que residen en el área determinada.
Población participante: son las personas que recibieron información efectiva, fueron citadas y efectuaron la consulta de riesgo dentro del programa.
Registro de personas por grupo de riesgo: deben registrarse todas las personas que cumplan criterios de inclusión por grupo de riesgo.
Población con derivación a colonoscopía: son las personas que luego de la entrevista de riesgo son derivadas para la realización de la colonoscopía.
Población con derivación para vigilancia endoscópica ulteriormente: son las personas que luego de la entrevista de riesgo deben estudiarse a futuro (por ejemplo: presentan estudios de calidad dentro de la cobertura estipulada para el grupo de riesgo y deben cumplir su control a futuro).
Población derivada para estudio de biología molecular (si está disponible): son las personas con antecedentes de síndromes hereditarios que ameriten el estudio de biología molecular y que son derivadas para su realización.
Población derivada para estudio de inmunohistoquímica (si está disponible): son las personas con antecedentes de síndromes hereditarios que ameriten el estudio de inmunohistoquímica y que son derivadas para su realización.
Población derivada para estudio genético (si está disponible): son las personas con antecedentes de síndromes hereditarios que ameriten el estudio genético y que son derivadas para su realización.
Población examinada: son las personas que efectivamente realizaron el estudio recomendado en la entrevista de riesgo. Discriminar por tipo de estudio: colonoscopía, biología molecular, etc.
Detección de pacientes con displasia de bajo/alto grado en las colonoscopías de portadores de enfermedad inflamatoria intestinal: personas con enfermedad inflamatoria intestinal en las que se detectó una displasia en la biopsia en la colonoscopía de vigilancia. Registrar displasia de bajo y alto grado por separado.
Detección de adenomas: número de personas adecuadamente testeadas en las que se detectó al menos un adenoma en el período de tiempo estipulado. Registrar por separado de acuerdo al grupo de riesgo.
Detección de adenomas avanzados: número de personas en las que se detectó al menos un adenoma avanzado (adenoma de más de 1cm / adenoma con componente velloso / adenoma con displasia de alto grado). Registrar por separado de acuerdo al grupo de riesgo.
Resección de adenomas por colonoscopía: número de personas y número de adenomas resecados por colonoscopía.
Indicación quirúrgica: número de personas a las cuales se indicó cirugía de acuerdo al grupo de riesgo. Registrar indicación de acuerdo al grupo.
Cáncer detectado por estadio: número de personas en las que se detectó al menos un cáncer colorrectal y el estadio tumoral correspondiente. Registrar por separado de acuerdo al grupo de riesgo.
Distribución por estadios de los cánceres diagnosticados:
- Estadio I: número de cánceres detectados en estadio I (T1/T2 N0 M0) de entre todos los cánceres detectados en el cribado.
- Estadio II: número de cánceres detectados en estadio II (T3/T4 N0 M0) de entre todos los cánceres detectados en el cribado.
- Estadio III: número de cánceres detectados en estadio III (cualquier T N1/N2 M0) de entre todos los cánceres detectados en el cribado.
- Estadio IV: número de cánceres detectados en estadio IV (cualquier T cualquier N M1) de entre todos los cánceres detectados en el cribado.
Complicaciones de la colonoscopía: número de personas con complicaciones graves (perforación, sangrado que requiere transfusión, internación u observación por 24 hs) en las colonoscopías.
Complicaciones de la cirugía: número de personas con complicaciones de la cirugía indicada.
Tratamiento oncológico: número de personas enviadas para tratamiento oncológico. Registrar por estadio.
Indicadores tempranos de rendimiento y de detección del programa en la primera fase (grupos de riesgo aumentado)
Todos los indicadores de rendimiento deben estar referidos a un plazo determinado, que puede ser anual o semestral. Depende de la decisión del programa, en virtud de la necesidad de corregir errores o no en forma inmediata.
Los tiempos de espera estimados como aceptables en esta primera fase para la realización de los estudios de diagnóstico son más prolongados que en la segunda fase, ya que, en general, la indicación en los grupos de riesgo se debe a antecedentes o situaciones de control que permiten mayor flexibilidad.
Cobertura de la población objetivo: número de personas de la población objetivo alcanzadas por la información, invitación y difusión del programa sobre el total de la población.
Detección de población objetivo: son las personas que cumplen los criterios de inclusión sobre el total de la población objetivo, alcanzadas por la difusión en un plazo determinado.
Tiempo de espera máximo para la consulta de riesgo: 90% dentro de los 30 días; deseable, 95% dentro de los 30 días.
Tasa de participación: son las personas que recibieron información efectiva y efectuaron la consulta de riesgo dentro del programa sobre el total de personas de la población elegible. Plazo determinado.
Tasa de aceptación/ejecución de colonoscopía: número de personas enviadas para colonoscopía que realizaron la misma sobre el total de personas enviadas para el estudio.
Tiempo de espera máximo entre la solicitud y la realización de colonoscopía: aceptable, 90% dentro de los 60 días; deseable, 95%.
Tasa de colonoscopías completas: número de colonoscopías que llegaron al ciego sobre el total de colonoscopías efectuadas: aceptable 90%; deseable 95%.
Tasa de aceptación de vigilancia endoscópica: número de personas que realizaron la vigilancia endoscópica sobre el total de las personas derivadas para vigilancia.
Tasa de aceptación/ejecución de estudio de biología molecular (si está disponible): número de personas que efectuaron estudio de biología molecular sobre el total de las personas derivadas para estudio de biología molecular.
Tiempo de espera máximo entre la solicitud y la realización del estudio de biología molecular: aceptable, 90% dentro de los 60 días; deseable, 95%.
Tasa de positividad del estudio de biología molecular: número de personas con resultado positivo en el estudio de biología molecular sobre el total de las personas que efectuaron el estudio de biología molecular.
Tasa de aceptación/ejecución de estudio de inmunohistoquímica (si está disponible): son las personas que efectuaron el estudio de inmunohistoquímica sobre el total de personas derivadas para su realización.
Tiempo de espera máximo entre la solicitud y realización de estudio de inmunohistoquímica: aceptable, 90% dentro de los 60 días; deseable, 95%.
Tiempo de espera máximo para estudio anatomopatológico: aceptable, 90% dentro de los 15 días; deseable, 95%.
Tasa de positividad del estudio de inmunohistoquímica: número de personas con resultado positivo en el estudio de biología molecular sobre el total de las personas que efectuaron el estudio de biología molecular.
Tasa de aceptación/ejecución del estudio genético: son las personas que efectuaron el estudio genético aconsejado sobre el total de personas derivadas para su realización.
Tasa de positividad del estudio genético: son las personas con resultado positivo en el estudio genético aconsejado sobre el total de personas que efectuaron el estudio. Discriminar por grupo de riesgo.
Tiempo de espera máximo entre la solicitud y realización de estudio genético: aceptable, 90% dentro de los 60 días; deseable, 95%.
Tasa de detección de displasia en enfermedad inflamatoria intestinal: número de pacientes con displasia en las biopsias de la colonoscopía de vigilancia sobre el total de pacientes con enfermedad inflamatoria intestinal que se efectuaron la colonoscopía de vigilancia. Discriminar entre displasia de bajo y alto grado.
Tasa de detección de adenomas: número de personas en las que en la colonoscopía se detectó al menos un adenoma sobre el número de personas estudiadas con colonoscopía en el período de tiempo estipulado. Calcular por separado de acuerdo al grupo de riesgo.
Tasa de detección de adenomas avanzados: número de personas en las que en la colonoscopía se detectó al menos un adenoma avanzado (adenoma de más de 1 cm / adenoma con componente velloso / adenoma con displasia de alto grado) sobre el total de personas estudiadas con colonoscopías. Calcular por separado de acuerdo al grupo de riesgo.
Tasa de diagnóstico de cáncer detectado por estadio: número de personas en las que se detectó al menos un cáncer colorrectal y el estadio tumoral correspondiente. Calcular por separado de acuerdo al grupo de riesgo.
Porcentaje de cánceres diagnosticados en estadio I: proporción de personas diagnosticadas en estadio I en relación a todos los diagnósticos de cáncer (todos los estadios). Calcular por separado de acuerdo al grupo de riesgo.
Tasa de complicaciones de la colonoscopía: número de personas con complicaciones graves (perforación, sangrado que requiere transfusión, internación u observación por 24 hs) sobre el total de personas a las cuales se les realizó colonoscopía. Deseable: 0,0%-0,3%
Tasa de aceptación de cirugía: número de personas derivadas a cirugía que se operaron sobre el total de personas derivadas a cirugía. Calcular por indicación y grupo de riesgo.
Tiempo de demora entre la indicación quirúrgica y la realización de la cirugía: aceptable, 90% dentro de los 30 días; deseable, 95%.
Tasa de complicaciones de la cirugía: número de personas con complicaciones quirúrgicas sobre el total de personas operadas.
Intervalo de tiempo entre el diagnóstico y el tratamiento de las patologías detectadas: aceptable, 90% dentro de los 30 días; deseable, 95%.
En la tabla 49 se muestran los principales indicadores tempranos de rendimiento de la primera fase del programa (prevención y detección temprana del CCR en grupos de riesgo aumentado.
Registro de datos de la segunda fase del programa (grupo de riesgo promedio)
Los datos que deben registrarse del programa son:
Población objetivo: son las personas dentro de la edad elegida de acuerdo con la política del programa que residen en el área determinada.
Población elegible: son las personas en la población objetivo que cumplen con los criterios de inclusión en la política del programa.
Población testeada o participante: son las personas que recibieron el test de pesquisa y lo realizaron independientemente del resultado. Se incluyen aquellos con pruebas positivas, negativas e inadecuadas o erróneas.
Población con test inadecuado o erróneo: es un examen entregado por un participante cuyo resultado no se puede determinar con fiabilidad y no puede ser utilizado para registrar un resultado.
Población con test positivo: un resultado positivo del test de sangre oculta es un resultado basado en una prueba adecuada que, de acuerdo con la política del programa, lleva directamente a la remisión o a una colonoscopía complementaria diagnóstica.
Población enviada a la colonoscopía: participantes con un test positivo enviados a colonoscopía complementaria estipulada en el programa.
Población que completó la colonoscopía: número de personas que realizaron la colonoscopía indicada luego de SOMFi positivo.
Población con SOMFi positivos con colonoscopía negativa (sin hallazgos): número de personas con SOMFi positivo en las que la colonoscopía complementaria no detectó patología.
Detección de lesiones: número de personas adecuadamente testeadas en las que se detectó al menos una lesión.
Detección de adenomas: número de personas adecuadamente testeadas en las que se detectó al menos un adenoma en el período de tiempo estipulado.
Detección de adenomas avanzados: número de personas en las que se detectó al menos un adenoma avanzado (adenoma de más de 1 cm / adenoma con componente velloso / adenoma con displasia de alto grado).
Cáncer detectado por estadio: número de personas en las que se detectó al menos un cáncer colorrectal y el estadio tumoral correspondiente.
Distribución por estadios de los cánceres diagnosticados:
- Estadio I: número de cánceres detectados en estadio I (T1/T2 N0 M0) de entre todos los cánceres detectados en el cribado.
- Estadio II: número de cánceres detectados en estadio II (T3/T4 N0 M0) de entre todos los cánceres detectados en el cribado.
- Estadio III: número de cánceres detectados en estadio III (cualquier T N1/N2 M0) de entre todos los cánceres detectados en el cribado.
- Estadio IV: número de cánceres detectados en estadio IV (cualquier T cualquier N M1) de entre todos los cánceres detectados en el cribado.
Porcentaje de cánceres diagnosticados en estadio I: proporción de personas diagnosticadas en estadio I en relación a todos los diagnósticos de cáncer (todos los estadios).
Complicaciones de la colonoscopía post SOMFi positivo: número de personas con complicaciones graves (perforación, sangrado que requiere transfusión, internación u observación por 24 hs) en las colonoscopías post SOMFi positivo.
Complicaciones de la colonoscopía de vigilancia: número de personas con complicaciones graves en las colonoscopías de vigilancia.
Indicación quirúrgica: número personas enviadas para cirugía. Registrar por indicación (pólipo no resecable endoscópicamente, cáncer, etc.).
Tipo de cirugía efectuada: tipo de cirugía efectuada de acuerdo a las características de la lesión y su localización.
Complicaciones de la cirugía: número de personas con complicaciones de la cirugía indicada. Registrar por tipo de cirugía e indicación.
Tratamiento oncológico: número de personas enviadas para tratamiento oncológico. Registrar por estadio.
Indicadores tempranos de rendimiento de la segunda fase del programa (grupo de riesgo promedio)
Estos indicadores de rendimiento se basan en las recomendaciones europeas para generar los datos para el monitoreo del cribado de cáncer colorrectal.5,12
Cobertura de la población por invitación: número de personas invitadas en un tiempo determinado del total de la población elegible dentro de la población objetivo en ese mismo tiempo.
Tasa de participación: número de personas invitadas y estudiadas con tamizaje en un determinado tiempo sobre el número de personas elegibles invitadas en el mismo tiempo.
Tasa de SOMFi inadecuado: proporción de personas examinadas con SOMFi inadecuados o erróneos sobre el total de personas testeadas en ese mismo período de tiempo (por ejemplo, exceso de muestra, escasez de muestra, muestra fuera de período aconsejado).
Tasa de SOMFi positivo: porcentaje de personas con resultado positivo de la determinación de sangre oculta sobre el total de personas que realizaron el test de manera adecuada (excluyendo erróneos).
Tiempo de espera para el resultado de la prueba de sangre oculta: en más del 90% de los casos sería aceptable como plazo máximo 15 días; deseable, dentro de los 7 días.
Tasa de referencia para una colonoscopía diagnóstica luego de un SOMFi positivo: se define como la proporción de personas enviadas a colonoscopía luego de un resultado positivo sobre el número de personas con test positivo en el mismo período.
Tiempo de espera máximo entre la solicitud y realización de colonoscopía diagnóstica en SOMFi positivo: aceptable, 90% dentro de los 30 días; deseable, 95%.
Índice de cumplimiento de la colonoscopía en los test positivos: número de personas que realizaron la colonoscopía luego de test positivo en un período de tiempo determinado sobre el número de personas referidas para colonoscopía luego de test positivo en el mismo tiempo.
Tasa de colonoscopías completas luego de SOMFi positivo: número de colonoscopías que llegaron al ciego sobre el total de colonoscopías efectuadas luego de test positivo.
Tasa de complicaciones de colonoscopía post SOMFi positivo: número de personas que presentaron complicaciones graves en la colonoscopía sobre el número de personas que se realizaron la colonoscopía post SOMFi positivo (tiempo determinado).
Tasa de complicaciones de la colonoscopía de vigilancia: número de personas que presentaron complicaciones en la colonoscopía de vigilancia sobre el número de personas que se realizaron la colonoscopía de vigilancia (tiempo determinado).
Intervalo de tiempo entre el diagnóstico de la enfermedad y el inicio del tratamiento definitivo: nivel aceptable: > 90% dentro de 30 días; deseable, > 95%.
Indicadores de detección de la segunda fase del programa (grupo de riesgo promedio)
Tasa de detección de lesiones: número de personas con SOMFi positivo donde la colonoscopía detectó al menos una lesión sobre el total de personas que realizaron la colonoscopía luego de SOMFi positivo.
Tasa de detección de adenomas: número de personas en las que se detectó al menos un adenoma en el período de tiempo estipulado sobre el número de personas adecuadamente testeadas en el mismo período.
Tasa de detección de adenomas avanzados: proporción de los participantes en los que se detectó al menos un adenoma avanzado entre los testeados adecuadamente durante el plazo determinado.
Tasa de detección de cáncer: número de personas con al menos un cáncer colorrectal detectado sobre el total de personas adecuadamente testeadas en un tiempo determinado.
Tasa de detección de cáncer temprano: porcentaje de cánceres en etapa temprana sobre el total de los cánceres detectados durante la pesquisa.
Valor predictivo positivo para la detección de lesiones: número de personas con al menos una lesión detectada en la colonoscopía post SOMFi positivo sobre el número de personas que se realizaron la colonoscopía post SOMFi positivo (período de tiempo determinado).
Valor predictivo positivo para la detección de adenomas: número de personas en las que se detectó al menos un adenoma en la colonoscopía de evaluación post SOMFi positivo sobre el número de personas que se realizaron la colonoscopía de control post SOMFi positivo (período de tiempo determinado).
Valor predictivo positivo para la detección de adenomas avanzados: número de personas en las que se detectó al menos un adenoma avanzado en la colonoscopía de evaluación post SOMFi positivo sobre el número de personas que se realizaron la colonoscopía de control post SOMFi positivo (período de tiempo determinado).
Valor predictivo positivo para la detección de CCR: número de personas en las que se detectó al menos un CCR en la colonoscopía de evaluación post SOMFi positivo sobre el número de personas que se realizaron la colonoscopía de control post SOMFi positivo (período de tiempo determinado).
Indicadores de impacto del programa de prevención y detección temprana del CCR a largo plazo (ambas fases)
Cánceres de intervalo: son los cánceres que ocurren después de una ronda de estudio negativa, en el intervalo antes de la invitación para el próximo test programado. En programas con SOMFi, los cánceres de intervalo pueden ocurrir después de un SOMFi negativo o después de un resultado positivo post colonoscopía negativa. En la primera fase del programa son los cánceres que aparecen en los intervalos de vigilancia o por falta de cumplimiento de la vigilancia recomendada. Las tasas de cánceres de intervalo reflejan tanto la sensibilidad de la prueba de detección (falsos negativos) como la incidencia de nuevos casos o deficiencias en el programa.
Tasa de incidencia de CCR: inmediatamente después de la introducción de un programa de cribado y control de grupos de riesgo, las tasas de incidencia en el rango de edad objetivo pueden aumentar debido a la detección por pesquisa de enfermedades prevalentes, pero luego bajarán en la medida en que el programa detecte y trate efectivamente más personas con lesiones precancerosas.
Tasa de CCR en estadio temprano (estadios I y II): número de cánceres detectados en estadio temprano con respecto al total de cánceres detectados.
Tasas de mortalidad por CCR: deben pasar varios años antes de que el impacto del cribado poblacional sobre la mortalidad por CCR llegue a ser observable y muchos años más para lograr el efecto completo
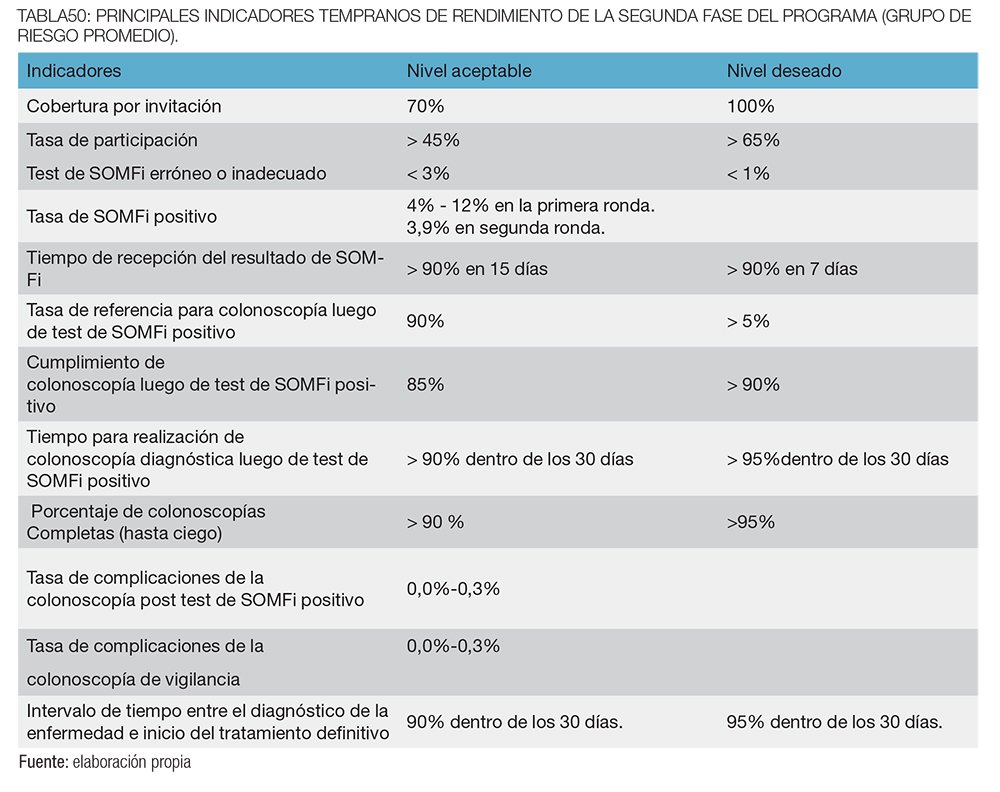
En la tabla 50 se muestran los principales indicadores tempranos de rendimiento de la segunda fase del programa (prevención y detección temprana del CCR en grupo de riesgo promedio.
BIBLIOGRAFÍA
- Resolución Ministerial 2173. Creación del Programa Nacional de Prevención y Detección temprana del cáncer colorrectal. Ministerio de Salud de la Nación, 30 de diciembre de 2013. Disponible online en: <http://www.msal.gob.ar>.
- Gualdrini, U.A. e Iummato, L.E. (2012): “Cáncer colorrectal en la Argentina: Organización, cobertura y calidad de las acciones de prevención y control. Informe final de diciembre de 2011: Diagnóstico de situación de la Argentina. Propuesta del Programa de prevención y detección temprana, y acciones para su implementación”. Buenos Aires: Instituto Nacional de Cáncer. Disponible online en: <http://www.msal.gob.ar>.
- OMS (2006): “Cancer control: knowledge into action: WHO guide for effective programmes: Planning”. Ginebra: OMS. Disponible online en: <http://www.who.int>.
- OMS (2007): “Cancer control: knowledge into action: WHO guide for effective programmes: early detection”. Ginebra: OMS. Disponible online en: <http://apps.who.int/iris/bitstream/10665/43743/1/9241547338_eng.pdf>.
- Segnan, N.; Patnick, J.; -Von Karsa, L. et al. (2010): “European guidelines for quality assurance in colorectal cancer screening and diagnosis”. Luxemburgo: European Commission, Publications Office of the European Union.
- Espinola, N.; Maceira, D. y Palacios, A. (2016): “Costo-efectividad de las pruebas de tamizaje del cáncer colorrectal en la Argentina”. En: Acta Gastroenterol Latinoam, 46: 8-17.
- Fernández Marcos, A.; Pastor, A.; Pérez Segura, P. et al. (2010): “Cribado del cáncer de colon en España. ¿Es costo-eficaz?”. Madrid: Alianza para la Prevención del Cáncer de Colon en España.
- Sharp, L.; Tilson, L.; Whyte, S. et al. (2012): “Cost-effectiveness of population-based screening for colorectal cancer: a comparison of guaiac-based faecal occult blood testing, faecal immunochemical testing and flexible sigmoidoscopy”. En: British Journal of Cancer, 106: 805-816.
- Van Rossum, L.G.; Van Rijn, A.F.; Verbeek, A.L.; Van Oijen, M.G.; Laheij, R.J.; Fockens, P.: Jansen, J.B.; Adang, E.M. y Dekker, E. (2011): “Colorectal cancer screening comparing no screening, immunochemical and guaiac fecal occult blood tests: A cost-effectiveness analysis”. En: International Journal of Cancer, 128: 1908-1917.
- Rabeneck, L.; Rumble, R.B.; Thompson, F.; Mills, M.; Oleschuk, C.; Whibley, A.; Messersmith, H. y Lewis, N. (2012): “Fecal immunochemical tests compared with guaiac fecal occult blood tests for populationbased colorectal cancer screening”. En: Canadian Journal of Gastroenterology, 26: 131.
- STAM colon, versión 1.2. Programa de prevención y detección temprana del cáncer colorrectal. Buenos Aires: Instituto Nacional del Cáncer. Disponible online en: <http://www.msal.gob.ar>.
- Anttila, A.; Lönnberg, S.; Ponti, A. et al. (2015): “Towards better implementation of cancer screening in Europe through improved monitoring and evaluation and greater engagement of cancer registries”. En: European Journal of Cancer, 51: 241-251.