Capítulo 7
CAPÍTULO 7
Planificación, organización e implementación de programas de pesquisa del cáncer colorrectal. Programas de pesquisa del CCR en el mundo*
PESQUISA ORGANIZADA Y OPORTUNISTA
Un programa de pesquisa organizado implica un proceso sistemático de invitación a participar del tamizaje a una población objetivo determinada, asegurando el seguimiento de los participantes con resultados positivos, además de garantizar y monitorear la calidad de cada paso en el proceso de ejecución del programa. La IARC define los siguientes elementos que definen un programa de cribado organizado:1
- Una política explícita que especifique las categorías de edad, el método de tamizaje y su intervalo.
- Una población objetivo definida.
- Un equipo de gestión responsable de la implementación.
- Un equipo de atención médica para adoptar las decisiones, el tratamiento, el cuidado y el seguimiento de los pacientes con pruebas de tamizaje positivas.
- Una estructura de garantía de calidad para cada paso en el proceso.
- Un proceso para el seguimiento, la evaluación y la identificación de los casos de cáncer en la población.
En el cribado organizado, es necesario una infraestructura tecnológica informática para apoyar el programa, que incluye sistemas para las invitaciones, re-llamados, recordatorios y seguimiento de los resultados, lo que garantiza el seguimiento y rastreo de los resultados clínicos, la incidencia, mortalidad y los estadios del cáncer colorrectal.2 Para el seguimiento de los resultados del tamizaje del CCR deben establecerse un conjunto de medidas e indicadores junto a un registro de cáncer con vinculación a otras bases de datos posibles, de laboratorios y centros de endoscopía.2,3
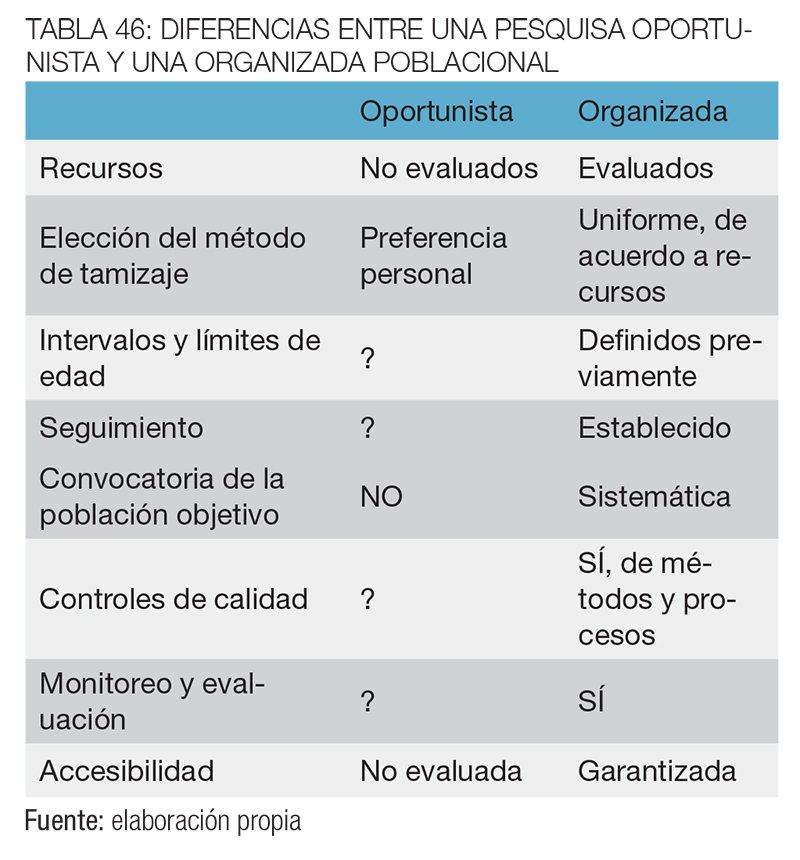
En contraste, el cribado oportunista no se ofrece de una manera organizada, solo por solicitud de las personas o por recomendación del médico en consulta, y en algunos sistemas de salud a través del pago por servicio de reembolso a los médicos. La pesquisa organizada brinda una mayor atención a las garantías de calidad y a la protección frente a los posibles daños de los exámenes, como la sobre indicación de estudios, insuficiencia o mala calidad de la pesquisa o las complicaciones derivadas de los exámenes. Busca asegurar el uso adecuado de los recursos y el apropiado seguimiento de las personas con hallazgos patológicos.1,3,4
En los programas de cribado oportunista estos aspectos no se toman en cuenta y no es posible una evaluación de los beneficios y los posibles daños. Otras desventajas del cribado oportunista son la probable indicación de exámenes innecesarios por persona y la baja cobertura de toda la población objetivo, lo que lleva a un menor impacto en los indicadores de salud pública.5
El enfoque para la pesquisa en los EE. UU. es en gran medida oportunista y las contribuciones e iniciativas de calidad de muchas organizaciones nacionales, como el Grupo de Servicios Preventivos de EE. UU. (USPSTF), fueron cruciales para generar recomendaciones y guiar la elección de los test de pesquisa.6 Además, múltiples asociaciones de profesionales en dicho país han hecho hincapié en la importancia de una colonoscopía de calidad en el contexto del tamizaje del CCR.7,8
No obstante, la equidad en el acceso a la pesquisa del CCR en los EE. UU. sigue siendo incierta.9
En la tabla 46, se enumeran las diferencias que existen entre una pesquisa de tipo oportunista y una organizada poblacional.
Principios básicos para la organización de un programa de pesquisa del cáncer colorrectal
-
Un programa de pesquisa del cáncer colorrectal es una misión multidisciplinaria cuyo objetivo es reducir la mortalidad y aun la incidencia por cáncer colorrectal sin afectar negativamente el estado de salud de las personas que participan del tamizaje y cuya eficacia depende de la calidad de los componentes individuales del proceso.
Requiere un liderazgo sólido para generar claridad y unidad de propósito, para fomentar la formación de equipos con propiedad y una amplia participación en los procesos con el fin de fomentar el aprendizaje continuo y el mutuo reconocimiento de los esfuerzos realizados. Es trascendental la participación de todos los sectores relacionados y en todos los niveles de la toma de decisiones, a fin de lograr una participación activa y el compromiso de los principales involucrados para el beneficio del programa.
Se debe estimular la creación de asociaciones con instituciones y organizaciones que tengan misiones e intereses comunes con el programa y que puedan aportar información, sugerencias, recursos y experiencia útil en la elaboración del plan y que, incluso, puedan involucrarse en alguna fase de su implementación. La interrelación con asociaciones de pacientes, ONG, colegios médicos, sociedades científicas, departamentos de universidades, etc. puede mejorar la eficacia a través de relaciones mutuamente beneficiosas, construir la confianza y complementar las capacidades.
- El programa debe tener en cuenta tanto los valores y preferencias de los individuos como también las perspectivas de salud pública.
-
En la planificación, la perspectiva de salud pública requiere el compromiso de garantizar la igualdad de acceso a toda la población y la sustentabilidad del programa a través del tiempo. Además deben tomarse decisiones basadas en la evidencia científica, en los valores sociales, en la eficiencia y en un uso costo-efectivo de los recursos.
Debe preverse la implementación del programa en un enfoque global de salud, integrando objetivos comunes con otros programas relacionados al control del cáncer u otras enfermedades (por ejemplo, otras enfermedades no transmisibles). Una estrategia integrada y global de control del cáncer permite un uso de los recursos limitados más equilibrado, eficiente y equitativo. También debe adoptarse un enfoque por etapas en la planificación y ejecución de las intervenciones, basándose en consideraciones y necesidades locales. En los medios de bajos recursos, un plan que considera la gradual aplicación de pocas intervenciones, asequibles, rentables y prioritarias, tendrá una mejor oportunidad de avanzar hacia una acción efectiva. -
Teniendo en cuenta la perspectiva del individuo, requiere un compromiso del programa con la participación informada de la población, con un servicio seguro y de alta calidad, que responda a las necesidades de las personas en riesgo de desarrollar CCR o de aquellas que ya presenten la enfermedad, con el fin de satisfacer sus necesidades psicosociales, físicas y espirituales.
Para el éxito de un programa de cribado, es necesario un criterio de selección adecuado, una tasa de participación alta de la población y una equidad en el acceso a las pruebas. Deben plantearse estrategias y esfuerzos de promoción para fomentar la participación en el programa. -
La implementación no solo requiere llevar a cabo pruebas de pesquisa y remisión de las personas a estudios complementarios cuando está indicado. Deben desarrollarse además protocolos específicos para identificar e invitar a la población objetivo, como también para el manejo de los pacientes en la fase de diagnóstico, tratamiento y vigilancia, garantizando que todas las personas tengan acceso a las opciones apropiadas.
La organización de un programa organizado de pesquisa del CCR es un proceso de múltiples pasos que incluye: la identificación de la población objetivo, el reclutamiento de las personas elegibles, la prueba de pesquisa, la notificación de los resultados, la información sobre la fecha de la próxima prueba en caso de estudios normales, el aviso a las personas con prueba errónea inadecuada, el seguimiento de las personas con pruebas positivas (procedimientos de diagnóstico y tratamiento necesarios) y el registro y evaluación de todo el programa. La eficacia del cribado (impacto sobre la mortalidad y la incidencia de CCR) está influenciada por la calidad de los componentes individuales del proceso, desde la organización y administración hasta la evaluación, tratamiento y seguimiento de las lesiones detectadas. - Registro completo y preciso de los datos relevantes de cada individuo y de cada prueba de detección, incluyendo los resultados del examen inicial, los procedimientos de diagnóstico y tratamiento y los resultados posteriores. Este proceso de monitoreo y evaluación es de fundamental importancia. Debe haber una interrelación entre el registro de cáncer o de defunciones y el registro de la población pesquisada para incluir los ajustes necesarios al programa y asegurar la evaluación de los efectos y el seguimiento de las causas de muerte a nivel individual.
- La garantía de calidad requerida para los diferentes pasos de la pesquisa, el diagnóstico y el tratamiento también deben mejorar la calidad del servicio ofrecido a los pacientes sintomáticos. Debe asegurarse la disponibilidad y accesibilidad a los servicios de calidad garantizada para el diagnóstico y el tratamiento de cáncer colorrectal y de las lesiones precursoras.
- Un adecuado apoyo político y financiero es crucial para la implementación exitosa y para la sustentabilidad de cualquier programa de pesquisa. Además, son necesarios recursos para la búsqueda de la mejora continua, la innovación y la creatividad, con el fin de maximizar el rendimiento y abordar las diversidades sociales y culturales, así como las necesidades y desafíos que se presenten.
Pre requisitos para organizar un programa de tamizaje del CCR
Cuando se busca organizar un nuevo programa de tamizaje del CCR deben ser considerados los siguientes aspectos fundamentales:1,10
- Un marco legal para la identificación y el seguimiento de la población.
- Datos epidemiológicos necesarios disponibles y exactos sobre los cuales se basa la decisión de comenzar la pesquisa.
- Disponibilidad y accesibilidad de los datos demográficos esenciales para identificar la población objetivo y establecer un sistema de invitación.
- Accesibilidad y disponibilidad de los servicios de calidad para el diagnóstico y tratamiento del cáncer colorrectal y sus lesiones precursoras.
- Campañas de promoción para fomentar la participación en el programa.
- Una relación de trabajo en conjunto con el registro local del cáncer, si está disponible, y los registros de mortalidad, registros poblacionales y registros del tamizaje, a fin de incluir los ajustes del programa asegurando la evaluación de los efectos y el seguimiento.
La evaluación y la interpretación de los resultados de todo el programa de cribado se ven directamente afectados por estos aspectos. Por lo tanto, la viabilidad de un programa administrado de manera efectiva debe ser construida gradualmente en base a los recursos y las limitaciones prácticas que impidan la cobertura total de la población objetivo en el comienzo del programa.11
El contexto y la logística de los programas de cribado serán diferentes según el país, e incluso en regiones o jurisdicciones dentro de un mismo país. La existencia previa de un registro de población facilita el envío de invitaciones personalizadas, mientras que la falta del registro puede fomentar el reclutamiento por invitación abierta. Muchas de estas diferencias contextuales explicarán las diferencias en los resultados.
Implementación de un programa de pesquisa del cáncer colorrectal
La pesquisa del CCR organizada es un proceso de múltiples etapas:1
- Identificación de la población objetivo.
- Reclutamiento de los sujetos elegibles.
- Entrega de prueba de tamizaje elegida.
- Notificación de los resultados de las pruebas.
- Información de resultados normales y agenda del próximo examen.
- Convocatoria para repetir pruebas de tamizaje insatisfactorias / inadecuadas.
- Seguimiento de las personas con pruebas positivas en los procedimientos de diagnóstico y tratamiento complementarios necesarios.
- Registro, monitoreo y evaluación de todo el programa.
Las regiones incluidas y la población objetivo deben estar claramente definidas. Los datos necesarios para la identificación de las personas, cobertura médica y la dirección de contacto pueden proporcionarlos los registros de población, de seguridad social, servicios de salud, electoral o de otros programas de cribado.
Si no existe un registro preciso, completo y actualizado periódicamente de la población objetivo, se debe implementar una base de datos administrativa para el programa combinando la información de los registros disponibles. La base jurídica para el acceso a estos registros debe estar establecida y todas las medidas de protección de datos deben ser implementadas de acuerdo con la legislación nacional.
La población objetivo de un programa de cribado del CCR incluye a todas las personas elegibles para asistir a la pesquisa en función de la edad y el área geográfica de residencia. Sin embargo, cada programa puede aplicar criterios adicionales de inclusión o exclusión para la población elegible, como por ejemplo: deterioro en las condiciones de salud de la persona en la que ofrecer la prueba de pesquisa no resulta beneficioso, examen de pesquisa previa reciente (el período en cuestión deben especificarse y justificarse), diagnóstico previo de CCR o lesiones pre-malignas (estos pacientes deberían estar controlados de acuerdo con protocolos específicos de vigilancia).1
Las personas con una historia familiar de CCR se excluyen de los exámenes de tamizaje destinados a las personas con riesgo promedio. Para ello se requiere la adopción de procedimientos para la identificación de las mismas y la recolección de información precisa y relevante para evaluar el nivel de riesgo. Por supuesto que también un programa organizado debe garantizar el control de los grupos de riesgo elevado con protocolos específicos de vigilancia que han demostrado ser eficaces y se recomiendan para los miembros de familias con síndromes hereditarios.12-15
Si no hay acceso a un protocolo específico de vigilancia para estos grupos, las personas con antecedentes familiares positivos no deberían ser excluidas de un programa de cribado basado en la población de riesgo promedio, ya que puede ser la única oportunidad de acceder a una intervención para estas personas que de otro modo no estarían incluidas.
La planificación y ejecución de los programas de cribado deben tener en cuenta los factores culturales, de comportamiento, económicos y de organización.11
Hay varios factores que influyen en la participación de la población relacionados con las características del individuo, el entorno, la organización de la pesquisa y el conocimiento, las actitudes y prácticas del proveedor de salud. La importancia relativa de estos factores en los estudios que evalúan los factores determinantes y las barreras a la participación no son concluyentes. Sin embargo, la variabilidad de los resultados reportados está probablemente relacionada con las diferentes condiciones en las que se han implementado las intervenciones.16
La organización de la pesquisa dentro de los servicios de salud aparece, en la mayoría de los países, como un determinante importante de la tasa de participación. La falta de cobertura y el costo de las pruebas han sido identificados como las principales influencias negativas sobre la participación con todas las estrategias y pruebas de tamizaje. Además, la falta de recursos es la explicación más probable de la asociación negativa entre el estatus socioeconómico más bajo con la realización de las pruebas de cribado del CCR.17-20 Otros factores relacionados con la organización del programa que fueron consistentemente relacionados con la mala asistencia a la pesquisa fueron el tiempo necesario para realizar el cribado, la distancia hasta el centro de salud y la falta de la recomendación del médico.
El conocimiento y la percepción de los beneficios del tamizaje y del riesgo de CCR y la motivación por la salud se asociaron con una mayor participación en muchos de los estudios.16 La preocupación por el dolor, incomodidad o vergüenza asociada con el examen o el miedo de los resultados también se asociaron consistentemente con una aceptación menor.16,21-23
Se han reportado diferencias de participación en el tamizaje del CCR de acuerdo a edad y género y la mayoría de los estudios han mostrado una tendencia a una menor participación de las personas mayores. Se ha informado que la participación puede ser mayor en las mujeres y una de las razones podría ser la experiencia previa de cribado para cáncer de mama y cuello uterino, y por lo tanto una mayor concientización de los beneficios.20,24
Una revisión sistemática reciente muestra la influencia positiva y el convencimiento que ejercen las parejas sobre los varones para la aceptación de la pesquisa del CCR, y también se señala el efecto positivo en la participación en las personas con antecedentes familiares de CCR y en aquellas que reciben información de las ventajas del tamizaje brindada por miembros de la familia o amigos.16
En una revisión sistemática se evaluaron diversas intervenciones para promover una mayor participación en la pesquisa, como incentivos financieros para los proveedores de salud o los pacientes, cambios en la organización (en los procedimientos o instalaciones e infraestructuras clínicas), recordatorios para los proveedores y participantes, la educación y los materiales visuales.25 El más efectivo fue la implementación de cambios organizativos para entregar estos servicios dentro de la atención rutinaria al paciente, el establecimiento de clínicas independientes dedicadas a la pesquisa y la adopción de enfoques de monitoreo y de mejoras en la calidad.
El envío por correo de un test de sangre oculta en materia fecal con un sobre pre pagado para el retorno de la muestra ha dado como resultado una captación significativamente mayor, en comparación a cuando la devolución de la muestra implica un gasto para el participante.26
La tasa de aceptación fue significativamente mayor para las personas sin seguro médico, y el ofrecimiento de una SOMF libre de gastos asociado a un folleto explicativo fue superior a la intervención educativa sola para promover la finalización del cribado. Ofrecer incentivos financieros a los sujetos invitados para el cribado no encontró un impacto positivo en la tasa de participación.27
Hay fuerte evidencia que señala que la recepción de una carta de invitación personal del médico de cabecera sola o anexada al kit de sangre oculta en heces entregado por correo se asocia con un aumento de la participación en la pesquisa cuando se compara con la recepción de cartas firmadas por otros profesionales.26,28,29
Varios estudios sobre pesquisa en cáncer de mama y cuello uterino informaron que un impacto positivo en la participación es el ofrecimiento de una cita prefijada para realizar los exámenes, como también se ha observado entre las personas invitadas para el cribado con sigmoideoscopía flexible.1
Los datos de un estudio reciente indican que una carta de notificación y explicación previa con una carta posterior con el kit de sangre oculta en heces, aumenta significativamente la participación en el cribado (39,5% vs. 48,3%).30
Una revisión que evaluó la eficacia de los diferentes tipos de recordatorios para personas que no respondieron a la primera convocatoria o deben repetir exámenes, como sistemas de aviso y re convocatoria enviada por correo, teléfono, contestador automático, o en persona, con un agente personalmente, concluyó que todos los tipos de recordatorio son eficaces, aunque los telefónicos son los más efectivos, pero también los más costosos.31
La información transmitida en la invitación se evaluó en una revisión sistemática de los métodos tendientes a mejorar los índices de aceptación. La conclusión es que las intervenciones educativas son menos eficaces que los cambios organizativos, y estudios más recientes apoyan esta conclusión.25,32-34 El contenido y el formato del material de información enviada con la invitación pueden influir en la decisión de un sujeto para llevar a cabo el cribado.35
Un programa multimedia interactivo en el consultorio del médico es eficiente para aumentar la disposición a participar de la pesquisa. Las intervenciones que utilizan instrumentos visuales para mejorar el atractivo y la claridad de los conceptos, como la adición de ilustraciones al material escrito, se asoció con un aumento significativo en el conocimiento y la comprensión. Este material debe confeccionarse con enfoques culturales y lingüísticos apropiados a cada región, que favorezcan el análisis y puedan mejorar la práctica del tamizaje en los grupos más vulnerables y en personas menos instruidas.36,37
Los profesionales de la atención primaria de la salud (médicos, enfermeras, agentes sanitarios) pueden mediar positivamente para mejorar el conocimiento de la población sobre el riesgo de cáncer y los beneficios de la pesquisa para aumentar la confianza en el método de tamizaje y para contrarrestar la renuencia a la participación. Para ello, deben estar capacitados para ofrecer información del cribado basada en la evidencia previamente elaborada y consensuada dentro del programa.16
La participación de los médicos de familia en la pesquisa del CCR puede ser muy eficaz para mejorar las tasas de captación de la población objetivo, aunque este efecto está influenciado por la voluntad de participación activa y la motivación del médico de cabecera.16,38-40
La inadecuada orientación médica representa un importante determinante negativo sobre la captación de las personas de menores recursos para la pesquisa del CCR.16,38,41-44
El conocimiento y capacitación de los médicos de atención primaria es fundamental para mejorar la participación de la población. Por ello, para promover eficazmente el cribado deben tener información adecuada sobre la eficacia del programa con información sobre la proporción de falsos negativos y falsos positivos.45
La capacitación de los efectores de la atención primaria ha sido identificada como una intervención potencialmente eficaz para promover el cribado de CCR, aunque deben aplicarse medidas de organización para lograr un impacto de los esfuerzos educativos. Una nota de aviso al médico de atención primaria para que dirija a sus pacientes a realizar el examen de tamizaje fue más eficaz que un recordatorio por correo y tan efectiva como el recordatorio telefónico para los pacientes.25,46 Aunque los médicos de atención primaria no entreguen los kits, no recojan las muestras ni lean los resultados, deben ser conscientes del funcionamiento del programa, ya que pueden colaborar aconsejando a los que no cumplieron la pesquisa para completarla, lo cual resulta importante para las personas mayores o para los que tienen un nivel socioeconómico más bajo.16
Cuando se utiliza un test de sangre oculta en heces, el kit puede ser entregado por correo, por agentes sanitarios, promotores de salud e incluso voluntarios en domicilio, en los consultorios externos, laboratorios u otras instalaciones de la comunidad.47-49 La entrega del kit de sangre oculta en heces con las instrucciones por correo, junto con la carta de invitación y el folleto de información, son eficaces en el aumento de las tasas de participación.50,51
La provisión de los kits debe aspirar a maximizar la accesibilidad, teniendo en cuenta las condiciones locales y los factores culturales, y debe estar disponible cerca de la población objetivo cuando se propicie su entrega en centros de salud o comunitarios, ya que la cercanía y el tiempo requerido para alcanzar el proveedor es un determinante muy fuerte de cumplimiento.39
Los voluntarios u otros profesionales también pueden estar implicados en la distribución y recolección de los kits. Además, este contacto puede representar una oportunidad adicional para el asesoramiento, para transmitir información sobre el programa y para proporcionar instrucciones sobre la utilización de la prueba.
Los sujetos contactados en su casa por un agente o voluntarios de la comunidad entrenados que entregaron el kit y recogieron la muestra desde el domicilio del participante, mostraron una tasa de participación sustancialmente mayor de la pesquisa en comparación con el grupo que recibió el kit por correo con una invitación de su médico de atención primaria.47,49 La sostenibilidad en el tiempo representa una cuestión importante a tener en cuenta en la planificación en caso de utilizar el apoyo de voluntarios.
Ensayos aleatorios han demostrado que se logra una mayor participación de la población con el test de SOMFi en comparación con una prueba basada en guayaco. Esto se relaciona con la falta de restricciones previas en la dieta y con el método de recolección más fácil con un menor número de muestras necesarias.52-54
El manejo de las muestras de heces debe estar protocolizado con identificación y localización de la muestra a través de todo el proceso garantizado mediante la adopción de un etiquetado adecuado.55,56
Una definición operativa de la prueba de detección inadecuada y la definición utilizada para clasificar el resultado de la prueba (como negativo o positivo) deberían explicitarse en el protocolo del programa, que en el caso del test de SOMFi de tipo cuantitativo debe definirse por el nivel de corte para la concentración de hemoglobina elegida.
En los casos de resultados anormales en la pesquisa, con diagnóstico de CCR o lesiones pre neoplásicas, deben ofrecerse a todos los pacientes el tratamiento y el seguimiento posterior siguiendo las guías basadas en la evidencia científica.
Las herramientas que se mostraron eficaces para incrementar el seguimiento oportuno fueron: la reducción de las barreras financieras para realizar nuevos exámenes, la utilización del correo o recordatorios por vía telefónica, el material de información escrita o asesoramiento telefónico para tratar los temores relacionados con hallazgos anormales, la implementación de sistemas informáticos de seguimiento, el monitoreo de la detección de anomalías y los cambios en la organización (trabajo en equipo multidisciplinario).
La comprobación de los cánceres de intervalo representa un componente clave de la evaluación de un programa de cribado, por lo cual el proceso de documentación y evaluación requiere planificación a largo plazo y la vinculación entre los registros de pesquisa y registros de cáncer y mortalidad general. La recogida de datos y elaboración de informes deben abarcar todos los cánceres que aparecen en la población objetivo.
El programa de pesquisa dentro del sistema de salud
Para la planificación de la pesquisa del CCR debe haber un marco programático en el contexto nacional y regional, ya que el programa, para su éxito, necesita del apoyo político y una financiación sostenible.1
Si el sistema de salud carece de las estructuras necesarias apropiadas, la pesquisa no debe aplicarse hasta que esas necesidades se desarrollen en una fase previa.11
Es esencial que el programa esté integrado en el sistema de salud, sea aceptado tanto por la población como por los profesionales involucrados en el proceso de diagnóstico y tratamiento del CCR, cumpla con las normas y protocolos nacionales y cuente con el financiamiento necesario.
Los profesionales y responsables de la organización de un programa de cribado deben tener suficiente autoridad y autonomía, incluyendo un presupuesto identificado y un control sobre el uso de los recursos, para controlar eficientemente la calidad, eficacia y costo-efectividad de la pesquisa. La estructura institucional debe facilitar la gestión eficaz con calidad y el rendimiento.1
Los indicadores de procesos y de resultados deben ser evaluados constantemente para satisfacer las necesidades de las personas y del servicio de salud, y debe garantizarse el resguardo de los datos, siguiendo los requisitos establecidos por las directivas relativas a la protección de datos y privacidad de la legislación nacional.
Antes de la implementación de un programa de cribado debe hacerse un inventario de las condiciones de base, que incluyen la información sobre las tasas de cribado oportunista, tasas de incidencia y mortalidad de CCR y con el fin de ejecutar un programa exitoso deben evaluarse, la disponibilidad de recursos endoscópicos, de personal adecuado e instalaciones con una infraestructura apropiada.11
La colonoscopía es el denominador común final de todas las estrategias de cribado del CCR, y la puesta en práctica de cualquier forma de tamizaje poblacional aumentará la demanda sobre los recursos de este estudio. Por esta razón, la viabilidad del programa dependerá principalmente de la disponibilidad de los servicios de colonoscopía que garantice su accesibilidad para todas las personas.
Existe una amplia variación en la utilización adecuada de la colonoscopía, incluso con indicaciones clínicas, que fueron juzgadas inapropiadas en aproximadamente un 25% de los casos, lo que sugiere el uso excesivo del recurso endoscópico.57 La utilización más adecuada de la colonoscopía podría aumentar la calidad de la atención y favorecer un uso eficiente de los recursos disponibles para satisfacer la demanda de las colonoscopías por cribado.58
Por otro lado, resulta poco probable que simplemente proporcionar fondos para aumentar la disponibilidad de equipos y la actividad existente permitirá por sí solo el éxito del programa. En paralelo, el programa debería considerar la aplicación de intervenciones educativas de capacitación del recurso humano dirigidas a mejorar la calidad de las colonoscopía y acciones de monitoreo para evitar exámenes innecesarios.1
Dependiendo del sistema de salud de cada país o jurisdicción dentro de una misma nación, diferentes profesionales de la salud −médicos de atención primaria, agentes sanitarios, enfermeras, paramédicos, farmacéuticos, bioquímicos, voluntarios de organizaciones sin fines de lucro, etc.− pueden estar involucrados en la entrega de kits de sangre oculta, recolección de las muestras, entrega de la preparación del intestino para la colonoscopía etc. Para ello cada programa debe seguir las normas de garantía de calidad y establecer los requisitos mínimos de formación para cada tipo de profesional.56
La pesquisa no será eficaz ni eficiente si los test positivos no van seguidos de una evaluación adecuada de todo el colon y, si fuera necesario, el tratamiento apropiado. Para ello son esenciales endoscopistas entrenados y que cada programa establezca y monitoree la formación validada para la colonoscopía.56
Para ayudar en la planificación de la localización de los servicios endoscópicos para el cribado, se proponen diferentes niveles de competencia.57 Las definiciones de los niveles propuestos tienen en cuenta las instalaciones y el nivel de idoneidad necesaria para tratar las lesiones detectadas mediante el cribado donde puedan ser extirpadas de forma segura y experta. Si todos los recursos no están disponibles en un área determinada, los grandes centros de diagnóstico y tratamiento pueden servir a más de un área, siempre que se establezca una comunicación adecuada.
Teniendo en cuenta los diferentes entornos sanitarios, se recomiendan especialistas en salud pública con formación y conocimiento de la epidemiología, estadísticas básicas y comunicación, para asegurar que el programa incluya un sistema de información que monitoree cada pasó del proceso de pesquisa, con el fin de identificar los problemas que requieren intervención. Estos especialistas en salud pública pueden actuar en un nivel nacional o regional, mientras que los otros profesionales de la salud que prestan servicios de tamizaje son necesarios en cada área de funcionamiento del programa.56
Se sugiere que la iniciativa de la pesquisa del CCR debe ser adaptada a las condiciones específicas de cada país, al sistema de salud y los métodos de financiación para decidir sobre la prueba a utilizar.
Los modelos de costo-efectividad de diferentes estrategias generalmente acuerdan en que lo óptimo es comenzar las pruebas en pacientes de entre 50 y 60 años con una interrupción a los 75 años.
La aceptación de la estrategia y la prueba propuesta representan un determinante crítico del impacto de un programa organizado que influyen en la evaluación de la relación costo-efectividad de las pruebas más comúnmente recomendados debido a los diferentes niveles de participación.59
Por lo tanto, la eficacia de una intervención está fuertemente influenciada por el nivel de cumplimiento que se puede lograr y se estima que una información relevante, cuando se comparan diferentes estrategias, es la evaluación del nivel de adherencia de las pruebas que proporcionan niveles comparables de años de vida ganados por número de colonoscopías. Así, más pruebas aceptables recogerían una mayor proporción de lesiones prevalentes, aunque su sensibilidad fuera menor, debido a que más personas asistirían al cribado.60
La disponibilidad de diferentes métodos de detección que permitan a los individuos de la población objetivo elegir su estrategia preferida en base a sus preferencias y valores no parece ser una opción efectiva para aumentar la cobertura.51
El ofrecimiento de una prueba alternativa a las personas que rechazan la estrategia de cribado principal de un programa podría representar una opción posible. Sin embargo, su sostenibilidad y el impacto en la organización del cambio de estrategia deben ser evaluados cuidadosamente.49
El costo por año de vida ganado para la pesquisa del CCR para la mayoría de las estrategias confrontadas con ningún cribado es comparable con otras intervenciones de salud preventivas comúnmente aprobadas, como la mamografía de detección para mujeres mayores de 50 años, la edad o el tratamiento de la hipertensión moderada.
Los costos de un programa de pesquisa se ven fuertemente afectados por la organización del tamizaje, incluyendo los costos de infraestructura, tecnología de la información, la promoción del programa, formación y control de calidad y por las características del sistema de salud. Estos mismos factores representan los principales determinantes del costo de cada prueba, lo que influye en las estimaciones de los costos relativos de las diferentes estrategias.
Además, la ventaja en términos de reducción del riesgo se debe balancear no solo con los costos del programa, sino también con las molestias para el paciente y los efectos adversos asociados con cada estrategia. Estos factores influyen en la probabilidad de que los pacientes completen las pruebas requeridas para una estrategia dada y también tienen un fuerte impacto en los costos de los exámenes.
La necesidad de recursos presenta diferencias considerables de acuerdo a la estrategia elegida. La limitada disponibilidad de los servicios de endoscopía favorecería la adopción de estrategias que usan pruebas muy específicas dirigidas a los grupos de mayor edad, mientras que una estrategia basada en la sigmoideoscopía sería preferible si se ven limitados los recursos financieros. Las limitaciones de recursos, principalmente relacionados con la disponibilidad de personal altamente calificado, representan una fuerte barrera a la adopción de la colonoscopía como herramienta de cribado primario.61
Desde el punto de vista de la implementación, es importante llevar el registro completo y preciso de todos los datos individuales relativos a cada participante desde el inicio del programa, la prueba de tamizaje, su resultado, las decisiones tomadas como consecuencia y su resultado final en términos de diagnóstico, tratamiento y el seguimiento.1
Se deben desarrollar proyectos piloto de demostración para evaluar la viabilidad de los programas nacionales o regionales y su impacto en los servicios de salud y para comprobar si los resultados esperados a corto plazo pueden ser alcanzados en un contexto de atención de rutina por un programa que cubra la totalidad de la población objetivo.
Un nuevo programa de pesquisa debe ser implementado de tal manera que pueda evaluarse su eficacia. Se sugiere una implementación por etapas, en las que la población objetivo se va incorporando poco a poco en el programa (por regiones o distritos o grupos etarios), de acuerdo a los recursos disponibles y expandiéndose gradualmente para cubrir más regiones o grupos de edad.
Para determinar si un programa ha sido efectivo con respecto a su impacto en la mortalidad y la morbilidad, se requiere un seguimiento continuo de la población objetivo durante un período prolongado de tiempo, el registro de los resultados del proceso de pesquisa y de los indicadores de impacto del programa.62
El seguimiento y la evaluación del programa, por tanto, requieren adoptar medidas adecuadas en el proceso de planificación para el registro completo y preciso de todos los datos pertinentes. El logro de este objetivo depende del desarrollo de sistemas integrales para la documentación del proceso de pesquisa, el seguimiento de los datos adquiridos y su calidad y notificación exacta de los resultados.62
El sistema de información debe ser diseñado para apoyar la implementación de las diferentes etapas del programa. A los efectos de la evaluación del impacto de esta información, debe estar vinculado a varias fuentes de datos externas, como los registros de población, registros de cáncer o de patología con fines de garantía de calidad y de retroalimentación para los médicos.1,62
El diseño del sistema de información debe tener en cuenta la visión y datos requeridos de todos los grupos que participan en el programa de cribado. Una amplia consulta y planificación participativa es importante para mejorar la evaluación del programa, a través de una definición común de los datos elementales, indicadores y estándares. El programa debe asegurar que los profesionales involucrados en el cribado reciban retroalimentación oportuna sobre el programa. El desempeño y los datos del monitoreo son importantes, ya que las unidades de diagnóstico y los responsables del programa necesitan la información para realizar los cambios necesarios y para cumplir con los estándares de calidad y formación.
A modo de síntesis, las directrices europeas para la garantía de calidad en la pesquisa del cáncer colorrectal recomiendan:10
- Con el fin de maximizar el impacto de la intervención y garantizar una alta cobertura y equidad en el acceso, solo deben aplicarse programas de cribado organizados, ya que en oposición con el cribado oportunista solo los programas organizados pueden garantizar la calidad adecuadamente.
- Cuando se organiza un programa de tamizaje deben considerarse varios aspectos fundamentales: el marco legal, la disponibilidad y precisión de los datos epidemiológicos y demográficos, la disponibilidad de servicios de calidad garantizada para el diagnóstico y el tratamiento de la enfermedad, los esfuerzos de promoción del tamizaje, interrelación con el registro local de cáncer y el registro de mortalidad.
- Debe implementarse un registro de la población para el tamizaje. Si no está disponible, tratar de obtener la información más exacta y actualizada sobre la población objetivo.
- Si el programa de tamizaje admite exclusiones, se debe brindar la definición exacta de los criterios y las exclusiones deben ser monitoreadas cuidadosamente de manera rutinaria para comprobar su adecuación.
- Salvo en los casos de síndromes hereditarios (ver próxima recomendación), personas con una historia familiar positiva no deben ser excluidos de los programas de tamizaje poblacional de CCR.
- Los sujetos que pertenecen a familias con síndromes hereditarios, identificados en el momento del tamizaje, deben ser referidos a los programas de vigilancia especiales.
- El acceso a la pesquisa y cualquier evaluación de seguimiento para las personas con resultados anormales de las pruebas de tamizaje no deben limitarse por barreras financieras, sino que deberían ser gratuitos para el participante.
- En el contexto de un programa organizado, se deben utilizar cartas de invitación personales, preferentemente firmadas por el médico de atención primaria. Se recomienda una carta de recordatorio por correo a todos los no asistentes para aumentar la tasa de asistencia.
- Los recordatorios telefónicos son más eficaces que otras modalidades, aunque pueden no ser costo-efectivos.
- El suministro de información es necesaria para permitir a los sujetos tomar una decisión informada, pero no es suficiente para aumentar la participación. Deben aplicarse medidas organizativas que permitan a la gente asistir a la pesquisa.
- Los agentes de atención primaria de la salud deben participar en el proceso de transmisión de información a las personas invitadas para el cribado.
- Los médicos generalistas, médicos de familia o profesionales de atención primaria deben estar involucrados en la implementación de los programas.
- La reducción de las barreras de organización a los médicos de atención primaria o de familia debe ser una prioridad en las acciones para aumentar la participación de los médicos en los programas de cribado organizados.
- Para los programas de cribado basados en SOMF, la forma de provisión de los kits debe aspirar a maximizar la accesibilidad para la población objetivo.
- El envío por correo de los kits de SOMF puede ser una buena opción, teniendo en cuenta las cuestiones de factibilidad (como la fiabilidad del sistema de distribución y características de la prueba), así como los factores que pueden influir en la costo- efectividad, como la tasa de participación.
- Deben proporcionarse instrucciones claras y simples junto al kit de SOMF.
- Con el fin de mejorar el cumplimiento, se prefieren test de SOMF que no requieran o solo demanden pequeñas restricciones dietéticas como el test de SOMFi.
- Deben ser implementados protocolos de control sistemático, preferentemente automatizados, con el fin de asegurar la correcta identificación de los resultados del examen de tamizaje y el reconocimiento de datos incompletos o erróneos.
- Con el fin de garantizar una evaluación oportuna y adecuada, debe aplicarse un seguimiento activo de las personas con un resultado anormal en la prueba de cribado, utilizando recordatorios y sistemas informáticos para la gestión del rastreo y el monitoreo de estos pacientes.
- Una programación específica por género y edades merecen especial atención en el diseño e implementación de las intervenciones de cribado.
- Los costos de organización de la pesquisa que incluyen la infraestructura, tecnología de la información, la promoción del tamizaje, formación y control de calidad y la aparición de efectos adversos o la probabilidad de que los pacientes no completen las pruebas requeridas, representan factores adicionales importantes que deben tenerse en cuenta en el diseño e implementación de intervenciones de tamizaje y en la elección de la estrategia.
- Idealmente, cualquier nuevo programa de pesquisa debe ser implementado inicialmente como piloto, si es posible utilizando la asignación al azar en grupos de tamizaje y control en la fase en la que los recursos y las limitaciones prácticas impiden la cobertura total de la población objetivo.
- Con el fin de poder evaluar la eficacia del tamizaje, los datos deben estar vinculados a varias fuentes de datos externas, incluyendo registro de la población, registros de cáncer o de patología y los registros de mortalidad de la población objetivo.
Evaluación y monitoreo de un programa de pesquisa del cáncer colorrectal
La evaluación e interpretación de los resultados de la pesquisa son esenciales para reconocer si un programa de cribado del cáncer colorrectal está alcanzando los objetivos propuestos. El contexto y la logística de los programas serán diferentes según el país e incluso por regiones, donde, por ejemplo, la existencia previa de un registro de población facilita el envío de invitaciones personalizadas.62
La eficacia de un programa depende de la calidad de sus componentes individuales y el éxito se mide no solo por su impacto en la salud pública, sino también por su organización, implementación y aceptación.10
Todos los aspectos del programa deben ser monitoreados y evaluados, y para determinar si un programa ha sido eficaz en cuanto a su impacto en la morbilidad y la mortalidad se requiere un seguimiento continuo de la población objetivo a lo largo de un plazo prolongado. Por lo tanto, los indicadores de rendimiento temprano, disponibles en los inicios de un programa son esenciales para evaluar la calidad del programa y su potencial impacto a largo plazo.62
Un programa de cribado poblacional se basa en que cada miembro de la población objetivo en el área designada conozca el programa y los miembros elegibles de la población objetivo están invitados a participar de forma individual.
Una base de datos donde consten registros individuales (un registro por persona para cada episodio de cribado) es esencial a fin de producir resultados en los aspectos organizativos del programa (cobertura, participación) y el rendimiento de la pesquisa.62
Durante todo el proceso, se debe proporcionar una información equilibrada a los participantes y los responsables del programa sobre los daños y beneficios de los servicios prestados. Esta información debe basarse en una evaluación y monitoreo sistemático que tiene en cuenta la complejidad del proceso de pesquisa.
Esta información surge de los registros de incidencia de cáncer en la región involucrada y del registro del programa de pesquisa que documenta la información de los programas y servicios de tamizaje que pueden funcionar en la misma institución o más de una institución. Es esencial que estos registros no solo sean responsables de la gestión de las bases de datos, sino también de la interpretación y la comunicación de resultados para el uso de los mismos para fines científicos.62
Para lograr un equilibrio adecuado entre el beneficio de la pesquisa y sus eventuales daños, se han desarrollado guías multidisciplinarias sobre garantías de calidad en el cribado del cáncer colorrectal.63
Ellas incluyen el monitoreo del desempeño de la organización, área técnica y profesional y la evaluación de impacto de los programas organizados de cribado del CCR.
Uno de los objetivos clave de los registros de pesquisa de cáncer es monitorear el desempeño de los programas y servicios de pesquisa del cáncer mediante la recolección, almacenamiento y presentación de informes con la información necesaria para apoyar una gestión eficaz y evaluar los servicios.1, 62 Estas actividades requieren una matriz de datos completa que incluye:
- Descripción de los ajustes de organización que brindan servicios de tamizaje.
- Características o eventos que describen cada variable.
- Normas de codificación pertinentes para los datos de cada variable.
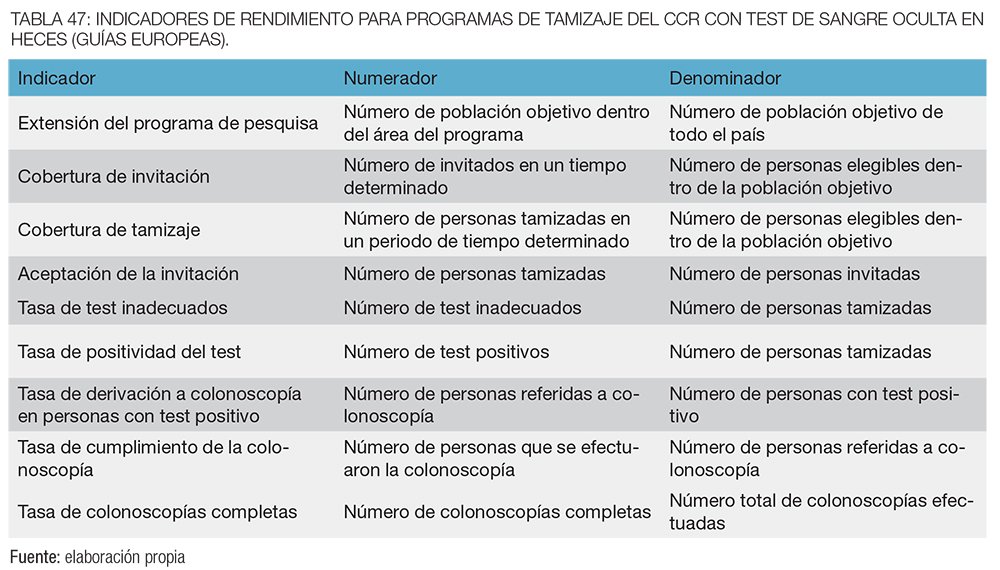
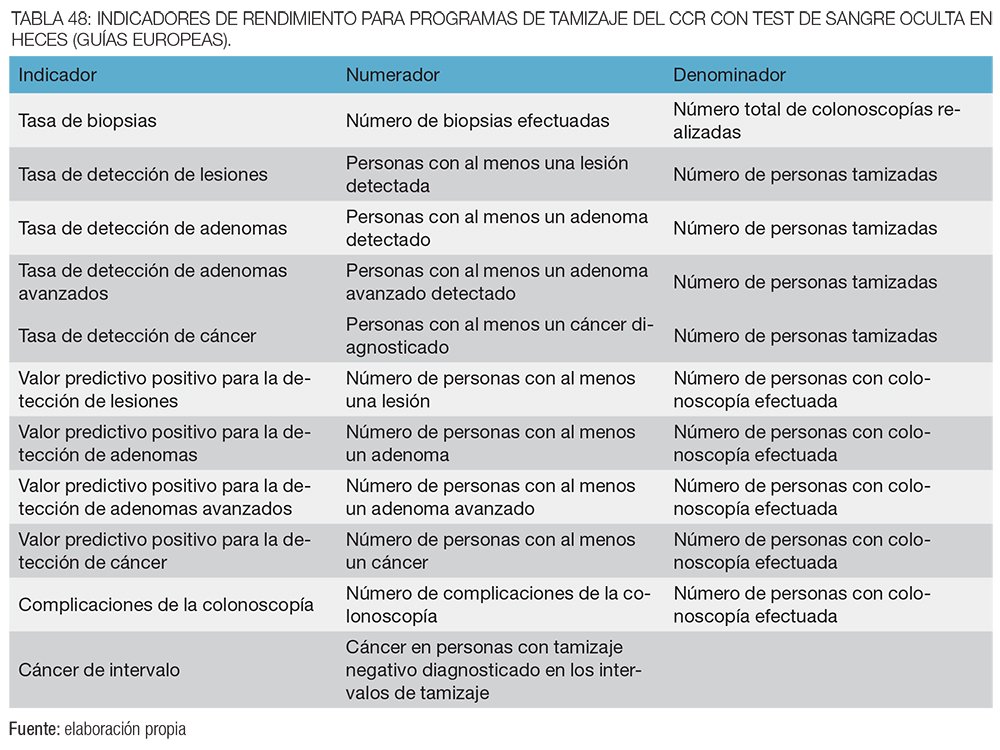
La matriz se debe utilizar para generar continuamente informes, utilizando conjuntos estándar de indicadores para monitorear el desempeño de los programas de cribado. Los indicadores recomendados a corto y largo plazo para CCR se refieren al protocolo de la prueba de uso común en Europa: prueba de sangre oculta en heces para el cáncer colorrectal con guayaco o inmunoquímica (SOMFi).
A continuación, en las tablas 2 y 3 se enumeran los datos e indicadores clave de rendimiento recomendados por las guías europeas para programas de tamizaje con SOMF que los registros deben recoger para el monitoreo estandarizado.62
Organización de un programa de pesquisa del CCR de acuerdo al nivel de ingreso de un país
Los estudios de costo-efectividad para la pesquisa del CCR han llegado a la conclusión de que esta estrategia es costo-efectiva en comparación con ningún tamizaje.64,65
Los modelos de micro simulación pueden ayudar a identificar la estrategia de cribado más adecuada de acuerdo a los recursos disponibles y a las restricciones presupuestarias e identificar las estrategias más eficaces en términos de años de vida ganados con relación a los costos de cada examen.66
Otros estudios de costo-efectividad han mostrado que la pesquisa del CCR puede también ser costo-efectiva en los países con recursos financieros limitados, aunque en estos casos, el acceso a un tratamiento apropiado del CCR puede ser el objetivo prioritario.67 Utilizar recursos para implementar el cribado poblacional del CCR en una región sin acceso o con un acceso muy limitado al tratamiento no sería una medida costo-efectiva.4,68
La disponibilidad de la pesquisa, el diagnóstico y el tratamiento del CCR en países con recursos limitados puede mejorarse mediante la asistencia técnica de organizaciones internacionales, como la Agencia Internacional de Investigación en Cáncer (IARC), redes, agencias, centros u otras asociaciones. Además son necesarios propulsores, actores locales, esenciales para promover la pesquisa y el tratamiento del CCR como una prioridad en la agenda de salud pública.4
El cribado del CCR sería igualmente costo-efectivo en zonas urbanas de países de ingresos medios en los que las tasas de incidencia se acercan a los niveles similares a las de los países con alto nivel de ingreso (tasa estandarizada de incidencia de 30 o más por 100.000 en hombres).4
Si bien la pesquisa poblacional del CCR no es la prioridad en la mayoría de los países de bajos ingresos, en algunas regiones de países emergentes donde hay cambios hacia un estilo de vida occidental y una población envejecida puede considerarse la implementación de programas limitados a esas regiones, en general áreas urbanas.11,69
Se han propuesto diferentes recomendaciones orientativas sobre cómo podrían implementarse la pesquisa y el diagnóstico del CCR en diferentes entornos de recursos diferentes siguiendo las recomendaciones para el control del cáncer de la Organización Mundial de la Salud.11,70
En países de bajos ingresos, la incidencia de CCR es relativamente baja y otras enfermedades, como otros tipos de cáncer, son prioridad para la pesquisa y el tratamiento. Puede ser importante instalar el fundamento de la pesquisa y el tratamiento del cáncer colorrectal, para lo cual se requiere inversión en salud pública y atención primaria, en los sistemas hospitalarios y en un registro de cáncer. Las inversiones en salud requieren personal médico y buenos sistemas de monitoreo y evaluación para el control de la calidad.
En países de bajos ingresos, debería posibilitarse al menos el tratamiento quirúrgico del cáncer colorrectal en un hospital conveniente. Si la colonoscopía no está disponible como una herramienta de diagnóstico, el colon por enema de bario puede ser una opción aceptable.
El manejo del dolor para los estadios avanzados de los cánceres es un imperativo ético en lugares donde la capacidad de tratar con eficacia estas lesiones es muy limitada.
En países con recursos medios hay un aumento −más pronunciado inicialmente en las zonas urbanas− en la incidencia de CCR y en la capacidad de intervención y el tamizaje oportunista se desarrolla mayormente para aquellas personas incluidas en alguna cobertura de salud.
Aquellos países o regiones dentro de algún país que ya han comenzado programas organizados de tamizaje de otros tipos de cáncer (incluidos países de América Latina y el Caribe y de ingresos medios de Asia) podrán decidir aplicar exámenes de cribado, inicialmente como un estudio piloto en regiones urbanas seleccionadas.
Como se señaló previamente, los países prioritarios son aquellos en los que la tasa estandarizada de incidencia de CCR en los hombres es de 30 por cada 100.000 habitantes. En Argentina, donde la tasa de incidencia estandarizada de
CCR en hombres es de 29.9 x 100.000, se está implementando un programa piloto para evaluar factibilidad de un programa de pesquisa.4,66
Los países donde las tasas de incidencia de CCR en los hombres se acercan a 20 por 100.000 pueden requerir una planificación previa para considerar iniciar medidas para la pesquisa del CCR.
Para el tamizaje del CCR se necesitan inversiones que pongan en práctica todos los componentes de la pesquisa y en el inicio de programas en países de ingreso medio puede aconsejarse el uso del test inmunoquímico en lugar del guayaco, dada la mayor aceptación y mejor rendimiento diagnóstico.
Además, los países de recursos medios tienen más acceso al tratamiento oportuno y pueden extenderlo a una mayor proporción de la población, y a medida que los cánceres se detectan más tempranamente, el objetivo del tratamiento pasa a ser la curación de la enfermedad y deja de ser la paliación.
Los países de recursos medios pueden ser participantes activos en las redes internacionales y los centros regionales o locales de excelencia y puede proporcionar soporte para otros países de su región que aún no iniciaron acciones específicas.
En los países de altos ingresos, las consideraciones de costo efectividad sugieren que la SOMFi, la sigmoideoscopía flexible acompañada de SOMFi o la colonoscopía son opciones válidas para el cribado. La adherencia al cribado varía, y a pesar de que cada prueba tiene sus defensores, la mejor prueba es la que se puede hacer en el contexto de los recursos endoscópicos y de acuerdo a las garantías de calidad. En estos países es factible una gama más amplia de opciones de tratamiento.
PROGRAMAS DE PESQUISA DEL CÁNCER COLORRECTAL EN EL MUNDO
Si bien hubo grandes cambios en los últimos 15 años, hay muchos países que carecen de programas poblacionales de cribado del CCR a pesar de tener una alta incidencia y mortalidad por esta enfermedad. Esto se debe, en la mayoría de los casos, a las limitaciones en los recursos disponibles, incluyendo la capacidad de colonoscopía y la organización de la estructura de asistencia sanitaria.
Algunos países que carecen de un programa, sin embargo, lo tienen en agenda para su aplicación, probablemente en los próximos años.
Muchos programas organizados de tamizaje del CCR utilizan test no invasivos de sangre oculta en heces (inmunoquímico o guayaco), mientras que la mayoría de los programas oportunistas se basan en la colonoscopía. En ambas estrategias de cribado, los niveles de captación varían considerablemente alrededor del mundo.
El desafío para implementar un programa, especialmente en países de recursos bajos que enfrentan un aumento en la incidencia de CCR, como consecuencia de la adopción de un estilo de vida más occidentalizado, es evaluar la necesidad del tamizaje del CCR y, si está indicado, desarrollar un programa a medida para que la captación de la población objetivo sea alta.
Con grandes variaciones geográficas, durante las últimas dos décadas, muchos programas poblacionales de pesquisa del CCR se han implementado en diferentes lugares en el mundo, más frecuentemente en países occidentales donde la carga de la enfermedad y los recursos disponibles son mayores.66
Región europea
Dentro de Europa, las tasas ajustadas de incidencia del CCR muestran una variación de hasta cinco veces, con tasas más bajas para hombres y mujeres en los países de los Balcanes: Bosnia Herzegovina (30 por 100 000 y el 19 por 100 000, respectivamente) y Albania (13 por 100 000 y el 11 por 100.000, respectivamente).
Mayores tasas de incidencia en los hombres se encuentran en Eslovaquia, Hungría y la República Checa, mientras que la incidencia más alta en las mujeres se observan en Noruega, Dinamarca y Países Bajos.71
Aunque las tasas de mortalidad siguen un patrón geográfico similar a las tasas de incidencia, la mortalidad por CCR es también elevada en algunos países donde las tasas de incidencia son relativamente bajas como Moldavia, Rusia, Montenegro, Polonia y Lituania.72 Esta circunstancia de mortalidad elevada con baja incidencia puede deberse a limitaciones en el acceso a la atención sanitaria y probablemente a un tratamiento inadecuado del CCR.
También, dentro del continente europeo, existen grandes variaciones con respecto a los programas implementados desde la publicación de las directrices de la Comunidad Europea en 2010.73
Ya en ese momento existían varios programas de tamizaje en marcha (pilotos, oportunistas u organizados) que evidenciaban considerables diferencias relacionadas a los recursos financieros regionales disponibles para la pesquisa. Lo mismo ocurre con la capacidad de la colonoscopía, con una variación de más de tres veces en este recurso dentro de los diferentes países de la región.
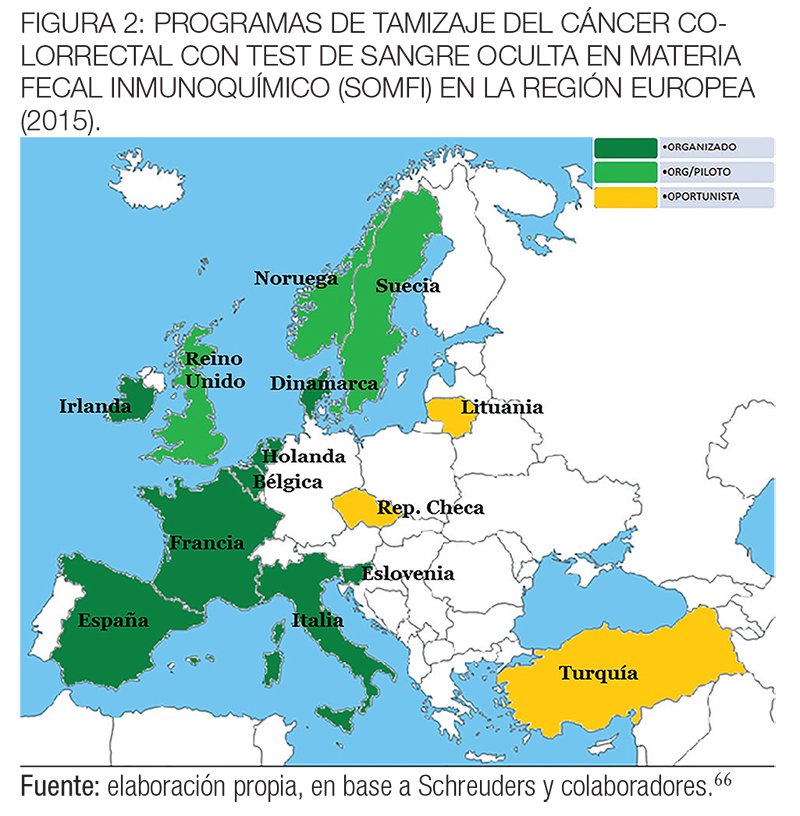
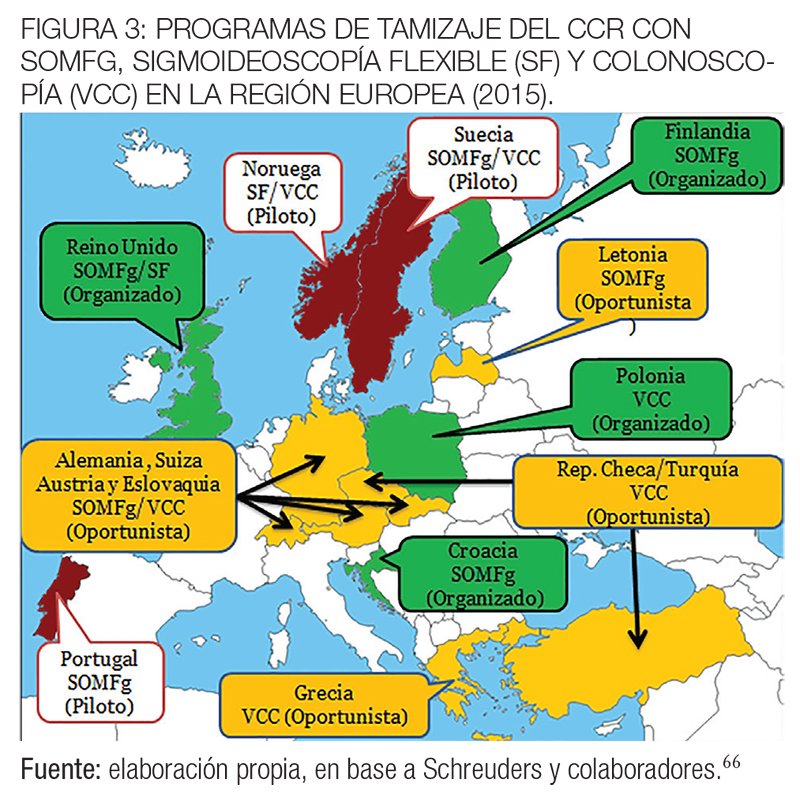
La mayoría de los países de Europa (24 sobre 28) en 2015 habían establecido o estaban preparando un programa nacional de cribado del CCR, oportunista u organizado. Nueve países tienen un programa oportunista y 16 tienen o están comenzando a poner en práctica programas poblacionales organizados.
Finlandia, Francia, Eslovenia y el Reino Unido han completado la implementación de sus programas organizados. En Bélgica, Países Bajos, Dinamarca, Irlanda, Italia, Malta, Polonia y España la implementación está en curso. Noruega, Portugal y Suecia están en la fase piloto.
Algunos países todavía tienen que poner en práctica un programa de cribado. En Grecia, a pesar de los recursos restringidos, por instancia de la Sociedad de Gastroenterología de ese país se estableció a la colonoscopía como método de elección para el tamizaje y la implementación de un programa organizado está en una fase de planificación.
Eslovaquia, a pesar de tener las tasas de incidencia de CCR más altas de Europa, no tiene un programa poblacional organizado y tampoco tienen un programa Bulgaria, Albania, Bosnia y Herzegovina, Kosovo, Macedonia, Montenegro, Rumania, Serbia y Rusia.66
La mayoría de los países europeos que iniciaron un programa organizado de pesquisa del CCR con test de SOMFg están cambiando al test inmunoquímico, como ocurrió en el Reino Unido desde 2014 y en Francia desde 2015. La sigmoideoscopía flexible está siendo gradualmente introducida en Inglaterra, y a partir de marzo de 2015, dos tercios de los centros de pesquisa estaban empezando a ofrecer este examen de una sola vez a los 55 años de edad. .
Los países con programas oportunistas se enfrentan a veces a una captación baja, como es el caso de Austria y la República Checa, que tienen una cobertura de la población objetivo de aproximadamente el 25%.74,75
También los programas organizados pueden enfrentarse a problemas de captación, como ocurrió en Francia, donde inicialmente la tasa de participación en los primeros dos años fue del 34% y posteriormente, con una participación activa de los médicos generalistas, aumentó al 50% en varias regiones del país.76
La tasa de participación en Croacia después de 3 años, con invitaciones a participar a casi un millón de personas, fue solo del 19,9%.77
En Países Bajos, Escocia y la República de Irlanda tuvieron que elevar el punto de corte de la detección de sangre oculta del test inmunoquímico para adaptarlo a la disponibilidad de colonoscopías.78,79
El cumplimiento de la colonoscopía tras un test de sangre oculta positivo también puede ser un problema, como se observó en Lituania, donde solamente el 52,4% de los test positivos se sometieron a la colonoscopía complementaria.80
En las figuras 1 y 2 se muestran los programas de tamizaje del cáncer colorrectal de tipo organizado u oportunista en fase de piloto o implementado en los diferentes países de la región europea hasta 2015.66
América del Norte
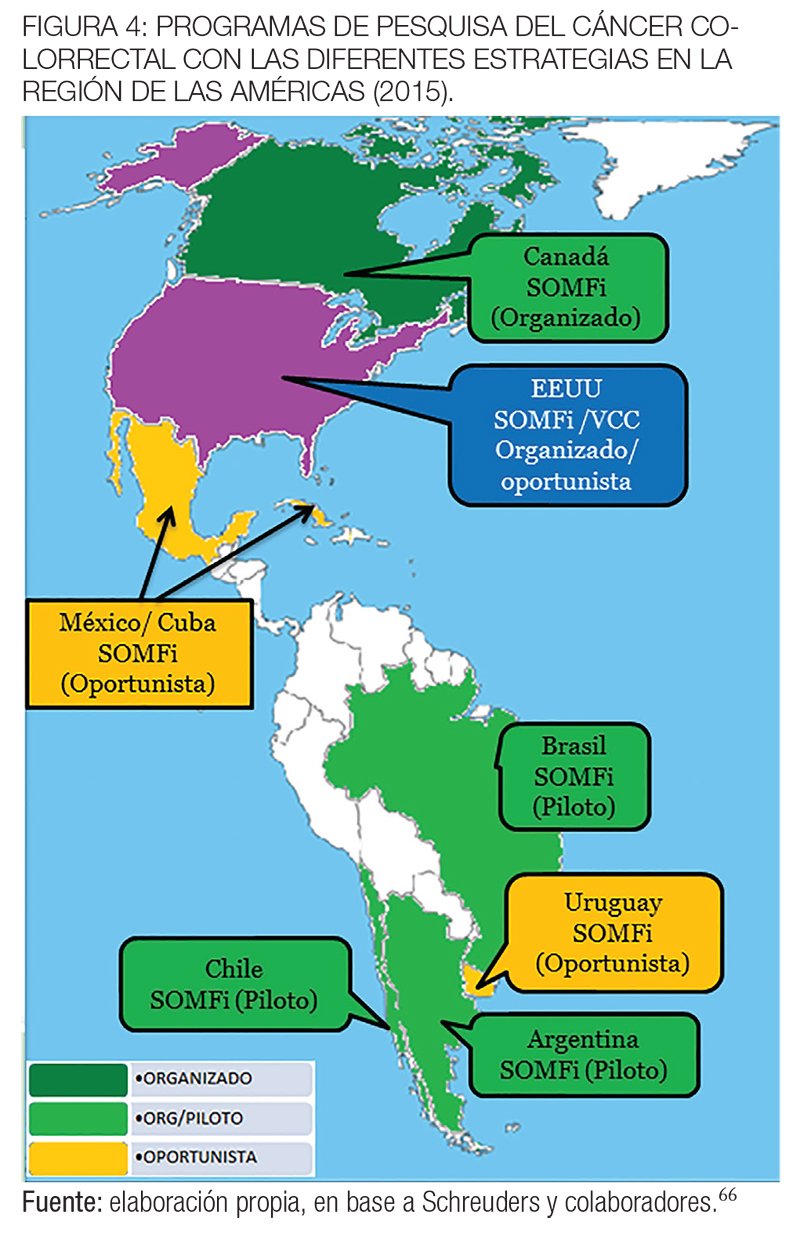
En Norteamérica, el reembolso para la colonoscopía ha facilitado la rápida adopción de una pesquisa oportunista del CCR, especialmente en EE. UU. y también en Canadá, donde antes de la puesta en marcha del programa poblacional organizado en 2008 en la provincia de Ontario se observó un incremento del uso de la colonoscopía.81
Hasta la fecha, las 10 provincias de Canadá han anunciado que están planeando o han implementado programas organizados de cribado del CCR, donde la mayoría está utilizando test de SOMFi en personas de riesgo promedio entre 50 y 74 años.82
El programa Colon Cancer Check de la provincia de Ontario es el primer programa organizado de tamizaje del CCR en Canadá, iniciado en toda la provincia en 2008. Para 2013, el 58% de la población objetivo se había efectuado tamizaje del CCR con algunas de las modalidades de examen.83 Los primeros resultados de la primera tanda de tamizajes (enero 2009-diciembre 2011) de cinco programas provinciales (Columbia Británica, Saskatchewan, Manitoba, Nueva Escocia y la Isla del Príncipe Eduardo) mostraron una tasa de participación mucho más baja (16,1%).84 La colonoscopía de tamizaje oportunista está disponible en un grado variable en la mayoría provincias de Canadá.
Como se señaló en capítulos precedentes, la pesquisa del CCR en los EE. UU. es recomendada por la USPSTF (U.S. Preventive Services Task Force) para las personas con riesgo medio (50-75 años) mediante SOMFg de alta sensibilidad o SOMFi anual, FS cada 10 años acompañada de SOMFi cada 3 años o colonoscopía cada 10 años.
La encuesta anual del sistema de vigilancia de factores de riesgo reveló que aproximadamente el 65% de los adultos en Estados Unidos habían efectuado tamizaje del CCR en 2013, siendo la colonoscopía el examen más ampliamente utilizado.85
La Sociedad Americana del Cáncer recientemente informó que las tasas de incidencia y mortalidad de CCR han disminuido significativamente en la última década en EE. UU., atribuyendo este hecho a la pesquisa del CCR.86, 87
El éxito del tamizaje oportunista visto en EE. UU. es propulsado con el apoyo de las sociedades nacionales, incluyendo USPSTF, Sociedad Americana del Cáncer, la Asociación Americana de Gastroenterología, Sociedad Americana de Endoscopia Gastrointestinal y la Nacional Colorectal Cancer Roundtable, una coalición nacional de organizaciones públicas, privadas y de voluntarios dedicada a promover la pesquisa para reducir la incidencia y la mortalidad por cáncer colorrectal a través del liderazgo coordinado, la planificación estratégica y la promoción.
Esto ha desempeñado un papel importante en la alta captación para el control del CCR en el país.
Por otra parte, se han desarrollado programas organizados en varias regiones del país, incorporando la SOMFi como alternativa de tamizaje, como por ejemplo el programa de Kaiser Permanente Northern California y el de Veterans Health Administration, con tasas de participación del 69% y del 68%, respectivamente.88,89
México ha puesto en marcha una campaña de sensibilización sobre el CCR centrándose en el cribado con SOMFg, pero sin mucha aceptación.
America Central, Caribe y Sudamérica
Aunque muchos países de América Central y del Sur tienen directrices para la pesquisa del CCR, muy pocos son los programas nacionales implementados hasta la actualidad.90
La infraestructura actual en muchos países es insuficiente para sostener un programa de cribado organizado, y además son muy pocas las acciones de concientización en muchas regiones, por ejemplo,Venezuela, Bolivia, Perú, Colombia y Costa Rica. Como resultado de esta situación, muchos de los casos de CCR se diagnostican en fases avanzadas.
En Brasil, la colonoscopía de tamizaje para las personas mayores de 50 años ha sido aprobada por el Ministerio de Salud, pero la captación sigue siendo baja y se han iniciado programas piloto en varios municipios. En el programa de la Asociación Brasileña de prevención del CCR, desarrollado en San Pablo, a partir de 2006, con SOMFi se distribuyeron 4.567 kits entre agosto de 2006 y marzo de 2007, de los cuales el 79,7% fueron devueltos y la tasa de positividad fue de aproximadamente 10,7%.91
El programa nacional de pesquisa del CCR en Argentina se creó en diciembre de 2013 por resolucion del Ministerio de Salud y se implementaron experiencias piloto en dos provincias (Tucumán y Misiones), que se encuentran en fase de ejecución. Además se encuentra en fase de planificación la implementación de programas piloto en otras jurisdicciones (Instituto Nacional del Cancer - Ministerio de Salud de la Nación).92,93
En Uruguay, un programa piloto oportunista de tamizaje del CCR se puso en marcha en 1996 para personas de riesgo medio con SOMFi, y entre junio de 1997 y julio de 2004, el 90,1% de los 11.734 personas inscritas en el programa de cribado de CCR completó el test de SOMFi con un 11,1% de positividad del examen.94
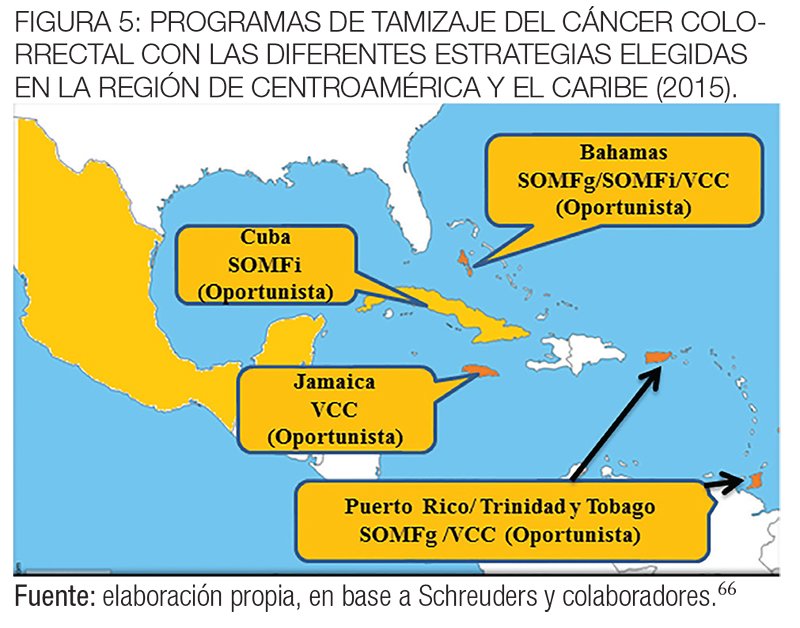
El cribado organizado para el CCR no se realiza de forma rutinaria en el Caribe. Solo la pesquisa oportunista está disponible en algunas islas con diferentes métodos, SOMFg, SOMFi y colonoscopía. Sin embargo, muchos países del Caribe carecen de las instalaciones médicas para proporcionar el tratamiento apropiado del cáncer, y por lo tanto el tamizaje del CCR no es una prioridad.90,95
Por otro lado, en otros países –Puerto Rico y Cuba– se ha reportado poca aceptación para el tamizaje del CCR.97,98
En las figuras 4 y 5 se muestran los programas de tamizaje del CCR en los países de la región de las Américas y en Centroamérica y el Caribe con las diferentes estrategias elegidas hasta 2015.66
Región de África
Se cuestiona la necesidad de tamizaje del CCR poblacional en los países de bajos ingresos de África, tomando en cuenta la carga relativamente baja de la enfermedad en dicha región, la sustancial carga de las enfermedades transmisibles y la limitación de los recursos.4
Además, hay carencia de medios para identificar la población objetivo, la disponibilidad de colonoscopía y el número de especialistas capacitados en la mayoría de regiones.69
Regiones de Asia y Oceanía
Las predicciones específicas para la región asiática del Mediterráneo oriental indican que, por lo general, los países de esta parte del mundo experimentarán un aumento de la mortalidad general por cáncer de aproximadamente 181% en los próximos 15 años.98
La incidencia de CCR actualmente es mayor en Israel (36 por 100 000), seguida por Jordania (26 por 100 000), Kazajistán (19 por 100 000), República Árabe Siria (23 por 100 000), República Armenia (16 por 100 000), Líbano (16 por 100 000) y el Estado de Palestina (15 por 100 000).
Las tasas de mortalidad por CCR son más altas en Jordania (16 por 100 000), Kazajistán (13 por 100 000), Armenia (11 por 100 000) e Israel (11 por 100 000).71
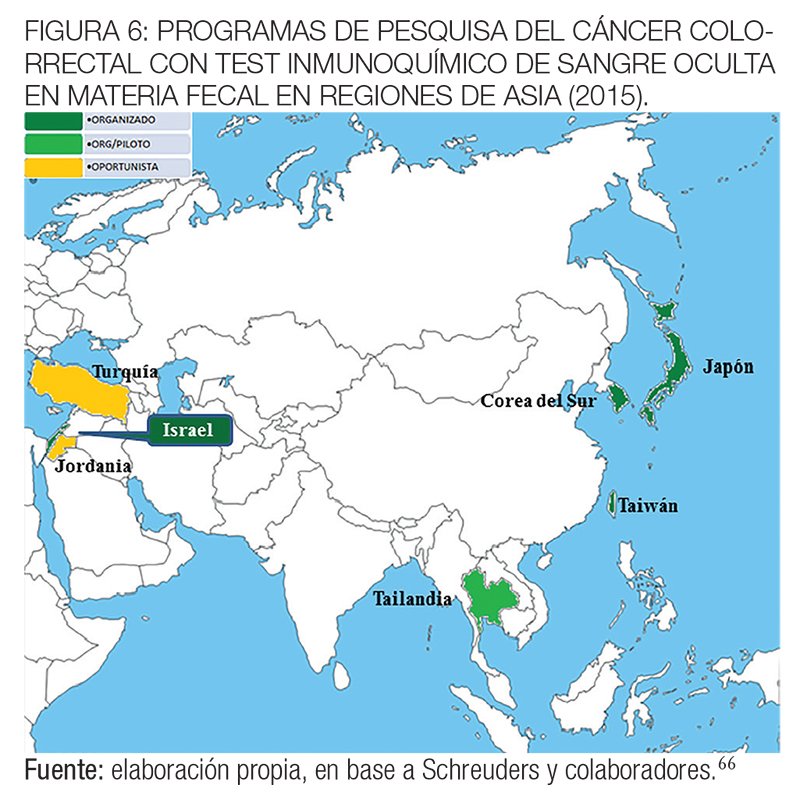
En Israel, se implementó un programa organizado para los individuos entre 50-74 años en los cuatro proveedores de salud, con supervisión del Estado, mediante SOMFi anual ofrecida por los médicos generalistas.
En Jordania, a pesar de la alta prevalencia de la enfermedad, las autoridades nacionales de salud aún no han adoptado un programa o estrategia organizada poblacional y solo existen alternativas oportunistas.99
En la región asiática del Pacífico, la incidencia de CCR varía entre los diferentes países. Corea es el país con la incidencia de CCR más alta del mundo (45 por 100 000) y otros países con alta incidencia, en Asia, son Singapur (34 por 100 000) y Japón (32 por 100 000).71
Se observa una alarmante tendencia al alza de la incidencia de CCR y mortalidad en Asia, especialmente en Japón, Corea y China.100
Esta tendencia ha sido explicada por los cambios en la dieta y un estilo de vida occidentalizado.101 Además, se observa que la prevalencia global de neoplasia colorrectal avanzada en personas asintomáticas en Asia es similar a las poblaciones occidentales.102
La incidencia de CCR y las tasas de mortalidad en la India (6 por 100 000 y 5 por 100 000, respectivamente) siguen siendo bajas en comparación con el resto de Asia.103
Las guías para el cribado del CCR en la Región Asiática del Pacífico han sido actualizadas recientemente y recomiendan la pesquisa del CCR, en lugares donde la tasa de incidencia es superior a 30 por 100.000, a personas entre 50 y 75 años mediante test de SOMFi de tipo cuantitativo seguido de colonoscopía en casos con resultado positivo.100
Recomiendan, además, en regiones con recursos limitados, una evaluación clínica del índice de riesgo para dar prioridad a las personas con mayor riesgo. Varios países de la región ya han desarrollado programas de cribado poblacionales: China, Japón, Taiwán, Corea y Singapur. En China, a las personas entre 40 y 74 años se les realiza el test de SOMFg seguido por un examen rectal digital y la colonoscopía. Sin embargo, el programa no está disponible para toda la población y solo se registró una captación del 13% de la población objetivo.104,105
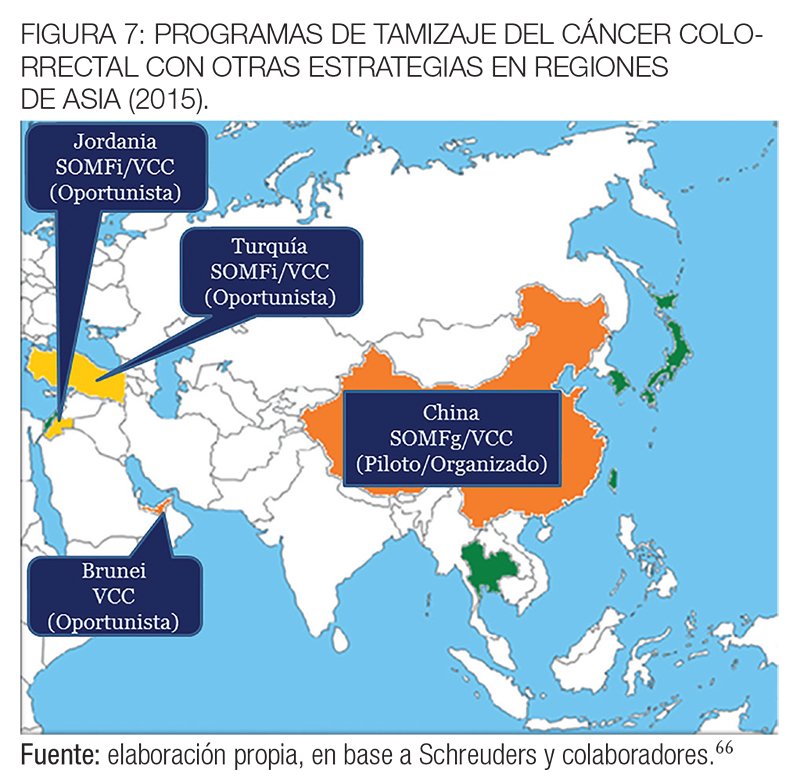
En Japón, el programa de tamizaje del CCR se ha iniciado en 1992 para los beneficiarios del Plan Nacional de Salud, mediante test de SOMFi a personas entre 40 y 69 años.106 En 2010, las tasas de participación fueron del 28,1% para los hombres y 23,9% para las mujeres.107
Un programa nacional de tamizaje del CCR se introdujo en la República de Corea en 2004, convocando a la población objetivo mediante cartas de invitación a principios del año para realizar un examen de SOMFi anual, y a aquellos con una prueba positiva se les ofreció el seguimiento con radiología de colon por enema doble contraste o colonoscopía.108,109
Los resultados publicados del programa coreano muestran un aumento de las tasas de participación desde su lanzamiento en 2004 (10,5%) a 2008 (21,1%) con una disminución en las tasas de positividad del test inmunoquímico de 8% a 6,8%.108
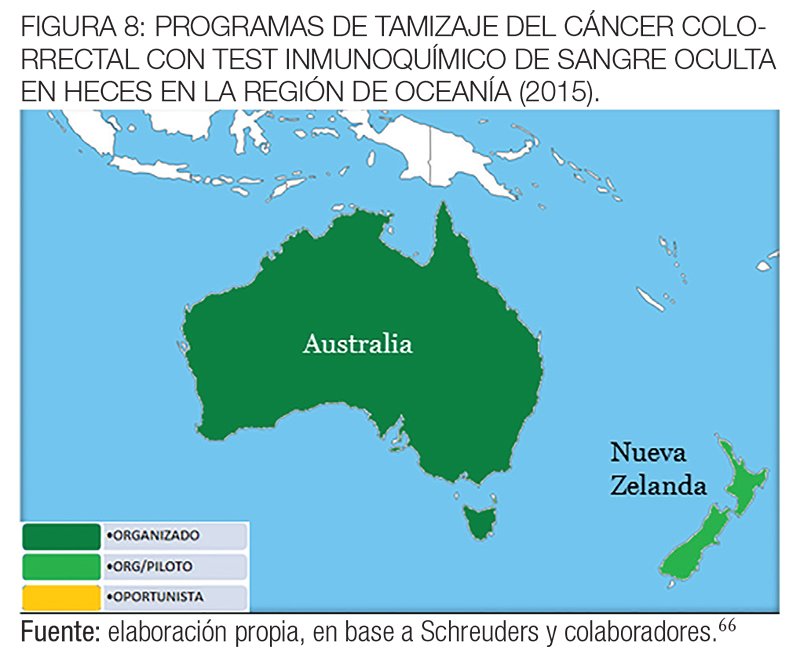
En Nueva Zelanda, comenzó un programa piloto de cribado del CCR de 4 años de duración en 2011 para determinar si un programa puede ser implementado a nivel nacional.
En Tailandia, un programa piloto organizado de cribado basado en la SOMFi ha sido implementado en abril de 2011, dirigido a personas entre 50-65 años en la provincia de Lampang, mostrando en sus resultados preliminares una tasa de participación del 62,9% entre las 127.301 personas convocadas.110
En Australia, se inició en 2002 un programa piloto de tamizaje del CCR y en 2006, el Programa Nacional de Pesquisa comenzó a proporcionar test de SOMFi con intervalo bienal a las personas de entre 55 y 65 años y continuará expandiéndose entre 2015 y 2020 para aplicar plenamente el cribado bienal para todos los australianos entre 50-74 años.111
En las figuras 6, 7 y 8 se muestran los programas de tamizaje del CCR en las regiones de Asia y Oceanía con las diferentes estrategias elegidas hasta 2015.66
BIBLIOGRAFÍA
- Von Karsa, L.; Dean, P.B.; Arrossi, S.; Sankaranarayanan, R. “Screening – principles”. En: Stewart, B.W. y Wild, C.P. (eds.), World Cancer Report 2014. Lyon: International Agency for Research on Cancer, pp. 322-329.
- Kuipers, E.J.; Rosch, T. y Bretthauer, M. (2013): “Colorectal cancer screening optimizing current strategies and new directions”. En: Nat Rev Clin Oncol, 10: 130-142.
- Garborg, K. (2015): “Colorectal Cancer Screening”. En: Surg Clin N Am, 95: 979-989.
- Rabeneck, L.; Horton, S.; Zauber, A.G. et al. (2015): “Colorectal Cancer”. En: Gelband, H.; Jha, P.; Sankaranarayanan, R. (edis.), Cancer: Disease Control Priorities, Volumen 3. Washington (DC): The International Bank for Reconstruction and Development / The World Bank.
- Miles, A.; Cockburn, J.; Smith, R.A. et al. (2004): “A perspective from countries using organized screening programs”. En: Cancer, 101: 1201-1213.
- U.S. Preventive Services Task Force (2008): “Screening for colorectal cancer: U.S. Preventive Services Task Force recommendation statement”. En: Ann Intern Med, 149: 627-637.
- Levin, B.; Lieberman, D.A.; McFarland, B. et al. (2008): “Screening and surveillance for the early detection of colorectal cancer and adenomatous polyps, 2008: a joint guideline from the American Cancer Society, the US Multi-Society Task Force on Colorectal Cancer, and the American College of Radiology”. En: Cancer J Clin, 58: 130-160.
- Rex, D.K.; Johnson, D.A.; Anderson, J.C. et al. (2009): “American College of Gastroenterology guidelines for colorectal cancer screening 2009 [corrected]”. En: Am J Gastroenterol, 104: 739-750.
- Gupta, S.; Sussman, D.A.; Doubeni, C.A. et al. (2014): “Challenges and Possible Solutions to Colorectal Cancer Screening for the Underserved”. En: J Natl Cancer Inst, 106.
- Malila, N.; Senore, C. y Armaroli, P. (2012): “European guidelines for quality assurance in colorectal cancer screening and diagnosis”. Endoscopy 2012; 44(S 03): SE31-SE48 DOI: 10.1055/s-0032-1309783.
- Goss, P.E.; Lee, B.L.; Badovinac-Crnjevic, T. et al. (2013): “Planning cancer control in Latin America and the Caribbean”. En: Lancet Oncol, 14: 391-436.
- Baglietto, L.; Jenkins, M.A.; Severi, G. et al. (2006): “Measures of familial aggregation depend on definition of family history: meta-analysis for colorectal cancer”. En: J Clin Epidemiol, 59: 114-124.
- Butterworth, A.S.; Higgins, J.P. y Pharoah, P. (2006): “Relative and absolute risk of colorectal cancer for individuals with a family history: a meta-analysis”. En: Eur J Cancer, 42: 216-227.
- Church, J.M. (2005): “A scoring system for the strength of a family history of colorectal cancer”. En: Dis Colon Rectum, 48: 889-896.
- Cottet, V.; Pariente, A.; Nalet, B. et al. (2007): “Colonoscopic screening of first-degree relatives of patients with large adenomas: increased risk of colorectal tumors”. En: Gastroenterology, 133: 1086-1092.
- Honein-AbouHaidar, G.N.; Kastner, M.; Vuong, V. et al. (2016): “Systematic Review and Meta-study Synthesis of Qualitative Studies Evaluating Facilitators and Barriers to Participation in Colorectal Cancer Screening”. En: Cancer Epidemiol Biomarkers Prev, 25(6): 907-917.
- Dassow, P. (2005): “Setting educational priorities for women’s preventive health: measuring beliefs about screening across disease states”. En: J Womens Health (Larchmt.), 14: 324-330.
- McCaffery, K.; Wardle, J.; Nadel, M. et al. (2002): “Socioeconomic variation in participation in colorectal cancer screening”. En: J Med Screen, 9: 104-108.
- Slattery, M.L.; Kinney, A.Y. y Levin, T.R. (2004): “Factors associated with colorectal cancer screening in a population-based study: the impact of gender, health care source, and time”. En: Prev. Med, 38: 276-283.
- Wardle, J.; Miles, A. y Atkin, W. (2005): “Gender differences in utilization of colorectal cancer screening”. En: J Med Screen, 12: 20-27.
- James, A.S.; Campbell, M.K. y Hudson, M.A. (2002): “Perceived barriers and benefits to colon cancer screening among African Americans in North Carolina: how does perception relate to screening behavior?”. En: Cancer Epidemiol Biomarkers Prev, 11: 529-534.
- Lawsin, C.; DuHamel, K.; Weiss, A. et al. (2007): “Colorectal cancer screening among low-income African Americans in East Harlem: a theoretical approach to understanding barriers and promoters to screening”. En: J Urban Health, 84: 32-44.
- Weinberg, D.S.; Turner, B.J.; Wang, H. et al. (2004): “A survey of women regarding factors affecting colorectal cancer screening compliance”. En: Prev. Med, 38: 669-675.
- Malila, N.; Oivanen, T. y Hakama, M. (2008): “Implementation of colorectal cancer screening in Finland: experiences from the first three years of a public health programme”. En: Z Gastroenterol, 46 (Suppl. 01): 25-28.
- Stone, E.G.; Morton, S.C.; Hulscher, M.E. et al. (2002): “Interventions that increase use of adult immunization and cancer screening services: a meta-analysis”. En: Ann Intern Med, 136: 641-651.
- Jepson, R.; Clegg, A.; Forbes, C. et al. (2000): “The determinants of screening uptake and interventions for increasing uptake: a systematic review”. En: Health Technol. Assess, 4: i-133.
- Plaskon, P.P. y Fadden, M.J. (1995): “Cancer screening utilization: is there a role for social work in cancer prevention?”. En: Soc Work Health Care, 21: 59-70.
- Cole, S.R.; Young, G.P.; Byrne, D. et al. (2002): “Participation in screening for colorectal cancer based on a faecal occult blood test is improved by endorsement by the primary care practitioner”. En: J Med Screen, 9: 147-152.
- Federici, A.; Giorgi, R.P.; Borgia, P. et al. (2005): “The immunochemical faecal occult blood test leads to higher compliance than the guaiac for colorectal cancer screening programmes: a cluster randomized controlled trial”. En: J Med Screen, 12: 83-88.
- Cole, S.R.; Smith, A.; Wilson, C. et al. (2007): “An advance notification letter increases participation in colorectal cancer screening”. En: J Med Screen, 14: 73-75.
- Jacobson, V.J. y Szilagyi, P. (2005): “Patient reminder and patient recall systems to improve immunization rates”. En: Cochrane Database Syst Rev, CD003941.
- Costanza, M.E.; Luckmann, R.; Stoddard, A.M. et al. (2007): “Using tailored telephone counseling to accelerate the adoption of colorectal cancer screening”. En: Cancer Detect Prev, 31: 191-198.
- Lipkus, I.M.; Green, L.G. y Marcus, A. (2003): “Manipulating perceptions of colorectal cancer threat: implications for screening intentions and behaviors”. En: J Health Commun, 8: 213-228.
- Robb, K.A.; Miles, A.; Campbell, J. et al. (2006): “Can cancer risk information raise awareness without increasing anxiety? A randomized trial”. En: Prev Med, 43: 187-190.
- Austoker, J.; Giordano, L.; Hewitson, P. et al. (2012): “European guidelines for quality assurance in colorectal cancer screening and diagnosis”. En: Communication. Endoscopy, 44: SE164-SE185.
- Jerant, A.; Kravitz, R.L.; Rooney, M. et al. (2007): “Effects of a tailored interactive multimedia computer program on determinants of colorectal cancer screening: a randomized controlled pilot study in physician offices”. En: Patient Educ Couns, 66: 67-74.
- Tu, S.P.; Taylor, V.; Yasui, Y. et al. (2006): “Promoting culturally appropriate colorectal cancer screening through a health educator: a randomized controlled trial”. En: Cancer, 107: 959-966.
- Brawarsky, P.; Brooks, D.R.; Mucci, L.A. et al. (2004): “Effect of physician recommendation and patient adherence on rates of colorectal cancer testing”. En: Cancer Detect Prev, 28: 260-268.
- Federici, A.; Giorgi, R.P.; Bartolozzi, F. et al. (2006): “The role of GPs in increasing compliance to colorectal cancer screening: a randomised controlled trial”. En: Cancer Causes Control, 17: 45-52.
- Seifert, B.; Zavoral, M.; Fric, P. et al. (2008): “The role of primary care in colorectal cancer screening: experience from Czech Republic”. En: Neoplasma, 55: 74-80.
- Sewitch, M.J.; Fournier, C.; Ciampi, A. et al. (2007): “Adherence to colorectal cancer screening guidelines in Canada”. En: BMC Gastroenterol, 7: 39.
- Klabunde, C.N.; Schenck, A.P. y Davis, W.W. (2006): “Barriers to colorectal cancer screening among Medicare consumers”. En: Am J Prev Med, 30: 313-319.
- Schenck, A.P.; Klabunde, C.N. y Davis, W.W. (2006): “Racial differences in colorectal cancer test use by Medicare consumers”. En: Am J Prev Med, 30: 320-326.
- Wee, C.C.; McCarthy, E.P. y Phillips, R.S. (2005): “Factors associated with colon cancer screening: the role of patient factors and physician counseling”. En: Prev Med, 41: 23-29.
- Woodrow, C.; Rozmovits, L.; Hewitson, P. et al. (2006): “Bowel cancer screening in England: a qualitative study of GPs’ attitudes and information needs”. En: BMC Fam Pract, 7: 53.
- Walsh, J.M.; Salazar, R.; Terdiman, J.P. et al. (2005): “Promoting use of colorectal cancer screening tests. Can we change physician behavior?”. En: J Gen Intern Med, 20: 1097-1101.
- Courtier, R.; Casamitjana, M.; Macia, F. et al. (2002): “Participation in a colorectal cancer screening programme: influence of the method of contacting the target population”. En: Eur J Cancer Prev, 11: 209-213.
- UK Colorectal Cancer Screening Pilot Group (2004): “Results of the first round of a demonstration pilot of screening for colorectal cancer in the United Kingdom”. En: BMJ, 329(7458): 133. doi: 10.1136/bmj.38153.491887.7C.
- Zorzi, M. De Bianchi, P.S.; Grazzini, G. et al. (2007): “Ouality indicators for the evaluation of colorectal cancer screening programmes”. En: Epidemiol Prev, 31: 6-56.
- Church, T.R.; Yeazel, M.W.; Jones, R.M. et al. (2004): “A randomized trial of direct mailing of fecal occult blood tests to increase colorectal cancer screening”. En: J Natl Cancer Inst, 96: 770-780.
- Segnan, N.; Senore, C.; Andreoni, B. et al. (2005): “Randomized trial of different screening strategies for colorectal cancer: patient response and detection rates”. En: J Natl Cancer Inst, 97: 347-357.
- Cole, S.R.; Young, G.P.; Esterman, A. et al. (2003): “A randomised trial of the impact of new faecal haemoglobin test technologies on population participation in screening for colorectal cancer”. En: J Med Screen, 10: 117-122.
- Federici, A.; Giorgi, R.P.; Borgia, P. et al. (2005): “The immunochemical faecal occult blood test leads to higher compliance than the guaiac for colorectal cancer screening programmes: a cluster randomized controlled trial”. En: J Med Screen, 12: 83-88.
- Van Rossum, L.G.; Van Rijn, A.F.; Laheij, R.J. et al. (2008): “Random comparison of guaiac and immunochemical fecal occult blood tests for colorectal cancer in a screening population”. En: Gastroenterology, 135: 82-90.
- Halloran, S.; Launoy, G. y Zappa, M. (2012): “European guidelines for quality assurance in colorectal cancer screening and diagnosis. Faecal Occult Blood Testing”. En: Endoscopy, 44: SE65-SE87.
- Steele, R.J.C.; Rey, J-F. y Lambert, R. (2012): “European guidelines for quality assurance in colorectal cancer screening and diagnosis. Professional requirements and training”. En: Endoscopy, 44: SE106-SE115.
- Valori, R.; Rey, J-F.; Atkin, W. et al. (2012): “European guidelines for quality assurance in colorectal cancer screening and diagnosis. Quality assurance in endoscopy in colorectal screening and diagnosis”. En: Endoscopy, 44: SE88-SE105.
- Seeff, L.C.; Manninen, D.L.; Dong, F.B. et al. (2004): “Is there endoscopic capacity to provide colorectal cancer screening to the unscreened population in the United States?”. En: Gastroenterology, 127: 1661-1669.
- Zauber, A.G.; Lansdorp-Vogelaar, I.; Knudsen, A.B. et al. (2008): “Evaluating test strategies for colorectal cancer screening: a decision analysis for the U.S. Preventive Services Task Force”. En: Ann Intern Med, 149: 659-669.
- Segnan, N.; Senore, C.; Andreoni, B. et al. (2007): “Comparing attendance and detection rate of colonoscopy with sigmoidoscopy and FIT for colorectal cancer screening”. En: Gastroenterology, 132: 2304-2312.
- Vijan, S.; Inadomi, J.; Hayward, R.A. et al. (2004): “Projections of demand and capacity for colonoscopy related to increasing rates of colorectal cancer screening in the United States”. En: Aliment Pharmacol Ther, 20: 507-515.
- Anttila, A.; Lönnberg, S. y Ponti, A. (2015): “Towards better implementation of cancer screening in Europe through improved monitoring and evaluation and greater engagement of cancer registries”. En: European Journal of Cancer, 51, 241-251.
- Segnan, N.; Patnick, J.; von Karsa, L. (2010): “European guidelines for quality assurance in colorectal cancer screening and diagnosis”. Disponible online en: <http://ec.europa.eu>.
- Lansdorp-Vogelaar, I.; Knudsen, A.B. y Brenner, H. (2011): “Cost-effectiveness of colorectal cancer screening”. En: Epidemiol Rev, 33: 88-100.
- Pignone, M.; Saha, S.; Hoerger, T. et al. (2002): “Cost-effectiveness analyses of colorectal cancer screening: a systematic review for the U.S. Preventive Services Task Force”. En: Ann Intern Med, 137: 96-104.
- Schreuders, E.H.; Ruco, A.; Rabeneck, L. et al. (2015): “Colorectal cancer screening: a global overview of existing programmes”. En: Gut, 64: 1637-1649, doi:10.1136/gutjnl-2014-309086.
- Ginsberg, G.M.; Lauer, J.A.; Zelle, S. et al. (2012): “Cost effectiveness of strategies to combat breast, cervical, and colorectal cancer in sub-Saharan Africa and South East Asia: mathematical modelling study”. En: BMJ, 344: e614.
- Ginsberg, G.M.; Lim, S.S.; Lauer, J.A. et al. (2010): “Prevention, screening and treatment of colorectal cancer: a global and regional generalized cost effectiveness analysis”. En: Cost Eff Resour Alloc, 17, 8: 2. doi: 10.1186/1478-7547-8-2.
- Lambert, R.; Sauvaget, C. y Sankaranarayanan, R. (2009): “Mass Screening for Colorectal Cancer Is Not Justified in Most Developing Countries”. En: International Journal of Circulation, 125: 253-256.
- OMS (2006): “Cancer control: knowledge into action: WHO guide for effective programmes: Planning World Health Organization 2006; II. Series”. Disponible online en: <http://www.who.int>.
- GLOBOCAN (2012): Estimated cancer incidence, mortality and prevalence worldwide in 2012. Disponible online en: <http://globocan.iarc.fr>.
- Ferlay, J.; Steliarova-Foucher, E.; Lortet-Tieulent, J. et al. (2013): “Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012”. En: Eur J Cancer, 49: 1374-1403.
- Von Karsa, L.; Patnick, J. y Segnan, N. (2012): “European guidelines for quality assurance in colorectal cancer screening and diagnosis”. First Edition—Executive summary. En: Endoscopy, 44(Suppl 3): SE1-8.
- Zavoral, M.; Suchanek, S.; Majek, O. et al. (2014): “Colorectal cancer screening: 20 years of development and recent progress”. En: World J Gastroenterol, 20: 3825-3834.
- Haidinger, G.; Waldhoer, T. y Vutuc, C. (2008): “Self-reported colonoscopy screening in Austria”. En: Eur J Cancer Prev, 17: 354-357.
- Leuraud, K.; Jezewski-Serra, D.; Viguier, J. et al. (2013): “Colorectal cancer screening by guaiac faecal occult blood test in France: Evaluation of the programme two years after launching”. En: Cancer Epidemiol, 37: 959-967.
- Katicic, M.; Antoljak, N.; Kujundzic, M. et al. (2012): “Results of National Colorectal Cancer Screening Program in Croatia (2007–2011)”. En: World J Gastroenterol, 18: 4300-4307.
- Steele, R.J.C.; McDonald, P.J.; Digby, J. et al. (2013): “Clinical outcomes using a faecal immunochemical test for haemoglobin as a first-line test in a national programme constrained by colonoscopy capacity”. En: United European Gastroenterology Journal, 1: 198-205.
- Van Veldhuizen, H.; Heijnen, M-L. y Lansdorp-Vogelaar, I. (2016): “Adjustment to the implementation of the colorectal cancer screening programme in 2014 and 2015”. Disponible online en: <www.onehealth.nl>.
- Poskus, T.; Strupas, K.; Mikalauskas, S. et al. (2015): “Initial results of the National Colorectal Cancer Screening Program in Lithuania”. En: Eur J Cancer Prev, 24: 76-80.
- Vinden, C.; Schultz, S. y Rabeneck, L. (2004): ICES research atlas: use of large bowel procedures in Ontario. Ontario: Institute for Clinical Evaluative Sciences. Disponible online en: <http://www.ices.on.ca>.
- Canadian Partnership Against Cancer (2013): “Colorectal cancer screening in Canada: Program performance results, January 2009-December 2011”. Toronto. Disponible online en: <http://www.cancerview.ca>.
- Rabeneck, L.; Tinmouth, J.M.; Paszat, L.F. et al. (2014): “Ontario’s ColonCancerCheck: results from Canada’s first province-wide colorectal cancer screening program”. En: Cancer Epidemiol Biomark Prev, 23: 508-515.
- Major, D.; Bryant, H.; Delaney, M. et al. (2013): “Colorectal cancer screening in Canada: results from the first round of screening for five provincial programs”. En: Curr Oncol, 20: 252-257.
- Centers for Disease Control and Prevention (2015): “Morbidity and mortality weekly report: Colorectal cancer screening test use - United States, 2013”. Disponible online en: <www.cdc.gov>.
- Siegel, R.; Desantis, C. y Jemal, A. (2014): “Colorectal cancer statistics, 2014”. En: CA Cancer J Clin, 64: 104-117.
- Edwards, B.K.; Ward, E.; Kohler, B.A. et al. (2010): “Annual report to the nation on the status of cancer, 1975–2006, featuring colorectal cancer trends and impact of interventions (risk factors, screening, and treatment) to reduce future rates”. En: Cancer, 116: 544-573.
- Levin, T.R.; Jamieson, L.; Burley, D.A. et al. (2011): “Organized Colorectal Cancer Screening in Integrated Health Care Systems”. En: Epidemiol Rev, 33: 101-110.
- Chao, H.H.; Schwartz, A.R.; Hersh, J. et al. (2009): “Improving colorectal cancer screening and care in the Veterans Affairs Healthcare system”. En: Clin Colorectal Cancer; 8: 22-28.
- Pan American Health Organization (2013): Cancer in the Americas: Country Profiles 2013. Ginebra, OMS.
- Coy, C. (2013): “Colorectal cancer prevention in Brazil. Where are we?” En: J Coloproctol, 33: 111-112.
- Programa nacional de prevención y detección temprana del cáncer colorrectal. Disponible online en: <http://www.msal.gob.ar>.
- Resolución Ministerial 2173. Creación del Programa Nacional de Prevención y Detección temprana del cáncer colorrectal. Ministerio de Salud de la Nación, 30 de diciembre de 2013. Disponible online en: <http://www.msal.gob.ar>.
- Fenocchi, E.; Martínez, L.; Tolve, J. et al. (2006): “Screening for colorectal cancer in Uruguay with an immunochemical faecal occult blood test”. En: Eur J Cancer Prev, 15: 384-390.
- Plummer, J.M.; Mitchell, D.I.; Ferron-Boothe, D. et al. (2012): “Colonoscopy in central Jamaica: results and implications”. En: West Indian Med J, 61: 610-614.
- Gonzalez, R.S. (2014): “Cancer Screening: Global Debates and Cuban Experience”. En: MEDICC Review, 16: 73-77.
- López-Charneco, M.; Pérez, C.M.; Soto-Salgado, M. et al. (2013): “Correlates of colorrectal cancer screening among Hispanics: Results from the 2008 Puerto Rico behavioral risk factor surveillance system survey”. En: P R Health Sci J, 32: 68-75.
- Dey, S. y Soliman, A.S. (2010): “Cancer in the global health era: opportunities for the Middle East and Asia”. En: Asia Pac J Public Health, 22: 75S-82S.
- Omran, S.; Barakat, H.; Muliira, J.K. et al. (2015): “Knowledge, experiences, and barriers to colorectal cancer screening: a survey of health care providers working in primary care settings”. En: J Cancer Educ, 30: 53-61.
- Sung, J.J.; Ng, S.C.; Chan, F.K. et al. (2015): “An updated Asia Pacific Consensus Recommendations on colorectal cancer screening”. En: Gut, 64: 121-132.
- Sung, J.J.; Lau, J.Y.; Goh, K.L. et al. (2005): “Increasing incidence of colorectal cancer in Asia: implications for screening”. En: Lancet Oncol, 6: 871-876.
- Byeon, J.S.; Yang, S.K.; Kim, T.I. et al. (2007): “Colorectal neoplasm in asymptomatic Asians: a prospective multinational multicenter colonoscopy survey”. En: Gastrointest Endosc, 65: 1015-1022.
- Pathy, S.; Lambert, R.; Sauvaget, C. et al. (2012): “The incidence and survival rates of colorectal cancer in India remain low compared with rising rates in East Asia”. En: Dis Colon Rectum, 55: 900-906.
- Goss, P.E.; Strasser-Weippl, K.; Lee-Bychkovsky, B.L. et al. (2014): “Challenges to effective cancer control in China, India, and Russia”. En: Lancet Oncol, 15: 489-538.
- Kang, L.N. y Qiao, R.L. (2014): “Cancer screening and prevention in China”. En: Cancer Control, 8: 131-133.
- Saito, H. (2006): “Colorectal cancer screening using immunochemical faecal occult blood testing in Japan”. En: J Med Screen, 13: S6-S7.
- Center for Cancer Control and Information Services NCC (2013): Cancer statistics in Japan ‘13. Tokio: Foundation for Promotion of Cancer Research.
- Choi, K.S.; Lee, H.Y.; Jun, J.K. et al. (2012): “Adherence to follow-up after a positive fecal occult blood test in an organized colorectal cancer screening program in Korea, 2004-2008”. En: J Gastroenterol Hepatol, 27: 1070-1077.
- Shim, J.I.; Kim, Y.; Han, M.A. et al. (2010): “Results of colorectal cancer screening of the national cancer screening program in Korea, 2008”. En: Cancer Res Treat, 42: 191-198.
- Khuhaprema, T.; Sangrajrang, S.; Lalitwongsa, S. et al. (2014): “Organised colorectal cancer screening in Lampang Province, Thailand: preliminary results from a pilot implementation programme”. En: BMJ Open, 4: e003671.
- Australian Government Department of Health (2015): National Bowel Cancer Screening Program 2015. Disponible online en: <http://www.cancerscreening.gov.au>.