Capítulo 4
CAPÍTULO 4
Prevención y detección temprana del cáncer colorrectal en población de riesgo promedio. Métodos de tamizaje*
La prevención primaria, el tamizaje y la vigilancia o prevención terciaria del CCR son las tres estrategias principales para el control de esta enfermedad en la población general.1-3 La prevención primaria tiene como objetivo disminuir el riesgo de desarrollar el CCR buscando modificar los factores de riesgo relacionados con la dieta y el estilo de vida.
A través del tamizaje o pesquisa del CCR, se busca la detección y tratamiento de lesiones precursoras (adenomas) y el diagnóstico de la enfermedad en etapas tempranas.1,3,4
La historia natural del CCR demuestra que los adenomas convencionales y aserrados son los precursores de la gran mayoría de los cánceres colorrectales, por lo cual su detección y extracción se asocian con una reducción de la incidencia.1
Por otra parte, la posibilidad de detectar un mayor número de cánceres en etapas tempranas permite tratamientos menos invasivos, con altas tasas de curación, disminuyendo significativamente la mortalidad.
Por último, la tercera estrategia, denominada prevención terciaria, es la vigilancia endoscópica de las personas que han sido diagnosticadas y tratadas por lesiones premalignas o un cáncer colorrectal. En este grupo también podrían incluirse aquellas personas con enfermedad inflamatoria intestinal que deben realizar colonoscopías de vigilancia regularmente.5-8
En 1968, la Organización Mundial de la Salud (OMS) definió los principios para justificar el tamizaje de una enfermedad.9
Los principios son:
- La condición debe ser un problema de salud importante para el individuo y la comunidad.
- Debe existir un tratamiento aceptado o una intervención útil para los pacientes con la enfermedad.
- Tiene que haber recursos instalados disponibles para el diagnóstico y el tratamiento.
- La enfermedad debe tener una fase latente reconocible o sintomática temprana.
- Debe existir una prueba o examen de tamizaje conveniente.
- La prueba tiene que ser aceptada por la población.
- La historia natural de la enfermedad debe ser adecuadamente conocida.
- Tiene que existir una política consensuada para referir a un nuevo examen complementario y al tratamiento de los pacientes que lo requieran.
- El costo debe ser económicamente equilibrado en relación a los gastos en atención médica del conjunto.
- La detección de casos tiene que ser un proceso continuo y no un evento de una sola vez.
El cáncer colorrectal cumple con los principios enunciados justificando su pesquisa en la población general:
- Tiene una historia natural conocida: la mayoría de los cánceres colorrectales se originan en pólipos adenomatosos cuya progresión a cáncer (secuencia adenoma-carcinoma) se estima en más de diez años.
- Existen test disponibles para el tamizaje del CCR con buena sensibilidad para detectar los adenomas y el cáncer colorrectal en etapas tempranas.
- La lesión precursora (adenoma) puede ser detectada y tratada efectivamente mediante la colonoscopía en más del 90% de los casos, disminuyendo la incidencia del CCR.
- El tratamiento del CCR en etapa temprana (pre-sintomática) permite su curación en más del 90% de los casos, cifra significativamente mayor a la curación obtenida cuando el diagnóstico se hace en etapa sintomática (60%).
- Varias estrategias de pesquisa del CCR han demostrado ser costo-efectivas.
Existe evidencia suficiente que ha demostrado que el tamizaje del cáncer colorrectal es eficaz.1,3,4,10,11
En el Plan Nacional de Programas de cribado en los Países Bajos12 se agregaron otros componentes adicionales para la consideración de programas poblacionales, tomando como base los principios para la pesquisa señalados por la OMS:
- El tiempo entre la prueba de tamizaje y su resultado y entre este y el tratamiento debe ser lo más corto posible.
- El procedimiento de reclutamiento o convocatoria debe ser efectivo y no debe limitarse a la voluntad de las personas en su libertad de participar.
- Los potenciales participantes deben recibir información adecuada sobre las ventajas y eventuales riesgos de la participación.
- Los beneficios y los riesgos también deben ser bien conocidos por los profesionales sanitarios.
- La educación pública debe promover una amplia accesibilidad al programa.
- Debe haber garantías de calidad y controles de calidad de los procedimientos en todas las fases del programa.
- Los programas de cribado son acciones concertadas que deben cumplir con los requisitos de organización y gestión.
Estos principios se han tenido en cuenta en la actual política de la Unión Europea (UE) establecida en la Recomendación del Consejo sobre el cribado del cáncer de diciembre de 2003. En la misma se incluye el cribado del CCR, ya que cumple los criterios anteriores señalados para la implementación de programas poblacionales.13
Los programas, ya sean organizados u oportunistas, cuya finalidad es la de reducir la mortalidad y la incidencia del CCR en la población, deben garantizar la calidad de los exámenes y procesos y proporcionar una adecuada protección contra los eventuales daños y complicaciones de los estudios, evitar un seguimiento deficiente de los casos positivos y un inadecuado tratamiento de los hallazgos.14,15
La calidad general depende del rendimiento en cada paso en el proceso de pesquisa para lograr el beneficio buscado, por lo tanto, la calidad debe ser óptima en cada acción desarrollada. Esto incluye la identificación y la invitación de la población objetivo, los resultados de la prueba de tamizaje y, si es necesario, un diagnóstico, tratamiento, vigilancia y cuidado posterior de las lesiones detectadas.16,17
La aplicación de programas de pesquisa de base poblacional debe fortalecer los servicios de diagnóstico y tratamiento disponibles para elevar los estándares de calidad que beneficien a los participantes en el tamizaje y a las personas con patologías detectadas.
El programa requiere una mayor capacitación de los profesionales para cumplir con los estándares del cribado. En consecuencia, estos esfuerzos también contribuyen a un mejor diagnóstico y tratamiento de las personas con enfermedad sintomática.17
Hay muchos factores que influyen en la elección de una prueba de pesquisa: evidencia de la eficacia, magnitud del efecto (reducción de la incidencia o la mortalidad por CCR), seguridad, conveniencia, comodidad, disponibilidad y costo-efectividad.
Las opciones para la pesquisa del CCR disponibles para la detección temprana del CCR y sus lesiones precursoras difieren sustancialmente en muchas de estas dimensiones.4
Antes de la elección de cualquier prueba de tamizaje, debe asegurarse la disponibilidad de una colonoscopía diagnóstica y/o terapéutica. Cualquiera de los métodos primarios empleados con resultados positivos (por ejemplo, SOMF positiva) llevan a un estudio endoscópico colónico complementario, por lo cual la falta de recursos endoscópicos hace inviable la ejecución de un programa de pesquisa organizado. La disponibilidad de la colonoscopía, ya sea como método de tamizaje primario o secundario a los otros test de tamizaje, varía de modo significativo según el país e incluso entre regiones, por lo cual la evaluación previa de los recursos endoscópicos locales es esencial para iniciar la pesquisa y decidir el método.
En países como los EE. UU., donde se propone la colonoscopía como método primario, un programa de pesquisa basado en la este estudio para la población objetivo mayor de 50 años requiere mayores recursos endoscópicos que los disponibles actualmente para satisfacer esa demanda.18
La disponibilidad endoscópica es una situación aún más relevante para la decisión de programas de tamizaje para países con medianos o bajos recursos.19
La realización de estudios de costo-efectividad tiene el propósito principal de proporcionar estimaciones razonables sobre la eficacia y la conveniencia de intervenciones para los responsables de políticas de salud y para la sociedad en general.20 Este análisis es crítico, especialmente cuando se aplica a intervenciones de salud dirigidas a la población en general y, en este aspecto, la pesquisa del cáncer colorrectal resulta consistentemente costo-efectiva, comparada con otras intervenciones médicas (como la pesquisa del cáncer de mama), con la posibilidad no solo de reducir la mortalidad por CCR, sino también la incidencia.20
Los estudios de costo-efectividad para pesquisa del CCR efectuados en Estados Unidos, en varios países europeos y asiáticos (Hong Kong, China, Corea, Singapur, Taiwán, China) llegaron a la conclusión de que la pesquisa del cáncer colorrectal es costo-efectiva comparada con la falta de pesquisa y que debe recomendarse a todas las personas con riesgo promedio a partir de los 50 años y hasta los 75 años.19,21-27
El uso de un estudio de costo-efectividad en cada país en particular puede ayudar a identificar la estrategia de cribado más adecuada teniendo en cuenta las limitaciones presupuestarias. De esta manera, se llevó a cabo en Argentina el primer estudio de costo-efectividad de las pruebas de tamizaje del cáncer colorrectal publicado en marzo de 2016, cuyos resultados muestran que el test de SOMFi anual y la colonoscopía cada 10 años son estrategias costo-efectivas en Argentina comparadas con la falta de pesquisa.28 Los detalles de este estudio se desarrollan en un capítulo específico.
Los diferentes modelos utilizados en los EE. UU., que fueron diseñados de forma independiente, por lo general llegan a conclusiones similares con una costo-efectividad en el mismo rango para las siguientes estrategias: SOMF de alta sensibilidad (Hemoccult Sensa o prueba inmunoquímica) anual, la sigmoideoscopia flexible cada 5 años más un test de SOMF sensible anual, o una colonoscopía cada 10 años.29
Los análisis de costo-efectividad no seleccionan una estrategia económicamente preferida sobre las demás, sino aquella más efectiva en términos de años de vida ganado para un nivel de gasto deseado (o posible). Las estrategias de cribado de CCR se clasifican en orden, de acuerdo con los años de vida ganados en relación con ningún cribado y comparándolas entonces de forma incremental de acuerdo con los costos de cada estrategia.30
Aquellas estrategias que tienen el mayor número de años de vida ganados con el menor costo, para un determinado umbral, se consideran las más eficientes. Así, la opción de menor costo es la prueba de sangre en heces; al incrementar el presupuesto, la seguiría la sigmoideoscopía y, por último, la colonoscopía se presenta como la opción más costosa.
Las clasificaciones que utilizan dos modelos de simulación, como el Sim CCR de la Universidad de Minnesota y el Hospital General de Massachusetts, y el modelo del Grupo del Instituto de Investigación de la Salud en Estados Unidos (CISNET) arrojaron datos muy similares, aunque el costo absoluto por año de vida ganado difería entre los modelos. Todas las estrategias tienen costos por año de vida ganado (en comparación con ningún cribado) que se ubican entre 10.000 y 25.000 dólares, muy por debajo del límite considerado como rentable en Estados Unidos (50.000 dólares por año de vida ganado).8,21
De los estudios efectuados en Estados Unidos surgen otros datos relevantes:19
- Como el cumplimiento de la pesquisa no llega al 100 por ciento, la promoción del tamizaje mediante cualquier estrategia ahorrará años de vida.
- Las diferencias en la costo-efectividad de algunas estrategias son modestas y susceptibles de variación en caso de modificarse parámetros de participación.
- El conocimiento de los detalles de progresión de la enfermedad, su variación con respecto a la edad, sexo o antecedentes es limitado.
- Diferentes supuestos con respecto a progresión de la enfermedad afectan los resultados del modelo de simulación.
Recientemente, se realizó un estudio de costo-efectividad en Irlanda, donde se demuestra que tanto el test de guayaco o el de SOMFi bienal y la sigmoideoscopía por única vez son altamente costo-efectivas en comparación con ningún cribado.31
Existe consenso entre distintos estudios en que las nuevas tecnologías como el Test de ADN en materia fecal, la colonografía por TC y la cápsula endoscópica no son aún costo-efectivas en los niveles actuales de costos.30,32
El análisis de un modelo de costo-efectividad muestra que, con el aumento de los costos de la quimioterapia para el cáncer colorrectal avanzado, la pesquisa del cáncer colorrectal, en un escenario de largo plazo, no solo es costo-efectiva sino que además permite ahorrar recursos.33
Dos modelos globales de costo-efectividad que reportan estimaciones de las intervenciones en varias regiones del mundo concluyen que en países de bajos ingresos, la expansión y accesibilidad al tratamiento del CCR son la prioridad antes que el tamizaje.34,35
Debido a las variaciones en los países en el nivel de ingresos y de recursos disponibles para la pesquisa y el diagnóstico del cáncer colorrectal, se elaboraron recomendaciones para países con diferentes niveles de ingresos.19
Generalmente, en países de bajos ingresos, la incidencia de CCR es relativamente baja y otras enfermedades, incluyendo otros tipos de cáncer, tienen prioridad para la pesquisa y el tratamiento. Instalar la pesquisa del cáncer colorrectal requiere incrementar la inversión en salud pública para mejorar la atención primaria de salud, fortalecer los servicios involucrados en el diagnóstico y tratamiento en los sistemas hospitalarios y generar un registro de cáncer.36 Las inversiones en salud también incluyen el personal médico capacitado, así como buenos sistemas de seguimiento, evaluación y controles de calidad.36 Los países más pequeños pueden carecer de recursos específicos, como servicios de oncología, instalaciones para radioterapia, laboratorios especializados, incluso no contar con cirujanos especialistas y hospitales de referencia que permitan un tratamiento quirúrgico de calidad.19 Si la colonoscopía no está disponible como una herramienta de diagnóstico, la radiología de colon por enema de bario puede ser la única opción, y hasta contar con el recurso endoscópico, la pesquisa del CCR resulta inviable. Al menos debería asegurarse el tratamiento de CCR sintomático, incluyendo cirugía de calidad, tratamientos oncológicos y cuidados paliativos, especialmente para el manejo del dolor en los casos avanzados, como un imperativo ético.19
En países de ingresos medios hay un aumento (más pronunciado inicialmente en las zonas urbanas) de la incidencia de CCR y la capacidad de intervención es mayor. La pesquisa oportunista aumenta en aquellas personas cubiertas por el seguro de salud y los países que ya han comenzado o planean tamizajes organizados de otros tipos de cáncer podrán decidir iniciar pruebas de cribado del CCR como un estudio piloto en regiones urbanas seleccionadas.
Los países prioritarios para implementar la pesquisa del CCR son aquellos en los que la tasa estandarizada de incidencia de CCR en los hombres es mayor a 30 por cada 100.000 habitantes (por ejemplo, Hungría, Serbia y otros países de Europa del Este) y en donde se han iniciado experiencias piloto, como en la Argentina (tasa estandarizada de incidencia de CCR en hombres de 29,9/100.000).19
En países donde las tasas de incidencia de CCR en los hombres se acercan a 20 por 100.000 debería iniciarse una planificación (por ejemplo, países como Cuba, Líbano y Malasia).
El acceso a datos de incidencia de CCR individualizado por ciudades permite analizar la inclusión de regiones urbanas con umbrales similares de incidencia en el programa de pesquisa.
Para el tamizaje de CCR, el test de sangre oculta es barato, aunque se necesitan inversiones adicionales para poner en práctica todos los componentes del cribado organizado. En países de ingresos medios para un programa organizado puede aconsejarse el uso del test inmunoquímico, en lugar del guayaco, por su mayor sensibilidad y especificidad. Los países de recursos medios también tienen más recursos para el tratamiento y puede ir expandiendo la cobertura a una mayor proporción de la población. A medida que los cánceres se detectan más tempranamente, el objetivo del tratamiento de la enfermedad cambia de la paliación a la curación.19,36 Por su parte, en los países de altos ingresos, las consideraciones de costo-efectividad sugieren que la prueba inmunoquímica en heces, la sigmoideoscopía o la colonoscopía son opciones para el cribado. La adherencia al cribado sigue siendo una variable esencial y a pesar de que cada prueba tiene sus defensores la prueba ideal no existe.
El concepto de la evaluación de recursos disponibles para iniciar la pesquisa del cáncer colorrectal también llevo al Comité de Recomendaciones de la Organización Mundial de Gastroenterología (WGO) a presentar un nuevo modelo conceptual “en cascada”, basado en la evidencia, pero orientado a los recursos, con especial énfasis en la disponibilidad de colonoscopías, donde varias pruebas puede ser ordenadas en el marco de este modelo. El concepto de “cascada” propone: “haz lo que puedas con lo que tienes”, en lugar de “Hazlo de esta manera o de ninguna manera”.37
Un conjunto de 4 niveles de recursos fueron delineados y así se realizaron recomendaciones de cribado, de mayor a menor, basados especialmente en el recurso endoscópico.
En el primer nivel, para países y sistemas de salud con recursos financieros, profesionales y de colonoscopía altos, la recomendación es la colonoscopía cada 10 años,
En el segundo nivel se ubican a aquellos lugares donde el recurso de colonoscopía es más limitado y la sigmoideoscopia flexible está disponible. Allí se recomienda este último estudio cada 10 años seguido de colonoscopía en caso de hallazgos positivos. Esto puede definirse como el hallazgo de adenomas avanzados o cualquier adenoma, dependiendo de los recursos.
En un tercer nivel, donde los recursos endoscópicos (tanto la colonoscopía como la sigmoideoscopía flexible) son limitados, recomiendan SOMFg de alta sensibilidad o SOMFi anual.
En el último nivel, donde la colonoscopía y la sigmoideoscopía flexible están severamente limitados recomiendan SOMFg menos sensible o SOMFi cuantitativo ajustado a menor sensibilidad.37
MÉTODOS DE TAMIZAJE DEL CÁNCER COLORRECTAL EN POBLACIÓN DE RIESGO PROMEDIO
Como ya se ha indicado, hay muchos factores que influyen en la elección de una prueba de pesquisa: evidencia de la eficacia, magnitud del efecto (reducción de la incidencia o la mortalidad por CCR), seguridad, conveniencia, comodidad, disponibilidad y costo-efectividad.
No obstante, la prueba o examen de detección es solo un evento dentro de un proceso de múltiples pasos que incluye la citación de la población objetivo, los test, la confirmación del diagnóstico, la comunicación, el tratamiento y la re-citación o la vigilancia según corresponda.19,38
La prueba debe poseer buena sensibilidad y especificidad, y para garantizar la eficacia de la pesquisa las personas deben estar dispuestas a aceptarla y los profesionales de la salud deben acompañar el objetivo con acciones de calidad.39
Las estrategias para el tamizaje del CCR se clasifican en dos grandes categorías: 40 la primera, los análisis en materia fecal, que incluyen:
- Test de sangre oculta en heces con guayaco (SOMFg).
- Test inmunoquímico de sangre oculta en heces (SOMFi).
- Test de detección de alteraciones del ADN en materia fecal.
La segunda, los exámenes estructurales colorrectales, que incluyen:
- Sigmoideoscopía flexible (SF).
- Colonoscopía convencional u óptica.
- La cápsula endoscópica.
- Radiología de colon por enema.
- La colonografía por TC (colonoscopía virtual).
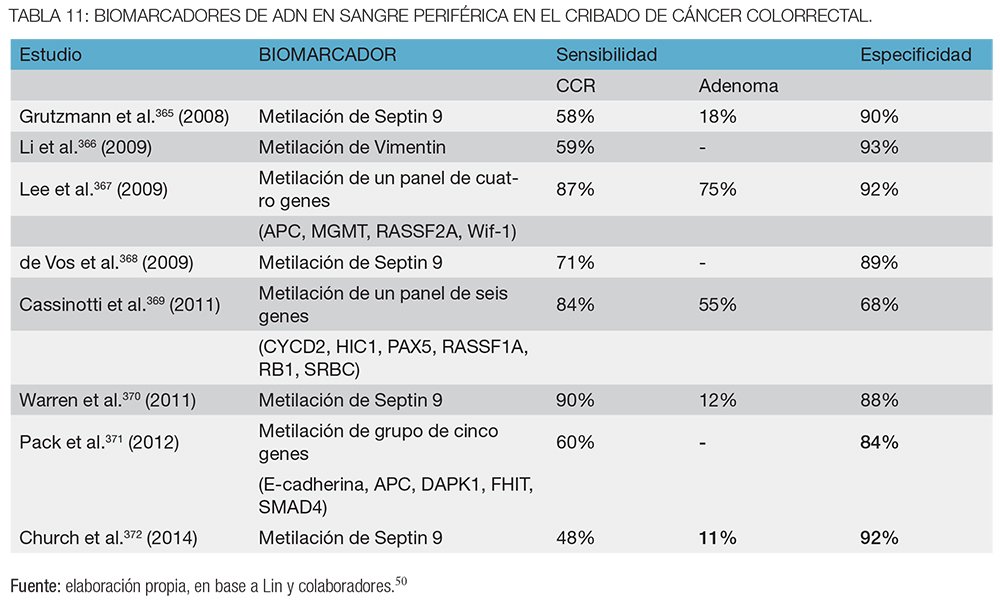
Además, hay que agregar los biomarcadores del CCR en sangre periférica, una opción de tamizaje en proceso de investigación, de utilidad aún incierta.
Los test de sangre oculta en heces, ya sea la prueba de guayaco (SOMFg) o la más sensible prueba inmunoquímica fecal (SOMFi) y la sigmoideoscopía flexible, son los exámenes predominantemente implementados en los programas organizados poblacionales en Europa, Canadá y Australia, mientras la colonoscopía es la modalidad de detección dominante en los EE. UU., donde el tamizaje es predominantemente de tipo oportunista.3, 41
EXÁMENES DE PESQUISA DEL CÁNCER COLORRECTAL EN MATERIA FECAL
Test de sangre oculta en materia fecal basado en guayaco (SOMFg)
El test de sangre oculta en la materia fecal con técnica del guayaco (SOMFg) permite detectar la presencia de pequeñas cantidades de sangre en las heces mediante una reacción de peroxidasa de la hemoglobina. El participante debe tomar tres muestras de materia fecal en días consecutivos, y como la prueba no es específica para hemoglobina humana, requiere una dieta previa, ya que pueden producirse falsos positivos por la presencia de hemoglobina de origen animal o peroxidasas presentes en algunos vegetales. Esta prueba puede detectar sangrados de todo el tubo digestivo, por lo tanto tampoco es específica para la detección de lesiones colorrectales.
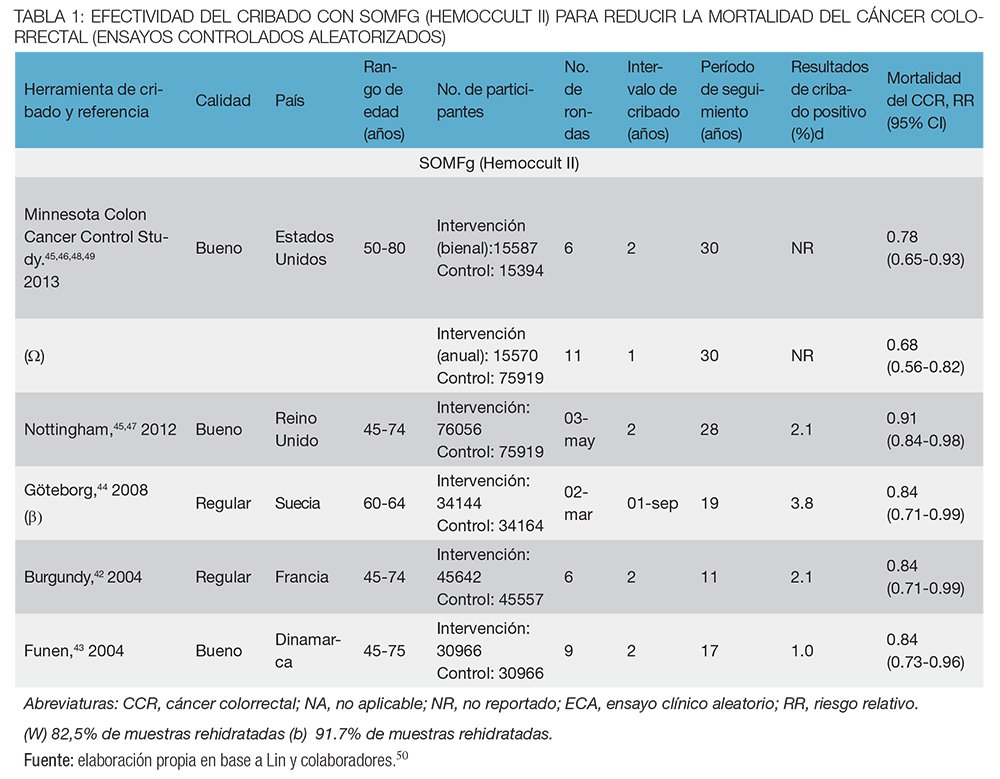
Se han llevado a cabo cinco ensayos controlados aleatorizados (ECA) a gran escala (n = 419.966) con 11 a 30 años de seguimiento que evaluaron la efectividad de los programas anuales o bienales de cribado con Hemoccult II42-49 (tabla 1). Basados en el análisis de intención de tratar, en comparación con ningún cribado, el cribado bienal con Hemoccult II dio lugar a una reducción en la mortalidad específica por CCR después de 2 a 9 rondas de cribado a los 19,5 años (riesgo relativo [RR], 0,91; IC del 95%, 0,84-0,98 y a los 30 años [RR], 0,78; IC del 95%, 0,65-0,93). En uno de los ensayos, realizado en los Estados Unidos, el cribado anual con Hemoccult II después de 11 rondas de tamizaje resultó en una mayor reducción de la mortalidad (RR, 0,68; IC del 95%, 0,56-0,82) que en el cribado bienal a los 30 años (RR, 0,78; IC del 95%, 0,65- 0,93).46,50
En el ensayo de Minnesota se asignaron al azar 46.551 hombres y mujeres de entre 50 y 80 años a uno de tres grupos: examen de SOMFg rehidratado anual (15.570 personas), cada dos años (15.587 personas) o control (15.394 personas). En este ensayo se demostró que la detección mediante SOMFg anual disminuyó la mortalidad por cáncer colorrectal un 33% luego de 18 años de seguimiento (riesgo relativo (RR), 0,67; (IC) 95%, 0,51-0,83), en comparación con el grupo de control y que las pruebas bienales redujeron la mortalidad relativa en 21% (RR 0,79; IC 95%, 0,62–0,97).48
La rehidratación de los frotis de las pruebas aumentó en gran medida la positividad y, en consecuencia, se incrementó el número de colonoscopías que se realizaron.51
Alrededor del 85% de los pacientes con resultado positivo del test se sometieron a procedimientos diagnósticos que incluyeron una colonoscopía o radiología de colon por enema doble contraste más sigmoideoscopía flexible (SF). En el seguimiento a 30 años, se observó una reducción sostenida de la mortalidad por CCR de 32% en el grupo de exámenes anuales (RR, 0,68; IC 95%, 0,56–0,82) y de 22% en el grupo de exámenes bienales (RR, 0,78; IC 95%, 0,5–0,93) y no hubo reducción de la mortalidad por todas las causas en ninguno de los grupos.46
En el ensayo en Reino Unido se asignaron cerca de 76.000 individuos a cada grupo. Al de tamizaje se les ofreció una SOMFg sin rehidratación cada dos años por tres a seis ciclos de 1985 a 1995.45, 47 Con una mediana de seguimiento de 7,8 años, el 60% completó al menos una prueba y el 38% completó todas las pruebas. La incidencia acumulada de CCR fue similar en ambos grupos y el ensayo informó una reducción del RR de 15% en la mortalidad por CCR (RR 0,85; IC 95%, 0,74-0,98). La tasa de complicaciones graves por la colonoscopía fue de 0,5% y hubo 5 muertes postquirúrgicas en pacientes operados por CCR o adenomas detectados en el grupo de tamizaje sobre un total de 75.253 individuos ingresados.52 Al cabo de una mediana de seguimiento de casi 12 años, no se observó ninguna diferencia en cuanto a la incidencia del CCR entre los grupos de intervención y de control. El cociente de la tasa de mortalidad específica de CCR fue de 0,87 (0,78-0,97; P = 0,01), mientras el cociente de la tasa de mortalidad por todas las causas fue de 1,00 (0,98-1,02; P = 0,79).45 Cuando la mediana de seguimiento se extendió a 19,5 años, hubo una reducción de 9% en la mortalidad por CCR (RR 0,91; IC 95%, 0,84-0,98), pero ninguna reducción en la incidencia de CCR (RR, 0,97; IC 95%, 0,91–1,03), o en la mortalidad por todas las causas (RR = 1,00; IC 95%, 0,99-1,02).45
En el ensayo de Funen, Dinamarca, se inscribieron aproximadamente 31.000 individuos que se asignaron a dos grupos. Se ofreció a los individuos en el grupo de intervención una SOMFg no rehidratada cada dos años, durante nueve ciclos, en un período de 17 años. Sesenta y siete por ciento completó el primer examen de detección y más de 90% de los individuos invitados a cada examen posterior se sometieron a una SOMFg. En este estudio se mostró una reducción del 18% en la mortalidad por CCR a los 10 años de seguimiento, del 15% a los 13 años de seguimiento (RR, 0,85; IC 95%, 0,73-1,00) y del 11% a los 17 años de seguimiento (RR, 0,89; IC 95%, 0,78-1,01).43,53
En el ensayo sueco se inscribieron 68.308 ciudadanos de edades entre 60 a 64 años y se los asignó al azar en el grupo de examen y de control.44 No se estableció contacto con los participantes del grupo de control y estos no sabían que eran parte del ensayo. El examen de detección se ofreció con frecuencias distintas a tres cohortes diferentes según el año de nacimiento y se realizó con la prueba SOMFg Hemoccult II. Cerca de 92% de las pruebas se rehidrataron. Se invitó a los individuos con resultado positivo a someterse a un examen que incluyó anamnesis, sigmoidoscopía flexible y enema de bario de doble contraste. El criterio primario de valoración fue la mortalidad específica por CCR. Los períodos de seguimiento oscilaron entre 6,7 años, y 19,5 años según la fecha de inscripción con tasas de cumplimiento de los exámenes de 70 y 47,2% de los participantes que completaron todos los exámenes, respectivamente. De los 2.180 participantes con un resultado positivo de la prueba, 1.890 (86,7%) se sometieron a una evaluación diagnóstica completa; se detectaron 104 casos de cáncer y 305 adenomas de al menos 10 mm. Se presentaron 252 muertes por CCR en el grupo de exámenes de detección y 300 en el grupo de control, con un cociente de mortalidad de 0,84 (IC 95%, 0,71-0,99). La diferencia en la mortalidad por CCR surgió después de 9 años de seguimiento. La mortalidad por todas las causas fue muy similar en los dos grupos, con un cociente de mortalidad de 1,02 (IC 95%, 0,99-1,06).44
En todos los ensayos se observó una distribución por estadios más favorable en la población que se sometió a exámenes de detección, en comparación con los grupos de control. Los datos del ensayo danés indican que, si bien la incidencia acumulada de CCR fue similar en el grupo que se sometió a exámenes de detección y el grupo de control, un porcentaje más alto de lesiones tempranas se observó en el grupo sometido a exámenes de detección.43
En una revisión sistemática realizada por medio de Cochrane Collaboration, se examinaron todos los ensayos aleatorizados de exámenes de detección del CCR, que incluyeron SOMFg en más de una ocasión.54 Los resultados combinados mostraron que los participantes en el ensayo que se asignaron a los exámenes de detección tuvieron una mortalidad por CCR 16% más baja (RR, 0,84; IC 95%, 0,78-0,90). Sin embargo, no hubo diferencia en la mortalidad por todas las causas entre el grupo que se sometió a exámenes de detección y el grupo de control (RR, 1,00; IC 95%, 0,99-1,02). Más aún, en los ensayos se notificó un valor predictivo positivo (VPP) bajo para la SOMFg, lo que indica que la mayoría de los análisis con resultados positivos fueron positivos falsos. A partir de los ensayos con frotis sin rehidratación (Funen43 y Nottingham45), el VPP osciló entre 5,0 y 18,7%, mientras que el VPP en los ensayos con frotis rehidratados (Gotenburgo44 y Minnesota46) fue de 0,9 a 6,1%. En el informe no se analiza la contaminación en los grupos de control de los ensayos y no hay información sobre el tratamiento por estadio.54,55
A la revisión sistemática de Hewitson,54 se suman otras dos revisiones que confirman la reducción de la mortalidad por CCR mediante el cribado del CCR con SOMFg.56,57
La prueba de SOMFg además de ser poco específica, requiriendo por lo tanto un número elevado de colonoscopías por falsos positivos es poco sensible para la detección de adenomas y lesiones avanzadas.38
En el análisis de intención de tratar la tasa de detección de lesiones avanzadas mediante SOMFg fue 0.6%, y en el análisis por protocolo fue de 1.2%.58
La sensibilidad para detectar CCR se ubica en el 54.2% y la especificidad en el rango de 96.9% al 98.1% con un VPP de 5.2% a 13.6%. La tasa de detección en el análisis de intención de tratar fue 0.1%, mientras en el análisis por protocolo fue 0.2%.58-61
En la SOMFg, las restricciones dietarías son una barrera para la participación, y en ciertas poblaciones la tasa de falsos positivos es alta, posiblemente debido a interferencias en la dieta.62,63
Hay distintos test comerciales que detectan la SOMF basados en la prueba de guayaco. El test Hemoccult SENSA ha demostrado tener mayor sensibilidad que el Hemoccult II (64-80% vs. 25-38%) a expensas de una menor especificidad (87-90% vs. 98-99%).64,65
Debido a que la adherencia a un programa de pruebas de sangre oculta en heces repetidas es baja, las guías de recomendaciones decidieron no aconsejar las pruebas que tienen menos de 50% de sensibilidad para la detección de cáncer, recomendando la utilización de los test de mayor sensibilidad como el Hemoccult SENSA o el test inmunoquímico (SOMFi).1,3,29
En la actualidad, esta prueba cayó prácticamente en desuso debido a los resultados de varios ensayos que confirman la superioridad de la prueba inmunoquímica (SOMFi) sobre el guayaco en la sensibilidad para la detección de neoplasias colorrectales, mayor participación de la población por falta de restricciones dietarías y el menor número de muestras necesarias.60,66,67
Test de sangre oculta en materia fecal inmunoquímico (SOMFi)
La prueba inmunoquímica de sangre oculta en materia fecal se caracteriza por detectar exclusivamente la presencia de hemoglobina humana. Eso la hace más específica que el guayaco, ya que no reacciona con hemoglobina de origen animal u otras peroxidasas presentes en algunos vegetales. Esta característica genera una mayor aceptación de la población al método, ya que no requiere restricciones previas en la dieta.
Además, resulta más específica para lesiones colónicas al reaccionar solo con hemoglobina entera, por lo tanto no detecta sangrados digestivos provenientes del tubo digestivo superior debido a que la hemoglobina se digiere durante su paso por el mismo.
La mayor especificidad de la prueba inmunoquímica permite disminuir el número de colonoscopías necesarias en un programa de tamizaje, hecho de vital trascendencia en escenarios con recursos endoscópicos limitados.
Desde el punto de vista técnico, los test de sangre oculta en materia fecal de tipo inmunoquímico utilizan anticuerpos monoclonales o policlonales específicos para la porción globina de la hemoglobina humana, midiendo la reacción anticuerpo-globina a través de diferentes métodos de inmunoensayo (inmunocromatografía, inmunoturbidimetría, ELISA).68
Existen dos tipos de test de SOMFi que se comercializan: uno de tipo cualitativo, donde el resultado solo mide si existe o no presencia de sangre en heces; y una variante cuantitativa, que permite regular un punto de corte para la detección de cantidades variables de sangrado (medida en ng/ml) donde los valores de corte más altos tienen menor sensibilidad aunque aumentan la especificidad.
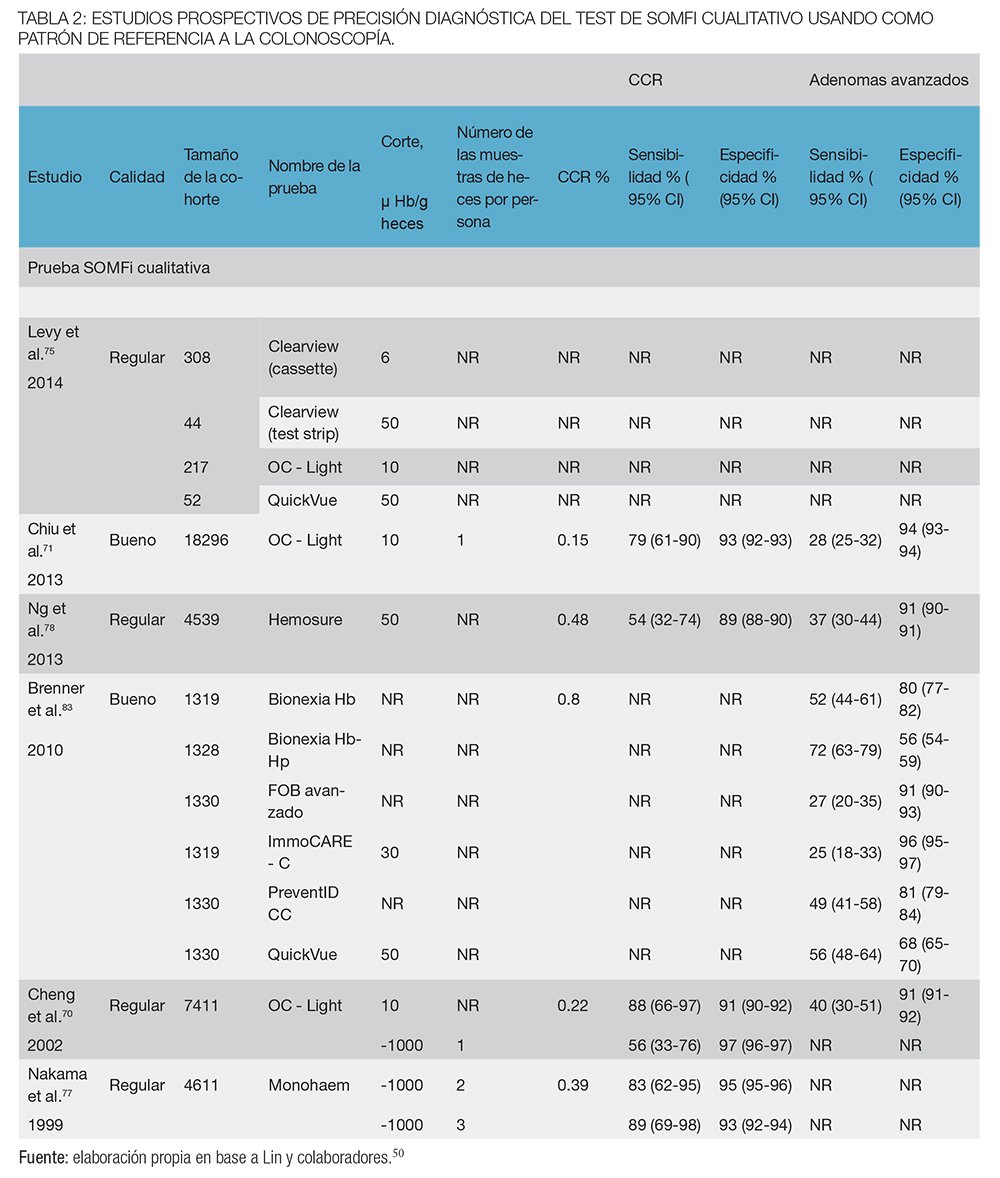
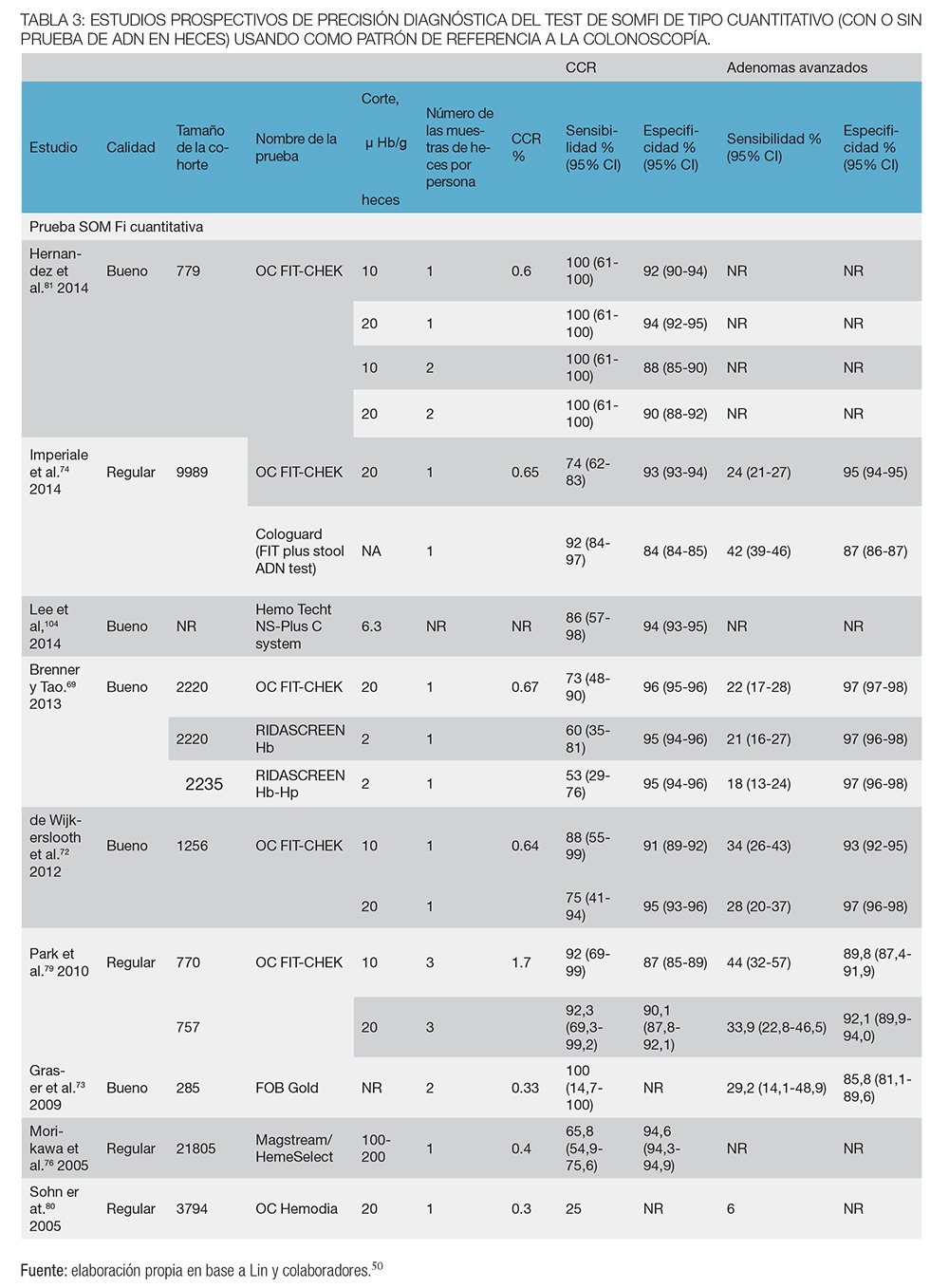
En total hay catorce estudios de razonable o buena calidad (n = 59.425) que utilizaron la colonoscopía como estándar de referencia en todos los participantes50 (tablas 2 y 3). Se muestra la sensibilidad y especificidad para 19 tipos diferentes de SOMFi cualitativos o cuantitativos, incluyendo un estudio con SOMFi más Test de ADN.69-85 En general, la sensibilidad para CCR y adenomas avanzados varía ampliamente. Dada la heterogeneidad de los test de SOMFi y su desempeño, se hizo hincapié en las características de rendimiento de las pruebas disponibles actualmente evaluadas en más de un estudio. Dos familias de test aprobados por la FDA (Food and Drug Administration), el OC-Light, test cualitativo (Nº de estudios = 3, n = 25. 924) y el OC FIT-Chek (OC-Sensor Diana, OC-Micro, OC-Auto) test cuantitativo (Nº de estudios = 5, n = 12.794), tenían una relativamente alta sensibilidad y especificidad.50
Con una sola muestra de heces, la sensibilidad más baja demostrada para el CCR fue del 73% (IC del 95%, 48%-90%) y una especificidad del 96% (IC del 95%, 95%-96%). Del mismo modo, la mayor sensibilidad con especificidad emparejada para el CCR fue del 88% (IC del 95%, 55%-99%) y 91% (IC del 95%, 89%-92%), respectivamente. En los estudios más grandes, la sensibilidad varió de 74% (IC del 95%, 62%-83%) para las categorías de las pruebas cuantitativas (n = 9.989) a 79% (IC del 95%, 61% y 90%) para las categorías de las pruebas cualitativas (n = 18.296).50 En un estudio pequeño (n= 770) que utilizó la prueba con 3 muestras de heces, la sensibilidad fue del 92% (IC del 95%, 69%-99%), pero la especificidad fue del 87% (IC del 95%, 85%-89%). La sensibilidad del OC-Light o OC FIT-Chek para los adenomas avanzados variaron de 22% (IC del 95%, 17%-28%) al 40% (IC del 95%, 30%-51%), y la especificidad varió de 97 % (IC del 95%, 97%-98%) al 91% (IC del 95%, 91%-92%). Aunque se obtuvieron sensibilidades más altas para detectar adenomas avanzados para ciertos test de SOMFi o mediante el uso de 3 muestras de heces, las especificidades correspondientes fueron menores.50
Las pruebas de SOMFi son más sensibles para detectar cánceres que lesiones neoplasias benignas, aunque, como se señaló previamente, tienen una tasa de detección de lesiones avanzadas muy superiores, incluso más del doble, que la técnica de guayaco.50,60,64,66,67,86,87,89,90
Varios estudios muestran también un significativo incremento en la tasa de participación con SOMFi comparada con guayaco.67,88,89
La tasa de positividad del test de SOMFi varía entre 5.5% y 11%; la sensibilidad para CCR, entre 53.3% a 94.1%; y la especificidad para CCR, de 87.5% a 96.9%.79,90
El VPP para CCR varía entre 5.2% y 12.8% en las pruebas cuantitativas a un valor de corte de 75 ng/mL.59,86,87,91,92
Para adenomas avanzados, la sensibilidad y especificidad del test de SOMFi varían entre 33.9% y 41.3% y 91.4% a 97.3%, respectivamente.64,79,93 El VPP para adenomas avanzados varió entre 49% y 51.8%.59,60
Ya se ha demostrado en diversos estudios que el tamizaje poblacional con SOMFi logra una mayor participación en comparación con el guayaco por no demandar restricciones alimentarias y requerir un menor número de determinaciones.63,94 Esta observación fue confirmada por estudios posteriores.59,60,95,96
Las pruebas inmunoquímicas en materia fecal pueden variar sus resultados en relación con el número de muestras de materia fecal analizadas y los valores de corte (niveles de detección de sangre) seleccionados para un resultado positivo, permitiendo elegir la estrategia óptima para una población determinada de acuerdo a la disponibilidad de los recursos endoscópicos.59,60,97
Si bien, como se señaló previamente, varios estudios muestran que la sensibilidad del test de SOMFi para adenomas avanzados es superior al de SOMFg, esto se correlaciona con la elección del punto de corte de sangrado.50,79,90,98
La gran mayoría de los programas de pesquisa utilizan una o dos tomas de materia fecal.99 Muchos ensayos han señalado que dos muestras brindan la mayor sensibilidad y especificidad para CCR,79,100 y un estudio muestra que no hay diferencias en la sensibilidad entre 2 y 3 muestras y tampoco encontró diferencias en la especificidad entre una y dos muestras.100 Otro estudio indica que la aceptación de la población no se modificó utilizando una o dos muestras.101
En algunos estudios, se compararon la sensibilidad y especificidad del test SOMFi en diversos valores de corte para definir una prueba positiva. En un estudio de Van Rossum e t al.102 se halló que la reducción del valor de corte estándar de 100 a 50 ng/ml aumentó la detección de adenomas avanzados, pero no varió la detección del cáncer. El número de colonoscopías necesarias para detectar un adenoma avanzado único o cáncer aumentó de 1,9 a 2,3 y la especificidad disminuyó de 97,8 a 96%.102
Las compensaciones entre punto de corte y sensibilidad están bien descritas en el estudio de Rozen y colaboradores,103 donde se señala que: la sensibilidad es más baja y la positividad es más alta cuando se elige una baja concentración de hemoglobina como punto de corte, mientras que la especificidad y el valor predictivo positivo son más altos usando una concentración más alta. Un especificidad del 95% para CCR (considerado apropiado para tamizaje en riesgo promedio) se obtuvo con un punto de corte de 100 ng/ml de hemoglobina, mientras que dos o tres muestras a 50 ng/ml de corte aumentó la sensibilidad pero disminuyó la especificidad de 90,2 a 87,8%. Otro estudio evaluó variantes de puntos de corte de SOMFi y encontró que 75 ng/ml. provee un buen balance entre las tasas de detección de adenomas avanzados y CCR y el número de colonoscopías necesarias.59
Otros factores, diferentes de la configuración propia del test inmunoquímico, pueden contribuir a la variabilidad de la positividad del mismo. En diferentes programas de tamizaje se reporta que las diferencias en las tasas de positividad del test están directamente relacionadas con las rondas de cribado y la población estudiada, observando mayores tasas de positividad en hombres, en personas mayores y en aquellas de menores recursos.60,101,104,105
Si bien el estudio de Van Roon et al.101 comprueba que el tiempo de espera entre la toma de la muestra y su procesamiento no tienen influencia en la tasa de sensibilidad, otros ensayos sugieren que al producirse una degradación de la hemoglobina con el retraso del procesamiento, la sensibilidad disminuye.60,106 En estos datos se basa la recomendación de procesar las muestras dentro de los siete días posteriores a la toma.
También, estudios in vitro señalan que la temperatura ambiente por encima de 20° C puede afectar la tasa de positividad del test, por degradación de la hemoglobina.107,108 Esta observación se confirma con los datos de varios programas de tamizaje que reportan que en los meses de verano se produce una significativa reducción de la positividad del test.109,110 Tomando en cuenta estas observaciones, el Programa Nacional de tamizaje de CCR en Australia no envía invitaciones a la población para realizar los test inmunoquímicos en los meses de verano.111 Otros estudios, también reportan factores adicionales que pueden modificar la tasa de positividad del test de SOMFi, como por ejemplo el uso de antiagregantes plaquetarios que podrían incrementar la tasa de positividad.38,112
Se ha sugerido en diferentes ensayos que el tamizaje de CCR mediante SOMFi sería más eficaz que otras estrategias de pesquisa, especialmente por la mayor aceptación y una mejor optimización del uso de los recursos. Dos estudios han demostrado que la SOMFi es mejor aceptada que la sigmoideoscopía flexible o la colonoscopía, y por otra parte, tiene ventajas para el tamizaje masivo sobre la colonoscopía en relación a los recursos necesarios y las potenciales complicaciones relacionadas.67,113,114
En un estudio multicéntrico, aleatorizado y controlado en España (Colon Prev) se observó que un tamizaje de una sola vez mediante SOMFi fue equivalente a la colonoscopía en la detección de CCR en población de riesgo medio, en términos de rendimiento diagnóstico, tasa de detección y estadificación del tumor, pero la colonoscopía fue superior al SOMFi en la detección de adenomas no avanzados y avanzados.113
La superioridad de la colonoscopía para la detección de lesiones avanzadas observadas en el estudio de Quintero y colaboradores muestra una ventaja potencial de esta estrategia en términos de reducir no solo la mortalidad por CCR, sino también la incidencia.113
Sin embargo, también debe tenerse en cuenta que el TSOMFi detecta aproximadamente la mitad de los adenomas avanzados en una sola ronda, y considerando que esta estrategia basa su rendimiento en la repetición periódica de la prueba cada uno o dos años, es factible que la ventaja de la colonoscopía se reduzca en el análisis a largo plazo.41
Otro dato que surge del estudio español es que la estrategia mediante TSOMFi fue mejor aceptada que la colonoscopía y se observaron menor número de complicaciones. Esto se debe a que en un programa de cribado con SOMFi se requieren menos colonoscopías y las complicaciones de un programa de tamizaje, generalmente se producen en las colonoscopías terapéuticas, después de la polipectomía. En un programa de cribado con SOMFi de alta calidad, bien organizado, los riesgos y efectos adversos son limitados.113
Un estudio sobre el rendimiento de la pesquisa del CCR luego de varias rondas en un programa organizado con SOMFi anual fue recientemente publicado por Jensen y colaboradores.115 En dicho estudio de cohorte, retrospectivo, 323.349 miembros de un plan de salud con edades entre 50 y 70 años que habían completado la primera ronda, fueron seguidos durante un máximo de 4 rondas de tamizaje son SOMFi. Sobre un total de 670.841 pacientes inicialmente invitados para el cribado, el 48.2% completó la primera ronda; de los elegibles, la participación posterior fue de 75.3%, 83.4%, y 86.1% en la rondas 2 a 4, respectivamente. La participación fue superior en mayores de 65 años que en el grupo entre 50 y 64 años (77.5% vs. 60.3%).
La tasa de positividad de la SOMFi fue del 5% en la primera ronda, 3.9%, 3.7% y 4.3 % en las rondas subsiguientes y los valores predictivos positivos para adenoma y CCR fueron más altos en la ronda 1 (51,5% y 3,4% respectivamente). En general, el test de SOMFi programático detectó el 80,4% de los pacientes con CRC, el 84,5% en la ronda 1 y 73,4% a 78,0% en las rondas posteriores.
Los autores concluyen que el tamizaje anual con SOMFi se asoció con una alta sensibilidad para detectar CCR, con una alta adherencia al intervalo anual entre los participantes iniciales indicando que este tamizaje programático es factible y eficaz para pesquisa poblacional del CCR.115
La prueba de SOMFi es más costosa que la de guayaco, pero tiene el potencial de ahorro por el menor número de colonoscopías necesarias y los estudios muestran que es más costo-efectiva por su mayor tasa de participación, mayor sensibilidad y valor predictivo positivo.89,116,117
Hay consenso general que el test inmunoquímico debe reemplazar al guayaco en un programa de pesquisa del cáncer colorrectal basado en sangre oculta en materia fecal.88,89,118
Cuando se piensa en implementar un programa de tamizaje con el test de SOMFi, se puede flexibilizar o regular el desempeño programático de varias maneras: modificando el intervalo entre estudios (anual, bienal o trienal), el número de determinaciones (una o dos) y en el caso del test cuantitativo regulando el punto de corte de sangrado detectable.38 Esto permite equilibrar la detección del programa con la disponibilidad de recursos de diagnóstico endoscópico y tratamiento. Un Panel de Consenso Europeo (European Group on Tumour Markers) recomendó el uso de SOMFi cuantitativo con análisis automatizado, punto de corte ajustado y análisis de alto rendimiento como test fecal de elección para centros que inicien programas de pesquisa del cáncer colorrectal con test de sangre oculta.119
Test de ADN en materia fecal
Esta prueba se basa en la detección de alteraciones del ADN en células exfoliadas en la materia fecal en personas con lesiones pre-neoplásicas o cáncer colorrectal que permiten diferenciarlas del ADN normal de sujetos sanos.
La identificación de las mutaciones clave que se producen durante las primeras etapas del cáncer colorrectal (en K-Ras, APC y p53), así como los cambios epigenéticos ha guiado el desarrollo de pruebas de detección clínicamente relevantes.120
Los cambios genéticos moleculares del ADN que están asociados con el desarrollo de los adenomas y el cáncer colorrectal han sido bien caracterizados, y la heterogeneidad genética que muestra el CCR motiva la búsqueda de más de un marcador o incluso un panel de los mismos para mejorar la sensibilidad.121-123
Las mutaciones en el K-ras se encuentran en el 13%- 95% de los pacientes con CCR y es una de las mutaciones iniciales de la carcinogénesis colorrectal.124
Mutaciones del gen APC conducen a la poliposis adenomatosa familiar y es una de las mutaciones iniciales en la secuencia adenoma carcinoma y otro gen supresor el p53, se encuentra mutado o suprimido en 30%-60% de los CCR.125,126
La inestabilidad en microsatélites (MSI) es una condición que se produce por mutaciones en los genes reparadores de los errores de replicación del ADN (MMR) que generan alteraciones en las repeticiones en tándem de secuencias cortas de nucleótidos, los microsatélites y se presenta en el 15% de los CCR esporádicos.127
La hipermetilación de genes promotores es una mecanismo que puede promover la carcinogénesis y varios estudios preclínicos han identificado genes hipermetilados en muestras de heces de pacientes con CCR.127
Se han desarrollado técnicas avanzadas para detectar varias de estas mutaciones de genes en células desprendidas en las heces. Los primeros estudios que evaluaron el uso de test de ADN en materia fecal demostraron una sensibilidad poco satisfactoria para la detección de neoplasias colorrectales, especialmente adenomas avanzados.128-132
Imperiale y colaboradores130 efectuaron un estudio prospectivo en personas asintomáticas que recibieron colonoscopía, a las cuales se les efectuó sangre oculta en heces (Hemoccult II), y las pruebas de ADN en heces con un panel de marcadores de 21 mutaciones. Entre los 4.404 pacientes incluidos, el panel de ADN tuvo una sensibilidad para CCR de 51,6% (para todas las etapas del CCR) frente a 12,9% para Hemoccult II, mientras que los falsos positivos fueron del 5,6% y 4,8%, respectivamente.130
Un estudio de Ahlquist et al.133 comparó dos test de ADN en heces (uno con marcadores no utilizados en la prueba comercial) con las pruebas de guayaco de mayor sensibilidad y la colonoscopía.
La sensibilidad del test comercial fue menor en este estudio que en el estudio anterior y no fue mejor que Hemoccult SENSA (20% y 21%, respectivamente) para la detección de adenomas avanzados y CCR temprano. La sensibilidad para el panel de ADN en heces de segunda generación fue mejor (46% en comparación con el 24% de Hemoccult SENSA); sin embargo, también fue positiva en un 16% de los pacientes con una colonoscopía negativa.133
En los últimos años, importantes avances técnicos como la introducción de mejores buffers estabilizadores, la inclusión de más marcadores y métodos de análisis más sensibles han dado lugar a una mayor sensibilidad para la detección de cáncer y lesiones precancerosas.41
Recientemente, se publicaron los resultados del mayor ensayo prospectivo multicéntrico aleatorizado para evaluar la utilidad del ADN fecal en la detección de CCR.74 En este estudio, una nueva prueba de ADN en heces de panel múltiple (Cologuard®, Exact Sciences, Madison, WI, EE. UU.), que incluye mutaciones KRAS, NDRG4 aberrante y metilación BMP3, y β-actina, se compararon con SOMFi para la detección de CCR y lesiones precancerosas avanzadas. De los 9.989 participantes evaluados, 65 (0,7%) presentaron CCR y 757 (7,6%) lesiones precancerosas avanzadas (adenomas o serratos sésiles) en la colonoscopía.74
La sensibilidad para detectar el CCR fue del 92,3% con la prueba de ADN y el 73,8% con SOMFi (p = 0,002), mientras que para lesiones pre malignas avanzadas fueron 42,4% y 23,8%, respectivamente (p <0,001). La tasa de detección de pólipos serratos sésiles mayores a 10 mm fue del 42,4% con la prueba del ADN y el 5,1% con SOMFi (p <0,001). La especificidad de las pruebas de ADN y SOMFi fueron 89,8% y 96,4%, respectivamente (p <0,001).74,134
Los resultados de este estudio muestran que las pruebas de ADN en heces con panel múltiple detecta más lesiones neoplásicas que el test de SOMFi a costa de menor especificidad, aunque no se evaluaron los resultados comparados con la repetición del test de SOMFi en el tiempo. Un número mucho mayor de participantes (n = 689) fueron excluidos por dificultades con el test de ADN comparados con SOMFi (n = 34).74,135
Dos de las dificultades técnicas que pueden constituir una barrera en la aceptación del test de ADN para las personas participantes del tamizaje son el volumen de la muestra y su envío.136,137
No se han realizado estudios poblacionales que hayan evaluado la reducción de la mortalidad e incidencia de CCR de las pruebas de ADN en heces a pesar de lo cual la Administración de Alimentos y Medicamentos (FDA) de Estados Unidos recientemente aprobó el Cologuard® (Exact Sciences Corporation, Madison, WI, Estados Unidos), test de ADN de panel múltiple en heces como un alternativa en el cribado del CCR.40,138
Aunque la FDA recomendó un intervalo de tres años e incluyó la prueba en la cobertura del Medicare, no hay datos directos de estudios idóneos que apoyen este intervalo, por lo cual, se esperan ensayos para poder resolver esta importante cuestión y evaluaciones comparativas con otras estrategias.137,139,140
Una cuestión importante que debe abordarse antes de la aplicación generalizada de las pruebas de ADN en heces es lo relativo a los costos.40 La costo-efectividad parece ser una importante desventaja en las pruebas de ADN fecales, ya que tanto en los estudios iniciales como en los más recientes, basados principalmente en un modelo de Markov, se ha llegado a la conclusión de que el ADN fecal es rentable solamente cuando se compara con ningún tamizaje, pero es esencialmente inferior con la mayoría de las otras opciones de cribado disponibles, incluyendo sangre oculta en heces y la colonoscopía.141,142
Un análisis de costo-efectividad realizado en los Estados Unidos encontró que la prueba de ADN fecal puede ser rentable a un precio significativamente más bajo o con los costos actuales si genera un incremento de la participación de la población de más del 50% en comparación con las otras opciones de detección.143
Algunos estudios señalan que puede ser necesario reducir el número de marcadores de ADN para hacer que su uso clínico sea más razonable.137,139,144
Hacen falta evaluaciones sistemáticas prospectivas de las pruebas fecales de ADN en una población de cribado bien definida, a gran escala, con la recolección de muestras estándar, con un procesamiento y almacenamiento determinados y con seguimiento endoscópico además de analizar la repetición de los test.145
Otro parámetro que amerita evaluación prospectiva es la significación clínica de los resultados del test de ADN positivo en pacientes con colonoscopía negativa.139
Los daños de las pruebas basadas en las heces se producen como resultado principalmente de los efectos adversos asociados con la colonoscopía de seguimiento. Como la especificidad del test de ADN en materia fecal es inferior a la de SOMFi solo se producen un mayor número de resultados falsos positivos que implican un mayor número de colonoscopías de seguimiento. Tampoco existen datos empíricos sobre el apropiado seguimiento para un resultado de la prueba combinada FIT-ADN anormal seguida de una colonoscopía negativa; existe la posibilidad de una vigilancia excesivamente intensiva debido a las preocupación del médico y el paciente acerca de las implicancia del componente genético de la prueba.50,74
EXÁMENES ESTRUCTURALES DE PESQUISA DEL CÁNCER COLRRECTAL
Colon por enema con doble contraste de bario (CEDC)
Esta prueba radiológica no invasiva proporciona una evaluación completa del intestino grueso con una sensibilidad y especificidad para pólipos de cualquier tamaño de 38% y 86%, respectivamente.146
Como parte del National Polyp Study, se compararon el examen colonoscópico y el colon por enema de bario en exámenes de vigilancia con datos apareados de personas que se habían sometido a una polipectomía colonoscópica previa.146 La proporción de exámenes en los que se detectaron pólipos adenomatosos por medio del CEDC se relacionó con el tamaño del adenoma (P = 0,009); la tasa fue de 32% para lesiones de hasta 5 mm, 53% para los adenomas entre 6 a 10 mm y 48% en los adenomas de más de 10 mm.146 Un estudio comparativo de enema de bario con colonografía por TC y colonoscopía mostró que CEDC tiene la más baja sensibilidad (41%) para lesiones de ≥ 6 mm y una sensibilidad de 41% y especificidad del 90% para las lesiones ≥ 10 mm.147
Los resultados son consistentes con los de un meta-análisis comparando el rendimiento del CEDC con la colonografía por TC, mostrando a la CTC más sensible y más específica que el enema de bario tanto para pólipos de ≥ 10 mm como para pólipos de 6-9 mm en poblaciones de riesgo medio y alto.148
No hay estudios que evalúen la eficacia del CEDC en la disminución de la mortalidad por CCR. El uso del CEDC ha ido disminuyendo con la utilización cada vez mayor de procedimientos endoscópicos y la aparición de la colonografía por tomografía.1
El colon por enema con doble contraste puede ser una alternativa de interés solo en aquellos lugares donde los recursos sean muy limitados para realizar colonoscopías y el estudio se realice con una técnica de calidad.19
Una indicación posible del colon por enema doble contraste es el estudio complementario del colon proximal, en caso de una colonoscopía incompleta, aunque, si está disponible, debe utilizase la colonografía por tomografía computarizada, cuyo rendimiento diagnóstico es claramente superior.
Sigmoideoscopia flexible (SF)
El sigmoideoscopio flexible permite un examen completo del colon distal con una tolerancia mejor para el paciente que su antecesor, el rectosigmoideoscopio rígido.
La preparación del paciente para la sigmoideoscopía es más simple que la de la colonoscopía o colonografía por TC. El procedimiento se puede realizar sin sedación y además puede ser efectuado por médicos de atención primaria e incluso asistentes médicos que lleguen a dominar la técnica con un entrenamiento adecuado.149
El rectosigmoideoscopio rígido puede descubrir el 25% de los pólipos colorrectales, mientras el sigmoideoscopio flexible (SF) de 60 cm permite detectar hasta el 65% de los mismos.
Un estudio de Liberman y Weiss150 demostró que el 66% de las lesiones avanzadas de colon en los hombres podrían ser detectadas con la sigmoideoscopía.
Parecería que las mujeres son más propensas a presentar lesiones colónicas proximales (cáncer o pólipos) como muestra un estudio donde solo el 35 % de las lesiones avanzadas detectadas en mujeres se identificaron con la sigmoideoscopía flexible sola.151
La aparición de un adenoma en la SF puede justificar la realización de una colonoscopía para detectar probables lesiones en el colon proximal, y esta probabilidad ha sido relacionada con las características histológicas de la lesión distal (adenoma túbulo-velloso o con displasia de alto grado) y con el tamaño del adenoma, aunque esta circunstancia es una indicación más controvertida.152-154
La prevalencia de neoplasia proximal avanzada aumenta en pacientes con un adenoma velloso o túbulovelloso distal, en mayores 65 años, en personas con antecedentes familiares positivos de CCR y con adenomas distales múltiples.155 Muchas de las lesiones proximales son polipoideas, planas o planas deprimidas, que parecen ser más prevalentes de lo que se postuló con anterioridad.156
En un estudio en 3.121 veteranos en Estados Unidos (edad media: 63 años) a los cuales se les efectuó una colonoscopía, una neoplasia avanzada proximal (definida como un adenoma mayor a 10 mm, un adenoma velloso, un adenoma con displasia de alto grado) se identificó en el 10,5% de los individuos.157 Entre los pacientes sin adenomas distales al ángulo esplénico, el 2,7% presentaba una neoplasia avanzada proximal. Los pacientes con adenomas grandes (≥10.0 mm) o adenomas pequeños (<10,0 mm) en el colon distal eran más propensos a tener una neoplasia avanzada proximal que aquellos pacientes sin adenomas distales (OR, 3,4; IC del 90%, 1.8-6.5 y OR, 2,6; IC del 90%, 1.7-4.1, respectivamente). La mitad de los pacientes que tienen neoplasia proximal avanzada, sin embargo, no tenía adenomas distales.157
En un estudio de 1.994 adultos (de 50 años o mayores) que se sometieron a una colonoscopía como parte de un programa patrocinado por un empleador, 5.6% tenían neoplasias avanzadas.154 Cuarenta y seis por ciento de las personas con neoplasias proximales avanzadas no tenían pólipos distales (hiperplásicos o adenomas).
Si el cribado mediante colonoscopía se realiza solo en los pacientes con pólipos distales, no serán detectados alrededor de la mitad de los casos de neoplasia proximal avanzada.154
La historia natural de la neoplasia avanzada no se conoce, por lo que su importancia como resultado en los estudios de pesquisa no es clara. Esta circunstancia ha dado lugar a una gran variabilidad en la indicación de una colonoscopía complementaria basada en los hallazgos en la SF. En un ensayo en Reino Unido, 158, 159 los criterios para indicar una colonoscopía complementaria incluyeron: un adenoma distal ≥10 mm, un adenoma con componente velloso o displasia de alto grado, tres o más adenomas distales o CCR. En el ensayo SCORE,160 el tamaño limitante para un adenoma distal fue de 5 mm y en el ensayo NORCCAP161,162 cualquier adenoma era indicativo para su remisión a una colonoscopía complementaria En un análisis de simulación de rendimiento de la SF de acuerdo a los criterios de selección empleados por los diferentes ensayos para referir a una colonoscopía complementaria de acuerdo a los hallazgos distales, el número de individuos que cumplían los criterios de NORCCAP y SCORE fueron el triple y el doble, respectivamente, de los que cumplían los criterios del ensayo de Reino Unido.163 Además, mientras que los criterios de NORCAP alcanzan la más alta tasa de detección general de neoplasia avanzada asociada con la más alta sensibilidad para detectar neoplasias avanzadas proximales, el conjunto de requisitos expuestos en el ensayo del Reino Unido logró la mayor especificidad y menor número de individuos referidos para colonoscopía.163
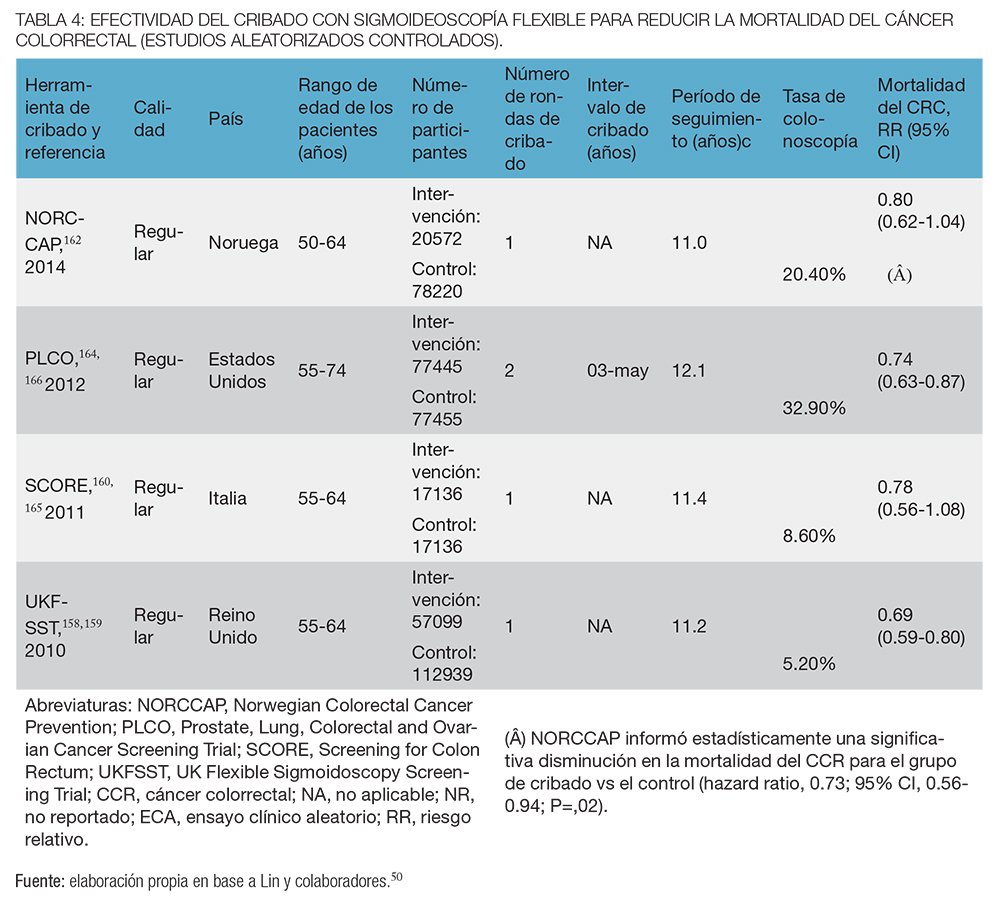
La sigmoideoscopía flexible ha demostrado reducir la incidencia y mortalidad por CCR en los cuatro ECA de gran tamaño (n = 458 002) que evaluaron la efectividad de 1 o 2 rondas de SF en adultos con riesgo promedio de entre 50 a 74 años50,158-160,162,164,166 (tabla 4).
La adhesión a la SF en estos ensayos varió de 58% a 84%, y las tasas de colonoscopía diagnóstica variaron de 5% a 33% debido a las diferencias en los criterios de derivación.50 En base al análisis por intención de tratar la SF se asoció con una menor mortalidad específica por CCR en comparación con ningún cribado con 11 a 12 años de seguimiento (tasa de incidencia, 0,73; IC del 95%, 0,66-0,82). Sin embargo, el beneficio de la reducción de la mortalidad se limitó al CCR distal (tasa de incidencia, 0,63; IC del 95%, 0,49-0,84).50 En un ensayo, realizado en Noruega, la mitad de los participantes asignados al azar a SF también recibió una única prueba de SOMFi; el grupo SF-más-SOMFi tuvo menor mortalidad por CCR que el grupo con SF sola (RR: 0,62; IC del 95%, 0,42-0,90).162
En el ensayo de Schoen y colaboradores164 la pesquisa con sigmoideoscopía flexible se asoció con una reducción del 21% en la incidencia de CCR (RR, 0,79; CI 95%, 0,72-0,85), tanto en el colon distal (RR, 0,71; 95% CI, 0,64-0,80) como en el colon proximal (RR, 0,86; IC del 95%, 0,76-0,97) y una reducción del 26% en la mortalidad específica por CCR (RR, 0,74; IC del 95%, 0,63-0,87), en individuos con tumores localizados en el colon distal.
En el ensayo SCORE160 el rendimiento de una sigmoideoscopía sola en torno a los 60 años se asoció con una reducción del 18% en la incidencia de CCR (RR, 0,82; 95% CI, 0,69-0,96), mientras que la tasa de mortalidad no se redujo significativamente (RR, 0,78; IC del 95%, 0.56-1,08) en comparación con el grupo control en el análisis por intención de tratar. En el análisis por protocolo, tanto la incidencia de CCR (RR, 0,69; IC del 95% 0,56-0,86) como la mortalidad (RR, 0,62 IC del 95% 0,40-0,96) se redujeron significativamente entre los participantes del tamizaje.160
En el estudio realizado en Reino Unido158,159 la incidencia de CCR se redujo en un 23% (RR, 0,77; IC del 95%, 0,70-0,84) y la mortalidad en un 31% (RR, 0,69; IC del 95%, 0.59-0,82) con una única sigmoideoscopía flexible. En el análisis por protocolo, la incidencia de CCR en las personas participantes se redujo en un 33% (RR, 0,67; 95% CI, 0,60- 0,76) y la mortalidad en un 43% (RR, 0,57; IC del 95%, 0,45-0,72).
Por último, en el ensayo NORCCAP,162 la incidencia de CCR se redujo en un 20% RR, 0,80; IC del 95%, 0,70-0,92), y la mortalidad por CCR en 27% (RR, 0,73; IC del 95%, 0,56-0,94).
Los resultados de los estudios precedentes con la SF se resumieron en dos revisiones sistemáticas.167,168
Con la SF como pesquisa, hubo una reducción relativa de 28% en la mortalidad por CCR (RR, 0,72; IC 95%, 0,65-0,80), una reducción relativa en la incidencia de CCR de 18% (RR, 0,82; IC 95%, 0,73-0,91), y una reducción relativa de 33% en la incidencia de CCR del lado izquierdo (RR, 0,67; IC 95%, 0,59-0,76). No hubo efecto en cuanto a la mortalidad por todas las causas.
La SF, aunque demostró reducción de la incidencia y mortalidad específica por CCR, ha sido criticada por su menor capacidad para diagnosticar lesiones avanzadas proximales en comparación con la colonoscopía. En el análisis de Castells y colaboradores,163 la estrategia de simulación basada en sigmoideoscopía detectó un 35 a 43% menos de individuos con neoplasias avanzadas que la colonoscopía, con una sensibilidad para la detección de estas lesiones proximales de 22-37%, cifra similar a la reportada por estudios anteriores.154,157,160,162
A pesar de los notables resultados de los ensayos prospectivos con la SF en Estados Unidos y Europa en la reducción de la incidencia y mortalidad del CCR, esta estrategia de tamizaje es muy poco utilizada en Estados Unidos, y esto tendría al menos tres causas principales: en primer lugar, la insuficiente detección de lesiones avanzadas proximales en pacientes tamizados mediante este método; en segundo término, la cobertura de los sistemas de salud de la colonoscopía con la recomendación del Colegio Americano de Gastroenterólogos como el estudio preferido; y finalmente, la presunción de la mayor prevalencia de lesiones polipoideas planas y de adenomas serratos sésiles de frecuente localización en el colon proximal y que presentan una progresión al cáncer más acelerada.169
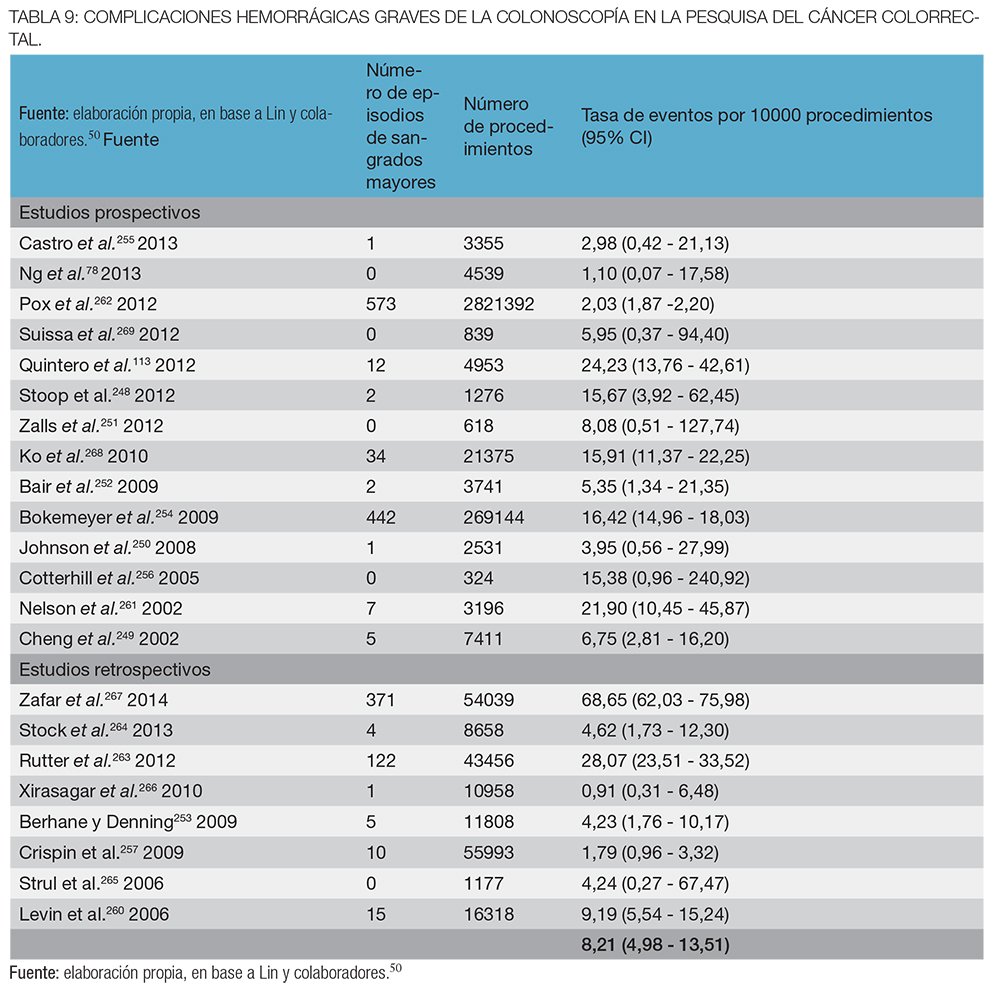
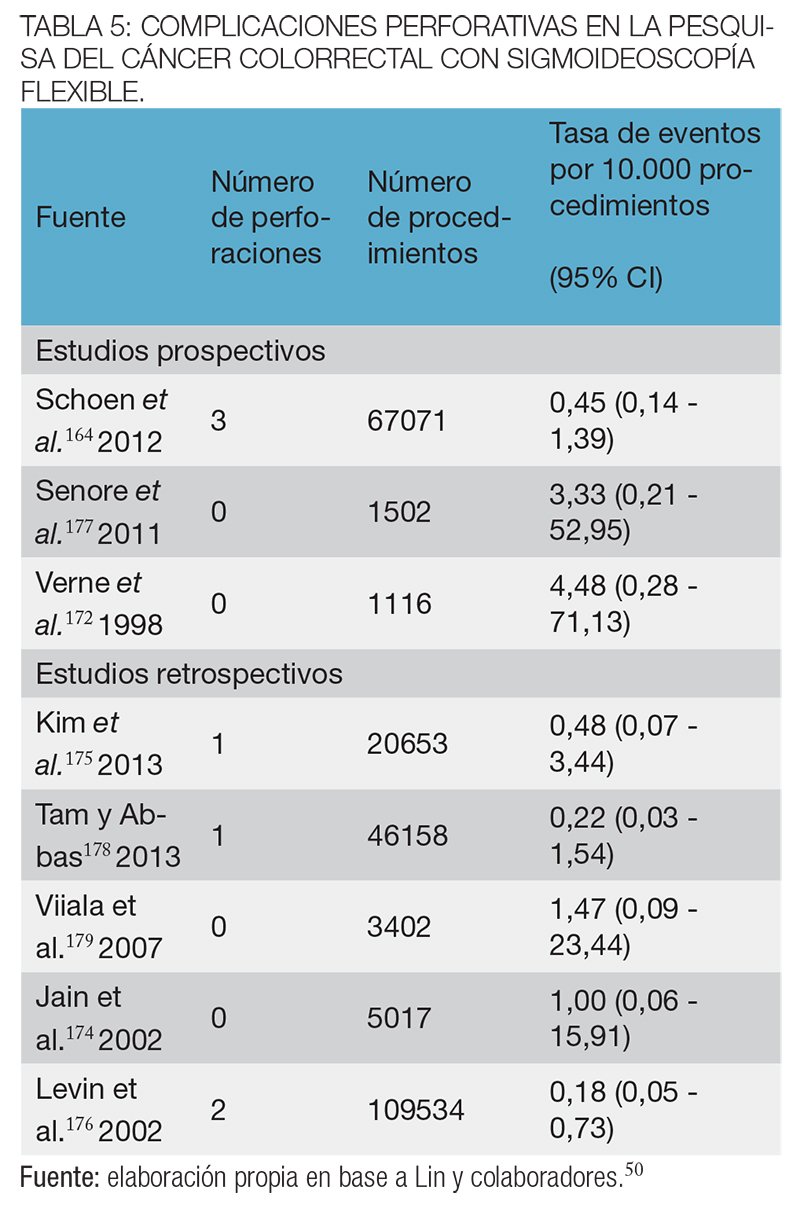
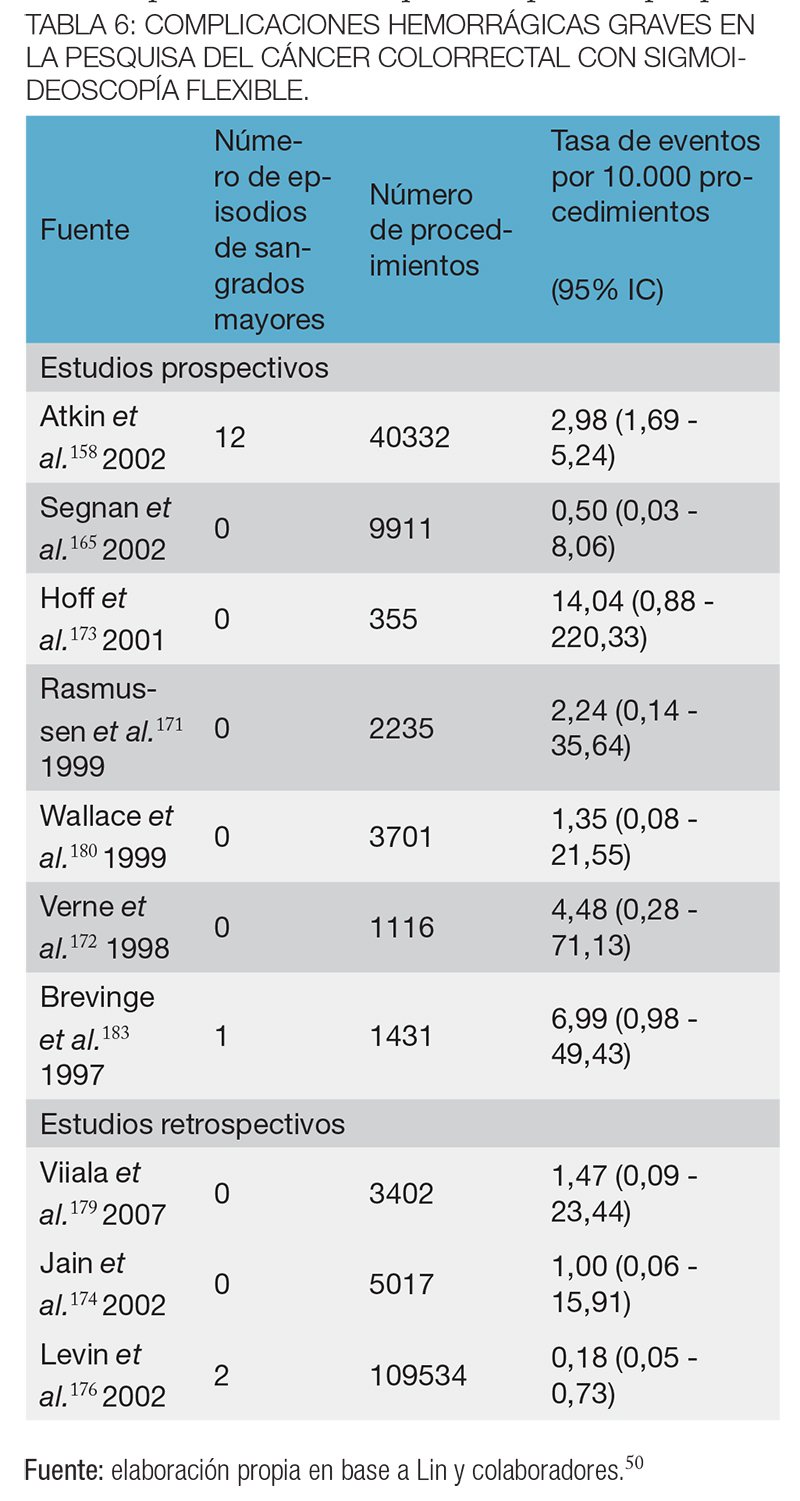
Los dieciocho estudios que informaron las complicaciones con la SF fueron realizados en población de riesgo habitual.50 Tomando los resultados de 16 estudios158,164,165,170-182 (n = 329.698), las perforaciones con la SF en la pesquisa del CCR en población de riesgo promedio fueron relativamente poco comunes: la estimación agrupada fue de 1 en 10.000 procedimientos (95 % IC, 0,4-1,4 en 10 000).50
En 10 estudios158,165,171-174,176,179,180,183 (n = 137.987) se observa que los episodios de sangrado grave por SF también fueron poco frecuentes, con una estimación combinada de 2 en 10.000 procedimientos (95% IC, 0,7 a 4 de cada 10 000)50 (tablas 5 y 6). La sigmoideoscopía flexible, sin embargo, puede requerir una colonoscopía diagnóstica o terapéutica complementaria. En base a 5 estudios de pesquisa con SF, la estimación combinada de perforaciones colónicas fue de 14/ 10.000 procedimientos (IC del 95%, 9-26 en 10.000) y en base a 4 ensayos se estimaron 34 hemorragias graves por 10.000 (IC del 95%, 5-63 en 10 000).50
En los programas bien organizados, de alta calidad de pesquisa con sigmoideoscopía flexible, el riesgo de complicaciones graves debería ser de alrededor de 0-0,03% para sigmoideoscopías y el 0,3-0,5% para las colonoscopías complementarias.184
Combinación de prueba de sangre oculta en la materia fecal y sigmoideoscopía flexible
La combinación de la prueba de sangre oculta en la materia fecal y sigmoideoscopía podría aumentar la detección de lesiones en el colon derecho, en comparación con la sigmoideoscopia sola. La sigmoideoscopia detecta lesiones en el colon izquierdo directamente y solo descubre lesiones en el colon derecho de modo indirecto, cuando un hallazgo distal, definido de varias maneras, como ya se expresó anteriormente, se utiliza para indicar el examen colonoscópico complementario.
Cuatro estudios informaron sobre el rendimiento diagnóstico de una combinación de sigmoideoscopía una sola vez y una SOMF solo una vez, en comparación con SOMF o sigmoideoscopía solos.150,170,182,185
El rendimiento de la combinación de sigmoideoscopía más SOMF una única vez fue significativamente mayor que el de una SOMF una única vez, pero no mayor que el de una sigmoideoscopía una única vez.
En un estudio de 21.794 personas asintomáticas (72% eran hombres), que se sometieron tanto a una colonoscopía como a una prueba inmunoquímica fecal, se comparó la detección de cánceres del lado derecho generados por resultados de prueba diferentes.186 La SOMFi sola tuvo una sensibilidad de 58,3% y una especificidad de 94,5% para el diagnóstico de cáncer proximal. La SOMFi más la presencia de neoplasia avanzada en el colon rectosigmoideo tuvo una sensibilidad de 62,5% y una especificidad de 93%.186 De este modo, el agregado de sigmoideoscopía a la SOMFi en este estudio no mejoró de forma sustancial la detección de los cánceres del colon derecho, en comparación con la prueba inmunoquímica sola.
En el estudio NORCCAP,182 evaluando un examen de detección realizado una sola vez, se asignó al azar a 20.780 hombres y mujeres de 50 a 64 años a una SF sola o una combinación de SF y SOMF con FlexSure FOBT. Una SF con resultado positivo se definió como la presencia de cualquier neoplasia o pólipo de por lo menos 10 mm. Una SF o una SOMF con resultados positivos se complementó con una colonoscopía. La participación en este estudio fue del 65%. Se detectaron 41 casos de CCR (0,3% de los individuos que se sometieron a exámenes de detección), adenomas en el 17% y adenomas de alto riesgo en el 4,2%. No hubo ninguna diferencia en el resultado del diagnóstico de CCR o adenoma de alto riesgo entre el grupo de SF sola y el grupo que se sometió a SF y SOMF.182
Sin embargo, en un estudio reciente, la sigmoideoscopía flexible combinada con SOMFi se observó una reducción mayor de la tasa de mortalidad específica por cáncer colorrectal que con la sigmoideoscopía sola.162
Estudios de simulación llevados a cabo por el Cancer Intervention and Surveillance Modeling Network (CISNET) en apoyo a las recomendaciones de tamizaje de la US Preventive Services Task Force (USPSTF) también predicen consistentemente que la prueba combinada de SF más SOMFi produce más años de vida ganados y mayor reducción de la mortalidad por CCR en comparación con la sigmoideoscopía flexible sola.187
Aunque varios ECA han demostrado que la sigmoideoscopía flexible sola para la pesquisa del CCR reduce las muertes por cáncer colorrectal y que resulta mejor que la falta de pesquisa, la sigmoideoscopía flexible sola es inferior a un enfoque combinado con SOMFi.50
Estos análisis llevaron a la USPSTF a incluir entre los exámenes para la pesquisa del CCR a la SF cada 10 años combinada con un test de SOMFi anual.188
Colonoscopía
La colonoscopía es uno de los métodos más atractivos para la prevención y detección temprana del cáncer colorrectal, ya que permite la visualización directa de toda la mucosa del colon para la detección de adenomas o CCR en etapas tempranas con la posibilidad de tomar biopsias y resecar lesiones durante el mismo procedimiento, y es además el estudio complementario ineludible luego de hallazgos positivos en cualquiera de los otros exámenes de tamizaje.1,4,41
El Colegio Americano de Gastroenterología considera a la colonoscopía el “test preferido” de detección cuando esté disponible, aunque otros grupos de expertos la incluyen en una lista de opciones para el tamizaje del cáncer colorrectal.189
La colonoscopía juega un rol principal tanto en la pesquisa del CCR en población de riesgo promedio como también en personas con riesgo elevado por antecedentes familiares, historia de adenomas o CCR previos.2, 190
La colonoscopía no es un procedimiento simple. Requiere sedación del paciente para asegurar el confort durante el examen y permitir su total evaluación, y precisa una preparación adecuada del colon para garantizar la visualización de toda la mucosa. Además, las personas deben destinar horas previas al examen para la preparación y deben retirarse luego del estudio acompañados por otra persona, sin poder regresar directamente a sus actividades habituales. La validez del método depende de su calidad, que está relacionada con el instrumental endoscópico utilizado y esencialmente con la experiencia y formación del operador. Es además un estudio costoso y no exento de complicaciones.
La evidencia de la eficacia de la colonoscopía en la prevención y detección temprana del CCR se fundamenta, aun en la actualidad, sobre la base de datos indirectos y estudios observacionales a la espera de los resultados de los estudios aleatorizados en marcha. La mayor evidencia indirecta surge de la sensibilidad del método para detectar adenomas avanzados y cáncer colorrectal en etapa temprana.
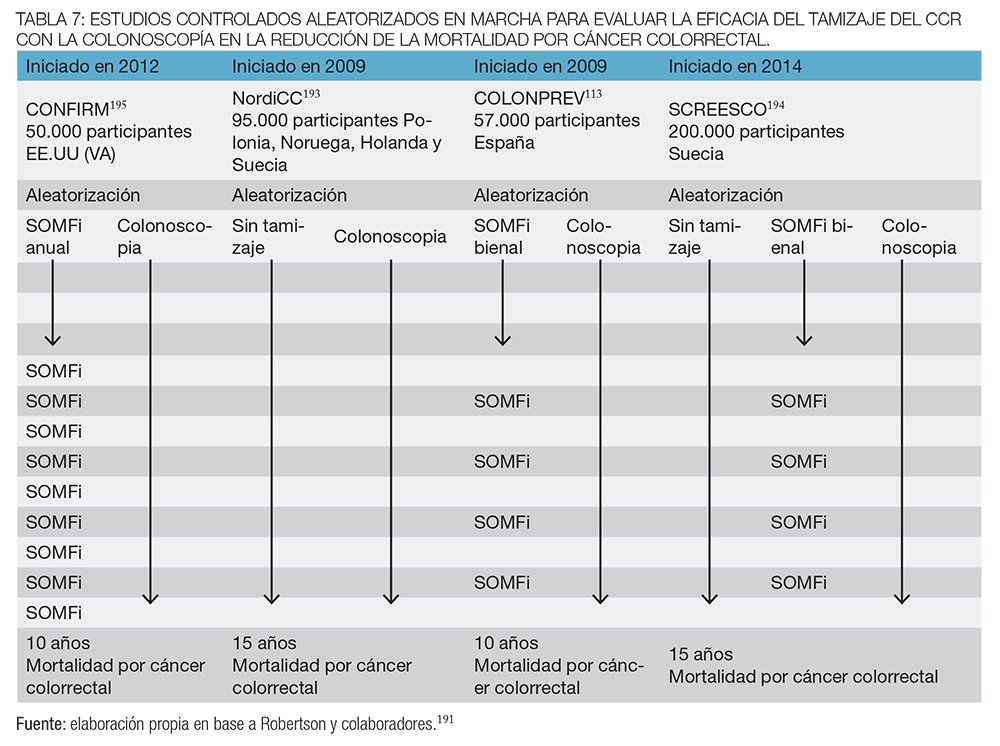
Cuatro grandes ensayos controlados aleatorizados que evalúan la eficacia de la colonoscopía en la pesquisa del CCR para la disminución de la incidencia y a mortalidad están en curso y sus resultados definitivos estarán disponibles dentro de algunos años191,192 (tabla 7).
El ensayo multinacional europeo NordICC193 (Polonia, Noruega, Holanda y Suecia) iniciado en 2009 evaluará la eficacia de la colonoscopía en comparación con ningún cribado en la mortalidad por CCR.192
El estudio SCREESCO,194 en Suecia, iniciado en 2014, proporcionará datos sobre la efectividad del cribado con colonoscopía, también en comparación con ningún cribado, pero agrega un tercer brazo de randomización comparando también con SOMFi bienal.
Los otros dos ensayos, CONFIRM (EE. UU.) ,195 iniciado en 2012, y COLONPREV (España),113 iniciado en 2009, evaluarán la eficacia comparativa de la colonoscopía con la prueba inmunoquímica fecal anual (CONFIRM) o bienal (COLONPREV).
Todos los ensayos se encuentran actualmente en marcha. Los ensayos COLONPREV y NordICC han concluido el reclutamiento de participantes y faltan varios años para obtener los resultados, mientras que el SCREESCO sueco y el CONFIRM de EE. UU. están actualmente reclutando los participantes y necesitarán más de una década para que los resultados estén disponibles.191
Hasta la actualidad, estudios de casos y controles de base poblacional han sugerido que la colonoscopía disminuye la incidencia y la mortalidad por CCR mientras hay evidencia que una colonoscopía negativa previa reduce notablemente el riesgo de CCR.196-202
En algunos estudios se puso en duda la eficacia de la colonoscopía en la reducción de la mortalidad por CCR del lado derecho. En un estudio de casos y controles en Canadá,197 la colonoscopía se asoció con una disminución de muertes por cáncer colorrectal en el lado izquierdo del colon (RR 0.33, IC 95%: 0,28-0,39), pero no en el lado derecho (RR 0,99, IC 95%: 0,86-1,14). Sin embargo, en el estudio no se distinguen las colonoscopías de pesquisa con las diagnósticas y el rendimiento de las colonoscopías realizadas por diferentes médicos que no eran gastroenterólogos o cirujanos.197,203
Los hallazgos fueron similares a un estudio de cohorte en Manitoba,204 en exámenes de pesquisa, donde la mortalidad por CCR para las personas que habían realizado una colonoscopía inicial se comparó con la mortalidad en la población general y se encontró una reducción del 47% en la mortalidad por CCR en el colon izquierdo (RR 0,53, IC 95%: 0,42-9,67), pero no hubo reducción en la mortalidad por CCR proximal (RR 0,94, IC 95%: 0,77- 1,17).
No obstante, un estudio de casos y controles (1.688 casos con 1.932 controles) mostró que la colonoscopía era eficaz para disminuir la incidencia del CCR tanto del lado izquierdo como del lado derecho, a pesar de que la reducción del riesgo fue mayor para el cáncer del lado izquierdo (84% de reducción (RR 0,16, IC 95%: 0,12-0,20) y 56% (RR 0,44, IC 95%: 0,35-0,55) para el cáncer del lado derecho. La reducción global del riesgo fue del 77%.196
Recientemente, un meta-análisis de seis estudios observacionales que evalúan la eficacia de la colonoscopía en personas con riesgo promedio llegó a la conclusión de que esta estrategia se asoció con una reducción en la incidencia del 69% (RR, 0,31; 95% IC 0,12-0,77) y de la mortalidad del 68% (RR, 0,32; 95% IC 0.23-0.43).205
Además, estudios de cohortes de pacientes con adenomas sugieren que la polipectomía endoscópica podría prevenir hasta el 80% de los cánceres colorrectales.206-208
La protección de la colonoscopía no es perfecta, ya que aproximadamente en un 6% de los pacientes se diagnostican cánceres colorrectales dentro de los 5 años posteriores a la realización de una colonoscopía por pesquisa negativa.209 Estos denominados cánceres de intervalo se definen como aquellos CCR que se producen luego de la colonoscopía de pesquisa pero antes del próximo examen de control programado y representan un importante indicador de la calidad de la colonoscopía y una información importante sobre las limitaciones en la eficacia del método contrarrestando el efecto de la polipectomía en la reducción de la incidencia del CCR.210,211
Se cree que, mayormente, los cánceres de intervalo se deben a lesiones inadvertidas en la colonoscopía basal o pólipos que fueron incompletamente resecados.209,212,213 Los cánceres de intervalo son más frecuentemente observados en el colon proximal, asociados a la presencia de múltiples adenomas en el estudio de base y a historia familiar de CCR.209
Además presentan más frecuentemente características moleculares de metilación e inestabilidad de microsatélites, lo que indica alteraciones en la función de los genes reparadores del ADN implicadas en la vía serrata de la carcinogénesis colorrectal.202,214-217
Los adenomas serratos sésiles son difíciles de ver en la colonoscopía. Son típicamente planos, pálidos, con bordes poco definidos y revestidos por una capa de moco (a veces único indicio de sospecha) y ocurren con mayor frecuencia en el colon derecho.
Las características moleculares de los cánceres de intervalo con una carcinogénesis mucho más rápida, su mayor frecuencia en colon derecho y la dificultad para reconocer y resecar adenomas serratos, también más frecuentes en colon derecho, explicarían en parte las fallas en la protección de la colonoscopía contra el cáncer colorrectal del lado derecho.88
La preparación intestinal, la tasa de intubación cecal, la tasa de complicaciones y la experiencia del endoscopista son otros factores que influyen significativamente en la calidad de la colonoscopía y por ende en su eficacia.218 Se reconoce que la colonoscopía es operador dependiente y existe una gran variación en la detección de adenomas en general y de adenomas serratos en particular entre los diferentes endoscopistas. Estudios recientes establecen una relación directa entre el endoscopista y el nivel de protección de la colonoscopía fuertemente asociada a la tasa de detección de adenomas y el porcentaje de intubación cecal.88,219-224
Una revisión sistemática de estudios de colonoscopías realizadas en tándem (doble colonoscopía, una detrás de otra por dos endoscopistas diferentes) sobre 465 pacientes, encontró una tasa de fallos del 2% para los adenomas ≥10 mm, 13% para los adenomas 5 a 10 mm, y 25% para los adenomas <5 mm.225 La tasa general de falla de detección de pólipos global (de cualquier tamaño) fue del 22%.
En los primeros 10 años del programa de detección de CCR de Alemania, la detección de los adenomas aumentó de 13,3 a 22,3% en los hombres, y de 8,4 a 14,9% en las mujeres. Sin embargo, la gran mayoría de los adenomas eran pequeños (menos de 0,5 cm), que tienen una importancia clínica incierta. La detección de los adenomas avanzados y los CCR aumentó aunque de modo menos considerable.226
La tasa de detección de adenomas (ADR), cuya definición es la proporción de personas a las cuales se le detectó al menos un adenoma en la colonoscopía, se ha convertido en el indicador más importante de la calidad del método, ya que está directamente relacionada con el cáncer de intervalo y puede ser un reflejo de otros indicadores de calidad: la preparación, el examen completo del colon, el tiempo de retirada y la dedicación y experiencia del endoscopista.218,223,224,227
Un estudio encontró asociación significativa del riesgo de desarrollar un cáncer de intervalo con la tasa de detección de adenomas del endoscopista.223
Una ADR más elevada está relacionada a menos cánceres de intervalo, por lo tanto las guías de garantías de calidad actuales sugieren que la tasa de detección de adenomas debería ser al menos de 25% en hombres y 15% en mujeres.228,229
En un estudio llevado a cabo para evaluar los probables factores relacionados con la ADR se observaron como factores independientes al tiempo medio de retirada de más de 8 minutos y la preparación intestinal dividida.218,227,230
Algunos pólipos y cánceres pueden ser difíciles de detectar debido a su ubicación, por lo que pueden pasar inadvertidos en las colonoscopías. Se observa que las lesiones planas o deprimidas son más frecuentes de lo que se pensaba en Occidente y en un porcentaje mayor, serían neoplasias avanzadas.226,229
La tasa de detección general de adenomas y cáncer puede verse afectada por el grado de detalle con el que los endoscopistas buscan estas lesiones planas. Si bien al fenómeno de las neoplasias planas se le ha dado importancia por años en Japón, solo se ha descripto recientemente en Estados Unidos. En un estudio en el que los endoscopistas usaron endoscopios de alta resolución y luz blanca, se encontró que las lesiones planas o no polipoideas representaron solo 11% de todas las lesiones superficiales del colon, pero fueron casi 9,8 veces más propensas a ser cancerosas (neoplasia in situ o cáncer invasivo) en comparación con las lesiones polipoides.156
La frecuencia de lesiones planas o deprimidas debe conducir a los endoscopistas a mejorar la calidad de las colonoscopías, ya que las lesiones planas inadvertidas pueden ser una de las causas de los cánceres de intervalo.231,232
La dificultad diagnóstica de estas lesiones se pone en evidencia en un estudio prospectivo de Heresbach et al.,233 donde el 29% de las lesiones sésiles y el 32% de las lesiones planas no se detectaron en comparación al 5% de lesiones pediculadas.
Los avances tecnológicos que se han producido en los últimos años para mejorar la definición de las imágenes endoscópicas han buscado mejorar la capacidad de detectar las lesiones precursoras y reducir así las tasas de adenomas perdidos y de cáncer de intervalo.234,235
La colonoscopía con luz blanca de alta definición no demostró, en algunos estudios, ser superior sobre los métodos convencionales y la cromoendoscopía muestra algunas ventajas, especialmente en grupos de riesgo mayor, como es el caso de pacientes con enfermedad inflamatoria intestinal.228,229,236-239
Un avance tecnológico promisorio es la incorporación al colonoscopio de un sistema de retrovisión llamado “tercer ojo”, que es un dispositivo que permite tener una visión complementaria retrógrada del colon.228,229,240,241
Múltiples estudios han demostrado que con este avance tecnológico mejoraron las tasa de detección de adenomas, aunque en uno de ellos se observó que el tiempo de retirada empleado era mayor que en los controles, lo que puede considerarse un factor independiente asociado a una mayor tasa de detección de adenomas.228,242
Sin embargo, el beneficio de las mejores tecnologías endoscópicas para una mayor detección de adenomas es limitado en comparación con los beneficios potenciales de reducir las variaciones de calidad entre los endoscopistas.243
Abordar el problema de un funcionamiento inadecuado de la colonoscopía es un desafío clave para los programas de cribado de CCR. Hay endoscopistas que son capaces de proporcionar una eficaz protección contra el CCR y así la mayoría de los cánceres de intervalo serían prevenibles.244 Además, una auditoría de calidad con un monitoreo frecuente (con revisión externa de vídeo grabaciones) se asocia con mejoras en la performance de la colonoscopía.244-246
El reconocimiento de la variación en la eficacia de la colonoscopía dependiente del operador ha llevado a impulsar recomendaciones internacionales para mejorar la calidad y los endoscopistas buscan participar en iniciativas tendientes a optimizar el método midiendo y reportando indicadores de calidad entre los cuales la tasa de detección de adenomas y el porcentaje de intubación cecal han sido señalados como los indicadores predictores más eficaces de los cánceres de intervalo.237,247
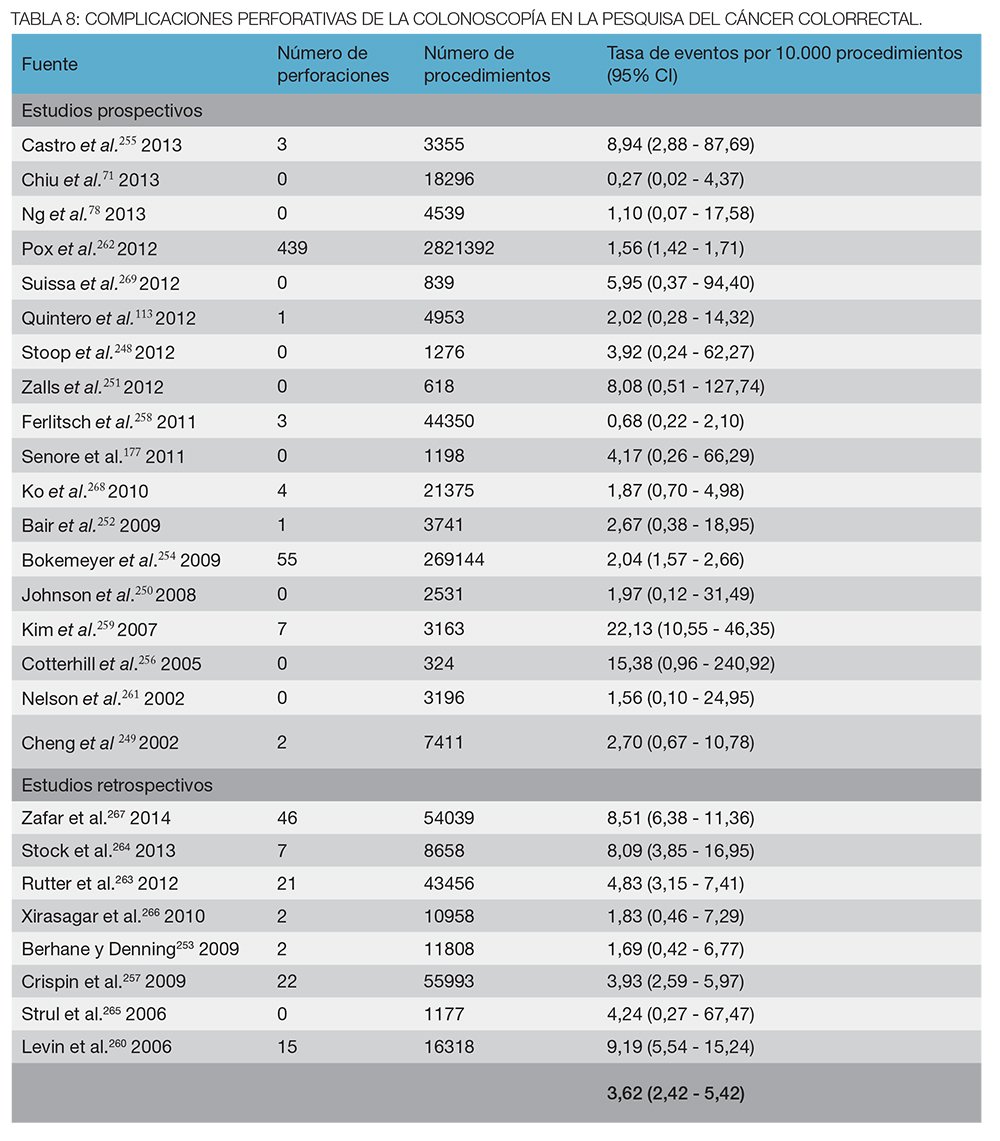
Las tasas de complicaciones mayores de una colonoscopía de cribado se publicaron en numerosos estudios y aproximadamente la mitad de ellos (29/55) fueron ensayos poblacionales en personas asintomáticas.50
Reuniendo 26 estudios71,78,113,177,248-269 de pesquisa en población general asintomática (n = 3.414.108), se estimó que el riesgo de perforaciones de la colonoscopía fue de 4 en 10.000 procedimientos (IC del 95%, 2-5 en 10000)50 (tabla 8).
Sobre la base de 22 de esos estudios (n = 3.347.101),78,113,248-257,260-269 se estimó que el riesgo de hemorragia mayor de la colonoscopía fue de 8 en 10.000 procedimientos (IC 95%, 5-14 de 10.000) (tabla 9).
Solo ocho estudios (n = 204.614) informaron de forma explícita si la perforación o la hemorragia grave se relacionaron con una polipectomía o biopsia.248,250,252,258,270-273 Sobre la base de este subconjunto limitado de estudios que aportan la información adecuada, el 36% (15/42) de las perforaciones y el 96% (49/51) de los eventos hemorrágicos graves se debieron a una polipectomía.50
Los datos de los ensayos con sigmoideoscopía flexible como tamizaje del CCR muestran aproximadamente 14 (IC del 95%, 9-26) perforaciones de colon y 24 (IC del 95%, 5-63) episodios de sangrado por cada 10.000 personas sometidas a colonoscopía.50
Los daños resultantes de una prueba de tamizaje deben ser considerados en el contexto de la frecuencia en que se repetirá la prueba durante la vida de un paciente. En el caso de la pesquisa del cáncer colorrectal, esto significa considerar el número de colonoscopías (la principal fuente de daños graves) necesario para el seguimiento de los resultados anormales. Los modelos CISNET sugieren que las estrategias disponibles van desde un estimado de 1.714 a 4.049 colonoscopías totales requeridos por cada 1000 personas examinadas durante toda la vida. La colonoscopía cada 10 años genera el más alto grado de carga asociada o daños.50
Además de la edad y la polipectomía, la experiencia de los endoscopistas es otro de los factores más importantes que influyen en el riesgo de perforación o sangrado en la colonoscopía.274,275
Las preocupaciones sobre el uso de la colonoscopía como método primario de cribado en un programa poblacional son los recursos necesarios y las potenciales complicaciones.
Un desafío adicional para los sistemas de salud es la evaluación del uso racional y apropiado de los recursos endoscópicos, ya que existe evidencia que muestra un uso insuficiente o a veces excesivo de la colonoscopía de vigilancia.276,277
La adhesión a las recomendaciones de vigilancia se puede corregir mejorando los procesos y controles de calidad.278,279
Otro dato a tener en cuenta cuando se hace un análisis desde la perspectiva de la salud pública es que, como se mostró anteriormente, aunque la tasa de efectos secundarios graves gastrointestinales de la colonoscopía (perforación y sangrado) es relativamente pequeña, el número absoluto no es despreciable y la calidad del procedimiento es la herramienta fundamental para disminuir el impacto de estas complicaciones en la población.41
Teniendo en cuenta las consideraciones de recursos insuficientes y calidad heterogénea, un enfoque racional podría ser el uso de colonoscopía en las personas que presentan más riesgo de presentar lesiones avanzadas, cuya prevalencia en la población de riesgo promedio no supera el 10%.113
De ese modo, a través de una evaluación y estratificación de riesgo, de acuerdo a diferentes estrategias de puntuación que estiman la probabilidad de desarrollo de lesiones avanzadas, se selecciona a la población que más se beneficiaría con una colonoscopía.
En los últimos años, se propusieron varios modelos derivados del análisis de regresión de grandes series de individuos sometidos a colonoscopía.280-283
La mayoría de ellos incluyen la edad, el género, antecedentes familiares de CCR, el consumo de cigarrillos y el índice de masa corporal. Este enfoque puede ser útil en cribado oportunista, pero puede ser más difícil para ponerlo en práctica un programa organizado.
Se ha propuesto recientemente utilizar el perfil genético o genómico para seleccionar aquellos individuos principalmente predispuestos a desarrollar neoplasias colorrectales.
De hecho, las variantes genéticas comunes es decir, los polimorfismos de nucleótidos identificados en grandes estudios de todo el genoma, parecen desempeñar un papel crítico en el desarrollo de CCR, pero su potencial utilidad en la estratificación del riesgo a efectos del cribado aún no se ha demostrado.284,285
Colonografía por tomografía computarizada (CTC) “colonoscopía virtual”
La colonografía por tomografía computarizada (CTC), conocida como “colonoscopía virtual” (CV), es una técnica para el tamizaje del CCR que consiste en la obtención de múltiples cortes tomográficos abdominales y reconstrucción virtual del colon y recto mediante un software a través de las imágenes digitales en dos y tres dimensiones que permiten investigar la presencia de lesiones en la mucosa colorrectal.
Los pacientes se preparan para la CTC con las mismas técnicas de limpieza del intestino que se utilizan para la colonoscopía convencional, y el examen no requiere sedación, por lo cual las personas pueden regresar a su trabajo una vez finalizado el estudio.
Se introduce, a través del ano, un catéter para insuflar aire o dióxido de carbono que permite distender el colon para mejorar las imágenes, circunstancia que suele causar desagrado al paciente. Estas molestias son más severas cuando se insufla aire, ya que tiene una absorción más lenta que el dióxido de carbono. Puede ser necesaria la administración por vía endovenosa de fármacos como el glucagón, que permiten relajar el músculo liso intestinal y evitar los espasmos colónicos.286
Ante la presencia de lesiones en la CTC se indica una colonoscopía convencional con biopsia y/o resección de la lesión. El escenario ideal sería que los pacientes efectuaran el mismo día, o en su defecto el día siguiente, la colonoscopía óptica complementaria para evitar la necesidad de una segunda limpieza intestinal y consecuente incomodidad.
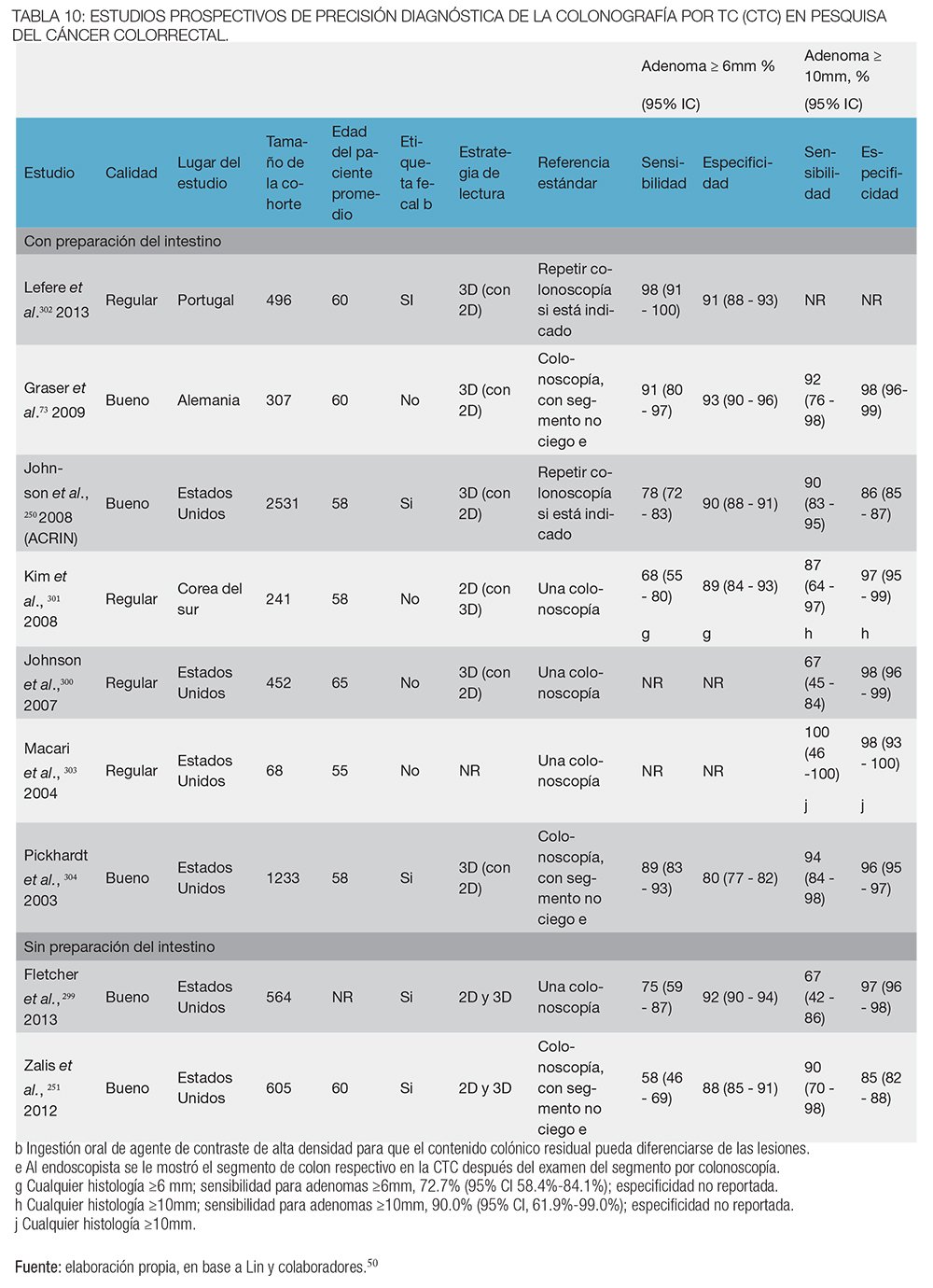
La tecnología para la CTC está evolucionando rápidamente, aunque no está disponible de forma extendida y uniforme, motivo por el cual los resultados obtenidos con diferentes técnicas pueden diferir significativamente.
Las mejoras técnicas actuales incluyen: la distensión del colon con dióxido de carbono, utilización de escáner de TC multidetector, software para detección de pólipos en 2D y 3D, a lo cual debemos agregar el mejor entrenamiento de los radiólogos para la interpretación de los resultados.250,287,288
La CTC detecta adenomas grandes tan bien como la colonoscopía convencional, permite visualizar todo el intestino y tiene una sensibilidad superior al colon por enema, por lo cual, es considerada la opción de elección ante una colonoscopía convencional incompleta.289-291
La evidencia convincente más reciente de la capacidad diagnóstica superior de la CTC para detectar cáncer colorrectal o pólipos grandes comparándola con el colon por enema doble contraste se muestra en un estudio aleatorizado sobre 3.804 pacientes sintomáticos donde la sensibilidad de la CTC para detectar pólipos grandes o cáncer colorrectal fue significativamente mayor que en el grupo de colon por enema (7.3% vs. 5.6%, p = 0.039), mientras que no hubo diferencias significativas en la detección de cáncer colorrectal solo (3.7% vs. 3.4%, p = 0.66).292
Una colonoscopía incompleta se produce, en promedio, en el 10% de los pacientes y se debe a puntos fijos, angulaciones del colon, visualización incompleta secundaria a mala preparación intestinal o a una lesión obstructiva.293,294
En dos grandes series retrospectivas de más de 100 pacientes, una CTC, luego de una colonoscopía incompleta, mostró hallazgos adicionales colónicos clínicamente relevantes que incluyeron pólipos grandes y cáncer, en más del 10% de los pacientes.290,295
Por otra parte, en una extensa serie de pacientes con cánceres colónicos obstructivos, Kim et al.296 mostraron que la CTC puede excluir de forma fiable patología proximal sincrónica y que la colonoscopía convencional de vigilancia se pueden posponer de forma segura hasta 12 meses.
Las desventajas de la CTC son la necesidad de una colonoscopía complementaria en caso de hallazgo positivo para una eventual biopsia o resección de las lesiones y la menor sensibilidad para la detección de los adenomas más pequeños y especialmente las lesiones planas.
El riesgo de la exposición a la radiación con la CTC es menor que con un colon por enema de bario con doble contraste, pero los riesgos de exposición de radiación acumulada son desconocidos.297,298
Aún no se han llevado a cabo estudios sobre el impacto de la pesquisa con CTC en la incidencia y mortalidad por CCR y solo se ha evaluado la precisión del método en comparación con la colonoscopía convencional efectuando ambos procedimientos en forma conjunta.
Nueve estudios de razonable o buena calidad73,250,251,299-304 (n = 6.497) evaluaron la precisión diagnóstica de la CTC multidetector en poblaciones de riesgo promedio50 (tabla 10). Los dos estudios más grandes y de mejor calidad fueron ensayos multicéntricos realizados en los Estados Unidos que evaluaron la CTC con preparación intestinal y marcadores fecales.250,304 En general, los estudios no fueron diseñados para estimar el rendimiento para detectar CCR.
Basado en los 7 estudios de CTC con preparación intestinal (n = 5.328), la sensibilidad por persona para detectar adenomas ≥ de 10 mm osciló del 67% (IC del 95%, 45% -84%) al 94% (IC del 95%, 84% -98%), y la especificidad varió de 98% (IC del 95%, 96% -99%) a 96% (IC del 95%, 95% -97%).50
La sensibilidad por persona para detectar adenomas ≥ 6 mm varió de 73% (IC del 95%, 58% -84%) a 98% (IC del 95%, 91% -100%) y la especificidad del 89% (95 % IC, 84% -93%) al 91% (IC del 95%, 88% -93%). Dos estudios (N = 1169) evaluaron la CTC sin preparaciónintestinal.251, 299 Aunque los datos fueron limitados, la sensibilidad de CTC sin preparación intestinal para detectar adenomas ≥ 6 mm parece ser inferior a la sensibilidad de los protocolos de CTC que incluyen preparación intestinal.50
Cuatro (n = 4.821) de los 9 estudios con CTC permitieron la estimación de la sensibilidad de la colonoscopía generalizable a la práctica en la comunidad.250,251,300,304 En comparación con la CTC o colonoscopía más CTC (por ejemplo, con segmento no ciego), la sensibilidad de la colonoscopía para detectar adenomas ≥ 10 mm varió de 89% (IC del 95%, 78% -96%) a 98% (IC del 95%, 74% -100%) y para los adenomas ≥ 6 mm varió de 75% (IC del 5%, 63%-84%) al 93% (95% IC, 88%-96%).50 Por lo tanto, CTC con la preparación intestinal tenía sensibilidad para detectar adenomas de ≥ 6 mm comparable con la colonoscopía, aunque con mayor variabilidad en el rendimiento. No está claro si la variación observada en el rendimiento de CTC se debió a diferencias en el diseño del estudio, las poblaciones, la preparación del intestino, las tecnologías de la CTC, o diferencias en la experiencia lector o los protocolos de lectura.50
El estudio multicéntrico del grupo del American College of Radiology Imaging Network sobre 2.531 personas de riesgo promedio con edad media de 58 años que se sometieron a exámenes de detección con colonografía por TC y colonoscopía óptica, mostró que de las 109 personas donde se detectó al menos un cáncer o un adenoma ≥ a 10 mm, 98 (90%) se detectaron por medio de la CTC con una especificidad de 86% y el VPP de 23%.250
Dado que los centros que realizaron los exámenes de detección eran principalmente centros académicos, y los radiólogos y endoscopistas estaban bien entrenados, es difícil asegurar la generalización de estos hallazgos.
Resultados similares (sensibilidad de 84 a 94%) se habían reportado en dos estudios previos con menor número de pacientes.300,304
En un estudio con programas paralelos de CTC y colonoscopía en la misma institución, se detectaron cuatro veces más adenomas en el grupo de la colonoscopía aunque sin hallar diferencias en el número de adenomas avanzados entre el grupo de CTC y el de colonoscopía (100 y 107 lesiones entre 3.120 y 3.163 pacientes, respectivamente.305
Similar sensibilidad para adenomas avanzados de más de 5 mm y cáncer colorrectal entre la colonoscopía y la CTC de alta resolución fue obtenida en un estudio prospectivo pequeño, de 311 personas, donde además se reportó una mayor preferencia de los pacientes por la CTC.73
En otro estudio, con la colonoscopía como referencia, en personas con riesgo aumentado de cáncer colorrectal (antecedentes familiares de CCR o antecedentes personales de adenomas) la sensibilidad y especificidad de la CTC fueron del 85% y 88%, respectivamente, para las lesiones ≥ 6mm.306
Un estudio reciente en 303 pacientes con antecedentes familiares de primer grado de CCR muestra una sensibilidad por paciente de 89% y un VPN de 99% en la detección de neoplasias avanzadas.307
Estos estudios sugieren que la colonoscopía virtual podría ser un examen de detección o vigilancia aceptable para las personas con riesgo alto de CCR, pero aún no hay datos concluyentes. Algunos autores señalan que la vigilancia en personas con mayor riesgo puede ser dificultosa por la mayor frecuencia de lesiones planas (de hasta el 50%) que pueden no detectarse con una CTC y por otro lado no hay datos que permitan establecer intervalos de vigilancia.308,309
Un meta-análisis de cinco estudios muestra una sensibilidad por paciente de 78% para adenomas de 6-9 mm, 83% para adenomas ≥6 mm y 88% para adenomas ≥1cm con una marcada heterogeneidad entre estudios especialmente para adenomas entre 6-9 mm.310 La especificidad por paciente fue 95% para adenomas de 6-9 mm, 91% para adenomas ≥6 mm y 98% para adenomas ≥1 cm.
Evaluando la sensibilidad para CCR, una reciente publicación de un estudio en 1,177 pacientes sintomáticos que se efectuaron CTC diagnóstica, muestra una sensibilidad para la detección de cáncer colorrectal del 95% y un valor predictivo negativo del 99%.311
Los resultados de un ensayo aleatorizado reciente, comparando colonoscopía óptica vs. CTC en 1.580 pacientes sintomáticos, mostró que no había diferencia en las tasas de detección de CCR o pólipos grandes entre los dos grupos (11,4% vs 10,7%. p = 0,69).312 Sin embargo, los pacientes del grupo de CTC eran tres veces más propensos a requerir investigaciones adicionales del colon que los del grupo de colonoscopía convencional (30,0% frente a 8,2%, RR = 3,65, p <0,0001) debido, sobre todo, a pequeños pólipos o incertidumbre clínica. Cáncer colorrectal o pólipos grandes se encontraron en el 34% de los pacientes que habían efectuado CTC y fueron remitidos para colonoscopía convencional y en el 17% de los pacientes que inicialmente fueron estudiados con la colonoscopía. Durante 3 años de seguimiento, un paciente (3,4%) presentó un cáncer adicional en el grupo de CTC y ninguno en el grupo de la colonoscopía. En conclusión, los datos sugieren que la colonoscopía convencional sigue siendo la prueba de elección en pacientes con sospecha de CCR.312
Una desventaja de la CTC es que las lesiones deprimidas y planas pueden pasarse por alto en el cribado mediante este método, sin embargo, en un estudio sobre 734 individuos seleccionados con lesiones en la CTC que se les practicó una colonoscopía convencional, solo 9 lesiones planas fueron inadvertidas y solo 2 de ellas eran adenomas.313,314
Contrariamente, un reciente estudio prospectivo evaluando la detección de los tumores lateralmente extendidos, un subconjunto de lesiones planas con mayor potencial maligno, encontró que de las lesiones previamente identificados en la colonoscopía, el 80% de los carcinomas y solo el 30% de los adenomas fueron detectados en la CTC realizada por un radiólogo experto, ciego a los resultados de la colonoscopía.315,316
La variación en los resultados de la sensibilidad de la CTC, como ocurre también en la colonoscopía convencional, depende de la experiencia del operador.317
Una ventaja de la CTC sobre la colonoscopía convencional para la pesquisa del CCR puede ser la mayor preferencia de los pacientes hacia la colonografía por TC, como se informa en varios estudios.318-320
Recientemente, un estudio prospectivo aleatorizado holandés comparó la participación en un tamizaje poblacional entre la CTC y la colonoscopía convencional.321 De 5.924 individuos invitados a realizar colonoscopía, participaron 1.276 (22%) comparados con 982 (34%) de los 2.920 invitados a CTC (riesgo relativo (RR: 1.56, 95% CI 1.46–1.68; p<0.0001). El rendimiento diagnóstico para neoplasias avanzadas fue 9% para la colonoscopía convencional versus 6% para la CTC (RR 1.46, 95% CI 1.06–2.03; p=0.02).321
Numerosos estudios informan los efectos adversos de la CTC y la evidencia, basada en los estudios prospectivos efectuados en pesquisa poblacional, sugiere poco o ningún riesgo de eventos adversos graves, incluyendo la perforación.50
Muchos de los estudios de CTC no informan la exposición a la radiación ni proporcionan información suficiente para calcularla. Basado en 4 estudios de precisión diagnóstica de la CTC,73,200,250,251 la dosis de radiación estimada para un examen completo con CTC (en decúbito supino y prono) fue aproximadamente 4,5 a 7 mSv. En tres estudios de cribado mediante CTC (2004-2008),322-324 la dosis de radiación estimada disminuyó a un rango de 1 a menos de 5 mSv.50
En algunos estudios se ha evaluado la eficacia de la colonoscopía virtual para detectar los pólipos colorrectales sin la preparación con laxantes. Esta opción tendría un impacto positivo en los pacientes ya que consideran una gran desventaja la preparación con laxantes.
Mediante la marcación de la materia fecal con material de contraste yodado que se ingiere varios días antes del procedimiento, los investigadores de un estudio pudieron detectar lesiones más grandes de 8 mm, con una sensibilidad de 95% y una especificidad de 92%.325 Sin embargo, el material de marcación específico que se usó en este estudio provocó náuseas en cerca de 10% de los pacientes.
En otro estudio, se utilizó una dieta baja en fibras, un medio de contraste ingerido por boca y una “limpieza electrónica”, proceso que elimina las heces marcadas en las imágenes computarizadas. La CTC identificó el 91% de los adenomas ≥ 10 mm y el 70% de las lesiones ≥ 8 mm.251
La CTC puede identificar neoplasias y otras lesiones extracolónicas entre el 27% y el 69% de los exámenes aunque resta conocer con exactitud el real beneficio o perjuicio relacionados con dichos diagnósticos.50,326
Los hallazgos extracolónicos en la CTC se clasifican de acuerdo a su importancia y requerimiento de estudios complementarios en: E0: examen limitado; E1: examen normal o variante normal; E2: hallazgo clínicamente sin importancia, por ejemplo, quiste hepático simple, hemangioma vertebral. No requiere estudios adicionales; E3: probablemente poco importante o hallazgo incompletamente caracterizado, por ejemplo, quiste renal mínimamente complejo. Remisión dependiente del centro de salud local; E4: hallazgo potencialmente importante, por ejemplo, masa renal sólida, aneurisma de aorta abdominal. Requiere estudios complementarios.327
Los estudios sugirieron una muy amplia gama de hallazgos que necesitan estudio diagnóstico adicional: 5% a 37% tenían hallazgos E3 o E4, y 1,7% a 12% tienen hallazgos E4.50
Entre los estudios que también informaron el seguimiento médico de los hallazgos extracolónicos, 1,4% a 11% fueron a la evaluación diagnóstica, cifra similar a la prevalencia de los resultados de la categoría E4.
Entre los estudios que informaron adecuadamente un tratamiento posterior, se muestra que solo el 3% requirieron tratamiento médico o quirúrgico definitivo y los cánceres extracolónicos se observaron solo en el 0,5% de las personas sometidas a exámenes de CTC.50 En la mayor serie de exámenes (n = 10.286), con 4 años de seguimiento, el 0,35% de las exploraciones reveló un tumor maligno extracolónico.328 Los aneurismas aórticos abdominales se observaron en el 1,4% de las personas o menos.
En una cohorte de 2.869 mujeres, se detectó una masa anexial indeterminada en 118 (4,1%) que llevó a una posterior evaluación en 80, donde no se identificaron cánceres de ovario.329,330
Si bien estos hallazgos tienen el potencial de identificar una enfermedad asintomática temprana, que permite el tratamiento con mejores resultados, las desventajas potenciales son: el sobrediagnóstico (identificación de una enfermedad que no causa problemas en la vida del paciente o tiene poca importancia clínica), el costo y el riesgo de evaluaciones adicionales, además de la ansiedad y preocupación de los pacientes asociadas con los resultados anormales.
Muchos de los estudios se realizaron en centros médicos académicos, donde la tecnología y la capacitación de los radiólogos era óptima por lo cual resta evaluar la replicabilidad de los resultados en los diferentes entornos. Además, en ninguno de estos estudios se exploró el efecto de los resultados extracolónicos en la ansiedad u otra alteración psicológica de los pacientes.
En muchos centros se están estudiando mejoras técnicas que incluyen la metodología de interpretación, como imágenes tridimensionales (3-D) y la preparación intestinal. Si bien la especificidad para la detección de pólipos es bastante homogénea en muchos estudios, la sensibilidad puede variar ampliamente. Estas variaciones se pueden atribuir a un número de factores como las características del explorador y el detector de TC, la amplitud de la colimación, la modalidad de imágenes (2-D vs. 3-D) y la destreza y experiencia de los radiólogos.331
Una nueva generación de equipos de tomografía computarizada que ha sido recientemente aplicada a la CTC es la TC de energía dual. La TC de energía dual representa una mejora sustancial en la técnica por la posibilidad de utilizar diferentes energías (kV) de rayos X y así lograr una mejor eliminación automática de restos fecales marcados.332
La evolución de los escáneres de TC incluye también diferentes sistemas encaminados a reducir la dosis de radiación.333,334
Un campo interesante para desarrollar es el reemplazo del aire insuflada por agua más contraste yodado hidrosoluble. El objetivo de esta técnica es mejorar la sensibilidad contrastando la interfaz entre la alta densidad del contenido intestinal (agua más líquido de contraste) y la baja densidad de la mucosa intestinal. Esta técnica además requiere la adquisición de imágenes en un solo decúbito del paciente (solo en posición supina) en comparación con los dos decúbitos (prono y supino) que por lo general se necesita en una CTC estándar.335
La eficacia y la costo-efectividad de la CTC realizada cada cinco años se comparó con otras estrategias de cribado en una población de 65 años o más en un estudio para proporcionar información a los Centros para Servicios de Medicare y Medicaid en EE. UU. En tres modelos de simulación del Instituto Nacional del Cáncer de Estados Unidos, se encontró que la CTC cada cinco años, con la colonoscopía complementaria ante pólipos mayores de 6 mm, se tradujo en menos años de vida ganados comparado con la colonoscopía, y es similar a la asociación de sigmoideoscopía flexible con SOMFi. La relación costo-efectividad de la CTC es inferior a la colonoscopía y mejora si se aumenta significativamente la adherencia del paciente al examen por encima de la adherencia a otras estrategias. No fueron considerados en el análisis el riesgo de la CTC en relación con la exposición a radiaciones y la detección de hallazgos extracolónicos.30
Ningún estudio ha examinado la eficacia de la CTC en la disminución de la mortalidad por cáncer colorrectal y cuestiones tales como costo-efectividad y las consecuencias de los hallazgos extracolónicos deben clarificarse antes de que la CTC pueda ser ampliamente implementada en un tamizaje de tipo poblacional.336
Los estudios de costo efectividad, que se basan en modelos matemáticos, en el caso de la CTC presentan resultados dispares. Mientras el análisis de Pickhardt y colaboradores muestra que la CTC cada 5 años asociada a colonoscopía convencional en casos de pólipos ≥6 mm es más costo efectiva que la colonoscopía cada 10 años, otros estudios muestran que la CTC es superada en términos de mayor beneficio y menor costo por las otras alternativas de tamizaje poblacional.337-339
Cápsula endoscópica
Una adaptación especial de la cápsula endoscópica utilizada para el intestino delgado ha sido desarrollada para obtener imágenes del colon. Esta cápsula, por medio de pequeñas cámaras de vídeo incorporadas en los dos extremos, toma imágenes a medida que atraviesa el colon, las cuales se transmiten a un receptor externo y se analizan para su interpretación en una computadora por gastroenterólogos experimentados.340
Esta técnica, menos invasiva que la colonoscopía, requiere preparación intensiva del intestino y no permite tomar biopsias o resecar pólipos, por lo tanto, los pacientes con lesiones detectadas durante el examen, demandan una colonoscopía posterior para una evaluación diagnóstica complementaria y eventual tratamiento.
Resultados variables con respecto a la sensibilidad y especificidad de la cápsula endoscópica para la detección de neoplasias colónicas se mostraron en diferentes estudios.341
Dos revisiones han evaluado el desempeño de esta prueba en el diagnóstico de lesiones colónicas en comparación con la colonoscopía y/o colonografía por tomografía computarizada, hallando una sensibilidad que varió del 56% al 76% y la especificidad de 64% al 69%.342,343
Luego de esas revisiones, se publicaron cuatro estudios sobre la precisión diagnóstica de la cápsula endoscópica que mostraron resultados un poco mejores, con una sensibilidad del 72% al 89% y una especificidad de entre el 53% y 78%.344-347
Los resultados obtenidos siguen siendo inferiores en comparación con la colonoscopía, aunque van mejorando con la evolución tecnológica.
Un meta-análisis de Rokkas y colaboradores348 demostró una sensibilidad relativamente baja para la detección de pólipos con respecto a la colonoscopía: sensibilidad para los pólipos significativos (definidos como las lesiones ≥ 6 mm o la presencia de 3 o más pólipos) del 69% con una especificidad del 89%.
En un estudio posterior, realizado en 545 pacientes, dos de los cinco cánceres que fueron detectados mediante colonoscopía no fueron identificados por la cápsula endoscópica y la sensibilidad para los pólipos significativos fue solo del 39%.349
En un estudio más reciente sobre 884 individuos sometidos a pesquisa del CCR con la cápsula de última generación (Pillcam 2), la sensibilidad de la cápsula para detectar pólipos mayores o iguales a 6 mm fue del 88% con una especificidad del 82% y para pólipos mayores o iguales a 10 mm, 92% y 95 %, respectivamente.350
En el mismo estudio, la cápsula detectó 3 de 4 cánceres colorrectales que se diagnosticaron en la colonoscopía, dando una sensibilidad del 75% para CCR.
Además, en el estudio antes mencionado, el 9% de los participantes incluidos fueron luego excluidos debido a la mala preparación del intestino y el 11% tuvieron eventos adversos no graves, en su mayoría relacionados con la preparación intestinal más agresiva.350
Otro estudio reciente que compara la cápsula colónica PillCam 2 con la colonografía por TC para preseleccionar individuos con test de sangre oculta positivo para colonoscopía convencional mostró resultados similares con ambos métodos para la identificación de pólipos mayores a 6 mm.351,352
La sensibilidad de la cápsula fue del 88%, igual porcentaje que la especificidad, y la mayoría de los sujetos prefirieron el examen con la cápsula antes que la colonografía por TC.351
Los datos disponibles de sensibilidad y especificidad y la falta de estudios poblacionales que hayan informado sobre la reducción de la incidencia y mortalidad por CCR no muestran aún a la cápsula endoscópica como una alternativa viable para el tamizaje del cáncer colorrectal.
La cápsula endoscópica tiene potencial como una alternativa a la colonoscopía, sin embargo, los datos muestran un desempeño marcadamente inferior en comparación con la con este procedimiento. Su uso se recomienda en casos de contraindicación o pacientes resistentes a efectuar una colonoscopía y en casos de colonoscopía incompleta.
Spada y colaboradores353 publicaron recientemente un estudio prospectivo que compara la cápsula endoscópica de colon con la colonografía por TC en pacientes con colonoscopía incompleta. Compararon la sensibilidad de ambos métodos para la detección de los pólipos de colon en el segmento no visualizado en la colonoscopía incompleta. La cápsula endoscópica detectó más del doble de las pacientes con pólipos que la colonografía virtual sin afectar a la tasa de falsos positivos. Existen algunos obstáculos para resolver: el largo tiempo de lectura del vídeo (más de una hora) hace que sea poco amigable para los médicos. Debería desarrollarse una herramienta de detección de pólipos automatizado, lo que permitiría al lector ir rápidamente sobre las sospechas marcadas y el uso de sistemas de alta definición incorporados al software que podrían mejorar la especificidad.354
En los Estados Unidos, la Administración de Alimentos y Medicamentos ha aprobado la cápsula endoscópica Pillcam COLON 2 (segunda generación) para los pacientes con una colonoscopía incompleta.40
Dos grandes ensayos están en desarrollo en Europa para evaluar el papel potencial de la cápsula endoscópica en los programas de cribado de CCR.355 Un ensayo italiano (CCANDY) que enrola a 400 pacientes SOMFi +, que tiene como objetivo evaluar la sensibilidad, especificidad, valor predictivo positivo y negativo en la detección de CCR y adenomas avanzados. Y un estudio que se está ejecutando en los Países Bajos (ORCA) donde se enrolarán 1.000 pacientes con el objetivo de determinar la aceptación de la población y el rendimiento diagnóstico de la cápsula como método primario de cribado poblacional. Los resultados de estos dos ensayos son muy esperados, ya que aclararán si la cápsula endoscópica, en los programas de cribado de CCR, tiene la aceptación y la precisión diagnóstica suficientes para pólipos y cáncer para incluirla en el panel de recomendaciones.355
Se realizó una reciente revisión sistemática y un meta-análisis para evaluar la precisión de las cápsulas endoscópicas de primera (CE1) y segunda (CE2) generación en la detección de pólipos colorrectales.356 Se seleccionaron catorce estudios que proporcionaron datos sobre 2.420 pacientes (1128 para CE1 y 1292 para CE2). Solo dos estudios incluyeron sujetos asintomáticos (1.109 personas, el 41,4% del total).
La CE2 y CE1 detectaron pólipos > 6 mm con una sensibilidad del 86% (95% IC: 82%-89%) y del 58% (95% IC: 95%: 44%-70%), respectivamente, y la especificidad fue del 88,1% (95 IC%: 74,2%-95,0%) para CE2 y del 85,7% (95% IC: 80,2% -90,0%) para CE1.
La CE2 y la CE1 detectaron pólipos > 10 mm con una sensibilidad del 87% (95% IC: 81% -91%) y del 54% (95% IC: 29%-77%), respectivamente, y una especificidad para la CE2 del 95,3% de especificidad (95% IC: 91,5 %-97,5%) y para la CE1 del 97,4% (95% CI: 96,0%-98,3%). La CE2 identificó los 11 cánceres invasivos detectados por colonoscopía.
La sensibilidad en la detección de pólipos > 6 mm y > 10 mm aumentó sustancialmente entre en la cápsula de colon segunda generación (CE2). Los valores más altos de especificidad para la detección de pólipos de la CCE-2 se alcanzan con un punto de corte de 10-mm.356
Los resultados de estudios poblacionales irán definiendo el rol que cumplirá la cápsula endoscópica en la pesquisa del cáncer colorrectal en el futuro.
Biomarcadores séricos
El uso de biomarcadores en suero o plasma está siendo investigado como una alternativa muy atractiva para el tamizaje del CCR, ya que, tratándose de un simple examen en sangre, puede favorecer a incrementar significativamente la aceptación de la población.
En la actualidad, la investigación es extensa, pero aún falta la validación de los resultados para su uso generalizado y eventual comercialización.357
De hecho, la mayor parte de la literatura actual se limita a resultados sobre la detección del cáncer colorrectal, más que en la detección de adenomas o lesiones avanzadas. Pero como sucede con la cápsula endoscópica, el campo de investigación es embrionario y al menos algunas de las innovaciones son prometedoras.
Los investigadores han encarado el problema desde dos direcciones: en primer lugar, buscando identificar nuevos y más potentes biomarcadores; y en segundo lugar, tratando de combinar biomarcadores conocidos para encontrar patrones sugestivos de cáncer colorrectal.
El antígeno carcinoembrionario (CEA) es el marcador tradicional asociado al CCR y su sensibilidad diagnóstica es de aproximadamente el 40%, demasiado baja para su uso como un examen de pesquisa o diagnóstico del CCR. Resulta valioso como una herramienta para monitorear la recurrencia del cáncer luego de su tratamiento, donde su sensibilidad se duplica (80%).358
Se intentó combinar el CEA con otros marcadores asociados al cáncer colorrectal, como CYFRA 21-1, ferritina, osteopontin (OPN), anti-p53, y seprase.359 La sensibilidad y la especificidad de la combinación de biomarcadores fue comparable al test de SOMFi para CCR.359
Dos tipos diferentes de moléculas se investigan para el cribado de CCR. En primer lugar, la alteración del patrón de normalidad de la metilación del ADN, que es un importante mecanismo epigenético involucrado en el proceso de carcinogénesis colorrectal y los patrones de metilación aberrante del ADN que se han encontrado en plasma de pacientes con CCR, sugiriendo una nueva clase de biomarcadores potenciales para el tamizaje.360,361 En segundo lugar, pequeñas porciones de ARN no codificados (micro ARNs) tienen un rol como reguladores de expresión genética con un papel crucial en diversos procesos celulares (desarrollo, diferenciación, proliferación y apoptosis) y en la iniciación y la progresión del cáncer en humanos.362,363
Varios estudios han evaluado la posible utilidad de la detección de la metilación del ADN circulante en el cribado del CCR y la mayoría de ellos sobre Septin 9357, 364 (tabla 10).
En la tabla 10 se muestran los resultados de 8 estudios365-372 que evaluaron la precisión diagnóstica para CCR y adenomas de biomarcadores en sangre periférica. La mayoría de ellos, especialmente aquellos que dependen de paneles de diferentes genes, han demostrado una relativamente alta sensibilidad para CCR, sin embargo, los resultados obtenidos con respecto a la detección de adenomas siguen siendo bastante pobres.41
Hasta ahora, el único biomarcador disponible comercialmente para el tamizaje del CCR aprobado por la FDA en abril de 2016 es precisamente Septin 9 (Epi proColon Assay®, Epigenómica, Alemania).
Desafortunadamente, los resultados del estudio Presept, el mayor ensayo clínico multicéntrico para evaluar la capacidad del Septin 9 para detectar CCR en población de riesgo promedio, fueron algo decepcionantes.372 En este estudio, sobre 1.516 participantes, la sensibilidad para la detección de CCR fue de 48%. Los valores correspondientes para las diferentes etapas del CCR de estadio I a IV fueron 35%, 63%, 46% y 77%, respectivamente, y para adenomas avanzados del 11%, con una especificidad del 92%. Estos resultados indican que Septin9 se puede detectar en el plasma de individuos asintomáticos con riesgo promedio, sometidos a tamizaje, aunque la prueba requiere una mayor sensibilidad para la detección de cáncer temprano y adenomas avanzados.372,373
Se ha investigado el papel de los microARNs en la génesis de diversos tumores observándose que cada tipo de tumor ha mostrado perfiles significativamente diferentes en comparación con las células normales.374,375
Informes recientes han demostrado que miARNs están presentes en el suero y plasma, con una circulación a niveles estables, reproducibles y consistentes. Por lo tanto, los perfiles de expresión de miARNs circulantes parecen ser una gran promesa para posicionarse como una estrategia novedosa, no invasiva de tamizaje del CCR.41,361
En un reciente estudio, se investigó si los niveles en plasma de miARNs pueden diferenciar pacientes con CCR o adenomas avanzados de individuos sanos.376
Fue posible demostrar que los perfiles de expresión de miARNs en plasma en pacientes con dichas lesiones difieren de los controles sanos y que se identificó un panel de seis miARNs (miR18a, miR19a, miR19b, miR15b, miR29a, y miR335) que están significativamente aumentados en pacientes con CCR.376 Sin embargo, solo el miR18a se confirmó que está sobre regulado significativamente en pacientes con adenomas avanzados. Estos resultados sugieren que los patrones de expresión de miARN pueden actuar como biomarcadores para CCR, aunque todavía tienen un valor limitado en la identificación de pacientes con lesiones premalignas.376
El campo de investigación de biomarcadores individuales o de paneles de marcadores en sangre para la detección del CCR y lesiones avanzadas premalignas se halla en permanente evolución y permite soñar con un escenario futuro donde se establezca como una estrategia de tamizaje del CCR.
Por supuesto que el camino de la validación de su eficacia para su utilización poblacional y la evaluación de su costo-efectividad llevara algún tiempo, aunque la potencial mayor aceptación de la población de este tipo de exámenes no invasivos es su principal fortaleza inicial.
Estudios recientemente publicados se encuentran en ese camino. Uno de ellos, abocado a la investigación de la sensibilidad y especificidad de un test que detecta regiones hipermetiladas en dos genes, BCAT1 e IKZF1, muestra tener una sensibilidad similar pero mayor especificidad que el test de SOMFi para la detección de CCR.377,378 Restan aún evaluaciones en un contexto de pesquisa poblacional para entender de modo completo las potenciales ventajas y desventajas de esos marcadores en el tamizaje del CCR.
Un meta-análisis sistemático reciente identificó un panel de dos miARNs como biomarcadores en sangre para la detección del cáncer colorrectal.379 Sobre un total de 134 sujetos, mostró resultados prometedores para una prueba de tamizaje del CCR que, sin embargo, deberá ser validada en una cohorte más grande con la estratificación de estadios del cáncer y en pacientes con otras enfermedades gastrointestinales.

La expresión de genes: TSPAN8, LGALS4, COL1A2 y CEACAM6 podría ser útil en la detección de CCR. La combinación de TSPAN8 y LGALS4 muestra valores prometedores de sensibilidad (92,5%) y especificidad (67,16%), compitiendo con sangre oculta en heces y con la prueba inmunoquímica fecal (74% y 95%) y el test de ADN en materia fecal, Cologuard (92% y 87%).379,380
A medida que se descubran marcadores moleculares para detectar el cáncer, se debe tener en cuenta el mismo estándar utilizado para los otros exámenes de tamizaje antes de su inclusión como alternativa para el cribado poblacional. Son necesarios estudios aleatorizados que demuestren la reducción de la mortalidad específica por CCR y permitirán evaluar la eficacia comparativa con otras pruebas, su beneficio contra el riesgo de detección inadecuada o resultado falso negativo y la necesidad de pruebas adicionales.381
GUÍAS DE PRÁCTICA CLÍNICA PARA LA EPSQUISA DEL CÁNCER COLORRECTAL
En la pesquisa oportunista, en la práctica diaria, el médico se plantea el desafío de hacer una prescripción a un paciente individual, con base en el análisis de las pruebas existentes, con el objetivo de no hacer “lo que nos parece” en forma casi automática, sino tener la posibilidad de reflexionar personalmente y con los pacientes acerca de las prescripciones que recomienda.
Las recomendaciones que el médico realiza exigen un análisis sistematizado de las distintas variables que las convertirán en una recomendación fuerte –aquella en la que los beneficios superan a los perjuicios–, o en una débil –aquella en la que los beneficios y perjuicios están balanceados.
La medicina basada en las pruebas es una metodología interesante para optimizar lo que leemos, lo que aprendemos y lo que hacemos.
Hace unas décadas, nos enfocábamos en plantearnos una pregunta adecuada a nuestro problema y buscar estudios randomizados por considerarlos la mejor evidencia. Luego empezamos a interesarnos en los meta-análisis, que integran los resultados de distintos estudios en un único estimador. Actualmente, parecería que las guías de práctica clínica (GPC) son las herramientas más completas para recopilar la mejor evidencia científica disponible y para considerar su aplicación más pertinente. Este instrumento toma particular relevancia en la evaluación de las múltiples estrategias de diagnóstico propuestas para la pesquisa del cáncer colorrectal.382
Las guías de práctica clínica son un conjunto de recomendaciones desarrolladas de manera sistemática, para ayudar a los médicos y a los pacientes en el proceso de la toma de decisiones, sobre cuáles son las intervenciones más adecuadas para resolver un problema médico en circunstancias sanitarias específicas. Su finalidad primordial consiste en ofrecer una serie de directrices con las que poder resolver, a través de la evidencia científica, los problemas que surgen diariamente con los pacientes.383
Las guías de práctica clínica sobre la pesquisa del cáncer colorrectal generalmente coincidían y ninguna estrategia de prevención se consideraba mejor que otra, a tal punto que la recomendación siempre era: “el mejor test de pesquisa es aquel que acepta el paciente”.383, 384
Muchas de las guías existentes adoptaron la premisa de ofrecer una gama de opciones de estudios que analizaran la evidencia científica, para elegir dentro de una pesquisa oportunista o, eventualmente, como alternativa en un programa organizado y en algunas de ellas estableciendo un orden de preferencia general o una predilección de acuerdo al objetivo propuesto del tamizaje, detección de adenomas o de cáncer colorrectal.192
La Guía de la U.S. Multi-Society Task Force/American Cancer Society (tabla 12) recomienda la pesquisa en personas asintomáticas, mayores de 50 años y sin antecedentes, definiendo dos categorías de pruebas de acuerdo al objetivo de detección. En la primera categoría ubican las pruebas que detectan principalmente los cánceres: SOMFg de alta sensibilidad anual, SOMF inmunoquímico anual o Test de ADN en heces (Cologuard) con un intervalo incierto.1,385
En la segunda categoría se encuentran los exámenes que detectan cáncer y adenomas y por lo tanto con mayor potencial preventivo: la sigmoideoscopía flexible cada 5 años, la colonoscopía cada 10 años, colon por enema doble contraste cada cinco años o colonografía por TC (colonoscopía virtual) cada cinco años.1,385

La guía del Colegio Americano de Gastroenterología (American College of Gastroenterology) corregida en 2009189 aconseja ofrecer en primer término exámenes para la prevención del CCR señalando a la colonoscopía cada 10 años como estudio preferido (tabla 13). Recomienda comenzar la pesquisa a los 50 años, excepto en afroamericanos, donde sugiere el inicio a los 45 años, aunque esta recomendación tiene un bajo nivel de evidencia.189,385
La guía señala que un test para la detección del cáncer colorrectal debe ser ofrecido en aquellas personas que rechazan la colonoscopía u otro test preventivo y el examen preferido en este caso es el test de sangre en heces inmunoquímico anual.
Luego marca recomendaciones alternativas para la prevención del CCR: sigmoideoscopía flexible cada 5-10 años y la colonografía por TC cada 5 años y test alternativos de detección de cáncer colorrectal: SOMFg de alta sensibilidad (Hemoccult Sensa) y test de ADN en materia fecal cada 3 años.189

La Asociación Canadiense de Gastroenterología (Canadian Association of Gastroenterology) publica en 2010 su propia guía (tabla 14), donde recomienda que la pesquisa del CCR en Canadá debe ser desarrollada mediante programas organizados regionales o provinciales con tamizaje a toda la población desde los 50 años y hasta los 75 años, dejando la decisión a cada caso en particular para las personas entre 75 y 85 años. No recomienda la pesquisa en mayores de 85 años.386
Entre las opciones de tamizaje, la guía recomienda de preferencia el test inmunoquímico de sangre oculta en heces o SOMFg de alta sensibilidad con intervalo anual o bienal, de acuerdo a los recursos disponibles o la sigmoideoscopía flexible con un intervalo de 10 años o más. Por el momento, la Asociación Canadiense de Gastroenterología no recomienda para la pesquisa programática la colonoscopía, el test de ADN en heces y la colonografía por TC, aunque en este último caso aconsejan su uso en circunstancias particulares, como por ejemplo luego de una colonoscopía incompleta.

Finalmente, para una pesquisa oportunista muestran un menú de opciones: sangre oculta en heces (SOMFi de preferencia), sigmoideoscopía y colonoscopía, con la recomendación de que este tipo de pesquisa deber ser efectuada en concordancia con los estándares de calidad aplicables a los programas organizados.386
En el año 2012, el American College of Physicians hace una evaluación de las diferentes guías o directrices existentes, desarrolladas por otras organizaciones con un análisis metodológico riguroso y publica sus recomendaciones para la pesquisa del CCR que luego actualiza en 2015387, 388 (tabla 15).
Para el análisis, los siete autores revisaron las GPC en forma independiente mediante el uso de una herramienta reconocida para la evaluación de este tipo de guías: Appraisal of Guidelines for Research & Evaluation II (AGREE II)389 con preguntas relacionadas al alcance y propósito de la guía, participación de los interesados, el rigor del desarrollo, la claridad y presentación, aplicabilidad e independencia editorial.387
Aunque las puntuaciones cuantitativas totales variaron en algún punto, la evaluación cualitativa de la calidad de las guías fue consistente entre los siete evaluadores. En efecto, la clasificación general de la calidad de las guías fue similar entre los evaluadores y la Guía de US Preventive Services Task Force (USPSTF)390 fue la única recomendada u nánimemente por los siete evaluadores.
Los comentarios finales sobre la evaluación de la guía de recomendaciones para la pesquisa del CCR de la USPSTF fueron que esta guía del año 2008, actualización de la anterior de 2002, presentaba la evidencia sobre los beneficios y los daños de las tecnologías de pesquisa, así como un modelo de decisión analítico para comparar los resultados esperados sobre la salud y las necesidades de recursos de los métodos de tamizaje disponibles. Los puntos fuertes de esta guía incluyen el uso de métodos rigurosos de evaluación de las pruebas, a través de una revisión sistemática de la literatura y los vínculos entre la evidencia y las recomendaciones, las cuales tienen una especificación de edad muy clara para el propósito de la pesquisa. La guía de la USPSTF es la única guía que no recomendaba la colonografía por TC como una opción para la pesquisa del cáncer colorrectal.387
Recientemente, en marzo de 2016 se publica la Guía de recomendaciones de tamizaje del cáncer colorrectal en la atención primaria, generada por la Canadian Task Force on Preventive Health Care (tabla 15), que aconseja a los médicos clínicos y responsables de políticas de salud la pesquisa del CCR en personas de 50 a 74 años mediante sangre oculta en heces (SOMFg o SOMFi) cada 2 años o sigmoideoscopía flexible cada 10 años. No recomiendan la colonoscopía cada 10 años.391

En 2016 se publica la actualización de la guía de la NCCN (National Comprehensive Cancer Network) de EE. UU.392 para el tamizaje del CCR (tabla 16), en la cual se recomienda una evaluación de riesgo de CCR antes de decidir el examen más apropiado a cada grupo de riesgo.
Se aconsejan en esta guía los estudios específicos para las personas con riesgo aumentado por antecedentes personales o familiares y en las personas con riesgo promedio se propone, a partir de los 50 años (no establecen una edad de finalización), las siguientes opciones: colonoscopía convencional cada 10 años, SOMFg de alta sensibilidad o SOMFi anuales, sigmoideoscopía flexible cada 5 años asociada a SOMF en el tercer año.
En 2015 se publica la actualización de las recomendaciones del Consenso del Asia Pacific Working Group, brindando la opinión de representantes de 14 países o regiones de Asia que se reunieron para revisar los datos de la bibliografía y actualizar las directrices.393
El objetivo de este grupo fue proporcionar un conjunto actualizado de recomendaciones con consenso regional, con la opinión de que cada país o región, para permitir su adaptación a las necesidades específicas.
En esta actualización,393 el grupo recomienda:
- Una propuesta de pesquisa estratificada de acuerdo al riesgo de CCR.
- Utilizar el score validado para identificar a las personas con alto riesgo de CCR o neoplasia avanzada que tiene en cuenta: edad, género masculino, historia familiar y tabaquismo394 (tablas 18 y 19).
- Considerar también la obesidad y la diabetes como factores de incremento del riesgo aunque aún no han sido incorporadas al score.
- Utilizar la colonoscopía como opción preferida de cribado de CCR en las personas con un mayor riesgo de CCR o neoplasia avanzada, basándose en el score previamente detallado.
- Las pruebas de sangre oculta en heces tienen un valor probado para el cribado del CCR, y el test con guayaco debe ser sustituido por la prueba inmunoquímica.
- Las personas con SOMFi positiva deben ser referidas para una colonoscopía complementaria.
- La sigmoideoscopía flexible es una alternativa efectiva para el tamizaje del CCR.
- Tanto lo colonografía por TC como la cápsula endoscópica no se recomiendan para la pesquisa del CCR y pueden ser utilizadas cuando no es posible una colonoscopía.
En junio de 2016 se publicó la actualización de las recomendaciones de la U.S. Preventive Services Task Force188 (tabla 20).

La USPSTF revisó la evidencia sobre la eficacia del cribado mediante colonoscopía, sigmoideoscopía flexible, colonografía por tomografía computarizada, la prueba de sangre oculta en heces basada con guayaco, la prueba inmunoquímica fecal, la prueba de ADN en heces y la prueba en sangre de la metilación del gen Septin 9 (SEPT9), en la reducción de la incidencia y la mortalidad por cáncer colorrectal o la mortalidad por todas las causas. Además analizó la evidencia sobre las características de rendimiento de estas pruebas para la detección de pólipos adenomatosos, adenomas avanzados, así como el cáncer colorrectal. Además, la USPSTF encargó un informe de modelos comparativos del Cancer Intervention and Surveillance Modeling Network (CISNET) y Colorectal Cancer Working Group para proporcionar información, de acuerdo a modelos comparativos, sobre beneficios, daños y la carga de las estrategias de detección de cáncer colorrectal durante toda la vida, sobre las edades óptimas de inicio y finalización de la pesquisa y los intervalos de los diferentes métodos disponibles que proporcionan años de vida ganados similares y un equilibrio comparable entre los años de vida ganados y la carga del tamizaje.187,395
En comparación con el análisis previo realizada por el USPSTF,390 en este se utiliza una definición de edades más estrechamente definidas de inicio y finalización y para los intervalos de cribado.
Los modelos utilizados por el Cancer Intervention and Surveillance Modeling Network (CISNET) incluyeron el modelo de simulación de cáncer colorrectal (SimCRC), el análisis de microsimulación para el screening del cáncer colorrectal (MISCAN) y el modelo de población de cáncer colorrectal simulado por incidencia e historia natural (CRC-SPIN).395
La USPSTF recomienda el cribado de cáncer colorrectal en personas entre 50 y 75 años, y enumera siete diferentes estrategias de cribado, afirmando que “las pruebas no se presentan en ningún orden de preferencia o jerarquización”, lo que implica que el grupo de trabajo considera que son equivalentes. Sin embargo, presenta evidencias de que algunas estrategias son mejores que otras cuando se ensayan en poblaciones representativas. En este estudio de modelos de microsimulación de una población previamente no tamizada, suponiendo una adhesión del 100% al tamizaje, las estrategias de colonoscopía cada 10 años, SOMFi anual, SF cada 10 años con SOMFi anual, y CTC cada 5 años proporcionan similares años de vida ganados y un equilibrio comparable entre el beneficio, la carga del tamizaje y la utilización de los recursos sanitarios. Estas estrategias se señalan como eficientes, estableciendo una llamada frontera de eficiencia que une las estrategias con la más alta ganancia de años de vida esperada por colonoscopía realizada. Las estrategias que se encontraban por debajo de esta frontera, pero con años de vida ganados al menos del 98% de las pruebas en la frontera eficiente, se denominaron casi eficientes o menos eficientes, y en este grupo se incluyó la prueba de ADN en materia fecal asociada a SOMFi. Por último, el grupo de trabajo incluye en la lista a la SOMFg y la sigmoideoscopía sola, pero con evidencia que sugiere que son ineficientes en los términos que señala la barrera de eficiencia.
La USPSTF parece estar diciendo que algunas pruebas son mejores que otras, pero luego no especifica una preferencia. ¿Cómo puede explicarse? Tomando el principio del grupo de trabajo que expresa: “la mejor prueba de detección es la que se consigue realizar”, una prueba puede ocupar un lugar de menor eficiencia en un modelo de simulación pero puede aumentarla cuando la preferencia de los pacientes la hacen una opción más aceptada. Por lo tanto, para elegir entre las estrategias de cribado, la USPSTF recomienda la toma de decisiones compartida, un proceso en el que el médico y el paciente comparten información y llegan a un consenso sobre qué prueba de tamizaje es mejor para el paciente. En la toma de decisiones compartida, las opciones no necesariamente tienen similares resultados o eficiencia equivalente. Los médicos y los pacientes van a entender la importancia de la pesquisa y hacer una elección informada entre las diferentes estrategias. Para las aseguradoras privadas, la recomendación de la pesquisa del cáncer colorrectal sin una declaración que indique cuáles estrategias específicas recomienda deja cierta ambigüedad acerca de si el seguro privado debe cubrir cada una de las pruebas específicas.396 El único test no incluido en el listado de opciones de la USPSTF fue la prueba en sangre de la metilación del gen septin 9 (SEPT9).
Si bien la FDA aprobó este test (Epi proColon; Epigenómica) en abril de 2016, la revisión sistemática de la evidencia apoya la recomendación de no incluirlo en la lista de opciones debido a su baja sensibilidad para la detección de CCR (48%).372
En el análisis del rango etario, la USPSTF concluye que la evidencia apoya la edad inicial de la pesquisa a los 50 años para la población en general. El equilibrio entre los beneficios y los daños se vuelve menos favorable cuando hay una menor esperanza de vida por comorbilidades y en personas con antecedentes de pesquisa previa. La USPSTF no recomienda el cribado de rutina contra el cáncer colorrectal en personas mayores de 85 años, y el beneficio neto de la pesquisa del cáncer colorrectal en adultos de 76 años a 85 años que habían sido controlados previamente es pequeño. Los adultos ente 76 y 85 años que nunca han sido examinados tienen más probabilidades de beneficiarse. La pesquisa es más adecuada para aquellas personas sanas, sin condiciones comórbidas que limiten considerablemente la expectativa de vida. Se recomienda una decisión en conjunto personalizada.188
En 2010, la Agencia Internacional para la Investigación en Cáncer (IARC), organismo dependiente de la Organización Mundial de la Salud (OMS), publicó un documento marco, las Directrices Europeas de Garantía de Calidad en la pesquisa y diagnóstico del cáncer colorrectal,3 especialmente diseñado para el establecimiento de programas organizados poblacionales cuyos lineamientos completos se expondrán en el capítulo referido a programas de pesquisa del CCR.
A partir de una revisión completa y sistemática de la evidencia científica, las recomendaciones son: el cribado del CCR en personas entre 50 y 75 años mediante SOMFg o SOMFi con un intervalo no mayor de tres años y en un rango mínimo de inclusión de personas entre 60-64 años o el cribado con sigmoideoscopía flexible en un intervalo no menor de 10 años. La colonoscopía no se recomienda hasta la actualidad para la pesquisa del CCR en la Unión Europea.
BIBLIOGRAFÍA
- Levin, B.; Lieberman, D.; Mcfarland, B.; Andrews, K.; Brooks, D.; Bond, J. et al. (2008): “Screening and surveillance for the early detection of colorectal cancer and adenomatous polyps, 2008: a joint guideline from the American Cancer Society, the US Multi-Society Task Force on Colorectal Cancer, and the American College of Radiology”. En: Gastroenterology, 134: 1570-1595.
- Castells, A.; Marzo-Castillejo, M.; Mascort, J.: Amador, F.: Andreu, M.: Bellas, B. et al. (2009): “Guía de práctica clínica. Prevención del cáncer colorrectal. Actualización 2009”. En: Gastroenterol Hepatol, 32: 717. e711–717.e758.
- Segnan, N.; Patnick, J.; Von Karsa, L. et al. (2010): European guidelines for quality assurance in colorectal cancer screening and diagnosis. Luxemburgo: European Commission, Publications Office of the European Union.
- Winawer, S.; Fletcher, R.; Rex, D.; Bond, J.; Burt, R.; Ferrucci, J. et al. (2003): “Colorectal Cancer screening and surveillance: clinical guidelines and rationale – update based on new evidence”. En: Gastroenterology, 124: 544-560.
- Rodriguez-Moranta, F.; Salo, J.; Arcusa, A.; Boadas, J.; Pinol, V.; Bessa, X. et al. (2006): “Postoperative Surveillance in patients with colorectal cancer who have undergone curative resection: a prospective, multicenter, randomized, controlled trial”. En: J Clin Oncol, 24: 386-393.
- Winawer, S.; Zauber, A.; Fletcher, R.; Stillman, J.; O’Brien, M.; Levin, B. et al. (2006): “Guidelines for colonoscopy surveillance after polypectomy: a consensus update by the US Multi-Society Task Force on Colorectal Cancer and the American Cancer Society”. En: Gastroenterology, 130: 1872-1885.
- Zauber, A.; Winawer, S.; O’Brien, M.; Lansdorp- Vogelaar, I.; van Ballegooijen, M.; Hankey, B. et al. (2012): “Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths”. En: N Engl J Med, 366: 687-696.
- Castells, A.; Andreu, M.; Binefa, G.; Fite, A.; Font, R. y Espinas, J. (2015): “Postpolypectomy surveillance in patients with adenomas and serrated lesions: a proposal for risk stratification in the context of organized colorectal cancer-screening programs”. En: Endoscopy, 47: 86-87.
- Wilson, J. M. G. y Jungner, G. (1968): “Principles and practice of screening for disease”. WHO, Ginebra, Report Nº 34. Disponible online en: <http://whqlibdoc.who.int/php/WHO_PHP_34.pdf>.
- Hewitson, P.; Glasziou, P.; Irwig, L.; Towler, B. y Watson, E. (2007): “Screening for colorectal cancer using the faecal occult blood test, Hemoccult, Cochrane”. En: Database. Syst. Rev. Nº 1, p. CD001216.
- Atkin, W. S.; Edwards, R.; Kralj-Hans, I. et al. (2010): “Once-only flexible sigmoidoscopy screening in prevention of colorectal cancer: a multicentre randomised controlled trial”. En: Lancet, 375: 1624-1633.
- Hanselaar, A. G. (2002): “Criteria for organized cervical screening programs. Special emphasis on The Netherlands program”. En: Acta Cytol., 46(4): 619-629.
- Council of the European Union (2003): “Council Recommendation of 2 December 2003 on cancer screening (2003/878/EC)”. En: Off J Eur Union, Nº L 327, pp. 34-38.
- Miles, A.; Cockburn, J.; Smith, R.A. et al. (2004): “A perspective from countries using organized screening programs”. En: Cancer. 101: 1201-1213.
- Sullivan, T.; Sullivan, R. y Ginsburg, O.M. (2015): “Screening for Cancer: Considerations for Low- and Middle-Income Countries”. En: Gelband, H.; Jha, P.; Sankaranarayanan, R. y Horton, S. (eds.), Source: Cancer: Disease Control Priorities, Volumen 3. Washington (DC): The International Bank for Reconstruction and Development / The World Bank. Disponible online en: <http://www.ncbi.nlm.nih.gov/books/NBK343622/>.
- Arbyn, M.; Anttila, A.; Jordan, J.; Ronco, G.; Schenck, U.; Segnan, N.; Wiener, H.; Herbert, A. y Von Karsa, L. (2010): “European Guidelines for Quality Assurance in Cervical Cancer Screening”. En: Ann. Oncol, 21(3): 448-458.
- Von Karsa, L.; Lignini, T.A.; Patnick, J.; Lambert, R. y Sauvaget, C. (2010): “The dimensions of the CRC problem”. En: Best Pract. Res.Clin Gastroenterol., 24(4): 381-396.
- Rodríguez-Moranta, F.; Trapero-Bertran, M.; Castells, A. et al. (2008): “Endoscopic requirements of colorectal cancer screening programs in average-risk population. Estimation according to a Markov model”. En: Gastroenterol Hepatol, 31(7): 405-412.
- Rabeneck, L.; Horton, S.; Zauber, A.G. y Earle, C. (2015): “Colorectal Cancer”. En: Gelband, H.; Jha, P.; Sankaranarayanan, R. y Horton, S. (eds.), Source: Cancer: Disease Control Priorities, Volumen 3. Washington (DC): The International Bank for Reconstruction and Development / The World Bank.
- Quintero, E.; Hassan, C.; Senore, C. y Saito, Y. (2012): “Progress and challenges in colorectal cancer screening”. En: Gastroenterol Res Pract, 8(4): 69-85.
- Pignone, M.; S. Saha, R. Hoerger, y Mandelblatt, J. (2002): “Cost-Effectiveness Analyses of Colorectal Cancer Screening: A Systematic Review for the U.S. Preventive Services Task Force”. En: Annals of Internal Medicine, 137 (2): 96-104.
- Pignone, M.; L. Russell, y Wagner, J. (eds.) (2005): Economic Models of Colorectal Cancer Screening in Average-Risk Adults. Washington, DC: National Academies Press.
- Bray, F.; Ren, J.S.; Masuyer, E. y Ferlay, J. (2005): “Estimates of Global Cancer Prevalence for 27 Sites in the Adult Population in 2008”. En: International Journal of Cancer, 132: 1133-1145.
- Park, S.M.; Yun, Y.H. y Kwon, S. (2005): “Feasible Economic Strategies to Improve Screening Compliance for Colorectal Cancer in Korea”. En: World Journal of Gastroenterology, 11 (11): 1587-1593.
- Tsoi, K.K.F.; Ng, S.S.M.; Leung, M.C.M. y Sung, J.J.Y. (2008): “Cost-Effectiveness Analysis on Screening for Colorectal Neoplasm and Management of Colorectal Cancer in Asia”. En: Alimentary Pharmacology and Therapeutics, 28: 353-363.
- Wong, S.S.; Leong, A.P.K. y Leong, T.Z. (2004): “Cost- Effectiveness Analysis of Colorectal Cancer Screening Strategies in Singapore: A Dynamic Decision Analytic Approach”. En: Studies in Health Technology Information, 107 (Pt 1): 104-110.
- Wu, G.H.-M.; Wang, Y.-M.; Yen, A.M.-F.; Wong, J.-M.; Lai, H.-C. et al. (2006): “Cost-Effectiveness Analysis of Colorectal Cancer Screening with Stool DNA Testing in Intermediate-Incidence Countries”. En: BMC Cancer, 6: 136-148.
- Espinola, N.; Maceira, D. y Palacios, A. (2016): “Costo-efectividad de las pruebas de tamizaje del cáncer colorrectal en la Argentina”. En: Acta Gastroenterol Latinoam, 46: 8-17.
- Zauber, A.G.; Lansdorp-Vogelaar, I.; Knudsen, A.B. et al. (2008): “Evaluating test strategies for colorectal cancer screening: a decision analysis for the U.S. Preventive Services Task Force”. En: Ann Intern Med, 149: 659.
- Knudsen, A.B.; Lansdorp-Vogelaar, I.; Rutter, C.M.; Savarino, J.E.; Van Ballegooijen, M. et al. (2010): “Cost-Effectiveness of Computed Tomographic Colonography Screening for Colorectal Cancer in the Medicare Population”. En: Journal of the National Cancer Institute, 102: 1238-1252.
- Sharp, L.; Tilson, L.; Whyte, S.; O’Ceilleachair, A.; Walsh, C.; Usher, C. et al. (2012): “Cost-Effectiveness of Population-based screening for colorectal cancer: a comparison of guaiac-based faecal occult blood testing, faecal immunochemical testing and flexible sigmoidoscopy”. En: Br J Cancer, 106: 805-816.
- Lansdorp-Vogelaar, I.; Knudsen, A. y Brenner, H. (2010): “Cost-effectiveness of colorectal cancer screening – an overview”. En: Best Pract Res Clin Gastroenterol, 24: 439-449.
- Lansdorp-Vogelaar, I.; Van Ballegooijen, M.; Zauber, A.G. et al. (2009): “Effect of rising chemotherapy costs on the cost savings of colorectal cancer screening”. En: J Natl Cancer Inst., 101(20): 1412-1422. doi: 10.1093/jnci/djp319. Epub 2009 Sep 24.
- Ginsberg, G.M.; Lim, S.S.; Lauer, J.A.; Johns, B.P. y Sepulveda, C.R. (2010): “Prevention, Screening and Treatment of Colorectal Cancer: A Global and Regional Generalized Cost-Effectiveness Analysis”. En: Cost Effectiveness and Resource Allocation, 8: 2-17.
- Ginsberg, G.M.; Lauer, J.A.; Zelle, S.; Baeten, S. y Baltussen, R. (2012): “Cost Effectiveness of Strategies to Combat Breast, Cervical, and Colorectal Cancer in Sub-Saharan Africa and South East Asia: Mathematical Modeling Study”. En: British Medical Journal, 344: E614.
- Goss, P.E.; Lee, B.L.; Badovinac-Crnjevic, T. et al. (2013): “Planning cancer control in Latin America and the Caribbean”. En: Lancet Oncol, 14: 391-436.
- Winawer, S.J.; Krabshuis, J.; Lambert, R. et al. (2011): “World Gastroenterology Organization Guidelines Committee. Cascade colorectal cancer screening guidelines: a global conceptual model”. En: J Clin Gastroenterol., 45(4): 297-300. doi: 10.1097/MCG.0b013e3182098e07.
- Young, G.P.; Symonds, E.L.; Allison, J.E. et al. (2015): “Advances in Fecal Occult Blood Tests: The FIT Revolution”. En: Dig Dis Sci, 60: 609-622.
- Von Karsa, L.; Patnick, J.; Segnan, N. et al. (2013): “European Colorectal Cancer Screening Guidelines Working Group. European guidelines for quality assurance in colorectal cancer screening and diagnosis: Overview and introduction to the full Supplement publication”. En: Endoscopy, 45(1): 51-59. doi:10.1055/s-0032-1325997.
- El Zoghbi, M. y Cummings, L. (2016): “New era of colorectal cancer screening”. En: World J Gastrointest Endosc, 10; 8(5): 252-258.
- Castells, A. (2015): “Choosing the optimal method in programmatic colorectal cancer screening: current evidence and controversies”. En: Ther Adv Gastroenterol, 8(4): 221-233.
- Faivre, J.; Dancourt, V.; Lejeune, C. et al. (2004): “Reduction in colorectal cancer mortality by fecal occult blood screening in a French controlled study”. En: Gastroenterology. 126(7): 1674-1680.
- Kronborg, O.; Jørgensen, O.D.; Fenger, C. y Rasmussen, M. (2004): “Randomized study of biennial screening with a faecal occult blood test: results after nine screening rounds”. En: Scand J Gastroenterol, 39: 846-851.
- Lindholm, E.; Brevinge, H. y Haglind, E. (2008): “Survival benefit in a randomized clinical trial of faecal occult blood screening for colorectal cancer”. En: Br J Surg, 95: 1029-1036.
- Scholefield, J.H.; Moss, S.M.; Mangham, C.M.; Whynes, D.K. y Hardcastle, J.D. (2012): “Nottingham trial of faecal occult blood testing for colorectal cancer: a 20-year follow-up”. En: Gut, 61:1036-1040.
- Shaukat, A.; Mongin, S.J.; Geisser, M.S. et al. (2013): “Long-term mortality after screening for colorectal cancer”. En: N Engl J Med, 369: 1106-1114.
- Hardcastle, J.D.; Chamberlain, J.O.; Robinson, M.H. et al. (1996): “Randomised controlled trial of faecal-occult-blood screening for colorectal cancer”. En: Lancet, 348 (9040): 1472-1477.
- Mandel, J.S.; Church, T.R.; Bond, J.H. et al. (2000): “The effect of fecal occult-blood screening on the incidence of colorectal cancer”. En: N Engl J Med., 343(22): 1603-1607.
- Mandel, J.S.; Bond, J.H.; Church, T.R, et al. (1993): “Reducing mortality from colorectal cancer by screening for fecal occult blood: Minnesota Colon Cancer Control Study”. En: N Engl J Med., 328(19): 1365-1371.
- Lin, J.S.; Piper, M.; Perdue, L.A. et al. (2016): “Screening for Colorectal Cancer: An Updated Systematic Review for the U.S. Preventive Services Task Force”. En: JAMA, 315(23): 2576-2594.
- Lang, C.A.; Ransohoff, D.F. (1994): “Fecal occult blood screening for colorectal cancer. Is mortality reduced by chance selection for screening colonoscopy?” En: JAMA, 271(13): 1011-1013.
- Robinson, M.H.; Hardcastle, J.D.; Moss, S.M. et al. (1999): “The risks of screening: data from the Nottingham randomised controlled trial of faecal occult blood screening for colorectal cancer”. En: Gut, 45(4): 588-592.
- Jørgensen, O.D.; Kronborg, O.; Fenger, C. (2002): “A randomised study of screening for colorectal cancer using faecal occult blood testing: results after 13 years and seven biennial screening rounds”. En: Gut, 50(1): 29-32.
- Hewitson, P.; Glasziou, P.; Irwig, L. et al. (2007): “Screening for colorectal cancer using the faecal occult blood test, Hemoccult”. En: Cochrane Database Syst Rev, CD001216.
- Hewitson, P.; Glasziou, P.; Watson, E. et al. (2008): “Cochrane systematic review of colorectal cancer screening using the fecal occult blood test (hemoccult): an update”. En: Am J Gastroenterol, 103(6): 1541-1549.
- Heresbach, D.; Manfredi, S.; D’Halluin, P.N.; Bretagne, J.F. y Branger, B. (2006): “Review in depth and meta-analysis of controlled trials on colorectal cancer screening by faecal occult blood test”. En: Eur. J. Gastroenterol. Hepatol. 18(4): 427-433.
- Kerr, J.; Day, P.; Broadstock, M.; Weir, R. y Bidwell, S. (2007): “Systematic review of the effectiveness of population screening for colorectal cancer”. En: N. Z. Med, 120 (1258). Disponible online en: <http://www.nzma.org.nz/journal/120-1258/2629/>.
- Parra-Blanco, A.; Gimeno-García, A.Z.; Quintero, E. et al. (2010): “Diagnostic accuracy of immunochemical versus guaiac faecal occult blood tests for colorectal cancer screening”. En: J Gastroenterol, 45: 703-712.
- Hol, L.; Wilschut, J.A.; Van Ballegooijen, M. et al. (2009): “Screening for colorectal cancer: random comparison of guaiac and immunochemical faecal occult blood testing at different cut-off levels”. En: Br J Cancer, 100: 1103-1110.
- Van Rossum, L.G.; Van Rijn, A.F.; Laheij, R.J. et al. (2008): “Random comparison of guaiac and immunochemical fecal occult blood tests for colorectal cancer in a screening population”. En: Gastroenterology, 135: 82-90.
- Dancourt, V.; Lejeune, C.; Lepage, C.; Gailliard, M.C.; Meny, B. y Faivre, J. (2008): “Immunochemical faecal occult blood tests are superior to guaiac-based tests for the detection of colorectal neoplasms”. En: Eur J Cancer, 44: 2254-2258.
- Wong, B.C.; Wong, W.M.; Cheung, K.L. et al. (2003): “A sensitive guaiac faecal occult blood test is less useful than an immunochemical test for colorectal cancer screening in a Chinese population”. En: Aliment Pharmacol Ther., 18: 941-946.
- Cole, S.R.; Young, G.P. (2001): “Effect of dietary restriction on participation in faecal occult blood test screening for colorectal cancer”. En: Med J Aust., 175: 195-198.
- Allison, J.E.; Sakoda, L.C.; Levin, T.R. et al. “Screening for colorectal neoplasms with new fecal occult blood tests: update on performance characteristics”. En: J Natl Cancer Inst., 99(19): 1462-1470.
- Whitlock, E.P.; Lin, J.S.; Liles, E.; Beil, T.L. y Fu, R. (2008): “Screening for colorectal cancer: a targeted, updated systematic review for the U.S. Preventive Services Task Force”. En: Ann. Intern. Med., 149(9): 638-658.
- Guittet, L.; Bouvier, V.; Mariotte, N. et al. (2007): “Comparison of a guaiac based and an immunochemical faecal occult blood test in screening for colorectal cancer in a general average risk population”. En: Gut, 56: 210-214.
- Hol, L.; Van Leerdam, M.; Van Ballegooijen, M.; Van Vuuren, A.; Van Dekken, H.; Reijerink, J. et al. (2010): “Screening for colorectal cancer: randomised trial comparing guaiac-based and immunochemical faecal occult blood testing and flexible sigmoidoscopy”. En: Gut, 59: 62-68.
- Allison, J.E.; Fraser, C.G.; Halloran, S.P. et al. (2014): “Population screening for colorectal cancer means getting FIT: the past, present, and future of colorectal cancer screening using the fecal immunochemical test for hemoglobin (FIT)”. En: Gut Liver, 8: 117-130.
- Brenner, H. y Tao, S. (2013): “Superior diagnostic performance of faecal immunochemical tests for haemoglobin in a head-to-head comparison with guaiac based faecal occult blood test among 2235 participants of screening colonoscopy”. En: Eur J Cancer, 49(14): 3049-3054.
- Cheng, T.I.; Wong, J.M.; Hong, C.F. et al. (2002): “Colorectal cancer screening in asymptomatic adults: comparison of colonoscopy, sigmoidoscopy and fecal occult blood tests”. En: J Formos Med Assoc., 101(10): 685-690.
- Chiu, H.M.; Lee, Y.C.; Tu, C.H. et al. (2013): “Association between early stage colon neoplasms and false-negative results from the fecal immunochemical test”. En: Clin Gastroenterol Hepatol., 11(7): 832-838.
- De Wijkerslooth, T.R.; Stoop, E.M.; Bossuyt, P.M. et al. (2012): “Immunochemical fecal occult blood testing is equally sensitive for proximal and distal advanced neoplasia”. En: Am J Gastroenterol. 107(10): 1570-1578.
- Graser, A.; Stieber, P.; Nagel, D. et al. (2009): “Comparison of CT colonography, colonoscopy, sigmoidoscopy and faecal occult blood tests for the detection of advanced adenoma in an average risk population”. En: Gut, 58(2): 241-248.
- Imperiale, T.F.; Ransohoff, D.F.; Itzkowitz, S.H. et al. (2014): “Multitarget stool DNA testing for colorectal-cancer screening”. En: N Engl J Med., 370(14): 1287-1297.
- Levy, B.T.; Bay, C.; Xu, Y, et al. (2014): “Test characteristics of faecal immunochemical tests (FIT) compared with optical colonoscopy”. En: J Med Screen, 21(3): 133-143.
- Morikawa, T.; Kato, J.; Yamaji, Y.; Wada, R.; Mitsushima, T.; Shiratori, Y. (2005): “A comparison of the immunochemical fecal occult blood test and total colonoscopy in the asymptomatic population”. En: Gastroenterology, 129(2): 422-428.
- Nakama, H.; Yamamoto, M.; Kamijo, N. et al. (1999): “Colonoscopic evaluation of immunochemical fecal occult blood test for detection of colorectal neoplasia”. En: Hepatogastroenterology, 46(25): 228-231.
- Ng, S.C.; Ching, J.Y.; Chan, V. et al. (2013): “Diagnostic accuracy of faecal immunochemical test for screening individuals with a family history of colorectal cancer”. En: Aliment Pharmacol Ther, 38(7): 835-841.
- Park, D.I.; Ryu, S.; Kim, Y.H. et al. (2010): “Comparison of guaiac-based and quantitative immunochemical fecal occult blood testing in a population at average risk undergoing colorectal cancer screening”. En: Am J Gastroenterol. 105(9): 2017-2025.
- Sohn, D.K.; Jeong, S.Y.; Choi, H.S. et al. (2005): “Single immunochemical fecal occult blood test for detection of colorectal neoplasia”. En: Cancer Res Treat, 37(1): 20-23.
- Hernandez, V.; Cubiella, J.; Gonzalez-Mao, M.C. et al. (2014): “COLONPREV Study Investigators. Fecal immunochemical test accuracy in average-risk colorectal cancer screening”. En: World J Gastroenterol. 20(4): 1038-1047.
- Lee, Y.H.; Hur, M.; Kim, H. et al. (2015): “Optimal cut-off concentration for a faecal immunochemical test for haemoglobin by Hemo Techt NS-Plus C15 system for the colorectal cancer screening”. En: Clin Chem Lab Med., 53(3): e69-e71.
- Brenner, H.; Haug, U. y Hundt, S. (2010): “Inter-test agreement and quantitative cross-validation of immunochromatographical fecal occult blood tests”. En: Int J Cancer., 127(7): 1643-1649.
- Brenner, H.; Haug, U. y Hundt, S. (2010): “Sex differences in performance of fecal occult blood testing”. En: Am J Gastroenterol. 105(11): 2457-2464.
- Morikawa, T.; Kato, J.; Yamaji, Y. et al. (2007): “Sensitivity of immunochemical fecal occult blood test to small colorectal adenomas”. En: Am J Gastroenterol. 102(10): 2259-2264.
- Faivre, J.; Dancourt, V.; Denis, B. et al. (2012): “Comparison between a guaiac and three immunochemical faecal occult blood tests in screening for colorectal cancer”. En: Eur J Cancer, 48: 2969-2976.
- Raginel, T.; Puvinel, J.; Ferrand, O. et al. (2013): “A population based comparison of immunochemical fecal occult blood tests for colorectal cancer screening”. En: Gastroenterology, 144: 918-925.
- Leggett, B.A. y Hewett, D.G. “Colorectal cancer screening”. En: Intern Med J, 45: 6-15.
- Kuipers, E.J.; Rösch, T.; Bretthauer, M. (2013): “Colorectal cancer screening—optimizing current strategies and new directions”. En: Nat Rev Clin Oncol, 10: 130-142.
- Brenner, H. y Tao, S. (2013): “Superior diagnostic performance of faecal immunochemical tests for haemoglobin in a head to head comparison with guaiac based faecal occult blood test among 2235 participants of screening colonoscopy”. En: Eur J Cancer, 49: 3049-3054.
- Tan, W.S.; Tang, C.L. y Koo, W.H. (2013): “Opportunistic screening for colorectal neoplasia in Singapore using faecal immunochemical occult blood test”. En: Singapore Med J, 54: 220-223.
- Fu, W.P.; Kam, M.H.; Ling, W.M.; Ong, S.F.; Suzannah, N.; Eu, K.W. (2009): “Screening for colorectal cancer using a quantitative immunochemical faecal occult blood test: a feasibility study in an Asian population”. En: Tech Coloproctol, 13: 225-230.
- Levi, Z.; Rozen, P.; Hazazi, R. et al. (2007): “A quantitative immunochemical fecal occult blood test for colorectal neoplasia”. En: Ann Intern Med, 146: 244-255.
- Cole, S.R.; Young, G.P.; Esterman, A. et al. (2003): “A randomised trial of the impact of new faecal haemoglobin test technologies on population participation in screening for colorectal cancer”. En: J Med Screen, 10: 117-122.
- Hoffman, R.M.; Steel, S.; Yee, E.F. et al. (2010): “Colorectal cancer screening adherence is higher with fecal immunochemical tests than guaiac-based fecal occult blood tests: a randomized, controlled trial”. En: Prev Med., 50: 297-299.
- Vart, G.; Banzi, R. y Minozzi, S. (2012): “Comparing participation rates between immunochemical and guaiac faecal occult blood tests: a systematic review and meta-analysis”. En: Prev Med., 55: 87-92.
- Whitlock, E.P.; Lin, J.S.; Liles, E. et al. (2008): “Screening for colorectal cancer: a targeted, updated systematic review for the U.S. Preventive Services Task Force”. En: Ann Intern Med, 149 (9): 638-658.
- Oort, F.A.; Terhaar Sive Droste, J.S.; Van Der Hulst, R.W. et al. (2010): “Colonoscopy-controlled intra-individual comparisons to screen relevant neoplasia: faecal immunochemical test vs. guaiac-based faecal occult blood test”. En: Aliment Pharmacol Ther., 31: 432-439.
- Lee, J.K.; Liles, E.G.; Bent, S. et al. (2014): “Accuracy of fecal immunochemical tests for colorectal cancer: systematic review and meta-analysis”. En: Ann Intern Med., 160: 171.
- Nakama, H.; Kamijo, N.; Fujimori, K. et al. (1997): “Relationship between fecal sampling times and sensitivity and specificity of immunochemical fecal occult blood tests for colorectal cancer: a comparative study”. En: Dis Colon Rectum, 40: 781-784.
- Van Roon, A.H.; Hol, L.; Van Vuuren, A.J. et al. (2012): “Are fecal immunochemical test characteristics influenced by sample return time? A population-based colorectal cancer screening trial”. En: Am J Gastroenterol. 107: 99-107.
- Van Rossum, L.G.; Van Rijn, A.F.; Laheij, R.J. et al. (2009): “Cutoff value determines the performance of a semi-quantitative immunochemical faecal occult blood test in a colorectal cancer screening programme”. En: Br J Cancer, 101 (8): 1274-1281.
- Rozen, P.; Comaneshter, D.; Levi, Z. et al. (2010): “Cumulative evaluation of a quantitative immunochemical fecal occult blood test to determine its optimal clinical use”. En: Cancer, 116: 2115-2125.
- Fraser, C.G.; Rubeca, T.; Rapi, S. et al. (2014): “Faecal haemoglobin concentrations vary with sex and age, but data are not transferable across geography for colorectal cancer screening”. En: Clin Chem Lab Med., 52: 1211-1216.
- Ventura, L.; Mantellini, P.; Grazzini, G. et al. (2014): “The impact of immunochemical faecal occult blood testing on colorectal cancer incidence”. En: Dig Liver Dis., 46: 82-86.
- Brown, L.F. y Fraser, C.G. (2008): “Effect of delay in sampling on haemoglobin determined by faecal immunochemical tests”. En: Ann Clin Biochem., 45: 604-605.
- Vilkin, A.; Rozen, P.; Levi, Z. et al. (2005): “Performance characteristics and evaluation of an automated-developed and quantitative, immunochemical, fecal occult blood screening test”. En: Am J Gastroenterol. 100: 2519-2525.
- Guittet, L.; Guillaume, E.; Levillain, R. et al. (2011): “Analytical comparison of three quantitative immunochemical fecal occult blood tests for colorectal cancer screening”. En: Cancer Epidemiol Biomark Prev., 20: 1492-1501.
- Grazzini, G.; Ventura, L.; Zappa, M. et al. (2010): “Influence of seasonal variations in ambient temperatures on performance of immunochemical faecal occult blood test for colorectal cancer screening: observational study from the Florence district”. En: Gut, 59: 1511-1515.
- Symonds, E.L.; Osborne, J.M.; Cole, S.R. et al. (2015): “Factors affecting faecal immunochemical test positive rates: demographic, pathological, behavioural and environmental variables”. En: J Med Screen, 22(4): 187-193.
- Australian Institute of Health and Welfare (2013): National Bowel Cancer Screening Program Monitoring report July 2011-June 2012. Canberra.
- Chiang, T.H.; Lee, Y.C.; Tu, C.H. et al. (2011): “Performance of the immunochemical fecal occult blood test in predicting lesions in the lower gastrointestinal tract”. En: CMAJ, 183: 1474-1481.
- Quintero, E.; Castells, A.; Bujanda, L.; Cubiella, J.; bSalas, D.; Lanas, A. et al. (2012): “Colonoscopy versus fecal immunochemical testing in colorectal-cancer screening”. En: N Engl J Med, 366: 697-706.
- Segnan, N.; Senore, C.; Andreoni, B.; Azzoni, A. Bisanti, L.; Cardelli, A. et al. (2007): “Comparing attendance and detection rate of colonoscopy with sigmoidoscopy and fit for colorectal cancer screening”. En: Gastroenterology, 132: 2304-2312.
- Jensen, C.D.; Corley, D.A.; Quinn, V.P. et al. (2016): “Fecal Immunochemical Test Program Performance Over 4 Rounds of Annual Screening. A Retrospective Cohort Study”. En: Ann Intern Med., 164: 456-463.
- Hundt, S.; Haug, U. y Brenner, H. (2009): “Comparative evaluation of immunochemical fecal occult blood tests for colorectal adenoma detection”. En: Ann Intern Med, 150: 162-169.
- Van Rossum, L.G.; Van Rijn, A.F.; Verbeek, A.L. et al. (2011): “Colorectal cancer screening comparing no screening, immunochemical and guaiac fecal occult blood tests: a cost-effectiveness analysis”. En: Int J Cancer, 128: 1908-1917.
- Lieberman, D. (2012): “Colorectal cancer screening: practice guidelines”. En: Dig Dis, 30 Suppl 2: 34-38.
- Duffy, M.J.; Van Rossum, L.G.; Van Turenhout, S.T. et al. “Use of faecal markers in screening for colorectal neoplasia: a European group on tumor markers position paper”. En: Int J Cancer, 128(1): 3-11.
- Vatandoost, N.; Ghanbari, J.; Mojaver, M. et al. (2016): “Early detection of colorectal cancer: from conventional methods to novel biomarkers”. En: J Cancer Res Clin Oncol., 142(2): 341-351.
- Kinzler, K.W. y Vogelstein, B. (1996): “Lessons from hereditary colorectal cancer”. En: Cell, 87 (2): 159-170.
- Lidgard, G.P.; Dominco, M.; Bruinsma, J.J. et al. (2013): “Clinical performance of an automated stool DNA assay for detection of colorectal neoplasia”. En: Clin Gastroenterol Hepatol., 11: 1313-1318.
- Ahlquist, D.A. (2015): “Multi-Target Stool DNA Test: A New High Bar for Noninvasive Screening”. En: Dig Dis Sci, 60: 623-633.
- Tanaka, T.; Tanaka, M.; Tanaka, T. e Ishigamori, R. (2010): “Biomarkers for colorectal cancer”. En: Int J Mol Sci, 11: 3209-3225.
- Coppedè, F.; Lopomo, A.; Spisni, R. y Migliore, L. (2014): “Genetic and epigenetic biomarkers for diagnosis, prognosis and treatment of colorectal cancer”. En: World J Gastroenterol, 20: 943-956.
- Kim, H.J.; Yu, M.H.; Kim, H.; Byun, J. y Lee, C. (2008): “Noninvasive molecular biomarkers for the detection of colorectal cancer”. En: BMB Rep, 41: 685-692.
- Wang, X.; Kuang, Y.Y. y Hu, X.T. (2014): “Advances in epigenetic biomarker research in colorectal cancer”. En: World J Gastroenterol, 20: 4276-4287.
- Ahlquist, D.A.; Skoletsky, J.E.; Boynton, K.A. et al. (2000): “Colorectal cancer screening by detection of altered human DNA in stool: feasibility of a multitarget assay panel”. En: Gastroenterology, 119 (5): 1219-1227.
- Traverso, G.; Shuber, A.; Levin, B.; Johnson, C.; Olsson, L.; Schoetz, D. Jr. et al. (2002): “Detection of APC mutations in fecal DNA from patients with colorectal tumors”. En: N Engl J Med, 346: 311-320.
- Imperiale, T.; Ransohoff, D.; Itzkowitz, S.; Turnbull, B. y Ross, M. (2004): “Fecal DNA versus fecal occult blood for colorectal-cancer screening in an average risk population”. En: N Engl J Med, 351: 2704-2714.
- Chen, W.; Han, Z.; Skoletsky, J.; Olson, J.; Sah, J.; Myeroff, L. et al. (2005): “Detection in fecal DNA of colon cancer-specific methylation of the nonexpressed vimentin gene”. En: J Natl Cancer Inst, 97: 1124-1132.
- Itzkowitz, S.; Jandorf, L.; Brand, R.; Rabeneck, L.; Schroy, P. 3rd, Sontag, S. et al. (2007): “Improved fecal DNA test for colorectal cancer screening”. En: Clin Gastroenterol Hepatol, 5: 111-117.
- Ahlquist, D.A.; Sargent, D.J.; Loprinzi, C.L. et al. (2008): “Stool DNA and occult blood testing for screen detection of colorectal neoplasia”. En: Ann Intern Med, 149: 441-450.
- Heigh, R.I.; Yab, T.C.; Taylor, W.R.; Hussain, F.T.N.; Smyrk, T.C.; Mahoney, D.W. et al. (2014): “Detection of Colorectal Serrated Polyps by Stool DNA Testing: Comparison with Fecal Immunochemical Testing for Occult Blood (FIT)”. En: PLoS ONE, 9(1): e85659.
- Robertson, D.J. y Dominitz, J.A. (2014): “Stool DNA and colorectal-cancer screening”. En: N Engl J Med, 370: 1350-1351.
- Anderson, J.C. y Shaw, R.D. (2014): “Update on colon cancer screening: recent advances and observations in colorectal cancer screening”. En: Curr Gastroenterol Rep, 16: 403 doi: 10.1007/s11894-014-0403-3.
- Dhaliwal, A.; Vlachostergios, P.J.; Oikonomou, K.G. et al. (2015): “Fecal DNA testing for colorectal cancer screening: molecular targets and perspectives”. En: World J Gastrointest Oncol, 7(10): 178-183.
- S/A (2014): “A stool DNA test (Cologuard) for colorectal cancer screening”. En: JAMA, 312(23): 2566. doi: 10.1001/jama.2014.15746.
- Ahlquist, D.A. (2015): “Multi-target stool DNA test: a new high bar for noninvasive screening”. En: Dig Dis Sci, 60: 623-633.
- Hutchinson, L. (2014): “Screening: Where does stool DNA testing FIT in the CRC screening menu?”. En: Nat Rev Clin Oncol., 11(5): 239. doi: 10.1038/nrclinonc.2014.60.
- Song, K.; Fendrick, A.M. y Ladabaum, U. (2004): “Fecal DNA testing compared with conventional colorectal cancer screening methods: a decision analysis”. En: Gastroenterology, 126: 1270-1279.
- Skally, M.; Hanly, P. y Sharp, L. (2013): “Cost effectiveness of fecal DNA screening for colorectal cancer: a systematic review and quality appraisal of the literature”. En: Appl Health Econ Health Policy, 11: 181-192.
- Lansdorp-Vogelaar, I.; Kuntz, K.M.; Knudsen, A.B. et al. (2010): “Stool DNA testing to screen for colorectal cancer in the Medicare population: a cost-effectiveness analysis”. En: Ann Intern Med, 153 (6): 368-377.
- Binefa, G.; Rodríguez-Moranta, F.; Teule, A. et al. (2014): “Colorectal cancer: from prevention to personalized medicine”. En: World J Gastroenterol, 20: 6786-6808.
- Shah, R.; Jones, E.; Vidart, V. et al. (2014): “Biomarkers for early detection of colorectal cancer and polyps: systematic review”. En: Cancer Epidemiol Biomarkers Prev, 23: 1712-1728.
- Winawer, S.J.; Stewart, E.T.; Zauber, A.G. et al. (2000): “A comparison of colonoscopy and double-contrast barium enema for surveillance after polypectomy. National Polyp Study Work Group”. En: N Engl J Med, 342: 1766-1772.
- Rockey, D.C.; Paulson, E.; Niedzwiecki, D. et al. (2005): “Analysis of air contrast barium enema, computed tomographic colonography, and colonoscopy: prospective comparison”. En: Lancet, 365: 305-311.
- Burling, D.; Halligan, S.; Slater, A.; Noakes, M.J. y Taylor, S.A. (2006): “Potentially Serious Adverse Events at CT Colonography in Symptomatic Patients: National Survey of the United Kingdom 1”. En: Radiology, 239: 464-471.
- Fletcher, R.H. (2002): “Rationale for combining different screening strategies”. En: Gastrointest Endosc Clin N Am, 12 (1): 53.
- Lieberman, D.A. y Weiss, D.G. (2001): “One-time screening for colorectal cancer with combined fecal occult-blood testing and examination of the distal colon”. En: N. Engl. J. Med., 345(8): 555-560.
- Schoenfeld, P.; Cash, B.; Flood, A.; Dobhan, R.; Eastone, J.; Coyle, W.; Kikendall, J.W.; Kim, H.M.; Weiss, D.G.; Emory, T.; Schatzkin, A. y Lieberman, D. (2005): “Colonoscopic screening of averagerisk women for colorectal neoplasia”. En: N. Engl. J. Med., 352(20): 2061-2068.
- Wallace, M.B.; Kemp, J.A.; Trnka, Y.M. et al. (1998): “Is colonoscopy indicated for small adenomas found by screening flexible sigmoidoscopy?”. En: Ann Intern Med, 129 (4): 273-8.
- Levin, T.; Palitz, A.; Grossman, S.; Conell, C. et al. (1999): “Predicting advanced proximal colonic neoplasia with screening sigmoidoscopy”. En: JAMA, 281: 1611-1617.
- Imperiale, T.; Wagner, D.; Lin, C.Y. et al. (2000): “Risk of advanced proximal neoplasms in asymptomatic adults according to the distal colorectal findings”. En: N Engl J Med, 343: 169-174.
- Levin, T.R.; Palitz, A.; Grossman, S. et al. (1999): “Predicting advanced proximal colonic neoplasia with screening sigmoidoscopy”. En: JAMA, 281 (17): 1611-1617.
- Soetikno, R.M.; Kaltenbach, T.; Rouse, R.V. et al. (2008): “Prevalence of nonpolypoid (flat and depressed) colorectal neoplasms in asymptomatic and symptomatic adults”. En: JAMA, 299 (9): 1027-1035.
- Lieberman, D.A.; Weiss, D.G.; Bond, J.H. et al. (2000): “Use of colonoscopy to screen asymptomatic adults for colorectal cancer. Veterans Affairs Cooperative Study Group 380”. En: N Engl J Med, 343 (3): 162-168.
- Atkin, W.S.; Cook, C.F.; Cuzick, J. et al. (2002): “UK Flexible Sigmoidoscopy Screening Trial Investigators. Single flexible sigmoidoscopy screening to prevent colorectal cancer: baseline findings of a UK multicentre randomised trial”. En: Lancet, 359(9314): 1291-1300.
- Atkin, W.; Edwards, R.; Kralj-Hans, I. et al. (2010): “Once-only flexible sigmoidoscopy screening in prevention of colorectal cancer: a multicentre randomised controlled trial”. En: Lancet, 375: 1624-1633.
- Segnan, N.; Armaroli, P.; Bonelli, L. et al. (2011): “Once-only sigmoidoscopy in colorectal cancer screening: follow-up findings of the Italian randomized controlled trial – SCORE”. En: J Natl Cancer Inst, 103: 1310-1322.
- Bretthauer, M.; Gondal, G.; Larsen, K. et al. (2002): “Design, organization and management of a controlled population screening study for detection of colorectal neoplasia: attendance rates in the NORCCAP study (Norwegian Colorectal Cancer Prevention)”. En: Scand J Gastroenterol, 37: 568-573.
- Holme, Ø.; Løberg, M.; Kalager, M. et al. (2014): “Effect of flexible sigmoidoscopy screening on colorectal cancer incidence and mortality: a randomized clinical trial”. En: JAMA, 312(6): 606-615.
- Castells, A.; Bessa, X.; Quintero, E.; Bujanda, L.; Cubiella, J.; Salas, D. et al. (2013): “Risk of advanced proximal neoplasms according to distal colorectal findings: comparison of sigmoidoscopy-based strategies”. En: J Natl Cancer Inst, 105: 878-886.
- Schoen, R.E.; Pinsky, P.F.; Weissfeld, J.L. et al. (2012): “PLCO Project Team. Colorectal-cancer incidence and mortality with screening flexible sigmoidoscopy”. En: N Engl J Med., 366(25): 2345-2357.
- Segnan, N.; Senore, C.; Andreoni, B. et al. (2002): “SCORE Working Group-Italy. Baseline findings of the Italian multicenter randomized controlled trial of “once-only sigmoidoscopy”: SCORE”. En: J Natl Cancer Inst., 94(23): 1763-1772.
- Weissfeld, J.L.; Schoen, R.E.; Pinsky, P.F. et al. (2005): “PLCO Project Team. Flexible sigmoidoscopy in the PLCO cancer screening trial: results from the baseline screening examination of a randomized trial”. En: J Natl Cancer Inst., 97(13): 989-997.
- Elmunzer, B.J.; Hayward, R.A.; Schoenfeld, P.S. et al. (2012): “Effect of flexible sigmoidoscopy-based screening on incidence and mortality of colorectal cancer: a systematic review and meta-analysis of randomized controlled trials”. En: PLoS Med., 9(12): e1001352.
- Littlejohn, C.; Hilton, S.; Macfarlane, G.J. y Phull, P. (2012): “Systematic review and meta-analysis of the evidence for flexible sigmoidoscopy as a screening method for the prevention of colorectal cancer”. En: Br J Surg., 99(11): 1488-1500.
- Bresalier, R.S. (2015): “Flexible Sigmoidoscopy: More Than a Unilateral Breast Exam?”. En: Dig Dis Sci, 60: 634-638.
- Segnan, N.; Senore, C.; Andreoni, B. et al. (2005): “Randomized trial of different screening strategies for colorectal cancer: patient response and detection rates”. En: J. Natl. Cancer Inst., 97(5): 347-357.
- Rasmussen, M.; Kronborg, O.; Fenger, C.; Jørgensen, O.D. (1999): “Possible advantages and drawbacks of adding flexible sigmoidoscopy to Hemoccult-II in screening for colorectal cancer: a randomized study”. En: Scand J Gastroenterol., 34(1): 73-78.
- Verne, J.E.C.W.; Aubrey, R.; Love, S.B.; Talbot, I.C. y Northover, J.M. (1998): “Population based randomized study of uptake and yield of screening by flexible sigmoidoscopy compared with screening by faecal occult blood testing”. En: BMJ, 317(7152): 182-185.
- Hoff, G.; Thiis-Evensen, E.; Grotmol, T.; Sauar, J.; Vatn, M.H.; Moen, I.E. (2001): “Do undesirable effects of screening affect all-cause mortality in flexible sigmoidoscopy programmes? Experience from the Telemark Polyp Study 1983-1996”. En: Eur J Cancer Prev., 10(2): 131-137.
- Jain, A.; Falzarano, J.; Jain, A.; Decker, R.; Okubo, G. y Fujiwara, D. (2002): “Outcome of 5,000 flexible sigmoidoscopies done by nurse endoscopists for colorectal screening in asymptomatic patients”. En: Hawaii Med J., 61(6): 118-120.
- Kim, J.S.; Kim, B.W.; Kim, J.I. et al. (2013): “Endoscopic clip closure versus surgery for the treatment of iatrogenic colon perforations developed during diagnostic colonoscopy: a review of 115,285 patients”. En: Surg Endosc., 27(2): 501-504.
- Levin, T.R.; Conell, C.; Shapiro, J.A.; Chazan, S.G.; Nadel, M.R. y Selby, J.V. (2002): “Complications of screening flexible sigmoidoscopy”. En: Gastroenterology, 123(6): 1786-1792.
- Senore, C.; Ederle, A.; Fantin, A. et al. (2011): “Acceptability and side-effects of colonoscopy and sigmoidoscopy in a screening setting”. En: J Med Screen, 18(3):128-134.
- Tam, M.S. y Abbas MA. (2013): “Perforation following colorectal endoscopy: what happens beyond the endoscopy suite?”. En: Perm J., 17(2): 17-21.
- Viiala, C.H. y Olynyk, J.K. (2007): “Outcomes after 10 years of a community-based flexible sigmoidoscopy screening program for colorectal carcinoma”. En: Med J Aust., 187(5): 274-277.
- Wallace, M.B.; Kemp, J.A.; Meyer, F, et al. (1999): “Screening for colorectal cancer with flexible sigmoidoscopy by nonphysician endoscopists”. En: Am J Med., 107(3): 214-218.
- Atkin, W.S.; Hart, A.; Edwards, R. et al. (1998): “Uptake, yield of neoplasia, and adverse effects of flexible sigmoidoscopy screening”. En: Gut, 42(4): 560-565.
- Gondal, G.; Grotmol, T.; Hofstad, B. et al. (2003): “The Norwegian Colorectal Cancer Prevention (NORCCAP) screening study: baseline findings and implementations for clinical work-up in age groups 50-64 years”. En: Scand J Gastroenterol., 38(6): 635-642.
- Brevinge, H.; Lindholm, E.; Buntzen, S. y Kewenter, J. (1997): “Screening for colorectal neoplasia with faecal occult blood testing compared with flexible sigmoidoscopy directly in a 55-56 years’ old population”. En: Int J Colorectal Dis., 12(5): 291-295.
- Valori, R.; Rey, J-F.; Atkin, W.S. et al. (2012): “European guidelines for quality assurance in colorectal cancer screening and diagnosis. First Edition – Quality assurance in endoscopy in colorectal cancer screening and diagnosis”. En: Endoscopy, 44(S 03): SE88-SE105.
- Rasmussen, M.; Fenger, C. y Kronborg, O. (2003): “Diagnostic yield in a biennial Hemoccult-II screening program compared to a once-only screening with flexible sigmoidoscopy and Hemoccult- II”. En: Scand. J. Gastroenterol., 38(1): 114-118.
- Kato, J.; Morikawa, T.; Kuriyama, M. et al. (2009): “Combination of sigmoidoscopy and a fecal immunochemical test to detect proximal colon neoplasia”. En: Clin Gastroenterol Hepatol, 7 (12): 1341-1346.
- Zauber, A.; Knudsen, A.; Rutter, C.M.; Lansdorp-Vogelaar, I. y Kuntz, K.M. (2015): “Evaluating the Benefits and Harms of Colorectal Cancer Screening Strategies: A Collaborative Modeling Approach”. En: AHRQ Publication No. 14-05203-EF-2. Rockville, MD: Agency for Healthcare Research and Quality.
- US Preventive Services Task Force (2016): “Screening for Colorectal Cancer. US Preventive Services Task Force Recommendation Statement”. En: JAMA, 315(23): 2564-2575.
- Rex, D.K.; Johnson, D.A.; Anderson, J.C. et al. (2009): “American College of Gastroenterology guidelines for colorectal cancer screening 2009” [corrected]. En: Am J Gastroenterol. 104(3): 739-750.
- Vasen, H.; Tomlinson, I. y Castells, A. (2015): “Clinical management of hereditary colorectal cancer syndromes”. En: Nat Rev Gastroenterol Hepatol, 12: 88-97.
- Robertson, D.J.; Kaminski, M.F. y Bretthauer, M. (2015): “Effectiveness, training and quality assurance of colonoscopy screening for colorectal cancer”. En: Gut, 64: 982-990.
- Garborg, K. (2012): “Colorectal Cancer Screening”. En: Surg Clin N Am, 95: 979-989.
- Kaminski, M.F.; Bretthauer, M.; Zauber, A.G. et al. (2012): “The NordICC Study: rationale and design of a randomized trial on colonoscopy screening for colorectal cancer”. En: Endoscopy, 44: 695-702.
- Screesco trial. Diponible online en: <https://clinicaltrials.gov/ct2/show/NCT02078804>.
- Dominitz, J.A. y Robertson, D.J. (2014): “Colonoscopy Versus Fecal Immunochemical Test in Reducing Mortality From Colorectal Cancer (CONFIRM)”. Disponible online en: <https://clinicaltrials.gov/ct2/show/NCT01239082>.
- Brenner, H.; Chang-Claude, J.; Seiler, C.; Rickert, A. y Hoffmeister, M. (2011): “Protection from colorectal cancer after colonoscopy: a population based, case-control study”. En: Ann Intern Med, 154: 22-30.
- Baxter, N.; Goldwasser, M.; Paszat, L.; Saskin, R.; Urbach, D. y Rabeneck, L. “Association of colonoscopy and death from colorectal cancer”. En: Ann Intern Med, 150: 1-8.
- Brenner, H.; Chang-Claude, J.; Seiler, C. y Hoffmeister, M. (2011): “Interval cancers after negative colonoscopy: population-based case-control study”. En: Gut, 61: 1576-1582.
- Brenner, H.; Chang-Claude, J.; Seiler, C. y Hoffmeister, M. (2011): “Long-term risk of colorectal cancer after negative colonoscopy”. En: J Clin Oncol, 29: 3761-3767.
- Imperiale, T.; Glowinski, E.; Lin-Cooper, C.; Larkin, G.; Rogge, J. y Ransohoff, D. (2008): “Five-year risk of colorectal neoplasia after negative screening colonoscopy”. En: N Engl J Med, 359: 1218-1224.
- Zauber, A.G.; Winawer, S.J.; O’Brien, M.J.; Lansdorp-Vogelaar, I.; Van Ballegooijen, M.; Hankey, B.F. et al. (2012): “Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths”. En: N Engl J Med, 366: 687-696.
- Nishihara, R.; Wu, K.; Lochhead, P.; Morikawa, T.; Liao, X.; Qian, Z.R. et al. (2013): “Long-term colorectal-cancer incidence and mortality after lower endoscopy”. En: N Engl J Med, 369: 1095-1105.
- Kahi, C.J.; Anderson, J.C. y Rex, D.K. (2013): “Screening and surveillance for colorectal cancer: state of the art”. En: Gastrointest Endosc, 77: 335-350.
- Singh, H.; Nugent, Z.; Demers, A.A. et al. (2010): “The reduction in colorectal cancer mortality after colonoscopy varies by site of the cancer”. En: Gastroenterology, 139:1128-37.
- Brenner, H.; Stock, C. y Hoffmeister, M. (2014): “Effect of Screening sigmoidoscopy and screening colonoscopy on colorectal cancer incidence and mortality: systematic review and meta-analysis of randomised controlled trials and observational studies”. En: BMJ, 348: g2467 doi: 10.1136/bmj.g2467.
- Winawer, S. (1993): “Colorectal cancer screening comes of age”. En: N Engl J Med, 328: 1416-1417.
- Citarda, F.; Tomaselli, G.; Capocaccia, R.; Barcherini, S. y Crespi, M. (2001): “Efficacy in standard clinical practice of colonoscopic polypectomy in reducing colorectal cancer incidence”. En: Gut, 48: 812-815.
- Zauber, A.; Winawer, S.; O’Brien, M.; Lansdorp- Vogelaar, I.; Van Ballegooijen, M.; Hankey, B. et al. (2012): “Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths”. En: N Engl J Med, 366: 687-696.
- Samadder, N.J.; Curtin, K.; Tuohy, T.M.; Pappas, L.; Boucher, K.; Provenzale, D. et al. (2014): “Characteristics of missed or interval colorectal cancer and patient survival: a population-based study”. En: Gastroenterology, 146: 950-960.
- Hewett, D.G.; Kahi, C.J. y Rex, D.K. (2010): “Does colonoscopy work?”. En: J Natl Compr Canc Netw, 8: 67-77.
- Hewett, D.G.; Kahi, C.J. y Rex, D.K. (2010): “Efficacy and effectiveness of colonoscopy: how do we bridge the gap?”. En: Gastrointest Endosc Clin N Am, 20: 673-684.
- Le Clercq, C.M.; Bouwens, M.W.; Rondagh, E.J.; Bakker, C.M.; Keulen, E.T.; De Ridder, R.J. et al. (2014): “Post colonoscopy colorectal cancers are preventable: a population based study”. En: Gut, 63: 957-963.
- Pohl, H.; Srivastava, A.; Bensen, S.P.; Anderson, P.; Rothstein, R.I.; Gordon, S.R. et al. (2013): “Incomplete polyp resection during colonoscopy: results of the Complete Adenoma Resection (CARE) study”. En: Gastroenterology, 144: 74-80.
- Arain, M.A.; Sawhney, M.; Sheikh, S.; Anway, R. Thyagarajan, B.; Bond, J.H. et al. (2010): “CIMP status of interval colon cancers: another piece to the puzzle”. En: Am J Gastroenterol, 105: 1189-1195.
- Sawhney, M.S.; Farrar, W.D.; Gudiseva, S.; Nelson, D.B.; Lederle, F.A.; Rector, T.S. et al. (2006): “Microsatellite instability in interval colon cancers”. En: Gastroenterology, 131: 1700-1705.
- Leggett, B. y Whitehall, V. (2010): “Role of the serrated pathway in colorectal cancer pathogenesis”. En: Gastroenterology, 138: 2088-2100.
- Rosty, C.; Hewett, D.G.; Brown, I.S.; Leggett, B.A.; y Whitehall, V.L. (2013): “Serrated polyps of the large intestine: current understanding of diagnosis, pathogenesis, and clinical management”. En: J Gastroenterol, 48: 287-302.
- Pullens, H.J. y Siersema, P.D. (2014): “Quality indicators for colonoscopy: current insights and caveats”. En: World Journal of Gastrointestinal Endoscopy, 6 (12): 571-583.
- Rex, D.K.; Cutler, C.S.; Lemmel, G.T.; Rahmani, E.Y.; Clark, D.W. y Helper, D.J. (1997): “Colonoscopic miss rates of adenomas determined by back-to-back colonoscopies”. En: Gastroenterol. 112(1): 24-28.
- Barclay, R.L.; Vicari, J.J.; Doughty, A.S.; Johanson, J.F. y Greenlaw, R.L. (2006): “Colonoscopic withdrawal times and adenoma detection during screening colonoscopy”. En: N Engl J Med, 355: 2533-2541.
- Kahi, C.J.; Hewett, D.G.; Norton, D.L.; Eckert, G.J. y Rex, D.K. (2011): “Prevalence and variable detection of proximal colon serrated polyps during screening colonoscopy”. En: Clin Gastroenterol Hepatol, 9: 42-46.
- Hetzel, J.T.; Huang, C.S.; Coukos, J.A.; Omstead, K.; Corda, S.R.; Yang, S. et al. (2010): “Variation in the detection of serrated polyps in an average risk colorectal cancer screening cohort”. En: Am J Gastroenterol, 105: 2656-2664.
- Kaminski, M.F.; Regula, J.; Kraszewska, E.; Polkowski, M.; Wojciechowska, U.; Didkowska, J. et al. (2010): “Quality indicators for colonoscopy and the risk of interval cancer”. En: N Engl J Med, 362: 1795-1803.
- Corley, D.A.; Jensen, C.D.; Marks, A.R.; Zhao, W.K.; Lee, J.K.; Doubeni, C.A. et al. (2014): “Adenoma detection rate and risk of colorectal cancer and death”. En: N Engl J Med, 370: 1298-1306.
- Van Rijn, J.C.; Reitsma, J.B.; Stoker, J. et al. (2006): “Polyp miss rate determined by tándem colonoscopy: a systematic review”. En: Am J Gastroenterol, 101: 343-350.
- Brenner, H.; Altenhofen, L.; Kretschmann, J. et al. (2015): “Trends in Adenoma Detection Rates during the First 10 Years of the German Screening Colonoscopy Program”. En: Gastroenterology, 149 (2): 356-366.
- Ko, B.M. (2014): “Colon cancer screening with image-enhanced endoscopy”. En: Clinical Endoscopy, 47: 504-508.
- Sharma, P.; Gupta, N.; Kuipers, E.J. et al. (2014): “Advanced imaging in colonoscopy and its impact on quality”. En: Gastrointestinal Endoscopy, 79: 28-36.
- Hazewinkel, Y. y Dekker, E. (2011): “Colonoscopy: basic principles and novel techniques”. En: Nature Reviews Gastroenterology and Hepatology, 8: 554-564.
- Jover, R.; Zapater, P.; Polania, E. et al. (2013): “Modifiable endoscopic factors that influence the adenoma detection rate in colorectal cancer screening colonoscopies”. En: Gastrointest Endosc, 77: 381-389.
- Lieberman, D.A. (2008): “Nonpolypoid colorectal neoplasia in the United States: the parachute is open”. En: JAMA, 299 (9): 1068-1069.
- Robertson, D.J.; Greenberg, E.R.; Beach, M. et al. (2005): “Colorectal cancer in patients under close colonoscopic surveillance”. En: Gastroenterology, 129 (1): 34-41.
- Heresbach, D.; Barrioz, T.; Lapalus, M.G. et al. (2008): “Miss rate for colorectal neoplastic polyps: a prospective multicenter study of back-to-back video colonoscopies”. En: Endoscopy, 40 (4): 284-290.
- Rex, D.K. (2006): “Maximizing detection of adenomas and cancers during colonoscopy”. En: Am J Gastroenterol, 101: 2866-2877.
- American Society for Gastrointestinal Endoscopy Technology Committee (2011): “Devices to improve colon polyp detection”. En: Gastrointest Endosc, 73: 1092-1097.
- Subramanian, V.; Mannath, J.; Hawkey, C.J. et al. (2011): “High definition colonoscopy vs. standard video endoscopy for the detection of colonic polyps: a meta-analysis”. En: Endoscopy, 43 (6): 499-505.
- Rex, D.K.; Petrini, J.L.; Baron, T.H. et al. (200): “Quality indicators for colonoscopy”. En: Am J Gastroenterol, 101: 873-885.
- Mysliwiec, P.A.; Brown, M.L.; Klabunde, C.N. y Ransohoff, D.F. (2004): “Are physicians doing too much colonoscopy? A national survey of colorectal surveillance after polypectomy”. En: Ann Intern Med, 141: 264-271.
- Bampton, P.A.; Sandford, J.J. y Young, G.P. (2007): “Achieving long-term compliance with colonoscopic surveillance guidelines for patients at increased risk of colorectalcancer in Australia”. En: Int J Clin Pract, 61: 510-513.
- Siersema, P.D.; Rastogi, A.; Leufkens, A.M. et al. (2012): “Retrogradeviewing device improves adenoma detection rate in colonoscopies for surveillance and diagnostic workup”. En: World Journal of Gastroenterology, 18: 3400-3408.
- Leufkens, A.M.; DeMarco, D.C.; Rastogi, A. et al. (2011): “Effect of a retrograde-viewing device on adenoma detection rate during colonoscopy: the TERRACE study”. En: Gastrointestinal Endoscopy, 73: 480-489.
- Mamula, P.; Tierney, W.M.; Banerjee, S. et al. (2011): “Devices to improve colon polyp detection”. En: Gastrointestinal Endoscopy, 73: 1092-1097.
- Hewett, D.G. y Rex, D.K. (2010): “Improving colonoscopy quality through health-care payment reform”. En: Am J Gastroenterol, 105: 1925-1933.
- Sovich, J.L.; Sartor, Z. y Misra, S. (2015): “Review Article Developments in Screening Tests and Strategies for Colorectal Cancer”. En: Bio Med Research International, Volumen 2015, ID 326728, http://dx.doi.org/10.1155/2015/326728.
- Kahi, C.J.; Ballard, D.; Shah, A.S.; Mears, R. y Johnson, C.S. (2013): “Impact of a quarterly report card on colonoscopy quality measures”. En: Gastrointest Endosc, 77: 925-931.
- Rex, D.K.; Hewett, D.G.; Raghavendra, M. y Chalasani, N. (2010): “The impact of videorecording on the quality of colonoscopy performance: a pilot study”. En: Am J Gastrenterol, 105: 2312-2317.
- Rex, D.K. (2011): “Can we fix colonoscopy? Yes!”. En: Gastroenterology, 140: 19-21.
- Stoop, E.M.; De Haan, M.C.; De Wijkerslooth, T.R. et al. “Participation and yield of colonoscopy versus non-cathartic CT colonography in population-based screening for colorectal cancer: a randomised controlled trial”. En: Lancet Oncol. 13(1): 55-64.
- Cheng, T.I.; Wong, J.M.; Hong, C.F. et al. “Colorectal cancer screening in asymptomatic adults: comparison of colonoscopy, sigmoidoscopy and fecal occult blood tests”. En: J Formos Med Assoc., 101(10): 685-690.
- Johnson, C.D.; Chen, M.H.; Toledano, A.Y. et al. (2008): “Accuracy of CT colonography for detection of large adenomas and cancers”. En: N Engl J Med., 359(12): 1207-1217.
- Zalis, M.E.; Blake, M.A.; Cai, W. et al. (2012): “Diagnostic accuracy of laxative-free computed tomographic colonography for detection of adenomatous polyps in asymptomatic adults: a prospective evaluation”. En: Ann Intern Med., 156(10): 692-702.
- Bair, D.; Pham, J.; Seaton, M.B.; Arya, N.; Pryce, M. y Seaton, T.L. (2009): “The quality of screening colonoscopies in an office-based endoscopy clinic”. En: Can J Gastroenterol. 23(1): 41-47.
- Berhane, C. y Denning, D. (2009): “Incidental finding of colorectal cancer in screening colonoscopy and its cost effectiveness”. En: Am Surg., 75(8): 699-703.
- Bokemeyer, B.; Bock, H. Hüppe, D. et al. (2009): “Screening colonoscopy for colorectal cancer prevention: results from a German online registry on 269000 cases”. En: Eur J Gastroenterol Hepatol., 21(6): 650-655.
- Castro, G.; Azrak, M.F.; Seeff, L.C. y Royalty, J. (2013): “Outpatient colonoscopy complications in the CDC’s Colorectal Cancer Screening Demonstration Program: a prospective analysis”. En: Cancer, 119(suppl 15): 2849-2854.
- Cotterill, M.; Gasparelli, R. y Kirby, E. (2005): “Colorectal cancer detection in a rural community: development of a colonoscopy screening program”. En: Can Fam Physician, 51: 1224-1228.
- Crispin, A.; Birkner, B.; Munte, A.; Nusko, G. y Mansmann, U. (2009): “Process quality and incidence of acute complications in a series of more than 230,000 outpatient colonoscopies”. En: Endoscopy, 41(12): 1018-1025.
- Ferlitsch, M.; Reinhart, K.; Pramhas, S. et al. (2011): “Sex-specific prevalence of adenomas, advanced adenomas, and colorectal cancer in individuals undergoing screening colonoscopy”. En: JAMA, 306(12): 1352-1358.
- Kim, J.S.; Kim, B.W.; Kim, J.I. et al. (2013): “Endoscopic clip closure versus surgery for the treatment of iatrogenic colon perforations developed during diagnostic colonoscopy: a review of 115,285 patients”. En: Surg Endosc., 27(2): 501-504.
- Levin, T.R.; Zhao, W.; Conell, C. et al. (2006): “Complications of colonoscopy in an integrated health care delivery system”. En: Ann Intern Med., 145(12): 880-886.
- Nelson, D.B.; McQuaid, K.R.; Bond, J.H.; Lieberman, D.A.; Weiss, D.G. y Johnston, T.K. (2002): “Procedural success and complications of large-scale screening colonoscopy”. En: Gastrointest Endosc., 55(3): 307-314.
- Pox, C.P.; Altenhofen, L.; Brenner, H.; Theilmeier, A.; Von Stillfried, D. y Schmiegel, W. (2012): “Efficacy of a nationwide screening colonoscopy program for colorectal cancer”. En: Gastroenterology, 142(7): 1460-1467.
- Rutter, C.M.; Johnson, E.; Miglioretti, D.L.; Mandelson, M.T.; Inadomi, J. y Buist, D.S. (2012): “Adverse events after screening and follow-up colonoscopy”. En: Cancer Causes Control. 23(2): 289-296.
- Stock, C.; Ihle, P.; Sieg, A.; Schubert, I.; Hoffmeister, M. y Brenner, H. (2013): “Adverse events requiring hospitalization within 30 days after outpatient screening and nonscreening colonoscopies”. En: Gastrointest Endosc., 77(3): 419-429.
- Strul, H.; Kariv, R.; Leshno, M. et al. (2006): “The prevalence rate and anatomic location of colorectal adenoma and cancer detected by colonoscopy in average-risk individuals aged 40-80 years”. En: Am J Gastroenterol. 101(2): 255-262.
- Xirasagar, S.; Hurley, T.G.; Sros, L.; Hebert, J.R. (2010): “Quality and safety of screening colonoscopies performed by primary care physicians with standby specialist support”. En: Med Care, 48(8): 703-709.
- Zafar, H.M.; Harhay, M.O.; Yang, J.; Armstron, K. (2014): “Adverse events following computed tomographic colonography compared to optical colonoscopy in the elderly”. En: Prev Med Rep., 1: 3-8.
- Ko, C.W.; Riffle, S.; Michaels, L. et al. (2010): “Serious complications within 30 days of screening and surveillance colonoscopy are uncommon”. En: Clin Gastroenterol Hepatol., 8(2): 166-173.
- Suissa, A.; Bentur, O.S.; Lachter, J. et al. (2012): “Outcome and complications of colonoscopy: a prospective multicenter study in northern Israel”. En: Diagn Ther Endosc., 2012: 612542.
- Loffeld, R.J.; Engel, A. y Dekkers, P.E. (2011): “Incidence and causes of colonoscopic perforations: a single-center case series”. En: Endoscopy, 43(3): 240-242.
- Rathgaber, S.W. y Wick, T.M. (2006): “Colonoscopy completion and complication rates in a community gastroenterology practice”. En: Gastrointest Endosc., 64(4): 556-562.
- Sieg, A.; Hachmoeller-Eisenbach, U. y Eisenbach, T. (2001): “Prospective evaluation of complications in outpatient GI endoscopy: a survey among German gastroenterologists”. En: Gastrointest Endosc., 53(6): 620-627.
- Singh, H.; Penfold, R.B.; DeCoster, C. et al. (2009): “Colonoscopy and its complications across a Canadian regional health authority”. En: Gastrointest Endosc., 69(3 pt 2): 665-671.
- Rabeneck, L.; Paszat, L.F.; Hilsden, R.J. et al. (2008): “Bleeding and perforation after outpatient colonoscopy and their risk factors in usual clinical practice”. En: Gastroenterology, 135: 1899-1906.
- Warren, J.L.; Klabunde, C.N.; Mariotto, A.B. et al. (2009): “Adverse events after outpatient colonoscopy in the Medicare population”. En: Ann Intern Med, 150: 849-857.
- Lee, J.K.; Levin, T.R. y Corley, D.A. (2013): “The road ahead: what if gastroenterologists were accountable for preventing colorectal cancer?”. En: Clin Gastroenterol Hepatol, 11: 204-207.
- Mysliwiec, P.A.; Brown, M.L.; Klabunde, C.N. y Ransohoff, D.F. (2004): “Are physicians doing too much colonoscopy? A national survey of colorectal surveillance after polypectomy”. En: Ann Intern Med, 141: 264-271.
- Bampton, P.A.; Sandford, J.J. y Young, G.P. (2002): “Applying evidence-based guidelines improves use of colonoscopy resources in patients with a moderate risk of colorectal neoplasia”. En: Med J Aust, 176: 155-157.
- Bampton, P.A.; Sandford, J.J. y Young, G.P. (2007): “Achieving long-term compliance with colonoscopic surveillance guidelines for patients at increased risk of colorectal cancer in Australia”. En: Int J Clin Pract, 61: 510-513.
- Kaminski, M.; Polkowski, M.; Kraszewska, E.; Rupinski, M.; Butruk, E. y Regula, J. (2014): “A score to estimate the likelihood of detecting advanced colorectal neoplasia at colonoscopy”. En: Gut, 63: 1112–1119.
- Ma, G. y Ladabaum, U. (2014): “Personalizing colorectal cancer screening: a systematic review of models to predict risk of colorectal neoplasia”. En: Clin Gastroenterol Hepatol, 12: 1624-1634.
- Wong, M.; Lam, T.; Tsoi, K.; Chan, V.; Hirai, H.; Ching, J. et al. (2014): “Predictors of Advanced colorectal neoplasia for colorectal cancer screening”. En: Am J Prev Med, 46: 433-439.
- Imperiale, T.F.; Monahan, P.O.; Stump, T.E. et al. (2015): “Derivation and validation of a scoring system to stratify the risk of advanced colorectal neoplasia in asymptomatic adults”. En: Ann Intern Med., 163(5): 339-346.
- Abuli, A.; Bessa, X.; Gonzalez, J.; Ruiz-Ponte, C.; Caceres, A.; Muñoz, J. et al. (2010): “Susceptibility genetic variants associated with colorectal cancer risk correlate with cancer phenotype”. En: Gastroenterology, 139: 788-796.
- Dunlop, M.; Tenesa, A.; Farrington, S. et al. (2013): “Cumulative impact of common genetic variants and other risk factors on colorectal cancer risk in 42,103 individuals”. En: Gut, 62: 871-881.
- Ferrucci, J.T. (2001): “Colon cancer screening with virtual colonoscopy: promise, polyps, politics”. En: AJR Am J Roentgenol, 177 (5): 975-988.
- Johnson, C.D. (2009): “CT Colonography: Coming of Age”. En: AJR, 193: 1239-1242.
- McFarland, E.; Fletcher, J.; Pickhardt, P. et al. (2009): “ACR Colon Cancer Committee White Paper: Status of CT Colonography”. En: J Am Coll Radiol., 6 (11): 756-772.
- Yee, J.; Rosen, M.; Blake, M. et al. (2010): “ACR Appropriateness Criteria® on Colorectal Cancer Screening”. En: J Am Coll Radiol, 7 (9): 670-678.
- Copel, L.; Sosna, J.; Kruskal, J.B.; Raptopoulos, V.; Farrell, R.J.; Morrin, M.M. (2007): “CT colonography in 546 patients with incomplete colonoscopy”. En: Radiology, 244: 471-478.
- Yucel, C.; Lev-Toaff, A.S.; Moussa, N.; Durrani, H. (2008): “CT colonography for incomplete or contraindicated optical colonoscopy in older patients”. En: Am J Roentgenol. 190: 145-150.
- Halligan, S.; Wooldrage, K.; Dadswell, E. et al. (2013): “Computed tomographic colonography versus barium enema for diagnosis of colorectal cancer or large polyps in symptomatic patients (SIGGAR): A multicenter randomized trial”. En: Lancet, 381: 1185-1193.
- Neerincx, M.; Terhaar Sive Droste, J.S.; Mulder, C.J. et al. (2010): “Colonic work-up after incomplete colonoscopy: significant new findings during followup”. En: Endoscopy, 42: 730-735.
- Cheng, R.W.; Chiu, Y.C.; Wu, K.L. et al. (2015): “Predictive factors for inadequate colon preparation before colonoscopy”. En: Tech Coloproctol, 19: 111-115.
- Pullens, H.J.; Van Leeuwen, M.S.; Laheij, R.J.; Vleggaar, F.P.; Siersema, P.D. (2013): “CT-colonography after incomplete colonoscopy: what is the diagnostic yield?”. En: Dis Colon Rectum, 56: 593-599.
- Kim, B.; Park, S.H.; Pickhardt, P.J. et al. (2014): “Adenomatous neoplasia: postsurgical incidence after normal preoperative CT colonography findings in the colon proximal to an occlusive cancer”. En: Radiology, 273: 99-107.
- Brenner, D.J. y Georgsson, M.A. (2005): “Mass screening with CT colonography: should the radiation exposure be of concern?”. En: Gastroenterology, 129: 328-337.
- Bellows, C.; Gagliardi, G. y Bacigalupo, L. (2015): “Review of Computed Tomographic Colonography from a Surgeon’s Perspective”. En: J Gastrointestin Liver Dis, 24(2): 215-223.
- Fletcher, J.G.; Silva, A.C.; Fidler, J.L. et al. “Noncathartic CT colonography: image quality assessment and performance and in a screening cohort”. En: AJR Am J Roentgenol. 201(4): 787-794.
- Johnson, C.D.; Fletcher, J.G.; MacCarty, R.L. et al. (2007): “Effect of slice thickness and primary 2D versus 3D virtual dissection on colorectal lesion detection at CT colonography in 452 asymptomatic adults”. En: AJR Am J Roentgenol. 189(3): 672-680.
- Kim, Y.S.; Kim, N.; Kim, S.H. et al. (2008): “The efficacy of intravenous contrast-enhanced 16-raw multidetector CT colonography for detecting patients with colorectal polyps in an asymptomatic population in Korea”. En: J Clin Gastroenterol., 42(7): 791-798.
- Lefere, P.; Silva, C.; Gryspeerdt, S. et al. (2013): “Teleradiology based CT colonography to screen a population group of a remote island; at average risk for colorectal cancer”. En: Eur J Radiol., 82(6): e262-e267.
- Macari, M.; Bini, E.J.; Jacobs, S.L. et al. (2004): “Colorectal polyps and cancers in asymptomatic average-risk patients: evaluation with CT colonography”. En: Radiology, 230(3): 629-636.
- Pickhardt, P.J.; Choi, J.R.; Hwang, I. et al. (2003): “Computed tomographic virtual colonoscopy to screen for colorectal neoplasia in asymptomatic adults”. En: N Engl J Med., 349(23): 2191-2200.
- Kim, D.H.; Pickhardt, P.J.; Taylor, A.J. et al. (2007): “CT colonography versus colonoscopy for the detection of advanced neoplasia”. En: N Engl J Med, vol. 357: 1403-1412.
- Regge, D.; Laudi, C.; Galatola, G. et al. (2009): “Diagnostic accuracy of computed tomographic colonography for the detection of advanced neoplasia in individuals at increased risk of colorectal cancer”. En: JAMA, 301 (23): 2453-2461.
- Fini, L.; Laghi, L.; Hassan, C. et al. (2014): “Noncathartic CT colonography to screen for colorectal neoplasia in subjects with a family history of colorectal cancer”. En: Radiology, 270: 784-790.
- MacCarty, R.L.; Johnson, C.D.; Fletcher, J.G. y Wilson, L.A. (2006): “Occult colorrectal polyps on CT colonography: implications for surveillance”. En: AJR Am J Roentgenol, 186: 1380-1383.
- Van Gelder, R.E.; Nio, C.Y.; Flor, I.E.J. et al. (2004): “Computed tomographic colonography compared with colonoscopy in patients at increased risk for colorectal cancer”. En: Gastroenterology, 127: 41-48.
- De Haan, M.C.; Van Gelder, R.E.; Graser, A.; Bipat, S. y Stoker, J. (2011): “Diagnostic value of CT- colonography as compared to colonoscopy in an asymptomatic screening population: a meta-analysis”. En: Eur Radiol, 21: 1747-1763.
- Badiani, S.; Hernandez, S.T.; Karandikar, S.; Roy-Choudhury, S. (2011): “CT colonography to exclude CRC in symptomatic patients”. En: Eur Radiol, 21: 2029-2038.
- Atkin, W.; Dadswell, E.; Wooldrage, K. et al. (2013): “Computed tomographic colonography versus colonoscopy for investigation of patients with symptoms suggestive of colorectal cancer (SIGGAR): A multicenter randomized trial”. En: Lancet, 381: 1194-1202.
- Arnesen, R.B.; Adamsen, S.; Svendsen, L.B.; Raaschou, H.O.; Von Benzon, E.; Hansen, O.H. (2005): “Missed lesions and false-positive findings on computed tomographic colonography: a controlled prospective analysis”. En: Endoscopy, 37: 937-944.
- Pickhardt, P.J.; Kim, D.H. y Robbins, J.B. (2010): “Flat (nonpolypoid) colorectal lesions identified at CT colonography in a U.S. screening population”. En: Acad Radiol, 17: 784-790.
- Kakugawa, Y.; Saito, Y.; Matsuda, T.; Nakajima, T.; Miyake, M. y Iinuma, G. (2013): “Colorectal laterally spreading tumors by computed tomographic colonography”. En: Int J Mol Sci, 14: 23629-23638.
- Togashi, K.; Utano, K.; Kijima, S. et al. (2014): “Laterally spreading tumors: limitations of computed tomography colonography”. En: World J Gastroenterol, 20: 17552-17557.
- Pooler, B.D.; Kim, D.H.; Hassan, C.; Rinaldi, A.; Burnside, E.S. y Pickhardt, P.J. (2013): “Variation in diagnostic performance among radiologists at screening CT colonography”. En: Radiology, 268: 127-134.
- Jensch, S.; De Vries, A.H.; Peringa, J.; Bipat, S.; Dekker, E.; Baak, L.C.; Bartelsman, J.F.; Heutinck, A.; Montauban Van Swijndregt, A.D. y Stoker, J. (2008): “CT colonography with limited bowel preparation: performance characteristics in an increased-risk population”. En: Radiology, 247(1): 122-132.
- Roberts-Thomson, I.C.; Tucker, G.R.; Hewett, P.J.; Cheung, P.; Sebben, R.A.; Khoo, E.E.; Marker, J.D. y Clapton, W.K. (2008): “Single-center study comparing computed tomography colonography with conventional colonoscopy”. En: World J.Gastroenterol, 14(3): 469-473.
- Benson, M.; Pier, J.; Kraft, S. et al. (2012): “Optical colonoscopy and virtual colonoscopy numbers after initiation of a CT colonography program: long term data”. En: J Gastrointestin Liver Dis, 21(4): 391-395.
- Stoop, E.M.; De Haan, M.C.; De Wijkerslooth, T.R. et al. (2012): “Participation and yield of colonoscopy versus non-cathartic CT colonography in population-based screening for colorectal cancer: A randomized controlled trial”. En: Lancet Oncol, 13: 55-64.
- An, S.; Lee, K.H.; Kim, Y.H. et al. (2008): “Screening CT colonography in an asymptomatic average-risk Asian population: a 2-year experience in a single institution”. En: AJR Am J Roentgenol. 191(3): W100-W106.
- Edwards, J.T.; Mendelson, R.M.; Fritschi, L. et al. (2004): “Colorectal neoplasia screening with CT colonography in average-risk asymptomatic subjects: community-based study”. En: Radiology, 230(2): 459-464.
- Multicentre Australian Colorectal-neoplasia Screening (MACS) Group (2006): “A comparison of colorectal neoplasia screening tests: a multicentre community-based study of the impact of consumer choice”. En: Med J Aust., 184(11): 546-550.
- Iannaccone, R.; Laghi, A.; Catalano, C. et al. (2004): “Computed tomographic colonography without cathartic preparation for the detection of colorectal polyps”. En: Gastroenterology, 127 (5): 1300-1311.
- Fletcher, R.H. y Pignone, M. (2008): “Extracolonic findings with computed tomographic colonography: asset or liability?”. En: Arch Intern Med, 168: 685-686.
- Zalis, M.E.; Barish, M.A.; Choi, J.R. et al. (2005): “CT colonography reporting and data system: a consensus proposal”. En: Radiology, 236 (1): 3-9.
- Pickhardt, P.J.; Kim, D.H.; Meiners, R.J. et al. (2010): “Colorectal and extracolonic cancers detected at screening CT colonography in 10,286 asymptomatic adults”. En: Radiology, 255(1): 83-88.
- ewari, V; Tewari D y Gress FG. (2013): “Computed Tomography Colonography for Colorectal Cancer Screening”. En: Gastroenterol Hepatol; 9(3): 158–163.
- Pickhardt, P.J. y Hanson, M.E. (2010): “Incidental adnexal masses detected at low-dose unenhanced CT in asymptomatic women age 50 and older: implications for clinical management and ovarian cancer screening”. En: Radiology, vol. 257: 144-150.
- Mulhall, B.P.; Veerappan, G.R. y Jackson, J.L. (2005): “Meta-analysis: computed tomographic colonography”. En: Ann Intern Med, 142 (8): 635-650.
- Cai, W.; Zhang, D.; Lee, J.G.; Shirai, Y.; Kim, S.H. y Yoshida, H. (2013): “Dualenergy index value of luminal air in fecal-tagging computed tomography colonography: Findings and impact on electronic cleansing”. En: J Comput Assist Tomogr, 37: 183-194.
- Yu, L.; Liu, X.; Leng, S. et al. (2009): “Radiation dose reduction in computed tomography: techniques and future perspective”. En: Imaging Med, 1: 65-84.
- Lubner, M.G.; Pickhardt, P.J.; Tang, J. y Chen, G.H. (2011): “Reduced image noise at low-dose multidetector CT of the abdomen with prior image constrained compressed sensing algorithm”. En: Radiology, 260: 248-256.
- Pendsé, D.A. y Taylor, S.A. (2013): “Complications of CT colonography: a review”. En: Eur J Radiol, 82: 1159-1165.
- De Haan, M.C.; Pickhardt, P.J. y Stoker, J. (2015): “CT colonography: accuracy, acceptance, safety and position in organised population screening”. En: Gut, 64(2): 342-350.
- Hassan, C.; Pickhardt, P.J.; Laghi, A. et al. (2008): “Computed tomographic colonography to screen for colorectal cancer, extracolonic cancer, and aortic aneurysm: model simulation with cost-effectiveness analysis”. En: Arch Intern Med, 168: 696-705.
- Vanness, D.J.; Knudsen, A.B.; Lansdorp-Vogelaar, I. et al. (2011): “Comparative economic evaluation of data from the ACRIN National CT Colonography Trial with three-cancer intervention and surveillance modeling network microsimulations”. En: Radiology, 261: 487-498.
- Lansdorp-Vogelaar, I.; Van Ballegooijen, M.; Zauber, A.G.; Boer, R.; Wilschut, J. y Habbema, J.D. (2009): “At what costs will screening with CT colonography be competitive? A cost-effectiveness approach”. En: Int J Cancer, 124: 1161-1168.
- Mamonov, A.V.; Figueiredo, I.N.; Figueiredo, P.N. y Tsai, Y.H. (2014): “Automated polyp detection in colon capsule endoscopy”. En: IEEE Trans Med Imaging, 33: 1488-1502.
- Spada, C.; Hassan, C.; Galmiche, J.P. et al. (2012): “Colon capsule endoscopy: European Society of Gastrointestinal Endoscopy (ESGE) guideline”. En: Endoscopy, 44(5): 527-536.
- Fireman, Z. y Kopelman, Y. (2007): “The colon - the latest terrain for capsule endoscopy”. En: Dig. Liver Dis, 39(10): 895-899.
- Tran, K. (2007): “Capsule colonoscopy: PillCam Colon, Issues Emerg”. En: Health Technol., 106: 1-4.
- Eliakim, R.; Yassin, K.; Niv, Y. et al. (2009): “Prospective multicenter performance evaluation of the second-generation colon capsule compared with colonoscopy”. En: Endoscopy, 41(12): 1026-1031.
- Gay, G.; Delvaux, M.; Frederic, M. y Fassler, I. (2010): “Could the Colonic Capsule PillCam Colon Be Clinically Useful for Selecting Patients Who Deserve a Complete Colonoscopy?: Results of Clinical Comparison With Colonoscopy in the Perspective of Colorectal Cancer Screening”. En: Am. J. Gastroenterol., 105(5): 1076-1086.
- Sieg, A.; Friedrich, K. y Sieg, U. (2009): “Is PillCam COLON capsule endoscopy ready for colorrectal cancer screening? A prospective feasibility study in a community gastroenterology practice”. En: Am. J. Gastroenterol, 104(4): 848-854.
- Van Gossum, A.; Muñoz-Navas, M.; Fernandez-Urien, I. et al. (2009): “Capsule endoscopy versus colonoscopy for the detection of polyps and cancer”. En: N. Engl. J. Med., 361(3): 264-270.
- Rokkas, T.; Papaxoinis, K.; Triantafyllou, K.; Ladas, S.D. (2010): “A meta-analysis evaluating the accuracy of colon capsule endoscopy in detecting colon polyps”. En: Gastrointest Endosc, 71(4): 792-798.
- Sacher-Huvelin, S.; Coron, E.; Gaudric, M. et al. (2010): “Colon capsule endoscopy vs. colonoscopy in patients at average or increased risk of colorectal cancer”. En: Aliment Pharmacol Ther, 32: 1145-1153.
- Rex, D.K.; Adler, S.N.; Aisenberg, J. et al. (2014): “Accuracy of capsule colonoscopy in detecting colorectal polyps in a screening population”. En: Gastroenterology, 148: 948-957.
- Rondonotti, E.; Borghi, C.; Mandelli, G. et al. (2014): “Accuracy of capsule colonoscopy and computed tomographic colonography in individuals with positive results from the fecal occult blood test”. En: Clin Gastroenterol Hepatol., 12: 1303-1310.
- Holleran, G.; Leen, R.; O’Morain, C. y McNamara, D. (2014): “Colon capsule endoscopy as possible filter test for colonoscopy selection in a screening population with positive fecal immunology”. En: Endoscopy, 46: 473-478.
- Spada, C.; Hassan, C.; Barbaro, B. et al. (2015): “Colon capsule versus CT colonography in patients with incomplete colonoscopy: a prospective, comparative trial”. En: Gut, 64(2): 272-281.
- Eliakim, R. y Adler, S.N. (2015): “Colon PillCam: Why Not Just Take a Pill?”. En: Dig Dis Sci, 60: 660-663.
- Spada, C.; Barbaro, F.; Andrisani, G. et al. (2014): “Colon capsule endoscopy: What we know and what we would like to know”. En: World J Gastroenterol, 20(45): 16948-16955.
- Spada, C.; Pasha, S.F.; Gross, S.A. et al. (2016): “Accuracy of First- and Second-Generation Colon Capsules in Endoscopic Detection of Colorectal Polyps: A Systematic Review and Meta-analysis”. En: Clin Gastroenterol Hepatol., S1542-3565 (16) 30151-3.
- Imperiale, T.J. (2012): “Noninvasive screening tests for colorrectal cancer”. En: Digestive Diseases, 30 (2): 16-26.
- Sovich, J.L.; Sartor, Z. y Misra, S. (2015): “Developments in Screening Tests and Strategies for Colorectal Cancer”. En: BioMed Research International, Article ID 326728, http://dx.doi.org/10.1155/2015/326728.
- Wild, N.; Andres, H.; Rollinger, W. et al. (2010): “A combination of serum markers for the early detection of colorectal cancer”. En: Clinical Cancer Research, 16 (24): 6111-6121.
- Esteller, M. (2008): “Epigenetics in cancer”. En: N Engl J Med, 358: 1148-1159.
- Mitchell, P.; Parkin, R.; Kroh, E.; Fritz, B.; Wyman, S.; Pogosova-Agadjanyan, E. et al. (2008): “Circulating MicroRNAs as stable blood-based markers for cancer detection”. En: Proc Natl Acad Sci U S A, 105: 10513-10518.
- Esquela-Kerscher, A. y Slack, F. (2006): “Oncomirs – microRNAs with a role in cancer”. En: Nat Rev Cancer, 6: 259-269.
- Giraldez, M.; Lozano, J.; Ramirez, G.; Hijona, E.; Bujanda, L.; Castells, A. et al. (2013): “Circulating microRNAs as biomarkers of colorectal cancer: results from a genome-wide profiling and validation study”. En: Clin Gastroenterol Hepatol, 11: 681-688.
- Mitchell, S.M.; Ross, J.P.; Drew, H.R. et al. (2014): “A panel of genes methylated with high frequency in colorectal cancer”. En: BMC Cancer, 14: 54. doi:10.1186/1471-2407-14-54.
- Grutzmann, R.; Molnar, B.; Pilarsky, C.; Habermann, J.; Schlag, P.; Saeger, H. et al. (2008): “Sensitive detection of colorectal cancer in peripheral blood by septin 9 DNA methylation assay”. En: PLoS ONE, 3: e3759.
- Li, M.; Chen, W.; Papadopoulos, N.; Goodman, S.; Bjerregaard, N.; Laurberg, S. et al. (2009): “Sensitive digital quantification of DNA methylation in clinical samples”. En: Nat Biotechnol, 27: 858-863.
- Lee, B.; Lee, E.; Jung, E.; Chun, H.; Chang, D.; Song, S. et al. (2009): “Aberrant methylation of APC, MGMt, RASSF2a, and WIF-1 genes in plasma as a biomarker for early detection of colorectal cancer”. En: Clin Cancer Res, 15: 6185-6191.
- DeVos, T.; Tetzner, R.; Model, F.; Weiss, G.; Schuster, M.; Distler, J. et al. (2009): “Circulating methylated SEPT9 DNA in Plasma is a biomarker for colorectal cancer”. En: Clin Chem, 55: 1337-1346.
- Cassinotti, E.; Melson, J.; Liggett, T.; Melnikov, A.;bYi, Q.; Replogle, C. et al. (2011): “DNA methylation patterns in blood of patients with colorectal cancer and adenomatous colorectal polyps”. En: Int J Cancer, 131: 1153-1157.
- Warren, J.; Xiong, W.; Bunker, A.; Vaughn, C.; Furtado, L.; Roberts, W. et al. (2011): “Septin 9 methylated DNA is a sensitive and specific blood test for colorectal cancer”. En: BMC Med, 9: 133.
- Pack, S.; Kim, H.; Lim, S.; Kim, H.; Ko, J.; Lee, K. et al. (2012): “Usefulness of Plasma epigenetic changes of five major genes involved in the pathogenesis of colorectal cancer”. En: Int J Colorectal Dis, 28: 139-147.
- Church, T.; Wandell, M.; Lofton-Day, C.; Mongin, S.; Burger, M.; Payne, S. et al. (2014): “Prospective evaluation of methylated SEPT9 in plasma for detection of asymptomatic colorectal cancer”. En: Gut, 63: 317-325.
- Johnson, D.A.; Barclay, R.L.; Mergener, K. et al. (2014): “Plasma Septin9 versus fecal immunochemical testing for colorectal cancer screening: a prospective multicenter study”. En: PLoS One, 9(6): e98238.
- Lu, J.; Getz, G.; Miska, E. et al. (2005): “MicroRNA expression profiles classify human cancers”. En: Nature, 435: 834-838.
- Calin, G. y Croce, C. (2006): “MicroRNA signatures in human cancers”. En: Nat Rev Cancer, 6: 857-866.
- Giraldez, M.; Lozano, J.; Ramirez, G.; Hijona, E.; Bujanda, L.; Castells, A. et al. (2013): “Circulating microRNAs as biomarkers of colorectal cancer: results from a genome-wide profiling and validation study”. En: Clin Gastroenterol Hepatol, 11: 681-688.
- Pedersen, S.; Symonds, E.; Baker, R. et al. (2015): “Evaluation of an assay for methylated BCAT1 and IKZF1 in plasma for detection of colorectal neoplasia”. En: BMC Cancer, 15: 654.
- Symonds, E.L.; Pedersen, S.K.; Baker, R.T. et al. (2016): “A Blood Test for Methylated BCAT1 and IKZF1 vs. a Fecal Immunochemical Test for Detection of Colorectal Neoplasia”. En: Clinical and Translational Gastroenterology, 7(1): e137. doi:10.1038/ctg.2015.67.
- Rodia, M.T.; Ugolini, G.; Mattei, G. et al. (2016): “Systematic large-scale meta-analysis identifies a panel of two mRNAs as blood biomarkers for colorectal cancer detection”. En: Oncotarget. doi: 10.18632/oncotarget.8108.
- Rengucci, C.; Maio, G.D.; Menghi, M. et al. (2014): “Improved Stool DNA Integrity Method for Early Colorectal Cancer Diagnosis”. En: Cancer epidemiology, biomarkers & prevention, 23: 2553-2560.
- Parikh, R.B. y Prasad, V. (2016): “Blood-Based Screening for Colon Cancer A Disruptive Innovation or Simply a Disruption?”. En: JAMA, 315(23): 2519-2520.
- Guyatt, G.; Gutterman, D.; Baumann, M.H.; Addrizzo-Harris, D.; Hylek, E.M.; Phillips, B.; Raskob, G.; Zelman Lewis, S.; Schunemann, H. (2006): “Grading Strength of Recommendations and Quality of Evidence in Clinical Guidelines. Report from an American College of Chest Physicians Task Force”. En: Chest, 129: 174-181.
- Imperiale, T.F. y Ransohoff, D.F. (2010): “Understanding Differences in the Guidelines for Colorectal Cancer Screening”. En: Gastroenterology, 138: 1642-1647.
- Guyatt, G.H.; Oxman, A.D.; Vist, G.E. et al. (2008): “GRADE: an emerging consensus on rating quality of evidence and strength of recommendations”. En: BMJ, 336: 924-926.
- Short, M.W.; Layton, M.C.; Teer, B.N. y Domagalski, J.E. (2015): “Colorectal Cancer Screening and Surveillance”. En: Am Fam Physician, 91(2): 93-100.
- Leddin, D.J.; Enns, R.; Hilsden, R. et al. (2010): “Canadian Association of Gastroenterology position statement on screening individuals at average risk for developing colorectal cancer 2010”. En: Can J Gastroenterol, 24(12): 705-714.
- Qaseem, A.; Denberg, T.D.; Hopkins, Jr. R.H. et al. (2012): “Screening for Colorectal Cancer: A Guidance Statement from the American College of Physicians”. En: Ann Intern Med., 156: 378-386.
- Wilt, T.J.; Harris, R.P.; Qaseem, A. et al. (2015): “Screening for Cancer: Advice for High-Value Care from the American College of Physicians”. En: Ann Intern Med., 162(10): 718-725.
- Brouwers, M.; Kho, M.E.; Browman, G.P. et al. (2010): “AGREE II: advancing guideline development, reporting and evaluation in health care”. En: CMAJ, 182(18): E839-E842.
- US Preventive Services Task Force. Screening for Colorectal Cancer (2008): “US Preventive Services Task Force Recommendation Statement”. En: Ann Intern Med., 149(9): 627-637.
- Canadian Task Force on Preventive Health Care (2016): “Guidelines: Recommendations on screening for colorectal cancer in primary care”. En: CMAJ, 188(5): 340-348.
- National Comprehensive Cancer Network (NCCN) (2016): “Clinical Practice Guidelines in Oncology. Colorectal Cancer Screening”. Versión I. Disponible on line en: <https://www.nccn.org/professionals/physician_gls/pdf/colorectal_screening.pdf>.
- Sung, J.J.; Ng, S.C.; Chang, F.K. et al. (2015): “An updated Asia Pacific Consensus Recommendations on colorectal cáncer screening”. En: Gut, 64: 121-132.
- Yeoh, K.G.; Ho, K.Y.; Chiu, H.M. et al. (2011): “The Asia-Pacific Colorectal Screening score: a validated tool that stratifies risk for colorectal advanced neoplasia in asymptomatic Asian subjects”. En: Gut, 60: 1236-1241.
- Knudsen, A.B.; Zauber, A.N.; Rutter, C.M. et al. (2016): “Estimation of Benefits, Burden, and Harms of Colorectal Cancer Screening Strategies Modeling Study for the US Preventive Services Task Force”. En: JAMA, 315(23): 2595-2609.
- Ransohoff, D.F. y Sox, H.C. (2016): “Clinical Practice Guidelines for Colorectal Cancer Screening New Recommendations and New Challenges”. En: JAMA, 315(23): 2529-2531.