Trasplante de Microbiota Fecal: Indicaciones, Metodología y Perspectivas Futuras
REV ARGENT COLOPROCT | 2015 | VOL. 26, Nº 4 : 225-234
REVISIÓN BIBLIOGRÁFICA
Trasplante de Microbiota Fecal: Indicaciones, Metodología y Perspectivas Futuras
Enrique Rodríguez de Santiago, Ana García García de Paredes, Carlos Ferre Aracil, Lara Aguilera Castro, Antonio López San Román
Servicio de Gastroenterología del Hospital Universitario Ramón y Cajal. Hospital Universitario Ramón y Cajal.
Ctra. de Colmenar Viejo Km 9.100. Madrid. 28034. España
Enrique Rodríguez de Santiago
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
RESUMEN
La microbiota intestinal se define como el conjunto de microorganismos que habitan de forma natural en el tubo digestivo. Bacterias, hongos y virus se incluyen dentro de este ente fisiológico que va mucho más allá de ser un mero espectador pasivo de la mucosa intestinal. La microbiota interviene de forma activa en la homeostasis y su desregulación se ha relacionado con múltiples enfermedades de naturaleza infecciosa, metabólica y autoinmunitaria. El trasplante de microbiota fecal (TMF) consiste en la introducción de una solución de materia fecal debidamente procesada procedente de un donante sano en el tracto gastrointestinal de otro individuo con el fin de manipular las características de la microbiota del receptor. Aunque pueda parecer algo novedoso, los primeros casos se remontan a la época de la China Imperial; no obstante, no ha sido hasta los últimos 20 años cuando el interés y la actividad investigadora en este campo se han multiplicado de forma exponencial. Fruto de este trabajo el TMF constituye hoy en día una herramienta eficaz y validada en casos refractarios de diarrea por C. Difficile. Aunque la evidencia científica es menor, ya existen ensayos clínicos que evalúan su beneficio en la enfermedad inflamatoria intestinal y en el síndrome metabólico. Lo atractivo de su mecanismo fisiopatológico, la sencillez del procedimiento y su bajo coste lo sitúan como un tratamiento prometedor en múltiples enfermedades extradigestivas. El objetivo de esta revisión es resumir de una forma concisa, rigurosa y actualizada las indicaciones, metodología y seguridad del TMF.
Palabras Claves: Heces; Microbiota; Transplante; Clostridium Difficile; Enfermedad Inflamatoria Intestinal; Colitis; Enfermedad de Crohn; EII; Colon Irritable
SUMMARY
The intestinal microbiota is defined as the set of organisms that live in the digestive tract. Bacteria, fungi and viruses are included in a physiological entity that goes far beyond being a passive spectator of the intestinal mucosa. The microbiota is actively involved in homeostasis and its imbalance has been linked to multiple infectious, metabolic and autoimmune diseases. Fecal microbiota transplantation (FMT) consists in the introduction of a solution made with processed stool from a healthy donor into the gastrointestinal tract of another individual in order to manipulate the characteristics of the receiver microbiota. Although it may seem new, the first cases date back to the days of Imperial China; however, it was not until the past 20 years when the interest and research in this field have grown exponentially. Nowadays, TMF is an effective and validated treatment in refractory cases of C.difficile diarrhea. Although the scientific evidence is less, there are clinical trials evaluating its benefit in inflammatory bowel disease and metabolic syndrome. The appeal of its pathophysiological mechanism, the simplicity of the procedure and its low cost place FMT as a promising treatment for multiple extraintestinal diseases. The objective of this review is to summarize in a concise, thorough and updated form its indications, methodology and safety.
Key words: Fecal; Microbiota; Transplantation; Clostridium Difficile; Inflammatory Bowel Disease; IBD; Colitis; Crohn’s; Irritable Bowel
INTRODUCCIÓN
La historia de la terapéutica está llena de ejemplos en los que ha sido necesario romper con ideas establecidas para encontrar medios de tratamiento nuevos, cuya simplicidad parece a veces obvia a posteriori. Algunos ejemplos pueden ser la colocación de TIPS en la hipertensión portal o la erradicación de Helicobacter pylori en la enfermedad péptica. En esta revisión, presentamos a los lectores un procedimiento de raíces antiguas, pero que se encuentra ahora mismo en el centro del interés de una buena parte de la comunidad de gastroenterólogos: el trasplante de microbiota fecal (TMF). El concepto rompe con la consideración intuitiva de las bacterias como elementos siempre dañinos y presta atención a la que probablemente es la más humilde y denostada de las excretas del cuerpo humano: las heces. La sorpresa y a veces la jocosidad con la que el procedimiento se recibe en ocasiones, se ven contestadas por su alta eficacia y por el número de pacientes a los que ha ayudado, que se puede ya cifrar en miles. Más aún, el TMF abre las puertas a una línea económicamente accesible de investigación en otras enfermedades del ser humano, tanto digestivas como extradigestivas. Nuestro interés por el procedimiento es reciente, y nuestra experiencia aún corta. Sin embargo, el tiempo de estudio y reflexión empleado en la puesta en marcha de nuestro programa (que creemos es el único que en España cuenta con una estructura estable), puede ser de utilidad a otros compañeros, y es esto lo que nos mueve a escribir esta revisión.
PERSPECTIVA HISTÓRICA DE LA MANIPULACIÓN TERAPÉUTICA DE LA MICROBIOTA INTESTINAL
La manipulación de la microbiota intestinal no es una novedad en la historia de la medicina. Los primeros ejemplos provienen de la medicina veterinaria: Fabricio di Aquapendente en el siglo XVII ya describe la ingesta de heces para aliviar ciertos padecimientos intestinales del ganado rumiante.1 En la medicina humana encontramos ejemplos desde la época Imperial de China, donde los médicos de entonces utilizaban diferentes preparados y suspensiones de material fecal para tratar todo tipo de padecimientos gastrointestinales como dispepsia, estreñimiento, diarrea o dolor abdominal.2
Ya en el siglo XX encontramos referencias de los consejos dados por los beduinos del desierto norteafricano a los soldados de la Segunda Guerra Mundial en cuanto a la ingesta de heces de dromedarios para tratar la disentería que frecuentemente padecían los combatientes. La primera publicación relevante en la Medicina moderna la encontramos hace casi sesenta años en el trabajo seminal de Eiseman y col. en donde se describe una serie de casos de colitis fulminante por C. difficile tratados mediante enemas fecales de retención, con una alta tasa de éxito y escasos efectos adversos asociados.3 A partir de este momento, el interés por el TMF decae durante las sucesivas décadas hasta los nuevos trabajos que han reabierto el entusiasmo en torno a esta "transgresora" modalidad terapéutica que promete un futuro, cuanto menos, interesante y fructífero.
Cada vez son más los centros en todo el mundo que ofrecen la bacterioterapia fecal entre su cartera de servicios. En el Center for Digestive Diseases de Nueva Gales del Sur (Australia), dirigido por el Dr. Thomas Borody, se concentra la mayoría de los casos realizados hasta la fecha.4 La aceptación por parte de los pacientes es en general buena e incluso muchos de ellos aparecen por nuestras consultas demandando información a los especialistas en patología digestiva sobre estos tratamientos; todo ello queda reflejado en la explosión de información no especializada que puede encontrarse en los medios de comunicación o en internet.
MICROBIOTA INTESTINAL: CONCEPTO, COMPOSICIÓN, FUNCIONES Y PAPEL EN LA FISIOLOGÍA HUMANA
La microbiota se define como el conjunto de microorganismos de todo tipo (bacterias, bacteriófagos, archeas, hongos e incluso virus) que viven de forma fisiológica en las superficies de nuestro organismo y sus diferentes tractos (respiratorio superior, digestivo, genitourinario y piel y otras mucosas). De todas estas localizaciones, el tracto gastrointestinal supone el reservorio más complejo en el organismo de elementos de la microbiota. Para que el lector se haga una idea de su complejidad e importancia, éstos son algunos datos referentes a la microbiota intestinal:
- Supone, aproximadamente, un kilogramo de peso de un adulto sano.5
- Las células de la microbiota son más numerosas que las células del huésped sobre el que viven.
- Se calcula que los genes albergados en la microbiota son 150 veces más numerosos que los del propio genoma humano.6
- La microbiota intestinal interviene en incontables funciones fisiológicas y homeostáticas. Tan sólo estamos empezando a vislumbrar la magnitud de su contribución al correcto funcionamiento del cuerpo humano.
La densidad microbiana va aumentando progresivamente a lo largo del tracto gastrointestinal humano, siendo los segmentos más proximales regiones relativamente libres de microorganismos (103 células por mililitro) y constituyendo el colon la región donde encontramos la mayor densidad y variedad de microorganismos (1012 células por mililitro).7 En términos de composición bacteriana, en la microbiota de un individuo sano existe una importante diversidad microbiana, predominando los phyla Firmicutes y Bacteriodetes, seguidos bastante lejos por miembros de los phyla Actinobacteria y Verrucomicrobia.
Para intentar sistematizar su estudio y comprensión se han descrito 3 enterotipos principales en adultos sanos. En el primero predominan las bacterias del género Bacteroides, en el segundo las del género Prevotella y en el tercero existe una alta proporción del género Ruminococcus. Estos enterotipos poseen distintas capacidades metabólicas y parecen ser independientes del sexo o de la edad del huésped; sin embargo, se ha observado que determinados tipos de dietas pueden contribuir a largo plazo al desarrollo de algún enterotipo concreto.8
- La multitud de funciones en las que interviene la microbiota intestinal requeriría una descripción detallada que excede los propósitos de esta revisión, Algunas de estas funciones son:
- Metabolismo intermediario: Los microorganismos intestinales proporcionan funciones metabólicas adicionales que el propio huésped no podría llevar a cabo sin ellos.
- Metabolismo energético: diferentes tipos de microbiomas se han relacionado con el desarrollo de alteraciones metabólicas como la obesidad, diabetes o síndrome metabólico.9
- Desarrollo inmunológico y del epitelio intestinal.
- Desarrollo neurológico (eje intestino-cerebro): Cada vez se le concede mayor importancia a la interrelación que se establece entre el Sistema Nervioso Central y el tracto gastrointestinal vía sistema nervioso entérico, nervio vago y neurotransmisor de producción digestiva.
PROCEDIMIENTO
A día de hoy no existe un protocolo estandarizado y validado para el TMF. A continuación revisaremos distintos aspectos controvertidos relacionados con la preparación del donante y receptor, la suspensión fecal y su administración.
El donante y receptor de microbiota
Debido a la falta de estandarización de la selección y el cribado del donante en el TMF, los criterios en cada estudio son variables.10
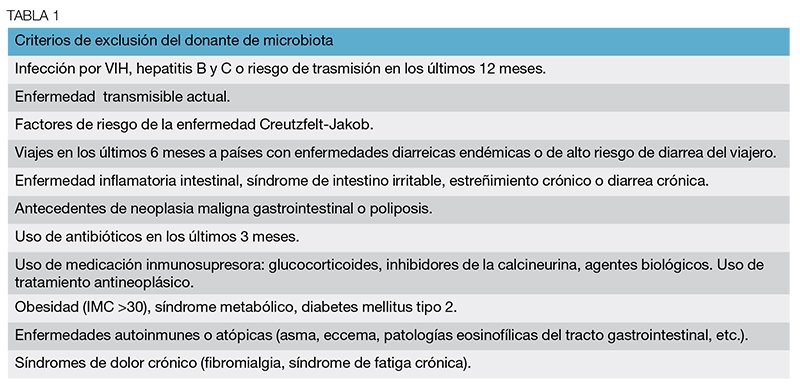
Los tipos de donantes pueden ser familiares del paciente; individuos con contacto íntimo con el paciente (marido, esposa o pareja) o voluntarios sanos sin relación con el receptor.11 Actualmente, se desconocen las características del donante ideal.12 En un estudio multicéntrico controlado se observó que la tasa de curación de infección por C. Difficile no estaba influenciada por la relación entre el receptor y el donante.13 Por otro lado, un ensayo reciente en colitis ulcerosa (CU) sugiere que la respuesta sí parece influenciada por el tipo de receptor.14 La entrevista con el donante es especialmente importante para identificar riesgos de enfermedades que puedan pasar desapercibidas por no tener pruebas diagnósticas específicas, ser éstas poco sensibles o no ser útiles en el periodo ventana. El cribado del donante antes del TMF es similar al requerido para un trasplante de órganos añadiendo un análisis exhaustivo en el de las heces del donante11 (Tablas 1 y 2). En algunos protocolos se han empleado laxantes osmóticos en la víspera de la donación.15,16
Las características de los pacientes receptores de TMF se evaluaron en una revisión sistemática realizada por Sha y colaboradores, la edad de los pacientes se situó entre 16 meses y 95 años.17 La mayoría de los estudios no especifican las comorbilidades del paciente ni si la infección por C. Difficile era adquirida en la comunidad o nosocomial.
Al margen de las diferentes indicaciones del TMF, los pacientes seleccionados para dicho tratamiento deben tener una esperanza de vida de al menos 3 meses. Muchos presentan comorbilidades que hay que considerar antes de realizar un TMF aunque no suelen llegar a contraindicar el procedimiento. Al igual que en el donante, no existe un consenso de los criterios de exclusión del receptor. En el estudio realizado por Van Nood y colaboradores se descartaron pacientes con inmunosupresión debida a quimioterapia reciente, infección por VIH con CD4 <240 o uso prolongado de prednisolona con dosis de al menos 60 mg diarios. Además, otras causas de exclusión fueron la gestación, el uso de antibióticos que no fuesen los propios del tratamiento por el C. Difficile, ingreso actual en una unidad de cuidados intensivos y el uso de drogas vasoactivas.18 Otros criterios de exclusión mencionados en la revisión de Bakken y colaboradores son la cirrosis hepática descompensada, trasplante reciente de médula ósea o uso de anti-TNF.15 Recientemente Kelly et al. han publicado un estudio retrospectivo que incluyó pacientes inmunocomprometidos (quimioterapia, trasplante de órganos sólidos, tratamiento con inmunosupresores y EII) sin encontrar complicaciones infecciosas atribuibles al TMF.19
Preparación del receptor
Algunos autores recomiendan la administración de soluciones evacuantes como el polietilenglicol el día previo a la realización del TMF, independientemente de la vía de administración elegida, siempre y cuando la situación clínica del paciente lo permita.20,21 Aunque el empleo de este tipo soluciones en la preparación del receptor no ha demostrado una mayor eficacia, su uso podría reducir la densidad de bacilos de C. Difficile e incluso de esporas inactivas.
Por otro lado, algunos protocolos han abogado por el uso de loperamida oral en dosis única o pauta múltiple (2 mg cada dos horas hasta un total de 8 mg) con el objetivo de facilitar la retención de la solución trasplantada.15 Otros autores no han empleado loperamida sin obtener por ello peores resultados.
Cuando se utiliza la vía nasogástrica o nasoyeyunal la mayoría de grupos de trabajo administran al receptor inhibidores de la bomba de protones la noche anterior y la mañana del procedimiento con el objetivo de atenuar un posible efecto negativo de la secreción ácida gástrica sobre la microbiota trasplantada.15
Otro aspecto controvertido lo constituye el uso de antibióticos en la infección por C. Difficile. Algunos investigadores no contemplan el uso de antibióticos a la hora de realizar TMF15 y otros administran vancomicina los días previos al procedimiento.18,22 ¿Si se administran, cuándo es el momento de suspenderlos? Hay autores que recomiendan suspender la antibioticoterapia entre 1 y 3 días antes del TMF.23 En un estudio recientemente publicado en infección grave/complicada por C. Difficile sin respuesta a tratamiento antibiótico se optó por reintroducir la vancomicina 24-48 horas tras el procedimiento si en la colonoscopia se objetivaban pseudomembranas, manteniéndola hasta la resolución de la infección durante un mínimo de cinco días.16

Preparación de las muestras
No disponemos de estudios controlados que evalúen la mejor forma de preparar de la suspensión fecal por lo que existe gran heterogeneidad en cuanto a la confección de las muestras.
Con respecto a las heces, la mayoría de los protocolos utilizan heces frescas conservadas en nevera y recomiendan que el tiempo transcurrido entre donación e infusión sea inferior a 24 horas y preferiblemente inferior a 6 horas.15 Hamilton et al. emplearon un crioprotector añadido a la suspensión fecal que permitía almacenarla congelada hasta 8 semanas, y obtuvieron resultados comparables en términos de eficacia a los de estudios que utilizan heces frescas, por lo que la microbiota no parece alterarse con la congelación.24 La congelación de las heces ofrece importantes ventajas como la eliminación del olor fecal y su mayor facilidad de uso. Se han empleado cantidades dispares de heces que oscilan entre 5 y 300 gramos.17 Se ha observado que en infección por C. Difficile el riesgo de recidiva puede ser hasta 4 veces mayor cuando se emplean menos de 50 gramos de heces.25
Se han utilizado distintas sustancias como el agua, la leche o el yogur como diluyentes, siendo el suero salino fisiológico el más comúnmente empleado.26 En infección recurrente por C. Difficile las soluciones preparadas con agua han presentado tasas de curación más elevadas (98,5%) que las que utilizan suero salino (86%) aunque el riesgo de recurrencia puede llegar a ser hasta dos veces mayor cuando se emplea agua que cuando se utiliza suero salino.26 El volumen empleado oscila entre 50 y 500 ml.24
Las heces y el diluyente deben homogeneizarse en una batidora y posteriormente se filtra la solución obtenida. El volumen de solución administrada varía entre 25 y 1500cc, objetivando mayor tasa de resolución de infección por C. Difficile a mayor volumen (97% con 500cc versus 80% con volúmenes inferiores a 200cc).26
Vías de administración
Para la administración de la solución se han empleado diversas vías. En una reciente revisión sistemática se recoge que en pacientes adultos la colonoscopia ha sido la vía más utilizada (42%) seguida de la nasogástrica (22,7%), los enemas (12,4%), la combinación de varias vías (11,8%) y la nasoyeyunal (2,5%).24
La vía digestiva alta ha demostrado su eficacia en estudios observacionales y en un estudio aleatorizado controlado en infección por C. Difficile.18 Asimismo, ha sido la escogida en un reciente ensayo clínico en CU.27 El posible rechazo por parte del receptor y el riesgo de aspiración constituyen sus principales desventajas.
Aunque podría pensarse que la administración por enemas podría ser menos efectiva por alcanzar solo hasta ángulo esplénico, numerosos casos publicados reflejan buenos resultados de esta vía en infección por C. Difficile tanto a nivel hospitalario como mediante autoinfusión en domicilio, constituyendo una vía eficaz, segura y barata.28,29 La colonoscopia permite la administración de la suspensión a lo largo de todo el colon e íleon terminal pero añade costes y riesgo de perforación especialmente en pacientes con infección grave por C. Difficile. Se han planteado diferentes formas de llevar a cabo la administración de la solución durante la colonoscopia, siendo una de las más utilizadas la instilación gradual cada 5-10 cm en retirada.30
No está establecida la vía óptima de administración. Recientemente se publicado un estudio que recoge 182 casos de infección recurrente por C. Difficile que objetivó una eficacia discretamente superior de la vía colonoscópica (95%) frente a la vía nasogástrica (85%) aunque sin alcanzar significación estadística.28 Por tanto, la ruta de administración deberá escogerse teniendo en cuenta la experiencia del centro y la situación clínica del paciente de forma que, por ejemplo, la presencia de íleo debe hacer obviar la vía alta.
Aproximadamente el 80% de los casos recogidos en la literatura han empleado una administración única que ha sido eficaz para curar la infección por C. Difficile.17 Otros pacientes han requerido varios procedimientos para lograr la resolución de la diarrea.31 No existe evidencia suficiente a día de hoy para establecer el número ni la frecuencia óptima de TMF necesarios para lograr el éxito terapéutico.
TMF EN CLOSTRIDIUM DIFFICILE: ESCENARIOS, EVIDENCIA Y RESULTADOS
La infección por C. Difficile puede producir desde un cuadro leve con diarrea acuosa hasta una colitis pseudomembranosa con perforación o shock. Su incidencia ha ido en aumento en los últimos años siendo una importante causa de diarrea nosocomial en nuestro medio.10 Los principales factores de riesgo para adquirir la infección son la edad avanzada, el uso de antibioterapia, la hospitalización, la inmunosupresión, las neoplasias y el uso de inhibidores de la bomba de protones.11-13,32 La base del tratamiento es la suspensión del tratamiento antibiótico que el paciente tomaba previamente y el inicio de metronidazol y/o la vancomicina.33 En las últimas décadas se ha producido un aumento de los fracasos terapéuticos con metronidazol y vancomicina con un preocupante número de casos recurrentes de hasta un 15-30%.34 Como tratamiento antibiótico alternativo existe la fidaxomicina, un antibiótico macrocíclico oral que ha demostrado tener una eficacia similar a la vancomicina.35
Actualmente, la principal indicación del TMF es la infección por C. Difficile en tres escenarios distintos: la infección recurrente, la infección grave y la infección en pacientes con EII. A pesar de que en los trabajos publicados existe una gran heterogeneidad respecto a la metodología empleada y el tipo de pacientes, la evidencia disponible apoya una clara efectividad terapéutica de este procedimiento en la infección por C. Difficile.
Recientes revisiones sistemáticas publicadas en 201328 y 201417,36 y que incluyen dos ensayos clínicos de alto impacto, concluyen que en términos generales la eficacia del TMF tiene una tasa de curación que ronda el 90%, siendo suficiente una sola dosis en la mayoría de los casos. Todos los estudios analizados presentaron una eficacia mayor del 50%, incluso en pacientes inmunodeprimidos, con edad avanzada o enfermedades graves con una tasa de curación mayor del 80%.37
A día de hoy la única indicación del TMF recogida en las guías de práctica clínica es la recurrencia de la infección a partir del tercer episodio.33,38 Respecto al primer escenario, la colitis por C. Difficile recurrente, existen tres ensayos clínicos publicados. El primero presentó una tasa del 81% en la resolución de los síntomas.18 En el segundo se compararon distintas vías de infusión sin grupo control logrando un 70% de curación y sin observarse diferencias respecto al modo de administración.39 El tercero sin grupo control y con administración mediante TMF en forma de cápsulas, presentó una tasa de éxito del 70% con una sola dosis y de hasta un 90% tras una segunda.40
En la infección grave por C. Difficile la experiencia es menor. La mayoría de estudios son series de casos donde se observa una alta tasa de resolución de hasta el 84% como tratamiento de primera línea y del 92% como tratamiento de segunda intención.41 Otros casos publicados han mostrado rápida recuperación tras TMF en pacientes con colitis grave por C. Difficile.42-44
La infección por C. Difficile se ha relacionado con un aumento de la gravedad y la mortalidad de la enfermedad inflamatoria intestinal (EII), siendo recomendable el cribado de dicha infección en el momento del brote. Existen estudios observacionales con resolución completa mediante el TMF de la infección refractaria por C. Difficile en pacientes con EII.24,45 En este tipo de pacientes pueden ser necesarias infusiones adicionales para asegurar la correcta erradicación de la infección.45
La experiencia de nuestro centro, aún limitada, será objeto de una próxima comunicación. Solamente hemos tratado pacientes con infección recurrente por C. Difficile, pero podemos dar fe de la buena tolerancia y del efecto, clínica y microbiológicamente bien definido, de este procedimiento.
TMF EN ENFERMEDAD INFLAMATORIA INTESTINAL
La hipótesis etiopatogénica actual de la EII sitúa al genotipo y a la microbiota intestinal como los dos agentes principales en el desarrollo de esta entidad. En individuos genéticamente predispuestos, factores tanto endógenos como exógenos parcialmente conocidos entre los que destaca la flora intestinal, desencadenarían una activación anómala del sistema inmunitario a nivel de la mucosa. Tras la infección por C. Difficile, probablemente sea la indicación que más interés ha suscitado en la comunidad científica y de la que más evidencia se dispone.
En el ámbito de la CU la primera publicación apareció en el año 1989. El investigador Justin Bennet, afecto de CU, fue el primero en aventurarse a probar la eficacia del TMF al autoimplantarse un enema de retención de solución de microbiota.46 A los 6 meses del procedimiento Bennet se encontraba asintomático y libre de toda medicación. Hasta el año 2015 toda la información disponible en la literatura provenía de casos aislados y pequeños estudios de cohortes. Este año se han dado conocer los resultados de los 2 primeros ensayos clínicos aleatorizados.14,37 Moayyedi et al. aleatorizaron 75 pacientes con CU a recibir un TMF vía enema de retención de 50 ml semanalmente durante 6 semanas (n=38) o placebo (n=35). La tasa de remisión clínica y endoscópica fue de un 24% el grupo TMF y de un 5% en el grupo placebo (p=0.03), sin diferencias significativas en los efectos adversos entre ambos grupos. Este estudio además sugiere que las características del donante y el tiempo de evolución de la enfermedad podrían influir en la eficacia del TMF.14 Por otro lado, Rossen et al., aleatorizaron 50 pacientes con una proporción 1:1 a recibir un TMF de donante sano vs. TMF autólogo como grupo control. La ruta de administración fue la sonda nasoyeyunal y se realizó una instilación al inicio del estudio y otra tres semanas más tarde. En este ensayo clínico no se encontraron diferencias estadísticamente significativas entre la tasa de remisión del grupo tratamiento (30.4%) vs. TMF autólogo (20%). Entre las posibles razones que explicarían la ausencia de diferencias significativas los autores barajan el bajo tamaño muestral, el modo de administración y el hecho de que únicamente se realizaron 2 sesiones de TMF.37
Por último, existe una revisión sistemática con metaanálisis, donde se incluye uno de estos ensayos, que estima que la tasa de remisión con el TMF se situaría en torno a un 22%; una cifra considerablemente inferior a las series inicialmente publicadas que lograban tasas del 67,7 -100%.47,48
En el terreno de la enfermedad de Crohn la evidencia disponible es aún más escasa y no se dispone aún de ningún ensayo clínico aleatorizado. El primer caso fue publicado por Borody et al. en el año 1989 en un varón de 31 años con enfermedad corticorrefractaria.49 Aunque la respuesta inicial fue satisfactoria, el paciente sufrió una recaída de su enfermedad 18 meses después del TMF. Posteriormente se publicaron varias series de casos con resultados decepcionantes que mitigaron el entusiasmo inicial en esta indicación.50-52 Sin embargo, dos recientes estudio pilotos sin grupo control que incluyeron un total de 39 pacientes han obtenido tasas de remisión por encima del 70%.53,54
En definitiva, aunque los estudios existentes señalan que el TMF se postula como una nueva terapia segura y eficaz en la EII, aún queda un largo camino por recorrer hasta poder clarificar cómo debe administrarse, cuándo y a qué subgrupo de pacientes.
EFECTOS ADVERSOS Y SEGURIDAD
A pesar de que en el mundo ya se han realizado miles de TMF, la naturaleza retrospectiva de gran parte de los estudios, el posible sesgo de publicación, la falta de rigurosidad en la recogida de efectos adversos y la escasez de seguimiento a largo plazo hacen que la información disponible deba ser interpretada con cautela. A corto plazo, el TMF suele ser bien tolerado con efectos adversos escasos, leves y transitorios. Los síntomas más comunes en los primeros días son sensación de hinchazón, dolor abdominal, diarrea, flatulencia y nauseas. Otros efectos secundarios descritos son vómitos, estreñimiento, fiebre, prurito, cefalea, clínica catarral y elevación de la proteína C reactiva.17,18 A estos efectos adversos habría que añadir los riesgos y complicaciones inherentes al medio de administración (endoscópico, enema o sonda nasoyeyunal).
Aunque poco frecuentes, también se han notificado efectos secundarios graves tras el TMF. Destacan 2 casos de infección por norovirus,55 un enfermo con bacteriemia por E. Coli 24 horas después del TMF56 y casos esporádicos de reactivación de CU y enfermedad de Crohn.57,58 A pesar de que existen 2 casos de fallecimientos por peritonitis y neumonía días después del procedimiento, su asociación con el TMF no quedó plenamente establecida.59 Hasta la fecha no se han comunicado muertes con una relación causal directa con el TMF.
La información disponible a largo plazo es muy limitada. La mayor preocupación, por muy riguroso que sea el cribado, es la posibilidad de transmisión de agentes infecciosos no reconocidos como ya ocurrió en el pasado con la hepatitis C o el VIH. Además, existe la posibilidad teórica de que el cambio en la microbiota pueda favorecer la aparición de patología de naturaleza autoinmunitaria, inflamatoria e incluso neoplásica.
TMF EN OTRAS INDICACIONES
Las fronteras del TMF se van ampliando año tras año. Existen casos aislados y pequeñas series que sugieren que puede ser útil en el síndrome del intestino irritable y en el estreñimiento crónico.60,61 Diversas líneas de investigación demuestran su importancia en patología extradigestiva, fundamentalmente en la obesidad y diabetes mellitus tipo.2 La base biológica que fundamenta estos trabajos es que la microbiota de las personas delgadas difiere notablemente de la de sujetos obesos.62 El grupo de Vrieze et al. han sido pioneros primeros en realizar un ensayo aleatorizado en 18 pacientes con síndrome metabólico. El grupo control (n= 9) recibió un TMF autólogo mientras que el grupo tratamiento recibió microbiota procedente de individuos con un IMC < 23. Observaron que en el grupo tratamiento se produjo un aumento significativo de la sensibilidad a la insulina.63
En nuestra búsqueda también se recogen casos aislados con resultados prometedores en el autismo,64 enfermedad de Parkinson,65 encefalopatía hepática, síndrome de fatiga crónica,66 esclerosis múltiple,67 erradicación de bacterias multirresistentes, sensibilidad a los antirretrovirales frente al VIH y pancreatitis aguda.64
CONCLUSIONES Y FUTURO
Bacterias y patología es una asociación decimonónica que se aleja del concepto actual de microbiota. La microbiota intestinal vive e interactúa de forma dinámica con el huésped jugando un papel decisivo en su estado de salud y enfermedad. El interés creciente en este campo se ve reflejado en el abrumador número de publicaciones científicas que aparecen diariamente. El TMF es un procedimiento seguro (al menos a corto -medio plazo), barato y que ha demostrado modificar la microbiota del receptor enfermo y asemejarla a la del donante sano. En una era en la que el incremento de la sofisticación de los fármacos corre paralelo al aumento exponencial de su precio, el disponer de una técnica como el TMF es probablemente de gran interés en pacientes o en medios sanitarios cuyo acceso a determinados tratamientos se puede ver limitado por motivos económicos. Dispone a día de hoy de evidencia sólida que avala su eficacia en la infección por C. Difficile (especialmente en infección recurrente), constituyendo una herramienta terapéutica que los centros sanitarios de referencia deben ofertar en su cartera de servicios por ser ya la mejor alternativa existente en un subgrupo de enfermos. Su eficacia en otras indicaciones, especialmente en la enfermedad inflamatoria intestinal y el síndrome metabólico, aunque prometedora es todavía preliminar. Quedan aún muchos aspectos pendientes de perfilar como la forma óptima de preparación y administración de la solución fecal, la seguridad a largo plazo o el número ideal de sesiones. De la evidencia disponible se deduce que muy probablemente no sea válido un procedimiento idéntico en todos los pacientes y que sólo un subconjunto de la flora trasplantada es la responsable de los efectos beneficiosos. Las formulaciones encapsuladas y el trasplante selectivo de microbiota son opciones prometedoras que permitirán individualizar y homogeneizar el procedimiento.
Los más de 100 ensayos clínicos en marcha (https://clinicaltrials.gov) que se darán a conocer en los próximos años serán cruciales para ver si finalmente el TMF se hace un hueco, o no, en la rutina de los centros sanitarios.
BIBLIOGRAFÍA
-
Borody TJ, Warren EF, Leis SM, Surace R, Ashman O, Siarakas S. Bacteriotherapy using fecal flora: toying with human motions. Journal of clinical gastroenterology. Jul 2004;38(6):475-483.
-
Zhang F, Luo W, Shi Y, Fan Z, Ji G. Should we standardize the 1,700-year-old fecal microbiota transplantation? The American journal of gastroenterology. Nov 2012;107(11):1755; author reply p 1755-1756.
-
Eiseman B, Silen W, Bascom GS, Kauvar AJ. Fecal enema as an adjunct in the treatment of pseudomembranous enterocolitis. Surgery. Nov 1958;44(5):854-859.
-
Borody TJ, Paramsothy S, Agrawal G. Fecal microbiota transplantation: indications, methods, evidence, and future directions. Current gastroenterology reports. Aug 2013;15(8):337.
-
Savage DC. Microbial ecology of the gastrointestinal tract. Annual review of microbiology. 1977;31:107-133.
-
Qin J, Li R, Raes J, et al. A human gut microbial gene catalogue established by metagenomic sequencing. Nature. Mar 4 2010;464(7285):59-65.
-
Stearns JC, Lynch MD, Senadheera DB, et al. Bacterial biogeography of the human digestive tract. Scientific reports. 2011;1:170.
-
Garcia Garcia de Paredes A, Rodriguez de Santiago E, Aguilera-Castro L, Ferre-Aracil C, Lopez-Sanroman A. [Fecal microbiota transplantation]. Gastroenterologia y hepatologia. Mar 2015;38(3):123-134.
-
Qin J, Li Y, Cai Z, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature. Oct 4 2012;490(7418):55-60.
-
Pituch H. Clostridium difficile is no longer just a nosocomial infection or an infection of adults. International journal of antimicrobial agents. Mar 2009;33 Suppl 1:S42-45.
-
Bartlett JG, Gerding DN. Clinical recognition and diagnosis of Clostridium difficile infection. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. Jan 15 2008;46 Suppl 1:S12-18.
-
McDonald LC, Owings M, Jernigan DB. Clostridium difficile infection in patients discharged from US short-stay hospitals, 1996-2003. Emerging infectious diseases. Mar 2006;12(3):409-415.
-
Pepin J, Saheb N, Coulombe MA, et al. Emergence of fluoroquinolones as the predominant risk factor for Clostridium difficile-associated diarrhea: a cohort study during an epidemic in Quebec. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. Nov 1 2005;41(9):1254-1260.
-
Moayyedi P, Surette MG, Kim PT, et al. Fecal Microbiota Transplantation Induces Remission in Patients With Active Ulcerative Colitis in a Randomized Controlled Trial. Gastroenterology. Jul 2015;149(1):102-109 e106.
-
Bakken JS, Borody T, Brandt LJ, et al. Treating Clostridium difficile infection with fecal microbiota transplantation. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association. Dec 2011;9(12):1044-1049.
-
Fischer M, Sipe B, Rogers N, et al. Faecal microbiota transplantation plus selected use of vancomycin for severe‐complicated Clostridium difficile infection: description of a protocol with high success rate. Alimentary pharmacology & therapeutics. 2015;42(4):470-476.
-
Sha S, Liang J, Chen M, et al. Systematic review: faecal microbiota transplantation therapy for digestive and nondigestive disorders in adults and children. Alimentary pharmacology & therapeutics. May 2014;39(10):1003-1032.
-
van Nood E, Vrieze A, Nieuwdorp M, et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. The New England journal of medicine. Jan 31 2013;368(5):407-415.
-
Kelly CR, Ihunnah C, Fischer M, et al. Fecal microbiota transplant for treatment of Clostridium difficile infection in immunocompromised patients. The American journal of gastroenterology. Jul 2014;109(7):1065-1071.
-
Brandt LJ, Aroniadis OC. An overview of fecal microbiota transplantation: techniques, indications, and outcomes. Gastrointestinal endoscopy. Aug 2013;78(2):240-249.
-
Borody TJ, Warren EF, Leis S, Surace R, Ashman O. Treatment of ulcerative colitis using fecal bacteriotherapy. Journal of clinical gastroenterology. Jul 2003;37(1):42-47.
-
Allegretti JR, Hamilton MJ. Restoring the gut microbiome for the treatment of inflammatory bowel diseases. World journal of gastroenterology : WJG. Apr 7 2014;20(13):3468-3474.
-
Rohlke F, Surawicz CM, Stollman N. Fecal flora reconstitution for recurrent Clostridium difficile infection: results and methodology. Journal of clinical gastroenterology. Sep 2010;44(8):567-570.
-
Hamilton MJ, Weingarden AR, Sadowsky MJ, Khoruts A. Standardized frozen preparation for transplantation of fecal microbiota for recurrent Clostridium difficile infection. The American journal of gastroenterology. May 2012;107(5):761-767.
-
Rohlke F, Stollman N. Fecal microbiota transplantation in relapsing Clostridium difficile infection. Therapeutic advances in gastroenterology. Nov 2012;5(6):403-420.
-
Gough E, Shaikh H, Manges AR. Systematic review of intestinal microbiota transplantation (fecal bacteriotherapy) for recurrent Clostridium difficile infection. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. Nov 2011;53(10):994-1002.
-
Rossen NG, Fuentes S, van der Spek MJ, et al. Findings From a Randomized Controlled Trial of Fecal Transplantation for Patients With Ulcerative Colitis. Gastroenterology. Jul 2015;149(1):110-118 e114.
-
Kassam Z, Lee CH, Yuan Y, Hunt RH. Fecal microbiota transplantation for Clostridium difficile infection: systematic review and meta-analysis. The American journal of gastroenterology. Apr 2013;108(4):500-508.
-
Silverman MS, Davis I, Pillai DR. Success of self-administered home fecal transplantation for chronic Clostridium difficile infection. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association. May 2010;8(5):471-473.
-
Yoon SS, Brandt LJ. Treatment of refractory/recurrent C. difficile-associated disease by donated stool transplanted via colonoscopy: a case series of 12 patients. Journal of clinical gastroenterology. Sep 2010;44(8):562-566.
-
Ponte A, Pinho R, Mota M, et al. Initial experience with fecal microbiota transplantation in Clostridium difficile infection - transplant protocol and preliminary results. Revista espanola de enfermedades digestivas : organo oficial de la Sociedad Espanola de Patologia Digestiva. Jul 2015;107(7):402-407.
-
Dial S, Delaney JA, Barkun AN, Suissa S. Use of gastric acid-suppressive agents and the risk of community-acquired Clostridium difficile-associated disease. JAMA : the journal of the American Medical Association. Dec 21 2005;294(23):2989-2995.
-
Cohen SH, Gerding DN, Johnson S, et al. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the society for healthcare epidemiology of America (SHEA) and the infectious diseases society of America (IDSA). Infection control and hospital epidemiology : the official journal of the Society of Hospital
-
Epidemiologists of America. May 2010;31(5):431-455.
-
Khoruts A, Dicksved J, Jansson JK, Sadowsky MJ. Changes in the composition of the human fecal microbiome after bacteriotherapy for recurrent Clostridium difficile-associated diarrhea. Journal of clinical gastroenterology. May-Jun 2010;44(5):354-360.
-
Louie TJ, Miller MA, Mullane KM, et al. Fidaxomicin versus vancomycin for Clostridium difficile infection. The New England journal of medicine. Feb 3 2011;364(5):422-431.
-
Cammarota G, Ianiro G, Gasbarrini A. Fecal microbiota transplantation for the treatment of Clostridium difficile infection: a systematic review. Journal of clinical gastroenterology. Sep 2014;48(8):693-702.
-
Rossen NG, MacDonald JK, de Vries EM, et al. Fecal microbiota transplantation as novel therapy in gastroenterology: A systematic review. World journal of gastroenterology: WJG. 2015;21(17):5359.
-
Surawicz CM, Brandt LJ, Binion DG, et al. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections. The American journal of gastroenterology. Apr 2013;108(4):478-498; quiz 499.
-
Youngster I, Sauk J, Pindar C, et al. Fecal microbiota transplant for relapsing Clostridium difficile infection using a frozen inoculum from unrelated donors: a randomized, open-label, controlled pilot study. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. Jun 2014;58(11):1515-1522.
-
Youngster I, Russell GH, Pindar C, Ziv-Baran T, Sauk J, Hohmann EL. Oral, capsulized, frozen fecal microbiota transplantation for relapsing Clostridium difficile infection. JAMA : the journal of the American Medical Association. Nov 5 2014;312(17):1772-1778.
-
Aroniadis O BL, Greenberg A, et al. . Long-term follow-up study of fecal microbiota transplantation (FMT) for severe or complicated Clostridium difficile infection (CDI). Gastroenterology. 2013;144:S-185.
-
Neemann K, Eichele DD, Smith PW, Bociek R, Akhtari M, Freifeld A. Fecal microbiota transplantation for fulminant Clostridium difficile infection in an allogeneic stem cell transplant patient. Transplant infectious disease : an official journal of the Transplantation Society. Dec 2012;14(6):E161-165.
-
Brandt LJ, Borody TJ, Campbell J. Endoscopic fecal microbiota transplantation: "first-line" treatment for severe clostridium difficile infection? Journal of clinical gastroenterology. Sep 2011;45(8):655-657.
-
Trubiano JA, Gardiner B, Kwong JC, Ward P, Testro AG, Charles PG. Faecal microbiota transplantation for severe Clostridium difficile infection in the intensive care unit. European journal of gastroenterology & hepatology. Feb 2013;25(2):255-257.
-
Duplessis CA, You D, Johnson M, Speziale A. Efficacious outcome employing fecal bacteriotherapy in severe Crohn's colitis complicated by refractory Clostridium difficile infection. Infection. Aug 2012;40(4):469-472.
-
Bennet J, Brinkman M. Treatment of ulcerative colitis by implantation of normal colonic flora. The Lancet. 1989;333(8630):164.
-
Borody T WE, Leis S, Surace R, Ashman O. Treatment of ulcerative colitis using fecal bacteriotherapy. Journal of clinical gastroenterology. 2003;37:42-47.
-
Kunde S CD, Conrad H, Kugathasan S. . Fecal microbial transplantation shows efficacy in children with refractory ulcerative colitis- early results of phase I clinical trial. Inflammatory bowel diseases. 2012;18:S66-67.
-
Borody TJ, George L, Andrews P, et al. Bowel-flora alteration: a potential cure for inflammatory bowel disease and irritable bowel syndrome? The Medical journal of Australia. May 15 1989;150(10):604.
-
Kao D, Hotte N, Gillevet P, Madsen K. Fecal Microbiota Transplantation Inducing Remission in Crohn's Colitis and the Associated Changes in Fecal Microbial Profile. Journal of clinical gastroenterology. Mar 24 2014.
-
Landy J OA-HH, Ronde E, et al. A prospective controlled pilot study of faecal microbiota transplantation for chronic refractory pouchitis. Journal of Crohn's & colitis. 2013;7(S247-8).
-
Vermeire S JM, Verbeke K, et al. Pilot study on the safety and efficacy of faecal microbiota transplantation in refractory Crohn´s disease. Gastroenterology. 2012;142(S360).
-
Cui B, Feng Q, Wang H, et al. Fecal microbiota transplantation through mid‐gut for refractory Crohn's disease: Safety, feasibility, and efficacy trial results. Journal of gastroenterology and hepatology. 2015;30(1):51-58.
-
Suskind DL, Brittnacher MJ, Wahbeh G, et al. Fecal microbial transplant effect on clinical outcomes and fecal microbiome in active Crohn's disease. Inflammatory bowel diseases. 2015;21(3):556-563.
-
Schwartz M, Gluck M, Koon S. Norovirus gastroenteritis after fecal microbiota transplantation for treatment of Clostridium difficile infection despite asymptomatic donors and lack of sick contacts. The American journal of gastroenterology. Aug 2013;108(8):1367.
-
Quera R, Espinoza R, Estay C, Rivera D. Bacteremia as an adverse event of fecal microbiota transplantation in a patient with Crohn's disease and recurrent Clostridium difficile infection. Journal of Crohn's and Colitis. 2014;3(8):252-253.
-
Angelberger S LC, Gratzer C, et al. Fecal transplantation in patients with moderately to severely chronic active ulcerative colitis (UC). . Journal of Crohn's & colitis. 2012;6,S159.
-
De Leon LM, Watson JB, Kelly CR. Transient flare of ulcerative colitis after fecal microbiota transplantation for recurrent Clostridium difficile infection. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association. Aug 2013;11(8):1036-1038.
-
Aas J, Gessert CE, Bakken JS. Recurrent Clostridium difficile colitis: case series involving 18 patients treated with donor stool administered via a nasogastric tube. Clinical infectious diseases. 2003;36(5):580-585.
-
Grehan MJ, Borody TJ, Leis SM, Campbell J, Mitchell H, Wettstein A. Durable alteration of the colonic microbiota by the administration of donor fecal flora. Journal of clinical gastroenterology. Sep 2010;44(8):551-561.
-
Andrews P BT, Shortis NP, Thompson S. Bacteriotherapy for chronic constipation – long term follow-up. Gastroenterology. 1995;108.
-
Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature. 2006;444(7122):1027-1131.
-
Vrieze A, Van Nood E, Holleman F, et al. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology. Oct 2012;143(4):913-967.
-
Aroniadis O.C BLJ. Fecal microbiota transplantation: past, present and future. Curr Opin Gastroenterol. 2013;29:79-84.
-
A. A. Faecal transplant eases symptoms of Parkinson´s. 2011;2796:8-9.
-
Borody TJ, Nowak A, Finlayson S. The GI microbiome and its role in chronic fatigue syndrome: A summary of bacteriotherapy. Journal of the Australasian College of Nutritional and Environmental Medicine. 2012;31(3):3.
-
Borody T LS, Campbell J, Torres M, Nowak A. Fecal microbiota transplantation (FMT) in multiple sclerosis (MS). The American journal of gastroenterology. 2011;106.
COMENTARIO EDITORIAL
Dr. Guillermo Rosato MAAC MSACP HFASCRS MISUCRS
Editor en Jefe de la Revista de la SACP
Esta publicación es una revisión bibliográfica de una modalidad terapéutica que esta siendo evaluada en trabajos bajo protocolo y en series observacionales. No refleja la experiencia personal del grupo de investigación del Servicio de Gastroenterología del Hospital Universitario Ramón y Cajal, quienes presentaran sus resultados próximamente.
El Trasplante de Microbiota Fecal (TMF) es un procedimiento novedoso, efectivo en un 90%, para el tratamiento de infecciones por Clostridium Difficile refractarios al tratamiento antibiótico como consecuencia de la disrupción del ecosistema bacteriano intestinal.
Su implementación esta siendo utilizado (bajo protocolo) para otras afecciones como: las enfermedades inflamatorias intestinales; síndrome de intestino irritable; la constipación crónica severa; pouchitis y otras patologías como la obesidad y el síndrome de fatiga crónica.
Aun tomando los recaudos correspondientes, no esta exento de riesgos y su implementación deberá hacerse siguiendo un protocolo de estudio y las normas vigentes para su implementación.1-3
Bibliografía
- Konturek, P. C., et al. Emerging role of fecal microbiota therapy in the treatment of gastrointestinal and extra-gastrointestinal diseases. Journal of Physiology and Pharmacology, 2015, vol. 66, no 4, p. 483-491.
- Rossen NG. Fecal microbiota transplantation as novel therapy in gastroenterology: A systematic review. WJG. 2015;21(17):5359–14.
- Weil AA, Hohmann EL. Fecal Microbiota Transplant: Benefits and Risks. Open Forum Infectious Diseases. 2015;2(1).
