REV ARGENT COLOPROCT | 2015 | VOL. 26, Nº 2 : 45-53
ARTÍCULO ORIGINAL
Protocolo para la Pesquisa de la Displasia Anal mediante Citología y Anoscopía de Alta Resolución
Trabajo para optar a Miembro Titular SACP
Gisela Jimena Presencia
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
RESUMEN
Introducción: El carcinoma anal escamoso (CAE) representa el 2% de todas las neoplasias colorrectoanales. Afecta a 2/100.000 habitantes por año en la población general. Se incrementa en los pacientes con serología positiva para el virus de la inmunodeficiencia humana (VIH-positivos), 60/100.000 habitantes por año y asciende a 92-144/100.000 habitantes por año en los hombres que tienen sexo con hombres (HSH) VIH-positivos. Al igual que en el carcinoma escamoso del cuello uterino, el virus del papiloma humano (VPH) está implicado en su génesis, y se encuentra presente en el 92% de los casos. El cáncer cervical y anal comparten el mismo origen embriológico, formando la zona de transformación, sitio donde se desarrollan las lesiones intraepiteliales escamosas (SIL) como resultado de la infección y persistencia del VPH, en especial de los genotipos de alto riesgo que pueden progresar a CAE invasor. El aumento significativo de CAE en las últimas décadas ha llevado a desarrollar la pesquisa de SIL anal (ASIL) mediante citología (PAP) y anoscopía de alta resolución (AAR) con técnica colposcópica, emulando los protocolos de detección temprana para prevención el cáncer de cuello uterino.
Objetivo: Conocer prevalencia de lesiones precursoras del CAE. Determinar sensibilidad (S), especificidad (E), valor predictivo positivo (VPP) y negativo (VPN) del PAP para la detección de displasias en población de riesgo.
Material y Método: Diseño: Prospectivo, transversal, observacional, analítico. Se incluyeron individuos de alto riesgo (VIH-positivos, HSH, individuos con historia de VPH anogenital, mujeres con antecedentes de cáncer o neoplasia intraepitelial genital inferior) estudiados en forma consecutiva, entre abril 2012 y febrero 2014, en Consultorio de Detección Temprana del Cáncer Anal.
Resultados: Se estudiaron 106 pacientes, 72 hombres (67%) y 34 (33%) mujeres. Edad: 38,2±8,3 (rango 18-69) años. Hombres: 70 (97%) eran HSH y 60 (83%) VIH-positivos. Mujeres: 9 (26%) VIH-positivas, 25 (73%) coito anal, 22 (64%) antecedentes de condilomas/displasia anogenital de alto grado y 11 (32%) carcinoma de cérvix. Hubo 71 (70%) PAP anormales: ASCUS (anal squamous cells undeterminated significance) 4 (6%), LASIL 58 (54,6%) y HASIL 10 (9,4%). La AAR fue anormal en 62 (58,5%) pacientes, biopsiándose 57. Se confirmaron displasias en 36 (63%): 26 (45%) LASIL (19 condilomas y 7 AIN 1) y 10 (17,6%) HASIL (3 AIN 2 y 7 AIN 3). El PAP con biopsia dirigida por AAR halló una prevalencia de ASIL del 86%. S 69,4%, E 62,5%, VPP 92% y VPN de 25%. Para HASIL: prevalencia 17,6%, S 60%, E 93,6%, VPP 66, 7% y VPN 91,7%.
Conclusión: La prevalencia de ASIL y HASIL fue elevada en los pacientes de riesgo. La pesquisa con PAP tuvo una moderada S y E para detectar ASIL de cualquier grado en los dos tercios de esta población. El PAP fue altamente específico para la detección de HASIL, pero subestimó el grado de displasia en el 30% de los pacientes.
Palabras clave: Pesquisa; Displasia Anal; Prevención Cáncer Anal
SUMMARY
Introduction: Anal squamous cell carcinoma (SCC) represents 2% of all colo-recto-anal malignancies. It is confirmed a higher rate of anal cancer among HIV-infected population in comparison with the HIV-uninfected population (60/100,000 person-years, versus 2/100,000 person-years). Among HIV-infected men who have sex with men (MSM), the incidence of anal cancer is as high as 92-144/100,000 population. Like cervical cancer, squamous-cell canal cancer is caused predominantly by high-risk, oncogenic strains of human papillomaviruses (HPV) detected in 92% of HIV-positive MSM. The cervical and anal cancer share the same embryological origin, and occurs at a squamo-columnar transition zone, site of squamous intraepithelial lesions (SIL) as a result of the persistence HPV infection, especially the high-risk genotypes that may progress to invasive cancer. In the last decades, the incidence of squamous-cell anal carcinoma is increasing rapidly forcing the research of anal SIL (ASIL) cytology (PAP) and high-resolution anoscopy (HRA) colposcopic technique, emulating protocols for early detection of cervical cancer as a primary prevention.
Objective: This study aimed to determine the prevalence of SCC precursor lesions. Determine sensitivity (S), specificity (Sp), positive predictive value (PPV) and negative predictive value (NPV) for the detection of anal dysplasia in the risk population.
Material and Methods: Design prospective, cross-sectional, observational, analytical study. High-risk patients (HIV-positive MSM, patients with history of anogenital HPV, women with history of cancer or lower genital intraepithelial neoplasia) were included consecutively between April 2012 and February 2014 in Anal Early Detection Cancer Clinic.
Results: We enrolled one 106 patients, 72 (67%) men and 34 (33%) women. Mean age: 38.2 ± 8.3 years (range 18-69). Men: 70 (97%) MSM and 60 (83%) HIV-positive. Women: 9 (26%) HIV-positive, 25 (73%) anal intercourse, 22 (64%) had history of warts or anogenital high-grade dysplasia and 11 (32%) cervical carcinoma. There were 71 (70%) abnormal cytology: ASCUS (anal squamous cells undeterminated significance) four (6%), LASIL 58 (54.6%) and HASIL 10 (9.4%). HRA was abnormal in 62 (58.5%) patients, which 57 (63%) were biopsied confirming dysplasia in 36: 26 (45%) LASIL (19 condylomata, 7 AIN 1) and 10 (17.6%) H-ASIL (3 AIN 2, 7 AIN 3). The prevalence of ASIL diagnosed with PAP and biopsy directed by HRA was 86%. S 69.4%, Sp 62.5%, PPV 92% and NPV 25%. For H-ASIL: prevalence 17.6%, S 60% E 93.6%, PPV 66, 7% and NPV 91.7%.
Conclusion: The prevalence of ASIL and HASIL was higher in risk patients. Cytology screening had a moderate S and Sp to detect any ASIL in two-thirds of this population. Cytology was highly specific detecting HASIL but underestimated dysplasia in 30% of patients.
Key words: Screening; Anal Dysplasia; Anal Cancer Prevention
INTRODUCCIÓN
El carcinoma anal escamoso (CAE), que representa el 2% de todas las neoplasias colorrectoanales, tiene una incidencia relativamente baja pues afecta a 2/100.000 habitantes por año en la población general de los países occidentales.1
Este incremento es aún más notable en los pacientes con serología positiva para el virus de la inmunodeficiencia humana (VIH-positivos), entre los cuales la incidencia es de 60/100.000 habitantes por año,2,3 ascendiendo a 92-144/100.000 habitantes por año en los hombres que tienen sexo con hombres (HSH) VIH-positivos.4
El CAE al momento de la consulta se diagnostica la mitad de las veces cuando aún se encuentra localizado; un 20% con enfermedad ganglionar regional y en un 2%, ya con metástasis a distancia.5 Se ha demostrado que se encuentra asociado al virus del papiloma humano (VPH) en el 92 % de los casos.6 Si bien el aumento de la incidencia del CAE no se explica, se cree que los cambios en los comportamientos sexuales de la segunda mitad del siglo XX aumentaron el riesgo de la exposición viral del conducto anal.
Por otra parte, en las mujeres es probable que la infección por VPH a nivel cervical actúe como reservorio y fuente de infección anal, pues es sabido que el virus se puede transmitir de un sitio a otro. Un estudio sueco de mujeres con neoplasia intraepitelial cervical mostró un mayor riesgo de desarrollar cáncer anal que vulvar,7 y un estudio inglés reportó una prevalencia del 19% de neoplasia intraepitelial anal en las mujeres con patología cervical; por lo que constituyen un grupo de riesgo para la pesquisa del cáncer del ano.8
El cáncer cervical y anal presentan similitudes. Comparten el mismo origen embriológico, pues derivan de la membrana cloacal, lugar en que el ectodermo y endodermo se reúnen para formar la zona de transformación; allí se desarrollan las lesiones intraepiteliales escamosas (SIL) como resultado de la infección y persistencia de los diversos genotipos del VPH.9 De los genotipos de alto riesgo, el 16 y 18 son responsables del desarrollo del 72% de casos de CAE invasor.10
La progresión de SIL anal (ASIL) de alto grado (HASIL) a CAE invasor se observa en el 62% de los VIH-positivos y en el 36% de los HSH VIH-negativos dentro de los dos años de evolución de la enfermedad.11 El riesgo de progresión de ASIL a CAE invasor es de aproximadamente el 10% en 5 años. Las HASIL muy rara vez involucionan, pero las de bajo grado (LASIL) si pueden lograrlo.12 Scholefield y col.13 informaron un 9% en la progresión de las HASIL a CAE invasor en 60 meses de seguimiento. Pineda y col.,14 reportaron una tasa de progresión a CAE invasor del 1,2% cuando la HASIL es tratada.
Aunque la baja incidencia global de esta patología redundó históricamente en un número limitado de estudios con poder estadístico adecuado en los cuales basar las recomendaciones para el diagnóstico y el tratamiento, el aumento significativo de casos permite datos suficientes para desarrollar protocolos de pesquisa de las lesiones precursoras de cáncer anal mediante la citología (PAP) y la anoscopía de alta resolución (AAR) con técnica colposcópica, emulando los protocolos de detección temprana para prevención el cáncer del cuello uterino.
OBJETIVO
El objetivo primario de esta investigación fue determinar la sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) del PAP anal para la detección de las lesiones ASIL y HASIL en la población de alto riesgo.
El objetivo secundario fue conocer la prevalencia de las ASIL y HASIL en dicha población en un Hospital Público de la Ciudad Autónoma de Buenos Aires.
MATERIAL Y MÉTODO
Fueron incluidos todos aquellos individuos de alto riesgo que llegaron en forma consecutiva, durante el periodo comprendido entre abril del 2012 y febrero del 2014, por demanda espontánea o por derivación médica (Infectología, Ginecología, Dermatología, Clínica Médica, Cirugía y Medicina Preventiva) al Consultorio de Detección Temprana del Cáncer Anal, dependiente del Consultorio Externo de Coloproctología del Hospital “Juan A. Fernández” de Buenos Aires.
Criterios de inclusión:
-
Hombres y mujeres VIH positivos.
-
Hombres que tienen sexo con hombres.
-
Hombres y mujeres con historia de infección por VPH (incluyendo condilomas anales o genitales).
-
Mujeres con antecedentes de cáncer o neoplasias intraepiteliales escamosas del tracto genital inferior (cervical, vulvar, vaginal).
-
Hombres y mujeres con trasplantes de órganos sólidos o inmunodepresión de otro origen no VIH.
Criterios de exclusión:
-
Individuos menores de 18 años.
-
Individuos con antecedente de cáncer anal invasor.
-
Individuos que no toleran la AAR por dolor o estenosis anal causada por patología infecciosa, inflamatoria o cirugía anal previa.
-
Individuos con contraindicación para la biopsia dirigida de las lesiones sospechosas diagnosticadas por la impresión macroscópica de la AAR, que impide la confirmación histológica de las mismas (Ej.: pacientes con coagulopatías, anticoagulados).
Aspectos éticos
Este protocolo fue presentado y aprobado por el Comité de Ética de Investigación Clínica del hospital. Todos los pacientes firmaron un consentimiento informado, diseñado a tal fin.
A todos los pacientes se les efectuó historia clínica en la primera consulta, con un interrogatorio normatizado e integral, consignando datos filiatorios, hábitos personales, sexuales, antecedentes infecciosos y antecedentes de otras enfermedades. Fueron sometidos a un examen físico completo, que incluyó inspección anogenital, tacto rectal y anoscopía convencional. Se solicitaron estudios de laboratorio (hemograma, glucemia, urea, creatinina, hepatograma, coagulograma, recuento de plaquetas, HIV, Hepatitis A, B, C, VDRL, recuento de CD4 y carga viral). El PAP y la AAR se emplearon como métodos complementarios en la pesquisa primaria a cada uno de los pacientes.
PAP: La única preparación consistió en la abstención de relaciones sexuales por vía anal, o del uso de cremas o enemas 24h antes del examen. La muestra se obtuvo con el paciente en decúbito lateral izquierdo, mediante un hisopo de fibras sintéticas (citobrush). El hisopo humedecido en solución salina o agua se insertó en el conducto anal, 5 a 6 cm más allá del margen anal, sin visualización directa y con una rotación de 360° en dirección a las agujas del reloj, presionando suavemente contra las paredes del conducto anal durante 10 a 15 segundos al tiempo que es retirado. El material obtenido fue colocado en un portaobjetos y fijado en alcohol al 96% para su lectura posterior. El resultado citológico se informó según el sistema de Bethesda15 (tabla 1).

AAR: Procedimiento ambulatorio, con una técnica similar a la de la colposcopia cervical. Se emplea un anoscopio de plástico transparente, descartable, que se inserta en el conducto anal y por el mismo se introduce una gasa embebida en ácido acético al 5% con una pinza de Mayer. Se retira el anoscopio y se deja la gasa por dos minutos. El anoscopio es reinsertado, retirándolo lentamente hasta visualizar la zona de transformación anal, ubicada inmediatamente proximal a la línea dentada. Para la visualización magnificada se utilizó un videocolposcopio digital, Ekhoson CPS-D 17X. Las lesiones sospechosas por ser acetoblancas, presentar puntillado, mosaico o vasos atípicos, se biopsiaron con una pinza mini Tischler y si se hallaban por debajo de la línea dentada, previa infiltración de lidocaína más epinefrina, con aguja 21 gauge y jeringa de 5cc. La hemostasia, de ser necesario, se obtuvo mediante la compresión con el anoscopio o la aplicación directa de nitrato de plata o solución de Monsel. La muestra obtenida se colocó en formol al 10% y se envió a anatomía patológica. Luego de la exploración con el colposcopio del conducto anal se hizo lo propio con la piel perianal, pintando nuevamente la zona con ácido acético al 5%.
Se advirtió al paciente de evitar el coito anal receptivo 72 hs siguientes a la biopsia.
No se evidenciaron complicaciones con el procedimiento, excepto una paciente que luego de la biopsia del conducto anal, presentó un sangrado incoercible aún con maniobras de compresión, que requirió cirugía con puntos hemostáticos.
Terminología empleada: El resultado histológico es informado según el Proyecto de estandarización en la terminología de lesiones del tracto anogenital inferior asociadas al VPH del año 2012 (LAST).16 Las ASIL son divididas en dos grupos según el grado de displasia: bajo grado (LSIL) y alto grado (HSIL). Las LSIL comprenden las neoplasias intraepiteliales anales (AIN) 1 y los condilomas mientras que las HSIL incluyen las AIN 2-3 y la papulosis bowenoide. De esta forma se armoniza la terminología de la histología, tradicionalmente informada según la Clasificación de la Organización Mundial de la Salud, con la de la citología, informada en base a la clasificación de Bethesda revisada en 2001 (Tabla 2).17
Actualmente, además del diagnóstico con hematoxilina-eosina se cuenta con el biomarcador p16 por inmunohistoquímica. Darragh y col.18 lo recomiendan no de forma rutinaria sino solo para el diagnóstico diferencial en los siguientes casos:
-
Duda entre AIN 2 y 3.
-
Ante la presencia de simuladores preneoplásicos (metaplasia escamosa inmadura, atrofia, cambios epiteliales reparadores).
-
Histología de LSIL con citología de HSIL, ASCUS o ASCH.
Análisis estadístico
La estadística descriptiva se expresa como promedio y desvío estándar, o mediana y rango. Se realizaron pruebas de sensibilidad, especificidad, VPP y VPN del PAP, utilizando como patrón oro la biopsia guiada por AAR. Cuando los pacientes tenían múltiples biopsias realizadas, para el análisis se tuvo en cuenta el resultado más severo. Para la comparación de las técnicas diagnósticas se empleó la prueba de Mc Nemar. Todos los datos fueron analizados mediante el software estadístico SPSS versión 18. Se interpretó un valor de P ≤0,05 como estadísticamente significativo.

RESULTADOS
Fueron evaluados 106 pacientes, 72 (67%) hombres y 34 (33%) mujeres. Edad promedio: 38,2 ± 8,3 (rango: 18-69) años. De los hombres, 70 (97%) eran HSH y 60 (83%) eran VIH-positivos. Con respecto a las mujeres solo 9 (26%) VIH-positivos, 25 (73%) practicaban coito anal, 22 (64%) tenían antecedentes de condilomas anogenitales y 11 (32%) del carcinoma del cuello uterino. Varias tenían más de un factor de riesgo. Todos los pacientes VIH-positivos tenían carga viral indetectable y recibían tratamiento antirretroviral de alta eficacia (HAART). La mediana de CD4 era 485 (rango: 50-2114) cel/mm3.
Se constató que 46 (43%) pacientes eran fumadores y 93 (88%) pacientes tenían antecedentes de una o más infecciones de transmisión sexual (ITS), siendo la infección por VPH la prevalente (n=65; 61%) pacientes, seguida por sífilis (n=31; 29%), hepatitis B (n=14; 13%), hepatitis A (n=12; 11%) y hepatitis C (n=4; 4%). Las variables relevantes principales relacionadas con los hábitos sexuales fueron el coito anal (n=95; 90%) y las múltiples parejas sexuales (n=74; 70%).
Al examen físico 28 (26%) pacientes presentaron tacto rectal anormal: todas lesiones verrugosas, asociadas en dos casos con una fisura anal y un nódulo submucoso, respectivamente, que no impidieron la inclusión en el protocolo de pesquisa.
Hubo 71 (70%) PAP patológicos: ASCUS 4 (6%), L-ASIL 58 (54,6%) y H-ASIL 10 (9,4%). En un caso se informó herpes.
La AAR no se realizó en 7 (6,6%) pacientes, en 2 por temor y en 3 por intolerancia. En dos casos el procedimiento fue inefectivo por grandes hemorroides internas que impidieron la visualización adecuada del conducto anal.
La AAR fue anormal en 62 (58,5%) pacientes, en quienes se identificaron áreas sospechosas de lesión intraepitelial, biopsiandose 57. Las restantes no fueron biopsiadas, por encontrarse sobre patología hemorroidal (3 casos), o por pérdida del área patológica previamente identificada al recolocar el anoscopio expulsado por esfuerzo evacuatorio del paciente (2 casos).
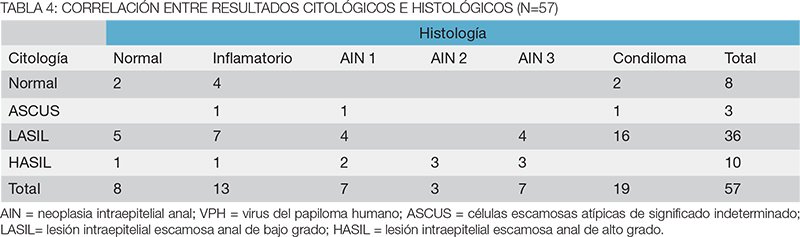
En las 57 lesiones sospechosas biopsiadas, el informe histopatológico mostró 36 (63%) ASIL: 26 (45%) LASIL (19 condilomas y 7 AIN 1) y 10 (17,5%) HASIL (3 AIN 2 y 7 AIN 3). En la Tabla 3 se detalla el resultado de las biopsias.
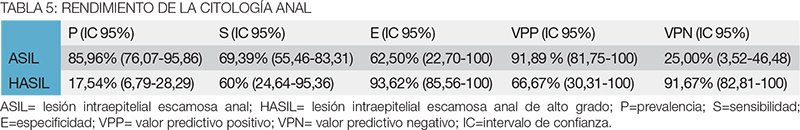
El PAP subestimó la AIN 2-3 en 4/10 casos (33,3%) en que informó L-ASIL. A su vez, la AAR no encontró la H-ASIL diagnosticada por el PAP en 4/10 casos (30%) en los que la biopsia mostró AIN 1 (Tabla 4). La prevalencia, sensibilidad, especificidad, VPP y VPN del PAP de los 57 pacientes biopsiados se resume en la tabla 5.

DISCUSIÓN
Aunque los primeros en usar un colposcopio para estudiar las ASIL fueron Scholefield y col.,18 quienes usaron citología y colposcopia anal para su detección, la primera propuesta de desarrollar un protocolo de pesquisa fue publicada en 1997 y llevada a cabo desde entonces por Palefsky y col.19 mediante citología y AAR en función del resultado del PAP. En nuestro medio ha habido reportes de experiencias iniciadas por distintos grupos tanto a nivel público como privado, pero siempre en el marco de protocolos de investigación.20-22 Pues no existe actualmente consenso respecto a cómo realizar la pesquisa ni tampoco cómo seleccionar a los pacientes. Los resultados de múltiples estudios coinciden en que citología subestima la severidad de las lesiones confirmadas luego por la AAR,23,24 de ahí que se sugiera asociar la AAR al PAP.
Los resultados obtenidos por nuestro grupo evidencian una alta prevalencia (86%) de ASIL confirmada por biopsia en la población con factores de riesgo. Esto es congruente con estudios previamente publicados en los que la prevalencia de la ASIL varió del 46% al 81%.25-27 De lo que se deduce que la población seleccionada para la realización de la pesquisa es la correcta.
La sensibilidad (69,4%) y especificidad (62,5%) de la citología anal para la detección de ASIL de cualquier grado en esta serie coinciden con las conclusiones de los grupos de Mallari y col.28 y Nahas y col.29 Ambos mostraron grados moderados de sensibilidad y especificidad 45% a 87% y 60% a 67%, respectivamente.
El VPP (92%) y el VPN (25%) en esta serie, se encuentran dentro del muy amplio rango reportado por diversos trabajos, que oscilan entre el 33% y 97% para el VPP y el 11% y 84% para el VPN.30-32
Con respecto a las HASIL, su verdadera prevalencia es todavía debatida, pues los datos reportados son muy variables, debido principalmente a diferencias en el diseño de los estudios, la interpretación histológica y la experiencia en el uso del colposcopio para identificar lesiones sugestivas de HASIL. En este estudio con excepción de un caso, todas las HASIL diagnosticadas fueron en pacientes VIH-positivos. La prevalencia obtenida (17,6%), resultó similar a la de otras series europeas que comunican del 16% al 29%33-35 y a la comunicada por Palefsky y col. en sus comienzos, del 26%.23 Por otra parte, otros grupos reportan prevalencias menores del 7,1%36 y otros mayores de HASIL como la UCSF un 52%37 y la Universidad de Rochester, New York 42%.28 La menor prevalencia de HASIL en nuestra población respecto de estos últimos estudios podría deberse a diversos factores, entre ellos a que el recuento de CD4 de los pacientes era relativamente alto. Además, muchos casos presentaban condilomas en el conducto anal, dificultando la correcta visualización del mismo y la pérdida de posibles lesiones planas eventualmente de alto grado. Por otra parte no puede obviarse la curva de aprendizaje necesaria para la AAR, y que esta se realizó simultáneamente al PAP, con lo cual no se contaba con el resultado de la citología, lo que pudo haber implicado una búsqueda colposcópica menos exhaustiva.
Coincidimos con Cranston y col.38 y Salit y col.39 en que el PAP anal tiene una alta especificidad pero moderada sensibilidad en la detección de HASIL, que en la presente serie fueron del 93,6% y 60%, respectivamente. El VPP (66,7%) y VPN (91,7%) se asemejan a otros publicados (30% a 81% y 65% a 91%).38,39 La citología repetida puede mejorar estos valores.
En el presente estudio el PAP subestimó las HASIL en el 33,3% de los casos, mientras la AAR no encontró la HASIL diagnosticada por el PAP en el 30%, cifras que se comparan favorablemente con las reportadas por otros investigadores (58% y 38,5%, respectivamente).40 El entrenamiento requerido para la realización de la AAR ha llevado también a otros autores a comunicar en los inicios de su aplicación un porcentaje de pérdida de lesiones tan elevado como del 87,5%.41
Cuando el PAP informó HASIL, pero no hubo correlato histológico, solicitamos la revisión del patólogo y cuando no se modificó su informe inicial, se recitó al paciente en búsqueda de la lesión de alto grado. Al igual que Goldstone y col.,42 se empleó el PAP como medida de control de calidad para el anoscopista, pues si en un individuo se detecta por citología HASIL, pero por AAR no se halla lesión o se halla LASIL, debe repetirse el procedimiento para asegurar que la lesión de alto grado no se haya perdido.
Los hallazgos de esta investigación nos llevan a recomendar la pesquisa de la displasia anal en los grupos de riesgo con PAP y en el caso de ser patológico, la AAR. Consideramos que no debería implementarse un programa de este tipo si no puede ofrecerse al paciente el estudio anoscópico magnificado ante un resultado citológico patológico. En centros que no se cuente con equipamiento ni entrenamiento en AAR podría tomarse la muestra para citología, que es un procedimiento sencillo y económico, y según el resultado derivar al paciente a los lugares de referencia.
CONCLUSIÓN
Los resultados obtenidos evidencian la alta prevalencia de ASIL y HASIL en los pacientes con los factores de riesgo considerados en esta investigación.
La pesquisa con PAP tuvo una moderada sensibilidad y especificidad para detectar ASIL de cualquier grado en los dos tercios de la población de riesgo.
El PAP fue altamente específico para la detección de HASIL, pero subestimó el grado de displasia en el 30% de los pacientes. Por eso creemos que la citología anal debe ser complementada por la AAR en el caso de hallazgos patológicos.
BIBLIOGRAFÍA
-
Jemal A, Siegel R, Ward E et al. Cancer statistics. Cancer J Clin 2007; 57: 43-66.
-
Piketty C, Selinger-Leneman H, Grabar S. Marked increase in the incidence of invasive anal cáncer among HIV-infected patients despite treatment with combination antiretroviral therapy. AIDS. 2008; 22: 1203–11.
-
Bower M, Powles T, Newsom-Davis T, et al. HIV-associated anal cancer: has highly active antiretroviral therapy reduced the incidence or improved the outcome? J Acquir Immune Defic Syndr. 2004;37:1563–65.
-
Garcia FU, Haber MM, Butcher J, Sharma M, Nagle D. Increased sensitivity of anal cytology in evaluation of internal compared with external lesions. Acta Cytol. 2007;51: 893–99.
-
Steele S, Varma M, Melton G, et al. Practice Parameters for Anal Squamous Neoplasms on behalf of the Standards Practice Task Force of the American Society of Colon and Rectal Surgeons Dis Colon Rectum 2012; 55: 735–49.
-
Frisch M, Fenger C, van den Brule AJ, et al. Variants of squamous cell carcinoma of the anal canal and perianal skin and their relation to human papillomaviruses. Cancer Res 1999;59:753–57.
-
Edgren G, Spare´n P. Risk of anogenital cancer after diagnosis of cervical intraepithelial neoplasia: a prospective population based study. Lancet Oncol 2007;8:281–82.
-
Scholefield JH, Hickson WG, Smith JH, Rogers K, Sharp F.Anal intraepithelial neoplasia: part of a multifocal disease process. Lancet 1992;340:1271–73.
-
Oon S, Winter D. Perianal condylomas, anal squamous intraepithelial neoplasms and screening: a review of the literature. J Med Screen 2010; 17:44–49.
-
Hoots BE, Palefsky JM, Pimenta JM, Smith JS. Human papillomavirus type distribution in anal cancer and anal intraepithelial lesions. Int J Cancer 2009; 124: 2375–83.
-
Palefsky JM, Holly EA, Ralston ML, Jay N, Berry JM, Darragh TM. High incidence of anal high-grade squamous intraepitelial lesions among HIV-positive and HIV-negative homosexual and bisexual men. AIDS 1998; 12: 495–503.
-
Scholefield JH, Ogunbiyi OA, Smith JH, Rogers K, Sharp F. Treatment of anal intraepithelial neoplasia. Br J Surg 1994; 81: 1238–40.
-
Scholefield JH, Harris D, Radcliffe A. Guidelines for Management of Anal Intraepithelial Neoplasia. Colorectal Colorectal Dis 2011; 13 (Suppl I): 3-10.
-
Pineda CE, Berry JM, Jay N, Palefsky JM, Welton ML. High resolution anoscopy in the planned staged treatment of anal squamous intraepithelial lesions in HIV-negative patients. J Gastrointest Surg. 2007; 11: 1410–16.
-
Bergeron C. El Sistema de Bethesda 2001. En: Alonso P, Lescano E, Hernandez M. Cáncer cervicouterino. Diagnóstico, prevención y control. Bs As.: Ed Panamericana 2005; 17: 219-24.
-
Darragh T, Terence, Colgan J, Cox T. The Lower Anogenital Squamous Terminology Standardization Project for HPV-Associated Lesions: Background and Consensus Recommendations from the College of American Pathologists and the American Society for Colposcopy and Cervical Pathology. Arch Pathol Lab Med. 2012; 136: 1266-97.
-
Svidler López L, Presencia GJ, Sidra GL, Pastore RLO, eds. HPV Guía de manejo multidisciplinario. Bs. As.: Ed. Nueva Libreria, 2014.
-
Scholefield JH, Sonnex C, Talbot IC, et al. Anal and cervical intraepithelial neoplasia: possible parallel. Lancet 1989; 2:765–68.
-
Palefsky JM, Holly EA, Hogeboom CJ, Berry JM, Jay N, DarraghTM. Anal cytology as a screening tool for anal squamous intraepithelial lesions. J Acquir Immune Defic Syndr Hum Retrovirol.1997;14:415–22.
-
La Rosa L, Gutiérrez A, Arias J, et al. Pesquisa del cáncer anal. Rev Argent Coloproct 2007;18:483-88.
-
Moreira Grecco A, Suzuki V, Lynn P, Fleider L, Tatti S. Tratamiento quirúrgigo de las lesiones anales intraepiteliales (AIN) de alto grado. Rev Argent Coloproct 2011; 22: 4-9.
-
Montero MC (h), Roldán SI, Pereyra C, et al. HPV perianal en pacientes VIH positivos. Anoscopía magnificada y determinación de serotipos por biología molecular. Rev Argent Coloproct 2008; 19: 103-11.
-
Jay N, Berry JM, Hogeboom CJ, Holly EA, Darragh TM, Palefsky JM. Colposcopic appearance of anal squamous intraepitelial lesions: relationship to histopathology. Dis Colon Rectum 1997;40:919–28.
-
Cranston RD, Hart SD, Gornbein JA, Hirschowitz SL, Cortina G, Moe AA. The prevalence, and predictive value, of abnormal anal cytology to diagnose anal dysplasia in a population of HIV-positive men who have sex with men. Int J STD AIDS 2007; 18: 77-80.
-
Palefsky JM, Holly EA, Ralston ML, et al. Anal squamous intraepithelial lesions in HIV-positive and HIV-negative homosexual and bisexual men: prevalence and risk factors. J Acquir Immune Defic Syndr Hum Retrovirol. 1998; 17: 320-26.
-
Hessol NA, Holly EA, Efird JT, et al. Anal intraepithelial neoplasia in a multisite study of HIV-infected and high-risk HIV-uninfected women. AIDS. 2009; 23: 59-70.
-
Chin-Hong PV, Vittinghoff E, Cranston RD, et al. Age-related prevalence of anal cancer precursors in homosexual men: the EXPLORE study. J Natl Cancer Inst. 2005; 97: 896-905.
-
Mallari A, Schwartz T, Luque A, Polashenski P, Rauh S, Corales R. Anal Cancer Screening in HIV-Infected Patients: Is It Time to Screen Them All?. Dis Colon Rectum 2012; 55: 1244–50.
-
Nahas CS, Lin O, Weiser MR, Temple LK, Wong WD, Stier EA. Prevalence of perianal intraepithelial neoplasia in HIV-infected patients referred for high-resolution anoscopy. Dis Colon Rectum. 2006;49:1581–86.
-
Cranston RD, Hart SD, Gornbein JA, Hirschowitz SL, Cortina G, Moe AA. The prevalence, and predictive value, of abnormal anal cytology to diagnose anal dysplasia in a population of HIV-positive men who have sex with men. Int J STD AIDS. 2007; 18: 77–80.
-
Fox PA, Seet JE, Stebbing J, et al. The value of anal cytology and human papillomavirus typing in the detection of anal intraepithelial neoplasia: a review of cases from an anoscopy clinic. Sex Transm Infect. 2005; 81: 142–46.
-
Lee A, Young T, Hanks D, Ung R, Stansell J. The evaluation of anal dysplasia with anal cytology (PAP) followed by high resolution anoscopy (HRA) and biopsy in HIV-infected men. Oral Abstract session: The XV International AIDS Conference. 2004.
-
Machalek DA, Poynten M, Jin F, et al. Anal human papilomavirus infection and associated neoplastic lesions in men who have sex with men: a systematic review and meta-analysis. Lancet Oncol. 2012;13:487–500.
-
Kreuter A, Brockmeyer NH, Hochdorfer B, et al. Clinical spectrum and virologic characteristics of anal intraepithelial neoplasia in HIV infection. J Am Acad Dermatol. 2005;52:603–08.
-
Sendagorta E, Herranz P, Guadalajara H, et al. Prevalence of Abnormal Anal Cytology and High-Grade Squamous Intraepithelial Lesions Among a Cohort of HIV-Infected Men Who Have Sex With Men. Dis Colon Rectum 2014; 57: 475–81.
-
Giménez F, Costa-e-Silva IT, Daumas A, Araújo J, Medeiros SG, Ferreira L. The value of high-resolution anoscopy in the diagnosis of anal cancer precursor lesions in HIV-positive patients. Arq Gastroenterol 2011; 48: 136-45.
-
Berry J, Palefsky JM, Jay N, et al. Performance Characteristics of Anal Cytology and Human Papillomavirus Testing in Patients with High-Resolution Anoscopy-Guided Biopsy of High-Grade Anal Intraepithelial Neoplasia. Dis Colon Rectum 2009; 52: 239-47.
-
Cranston R, Darragh T, Holly E, et al. Self-collected versus clinician-collected anal cytology specimens to diagnose anal intraepitelial neoplasia in HIV-positive men. J Acquir Immune Defic Syndr 2004; 36: 915-20.
-
Salit I, Tinmouth J, Lytwyn A, Chapman W, Mahony J, Raboud J. Anal cancer screening: test characteristics of cytology and oncogenic HPV testing for the detection of anal dysplasia [meeting abstract #899]. Program and Abstracts of the 12th Annual Conference on Retroviruses and Opportunistic Infections, 2005.
-
Nahas CSR, Edesio V, Da Silva F, Aluisio AC, Segurado MD, Raphael F. Screening Anal Dysplasia in HIV-Infected Patients: Is There an Agreement Between Anal Pap Smear and High-Resolution Anoscopy-Guided Biopsy? Dis Colon Rectum 2009; 52: 1854–63.
-
Palefsky JM, Holly EA, Efirdc JT, et al. Anal intraepithelial neoplasia in the highly active antiretroviral therapy era among HIV positive men who have sex with men. AIDS. 2005;19:1407–14.
-
Goldstone S, Johnstone A, Moshier E, Long-term Outcome of Ablation of Anal High-grade Squamous Intraepithelial Lesions: Recurrence and Incidence of Cancer. Dis Colon Rectum 2014; 57: 316–23.
COMENTARIOS SESIÓN SACP Viernes 14 de Noviembre de 2014
DISCUSIÓN
Dra. Luciana La Rosa: Te quería preguntar una cosa, vos dijiste que había más o menos un 30% de los pacientes en los que el PAP les había dado positivo para alto grado, y no habían visto nada en la anoscopía de alta resolución. Me gustaría saber qué hicieron en esos pacientes. Y por otro lado, cómo siguen después a los pacientes a los que diagnosticaron una lesión de alto grado y los trataron. ¿Hacen alguna diferencia entre los VIH positivos y los negativos?
Dra. Gisela Presencia: Los pacientes que tuvieron lesiones por PAP y que no las encontramos por anoscopía, las volvimos a citar. En dos casos pudimos hallar lesiones de alto grado y obviamente los tratamos. En principio generalmente comenzamos con imiquimod. Si no, lo que estamos usando es el coagulador infrarrojo, debido a la dificultad de quirófano de hacer una resección quirúrgica guiada por anoscopía. Y el seguimiento, si tratamos con coagulador infrarrojo una lesión de alto grado, generalmente a los 3 meses lo volvemos a citar para ver que todo el margen ha sido tratado. Y lo mismo, las lesiones de alto grado generalmente las estamos citando, si las tratamos con infrared, cada 3 meses para también saber si las estamos tratando en forma correcta.
Dr. Alejandro Moreira Grecco: En primer lugar quería felicitarte, muy prolijo el trabajo y muy bien presentado. En cuanto a la incidencia que ustedes presentan de alto grado, te quería decir que no es baja. Nosotros tenemos 7%, o sea ustedes tienen más del doble de incidencia de lesiones de alto grado. Y cuando lo comparas con la serie de Palefsky vos tenés que pensar que en los últimos años, Palefsky es como un centro de derivación terciario de los pacientes que ya tienen diagnóstico de alto grado, entonces que la mayoría de los pacientes que va a ver él son de alto grado, o sea que me parece que 17% es un muy buen número de detección de lesiones de alto grado.
Nosotros, en cuanto a la citología, encontramos lo mismo, que cuando la citología es positiva para alto grado tienen las lesiones, y no tiene tanta sensibilidad para las lesiones de bajo grado.
La que te quería hacer es si se han planteado, como ustedes hacen anoscopía, hacer directamente la anoscopía magnificada sin hacer citología previa.
Dra. Gisela Presencia: En el transcurso de esta investigación hubo varios planteos, si también hacíamos PAP seguido de anoscopía en el mismo momento, si sólo nos guiábamos por el PAP patológico. Fue todo un aprendizaje, una curva, yo creo que el PAP sirve en un momento porque a uno a veces se le pierde una lesión o porque tienen condilomas grandes o hemorroides. Y si el PAP te da de alto grado también es importante si no encontraste nada en la anoscopía, para poder volver a citarlo. Así que creo que el PAP sirve, mismo también para que cualquiera lo pueda hacerlo y lo pueda derivar, si el PAP da patológico, a lugares donde hacen anoscopía.
Dr. Fernando Serra: Voy a hacer un par de comentarios. Uno sobre la exclusión de los pacientes que han tenido antecedente de cáncer de ano. Michael Berry ya propone realizar dentro del seguimiento a todos los pacientes que han tenido antecedentes de cáncer de ano, PAP y anoscopía de alta resolución por el simple hecho de que el tratamiento no elimina el HPV. Y la primera forma de manifestación es una neoplasia intraepitelial de bajo o alto grado.
Y después la otra cosa es que a mí también por recomendación del grupo de Palefsky y de Goldstone, es no realizar el PAP anal de forma aislada y después derivar a un centro de referencia porque no vas a tener un patólogo entrenado en hacer PAP y generalmente recomiendan hacerlo donde puede hacer todo el procedimiento, tanto sea PAP, anoscopía, anoscopía de alta resolución y tratamiento de la lesión.
Nada más, felicitaciones.
Dr. Alejandro Gutierrez: Muchas gracias. Primero felicitarte, está muy prolijo y muy bien presentado. Tal vez lo dijiste y no escuché, ¿qué aumento utilizan?
Dra. Gisela Presencia: Comenzamos la primera parte, teníamos otro videocolposcopio, con 16, y los últimos casos de 25 (15 y 25).
Dra. Luciana La Rosa: Sólo un comentario, con respecto al screening que mencionaba recién el doctor. Yo creo que, al margen de que es cierto que lo mejor es poder hacer las dos cosas, me parece que para empezar hacer un tacto anual a la población de riesgo es algo, en lugares donde no contamos con el patólogo, ni siquiera para tomar un PAP o la anoscopía de alta resolución. Y si no, poder hacer el PAP y que haya un patólogo interesado, y poder derivar después a otro centro. Porque lamentablemente en la mayor parte de nuestro país, no contamos con los recursos con los que tenemos acá, y por eso yo insisto tanto siempre con el tema del tacto. El tacto está al alcance de todo el mundo y es fácil detectar lesiones, digamos un poco más groseras, pero mejor que nada es.
Dr. René Bun: ¿Te puedo hacer una pregunta? Aunque la transición de carcinoma in situ al carcinoma anal invasor, es una posibilidad análoga a la del carcinoma del cuello uterino, esto no lo pude comentar en muchos años. ¿Me podría decir si vio esa transformación de una displasia severa a un carcinoma invasor?
Dra. Gisela Presencia: En dos años con el tratamiento instaurado no vimos ninguna progresión. Sí hay un caso de un paciente que fue tratado por condilomas, no siguió en control y a los 2 años concurrió con un carcinoma invasor.
Dr. René Bun: Mi experiencia muy breve, en 26 años asistí a 2.340 pacientes con HIV, 1.300 verrugas diagnosticadas y tratadas en forma personal. De ese grupo, 52 displasias. Treinta y ocho carcinomas invasor de células escamosas y canal anal, 6 carcinomas verrugosos de Akcerman, y 3 enfermedad de Bowen. Todos estos están perfectamente documentados, seguidos, y cada 3 meses tanto las displasias como los carcinomas invasores, están vigilados.





