REV ARGENT COLOPROCT | 2014 | VOL. 25, Nº 3
RELATO ANUAL
CAPÍTULO 11
Estadificación del carcinoma del recto post-neoadyuvancia
Dr. Jorge A. Hequera
Después de la neoadyuvancia los estudios por imágenes pueden mostrar una reducción en el tamaño tumoral (downsizing) o en el estadío T de la lesión (downstaging) o una remisión tumoral completa.
Los problemas actuales del diagnóstico se deben a limitaciones en la capacidad para evaluar la respuesta tumoral a la radio y quimioterapia, usando Ultrasonido, Resonancia Magnética o Tomografía Computada.1
En forma genérica podría decirse que la respuesta clínica es completa cuando “el tumor no se ve ni se palpa digitalmente”. Hay hallazgos endoscópicos, que reafirman éste concepto y que pueden describirse como positivos y otros que caracterizan la poca efectividad de la neo-addyuvancia y que se rotulan como negativos.
Hallazgos positivos:
- Color blanquecino de la mucosa donde asentaba el tumor.
- Presencia de pequeñas telangectasias en la misma localización.
- Leve pérdida de los pliegues de la mucosa.
Hallazgos negativos:
- Ulcera profunda con o sin centro necrótico.
- Ulcera superficial o irregularidad de la mucosa.
- Nódulo palpable en la zona donde asentaba el tumor, incluso en presencia de mucosa indemne.
-
Estenosis significativa que impida el paso del rectoscopio.
Objetivos de los estudios por imágenes post-neoadyuvancia
- Reevaluar el tumor
- Determinar el grado de respuesta al tratamiento
- Ayudar a planificar el tipo de intervención
- Establecer la extensión de la resección quirúrgica
Rol de la ecografía endo-rectal
Por convención, la estadificación postoperatoria de un carcinoma rectal post-neoadyuvancia “refleja el grado tumoral presente en la pieza de resección y no se usa para explicar la propagación del tumor antes del tratamiento”.2 En realidad no se realiza una re-estadificación tumoral. Sólo se cuantifica la reducción del tumor, lo que de acuerdo a sus límites, posibilitará una terapéutica con conservación esfinteriana.
Murad-Regadas y col.3,4 han insistido en la medición, que posibilita la Ecografía 3D, de la distancia entre el borde inferior del tumor y el extremo proximal del EAI, y sus implicancias en la terapéutica quirúrgica. Con ésta metodología, en la evaluación post-neoadyuvancia, un margen de 2 o más cm., desde esos límites, permite planear cirugías no amputativas. Esto lo han demostrado en la evaluación imagenológica que se correlacionó con la anatomía patológica post-operatoria. La respuesta patológica completa mostrada por la ecografía 3D fue también confirmada por la histopatología y ello ocurre porque técnicamente la alta frecuencia (16 MHz) usada por éste método produce imágenes con alta resolución espacial que, “hace posible diferenciar lesiones residuales de tejido inflamatorio e identificar todas las capas de la pared rectal en el sitio previamente ocupado por el tumor”.3
El grupo de Arias y col. (Farina P., Arias J., Gutierrez A. y col. Evaluación de la ecografía 360° en 3D para predecir la respuesta a la neoadyuvancia en cáncer del recto. Presentación oral en la XVI Reunión Nacional de la Fundación de la Asociación Española de Coloproctología, 9 al 11 de mayo 2011, Sevilla,España) evaluaron la utilidad de la Ecografía 360° tridimensional como predictor de la respuesta clínica y patológica en carcinomas del recto (Fig. 1) a los que se realizó neoadyuvancia. Propusieron una clasificación de acuerdo a la respuesta ecográfica según el tamaño de reducción de la masa tumoral. La misma se la divide en 5 grados y se expone a continuación:
Grado 1: Respuesta ecográfica completa: reducción total de la masa tumoral (anatomía normal) (Fig. 2)
Grado 2: Respuesta ecográfica casi completa: reducción de la masa tumoral > de un 80%
Grado 3: Respuesta ecográfica moderada : reducción de la masa tumoral entre 50 y 80% (Fig. 3)
Grado 4: Respuesta ecográfica leve : reducción de la masa tumoral entre el 20 y 50%
Grado 5: Respuesta ecográfica nula: reducción por debajo del 20%
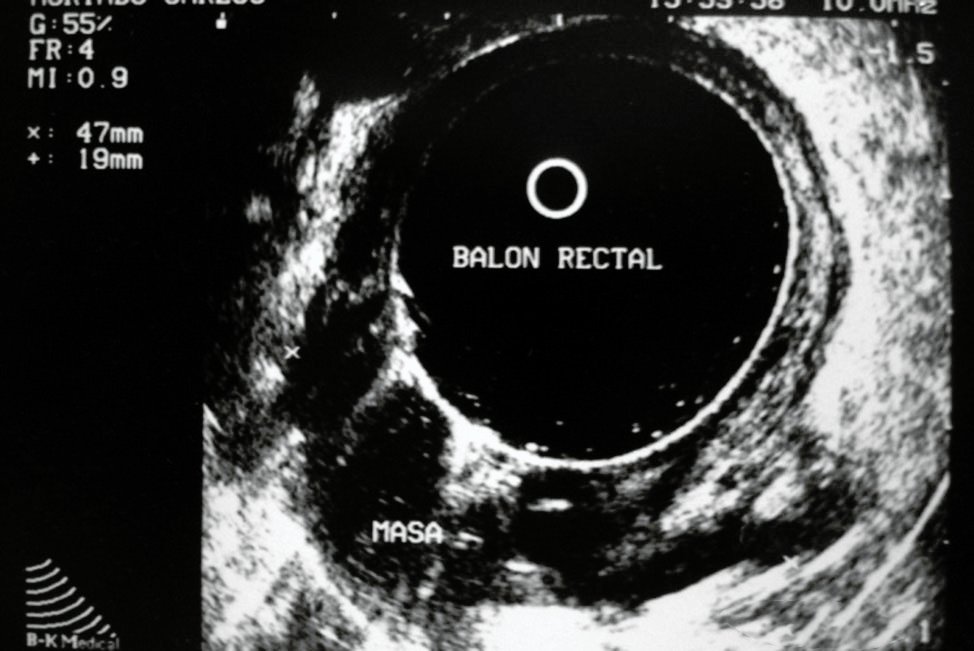
Figura 1: Tumor rectal pre-neoadyuvancia
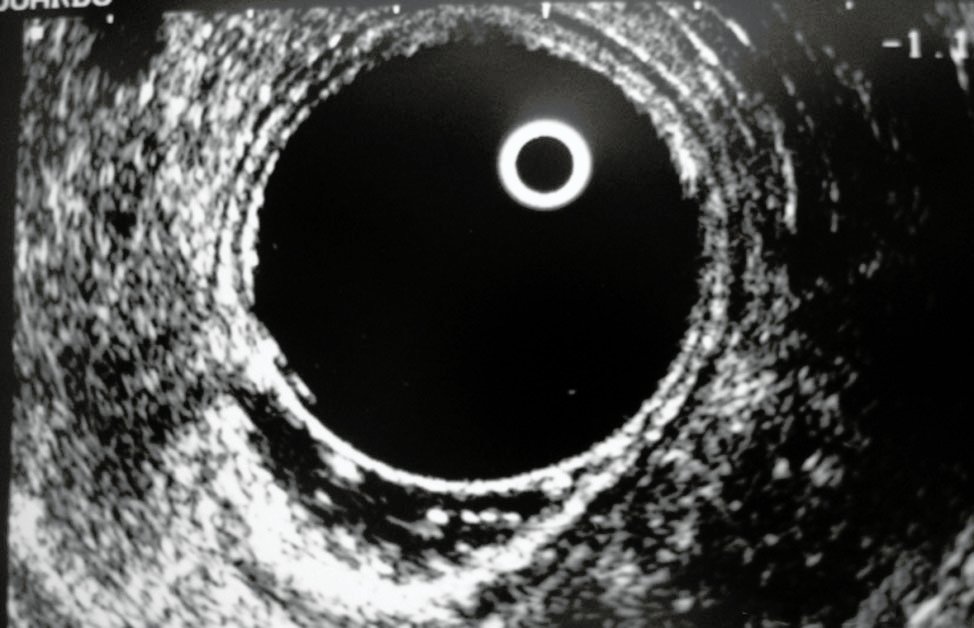
Figura 2: Respuesta completa post neoadyuvancia (grado 1)
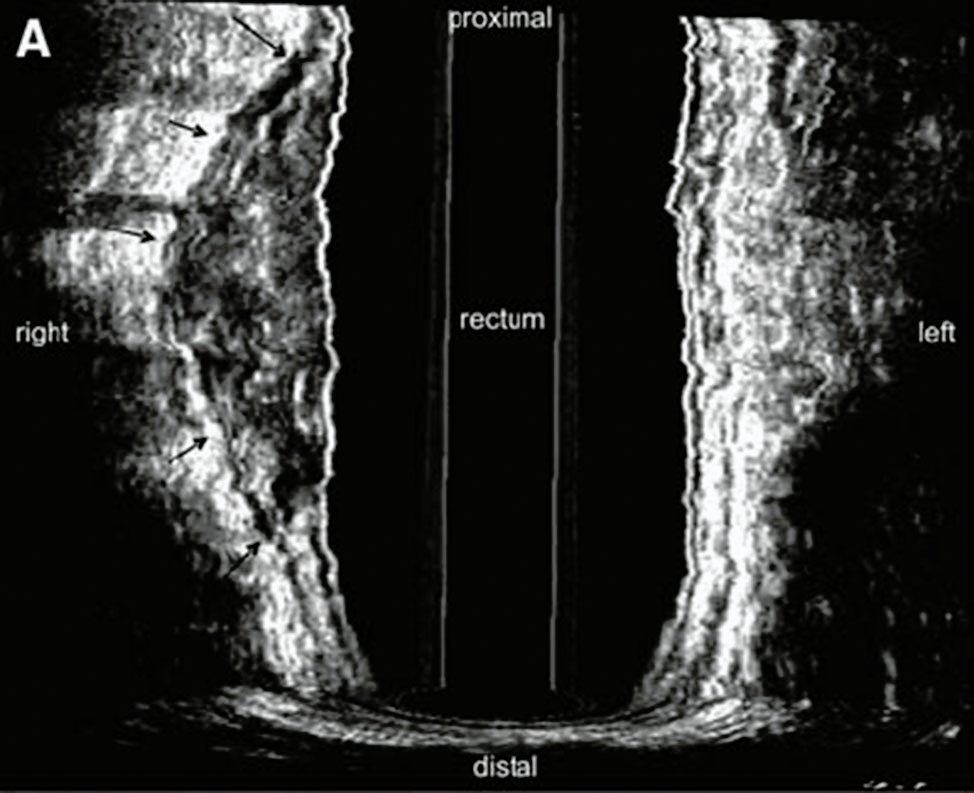
Figura 3: respuesta parcial post neoadyuvancia (grado 3)
Los parámetros para estadificar los ganglios como positivos fueron:
- Presencia de nódulos hipoecoicos
- Bordes bien definidos
- Bordes redondeados
- Tamaño de > de 3 mm
La sensibilidad y especificidad en la evaluación del uT y del uN fue del 68.3% y 82.3%; y del 76.6% y 80.2% respectivamente.
En un trabajo reciente5 la precisión diagnóstica post-neoadyuvancia, para la estadificación T disminuyó de 86 a 72% pero la estadificación N mostró una leve mejoría yendo de 71 a 80% y la ultrasonografía (así como la TC y la RMN) tuvo diagnóstico correcto sólo en el 50% de los pacientes post-neoadyuvancia, para predecir un estadío ToNo. La disminución en la predicción diagnóstica, está dada por:
- Edema post-radioterapia
- Inflamación peritumoral
- Fibrosis
- Necrosis del tumor
Por consiguiente puede haber tanto infraestadificación por la presencia de nidos tumorales viables en el seno de áreas fibróticas imposibles de identificar en pruebas de imágenes, como sobreestadificación por la estimación como tumor de zonas de fibrosis.
¿Cómo debería hacerse la estadificación post-neoadyuvancia?
Se siguen las mismas pautas de la estadificación pre-tratamiento, utilizando fundamentalmente el examen físico, el laboratorio y las imágenes.
- Examen digital
- Endoscopía rígida y flexible
- CEA
- Ultrasonografía y Resonancia Magnética de alta resolución
- Resonancia Magnética con técnica de difusión
- PET/TC
Para mejorar el diagnóstico, posiblemente sea necesario realizar una combinación de imágenes estructurales (CT, RMN y US) e imágenes funcionales (PET)4,6
BIBLIOGRAFÍA
- Sauer R., Becker H., Hohenberg W. y col. German rectal cancer study group: preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004;351:1731-1740
- Chapuis PH., Chan C. y Dent OF. Clinicopathological staging of colorectal cancer: evolution and consensus- an Australian perspective. J Gastroenterol Hepatol 2011;26:58-64
- Murad-Regadas SM., Regadas SF., Rodrigues LV. y col. Role of the three-dimensional anorectal ultrasonography in the assessment of rectal cancer after neoadjuvant radiochemotherapy: preliminary results. Surg Endosc DOI 10.1007/s00464-008-0150-3
- Murad-Regadas SM., Regadas SF., Rodrigues LV. y col. Criteria for three-dimensional anorectal ultrasound assessment of response to chemoradiotherapy in rectal cancer patients. Colorectal Disease 2010;13:1344-1352
- Maor Y., Nadler M., Barshak I. y col. Endoscopic ultrasound staging of rectal cancer: diagnostic value before and following chemoradiation. J Gastroenterol Hepatol 2006;21:454-458
- Swartling T., KäleboP., Derwinger K. y col. Etapa y tamaño usando imágenes de resonancia magnética y la ecografía en pacientes con cáncer del recto tratados con neoadyuvancia. Mundial J Gastroenterol 2013;19:3263-3271
Rol de la resonancia magnética nuclear
La disminución de la estadificación (“downstaging”) ha sido considerada como un marcador de la radiosensibilidad tumoral. Por eso la comparación con las imágenes pre-tratamiento es esencial porque es difícil visualizar la zona tumoral en los pacientes con buena respuesta al tratamiento
Interpretación de las imágenes post-neoadyuvancia
Hay tres opciones:
- Areas de fibrosis que aparecen con señales de intensidad muy baja (Fig. 4).
- Tumor residual con señales intermedias (similar a la imagen basal pre-tratamiento) (Fig. 5).
-
Lagos de mucina (como respuesta tumoral coloide) con señales de muy alta intensidad (Fig. 6).
Es necesario destacar que un pool de mucina acelular en especímenes de pacientes que recibieron neoadyuvancia, representan un tumor completamente erradicado y no se usa para asignar pT o conteo como ganglios positivos.
Grado histopatológico de respuesta tumoral
La radioterapia modifica el aspecto macro y microscópico del tumor.
Los cambios incluyen:
- Fibrosis marcada, con o sin reemplazo de células neoplásicas por células inflamatorias
- Posible producción de lagos de mucina
El grado de respuesta tumoral a la radioterapia se evalua describiendo:
- Profundidad de diseminación local (ypT)
- Estadío ganglionar (ypN)
- Grado de regresión tumoral (Las imágenes se detallan en el capítulo respectivo)
Hay varias clasificaciónes (Mandard, Dworak, Ryan, etc. que se explicitan en otra sección de éste Relato)
Tiempo apropiado de reestadificación
Cuando se re-estadifica un tumor irradiado, en un período corto después de finalizada la neoadyuvancia, puede haber estadificaciones incorrectas por la falta de discriminación, al comienzo, entre el tumor residual y los cambios inflamatorios post-irradiación. Ello se mostró en un trabajo reciente1 donde la correlación entre las imágenes y la histopatología para la estadificación T, fue del 88% cuando la RMN se realizó entre 11 y 12 semanas post neoadyuvancia comparada con el 59% de coincidencia cuando las imágenes se hicieron a las 6 semanas post-tratamiento.
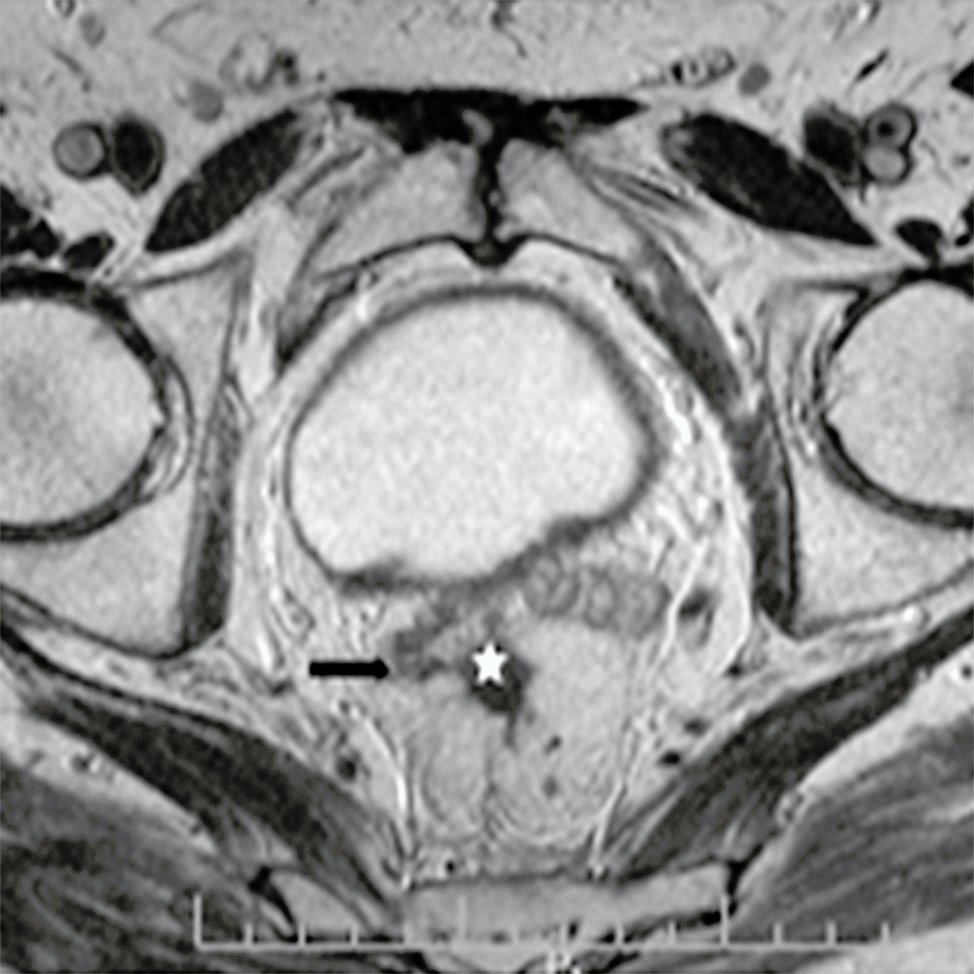
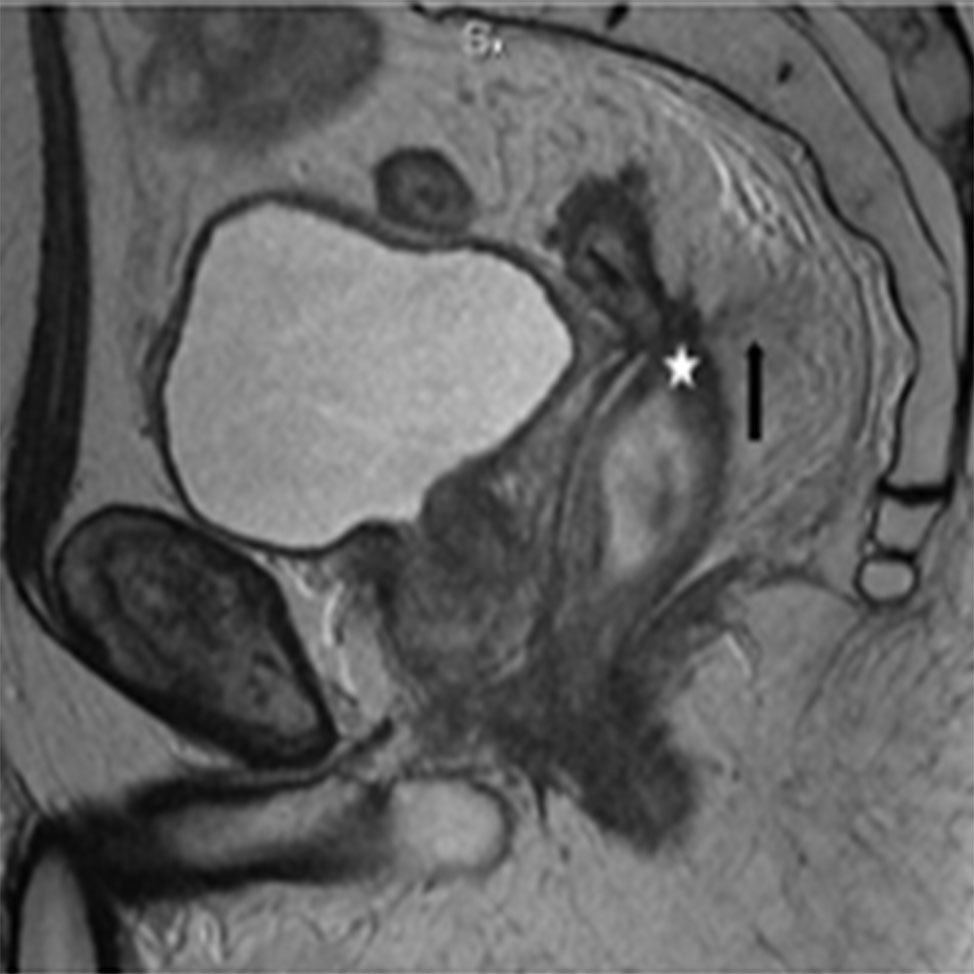
Figura 4: RM AR, secuencias axial y sagital T2. Fibrosis de la pared rectal con disminución de su luz (estrella) y retracción de vesículas seminales y mesorecto (flechas negras).
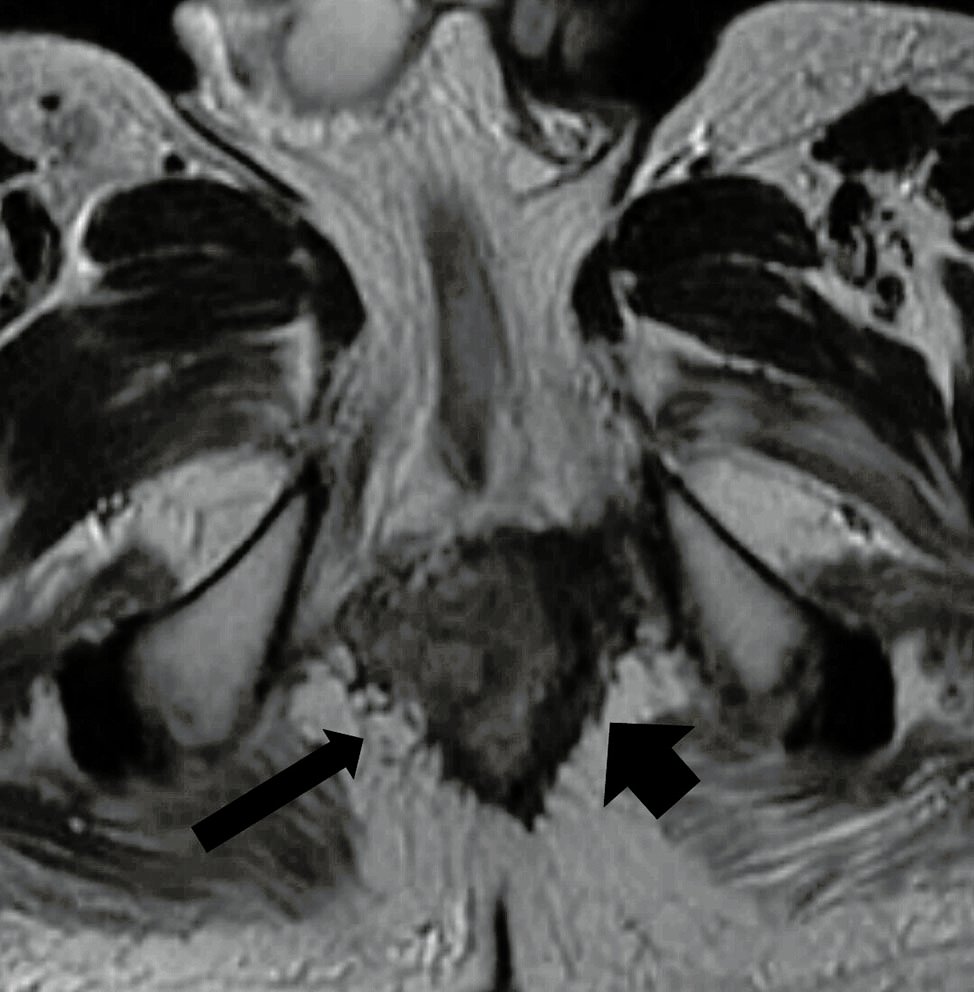
Figura 5: RM AR, secuencia axial T2. Señal gris intermedia correspondiente a persistencia tumoral (flecha larga) frente a áreas de fibrosis (flecha corta).
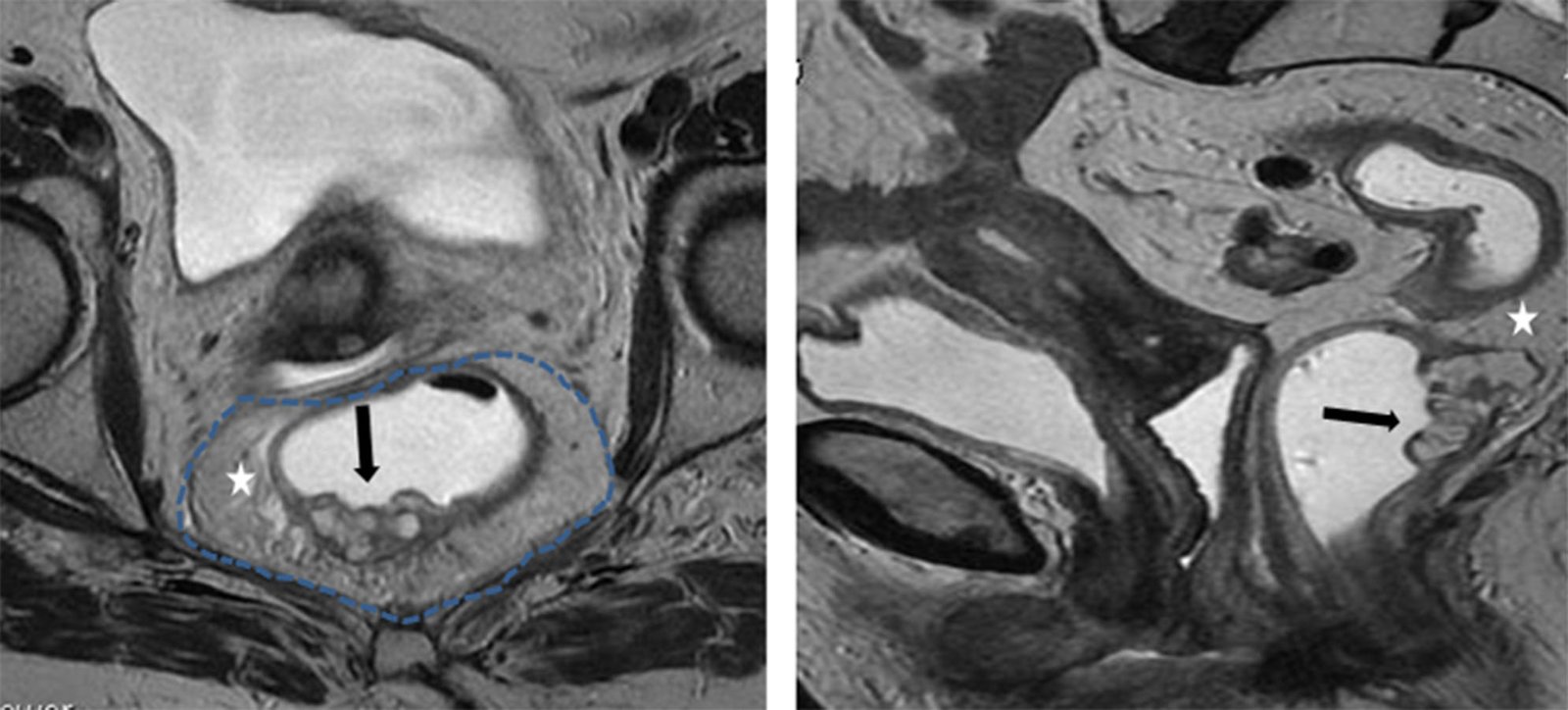
Figura 6: RM AR, secuencias axial y sagital T2. Áreas de mucina, hiperintensas (flechas negras), mesorecto (estrella), fascia mesorectal (línea de puntos).
BIBLIOGRAFÍA
- Johnston DF., Lawrence KM., Sizer BF. y col. Locally advanced rectal cancer: histopathological correlation and predictive accuracy of serial RMN after neoadjuvant chemotherapy.Br J Radiol 2009;82:332-336
Estadificación con RMN con técnica de difusión (DWI)
La DWI (imagen de difusión ponderada, por su sigla en inglés) es una técnica de imagen funcional de RMN que usa las diferencias de movimiento de los protones del agua extracelular (movimiento Browniano) para diferenciar los tejidos según el grado de celularidad, como respuesta a una energía térmica. Depende de la arquitectura, densidad e integridad de las membranas celulares, asi como de la vascularización.
En tejidos con celularidad normal, los movimientos de protones son relativamente libres, lo que condiciona una disminución de la señal con la DWI.
Por el contrario, en tejidos con hipercelularidad (tumores) la difusión del agua está limitada y como resultado se obtiene una elevada y persistente señal en la DWI.
Durante la adquisición de las imágenes se utiliza un parámetro llamado valor b que se expresa en seg/mm2 y mide el movimiento de las moléculas reflejando el aumento o la caída de la señal en las imágenes.
Con las imágenes obtenidas se realiza un análisis cuantitativo y cualitativo en la estación de trabajo (Fig. 7 A, B, C).
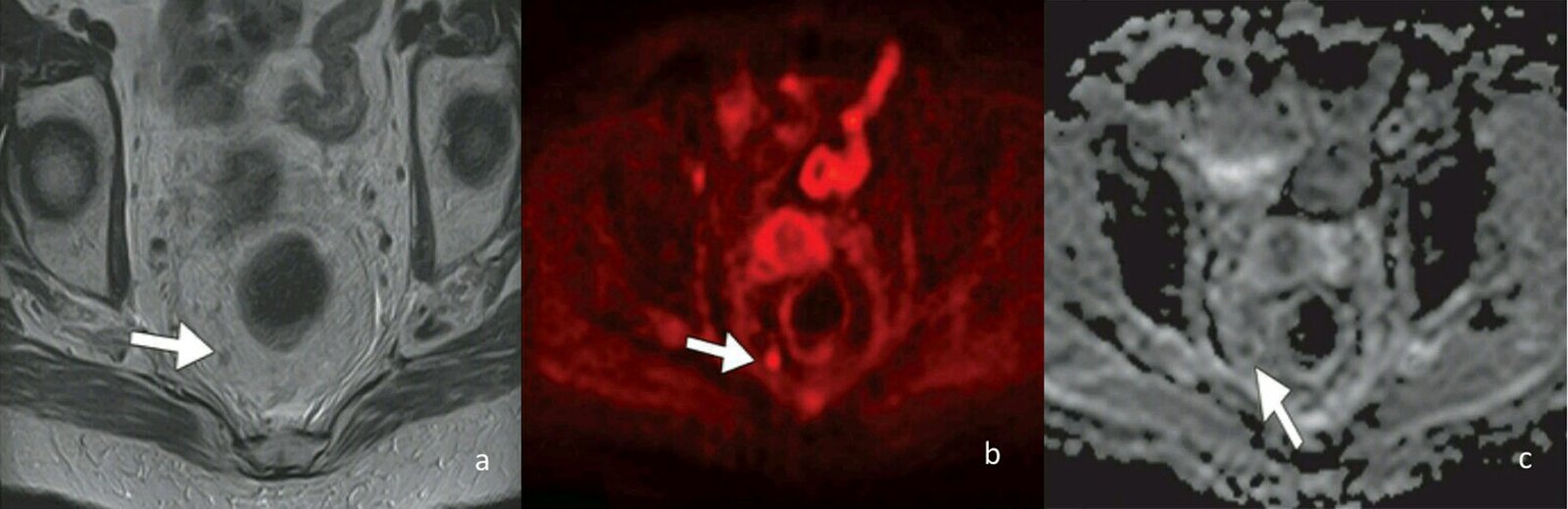
Figura 7: (a) Secuencia morfológica de alta resolución axial T2 . Ganglio mesorrectal (flecha). (b) Secuencia de difusión el ganglio restringe su señal o brilla. (c) En la estación de trabajo se procesa el mapa ADC y éste muestra caída de su señal
Análisis cualitativo: se analizan las imágenes en escala de grises.
Análisis cuantitativo: el valor de la difusión del agua en los tejidos es medido por el coeficiente de difusión aparente (ADC por su sigla en inglés). La reducción del ADC refleja el estándar histológico de mayor densidad celular, lo que inhibe el movimiento efectivo del agua, restringe la difusión y causa caída de la señal.
Una adenopatía metastásica brilla en la secuencia de difusión con caída en el mapa de ADC. Se utiliza un umbral de 1,0 a 1,38 x 10-3 sec/mm2 con una sensibilidad y especificidad mayor al 90% para diferenciarlos.
La DWI es una alternativa a la FDG-PET. En el recto permite el diagnóstico diferencial entre tejido neoplásico y tejido normal y además también posibilita detectar pequeños tumores. Sin embargo, la consideración más importante es definir cúan fiable es el método para evaluar la respuesta tumoral al tratamiento neoadyuvante. Los resultados preliminares para ésta re-estadificación, afirman ésta posibilidad.1-3
Los cambios en el ADC tienen correlación con:
- Desarrollo de fibrosis intratumoral post-neoadyuvancia2
- Muerte celular por apoptosis, histológicamente probada4
- Reducción del tamaño tumoral1
BIBLIOGRAFÍA
- Dzik-Jurasz A., Domening C., George M. y col. Diffusion MRI for prediction of response of rectal cancer to chemoradiation. Lancet 2002;360:307-308
- Barbaro B., Vitale R., Vecchio FM. y col. Restaging locally advanced rectal cancer with MR imaging after chemoradiation therapy. Radiographics 2010;30.699-716
- Hein PA., Kremser C., Judmaier W. y col. Diffusion-weighted magnetic resonance imaging for monitoring diffusion changes in rectal carcinoma during combined, preoperative chemoradiation: preliminary results of a prospective study. Eur J Radiol 2003;45:214:222
- Chinnaiyan AM., Prasad U., Shankar S. y col. A combined effect of tumor necrosis factor-related apoptosis-inducing ligand and ionizing radiation in breast cancer therapy. Proc Natl Acad Sci USA 2000;97:1754-1759
Estadificación con PET/TC
Las imágenes convencionales morfológicas para evaluar la respuesta a la neoadyuvancia tienen, como se refirió antes, limitaciones por la necrosis, fibrosis y edema.
Una alternativa es la Tomografía por Emisión de Positrones (PET) con fluor-2-desoxi D- glucosa (FDG-PET) combinada con TC (FDG-PET/TC) que permite obtener resultados más eficaces en la detección de recidivas locales en pacientes con cirugías sin quimioradioterapia o con ellas.1-3 Este examen debe realizarse en una etapa alejada de la irradiación para evitar el riesgo de los falsos positivos relacionados con la radioterapia.1
El PET, no sólo puede visualizar la recidiva local, sino también las metástasis alejadas, especialmente las hepáticas.4 También hay trabajos que refieren5-6 que la evaluación de la respuesta metabólica con FDG-PET permite predecir resultados a largo plazo demostrado por la reducción tumoral del SUV (valor de captación estandarizada de la glucosa).
En otro apartado de éste Relato se desarrollan los conceptos y aplicaciones del PET.
BIBLIOGRAFÍA
- Even-Sapir E., Parag Y., Lerman H. y col. Detection of recurrence in patients with rectal cancer: PET/CT after Abdominoperineal or anterior resection. Radiology 2004;323:815
- Fukunaga H., Sekimoto M., Ikeda M. y col. Fusion of image of positrón emission tomography and computed tomography for the diagnosis of local recurrence of rectal cancer. Ann Surg Oncol 2005;12:561
- Moore HG., Akhurst T., Larson SM. y col. A case-controlled study of 18-fluorodeoxyglucose positrón emission tomography in the detection of pelvic recurrence in previously irradiated rectal cancer patients. J Am Coll Surg 2003;197-22
- Chessin DB., Kiran RP., Akhurst T. y col. The emerging role of 18-fluorodesoxyglucose positron emission tomography in the management of primary and recurrent rectal cancer. J Am Coll Surg 2005;201-948
- Kalff V., Duong C., Drummond EG. y col. Findings on 18 F-FDG/PET scan after neoadjuvant chemoradiation provides prognostic stratification in patients with locally advanced rectal cancer subsequently treated by radical surgery. J Nucl Med 2006;47:14-22
- Capirci C., Rubello D., Chiericheti F. y col. Long term prognostic value of 18 FDG PET in patients with locally advanced rectal cancer previously treated with neoadjuvant radiochemotherapy. Am J Roentgenol 2006;187:W202-8
Resumen y conceptos destacables
- La re-estadificación sigue las mismas pautas que la estadificación primaria (examen físico, imágenes y laboratorio).
- La estadificación post-neoadyuvancia tiene limitaciones por los cambios histológicos producidos (necrosis, fibrosis y edema).
- El tiempo apropiado de re-estadificación es cuando los cambios inflamatorios son mínimos o no existen (alrededor de 12 semanas post-irradiación).
- El diagnóstico se mejora combinando imágenes estructurales (TC, RMN, ECO) e imágenes funcionales (PET).
- La disminución de la estadificación (“downstaging”) es un marcador de la radiosensibilidad tumoral.
Grado de regresión tumoral (GRT)
La neoadyuvancia es actualmente un tratamiento estándar para el carcinoma colo-rectal localmente avanzado (T3-T4 y N positivo). La respuesta histológica a ésta terapéutica se denomina “grado de respuesta o regresión tumoral” (TRG por su sigla en inglés).
Esa respuesta tumoral puede ser significativa, con disminución de la estadificación previa (downstaging).1
Obviamente el pronóstico es mejor sino se hallan restos de tumor en el recto resecado luego de la irradiación, o si la presencia de tumor residual es mínima (downsizing)2 y ese pronóstico según el grado de regresión, tiene correlación con la sobrevida.3,4,5
Ello hace que la evaluación anátomo-patológica sea esencial no sólo para ver el GRT sino también para planificar tratamientos adicionales y para establecer pautas pronósticas.6
Hay varios sistemas de estadificación para evaluar la regresión tumoral. Todos evalúan el tumor primario y no se incluyen en el examen los ganglios linfáticos metastásicos. La presencia de lagos de mucina, en los rectos irradiados, se consideran como completa erradicación tumoral y no se usa para asignar un estadío pT o para recuento de ganglios linfáticos.
La respuesta tumoral a la neoadyuvancia o regresión tumoral se traduce en una reducción del volumen tumoral que conduce frecuentemente a una reducción del estadío T (de T3 a T2, de T3 a T1) y del estadío N (N+ a N-). Pero la reducción del estadío T es la disminución de la invasión tumoral en la pared del recto y por lo tanto regresión tumoral no es reducción de estadío T, confusión que a veces ocurre.
Es importante destacar, que aún sin tumor residual en la pared rectal, puede haber restos neoplásicos en los ganglios.
Por ello deben hacerse algunas consideraciones:
- El volumen tumoral puede quedar reducido a unos pocos nidos de células malignas residuales y el estadío T no modificarse
- Puede haber una reducción del estadío T preoperatorio sin una retracción tumoral marcada
- Sólo el grado de regresión tumoral es análogo a la reducción del estadío T cuando hay una respuesta tumoral completa, ya que la misma lleva a un ypT0 (no hay tumor)
- Solo ante la respuesta tumoral completa deben constatarse la ausencia de metástasis ganglionares
La estadificación de la regresión tumoral a través de la histología se realiza registrando la proporción de tumor residual y la reacción inflamatoria y fibrótica que rodea a los nidos tumorales. Es oportuno destacar que si macroscópicamente hay tumor residual en un recto irradiado, el patólogo debe tomar tacos con la misma metodología que en un tumor no irradiado. Si no hay tumor residual macroscópico se incluye toda la pieza y si microscópicamente no se halla tumor, se realiza desgaste en tres niveles de los tacos. Si esta evaluación es negativa se considera regresión completa. Se han propuesto varias clasificaciones y de acuerdo a la ecuación tumor/fibrosis se establece una escala numérica en grados. Hay clasificaciones de 5 grados (Mandard, Dworak) y otras de 4 grados (Ryan), ésta última sostenida por el Colegio Americano de Patólogos.
Cambios microscópicos en la pared rectal
La respuesta al tratamiento neoadyuvante puede causar una regresión tumoral significativa, incluso con desaparición completa del carcinoma y su reemplazo por tejido fibroso o inflamatorio.
Pueden observarse macrófagos con hemosiderina y mucus. También puede objetivarse lo que se llama respuesta coloide o lagos de mucina. Es necesario enfatizar que esas imágenes no deben confundirse con un carcinoma coloide. Sin embargo, hay que insistir que esos lagos de mucina no deben considerarse un tumor residual, pero hay que evaluar con exactitud la ausencia de células tumorales viables.
Una eosinofilia marcada y a menudo asociada con atipías nucleares, son signos histológicos de tumor recurrente post-irradiación.
Cambios microscópicos en los ganglios
Los cambios fibróticos vistos en el tumor primario tratado con neoadyuvancia, también pueden objetivizarse en los ganglios linfáticos.
Se pueden observar nódulos fibróticos con escasas células linfáticas o cambios fibróticos focales y mucina. Hay que descartar pequeños focos de metástasis residuales dentro de la fibrosis antes de afirmar la esterilización del ganglio por efectos de la radioterapia.
Clasificación de Mandard modificada7
La gradación histológica de ésta clasificación y su homóloga de Dworak, se muestran en las figuras 8, 9, 10, 11 y 12.
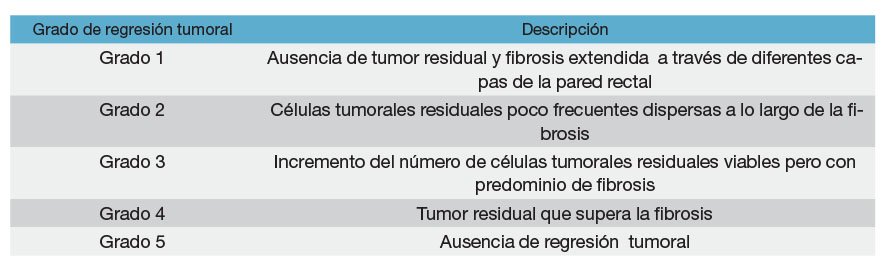
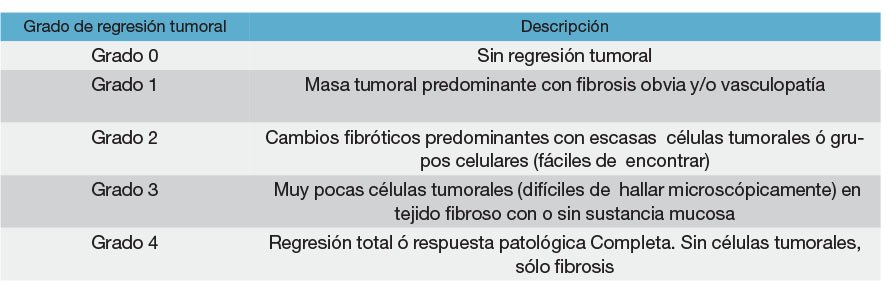
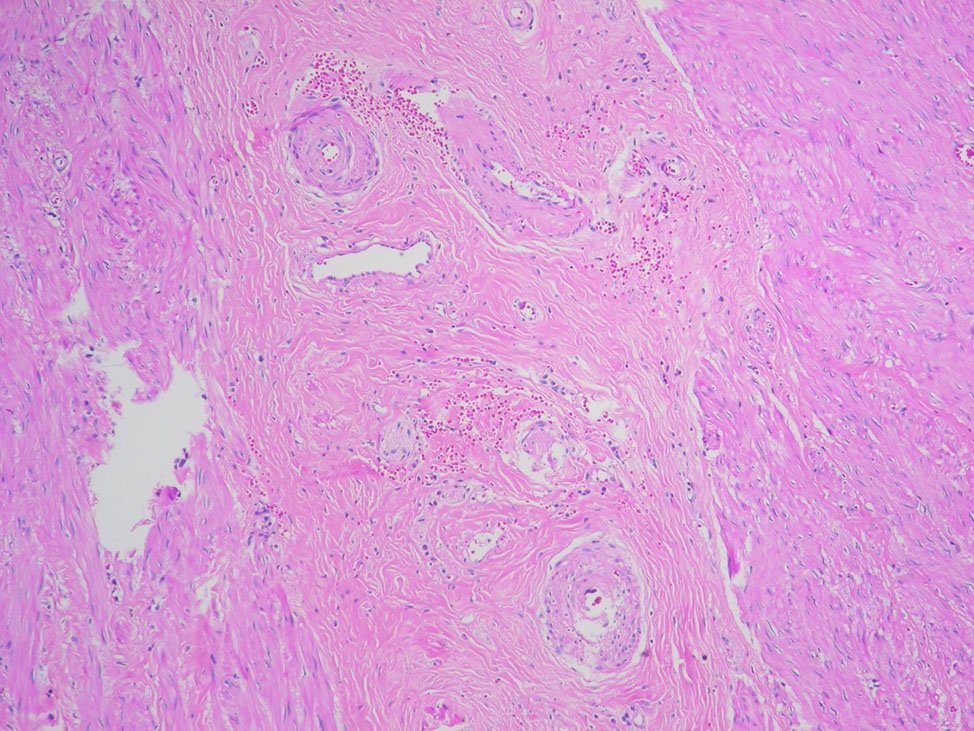
Figura 8: Grado 1, regresión completa
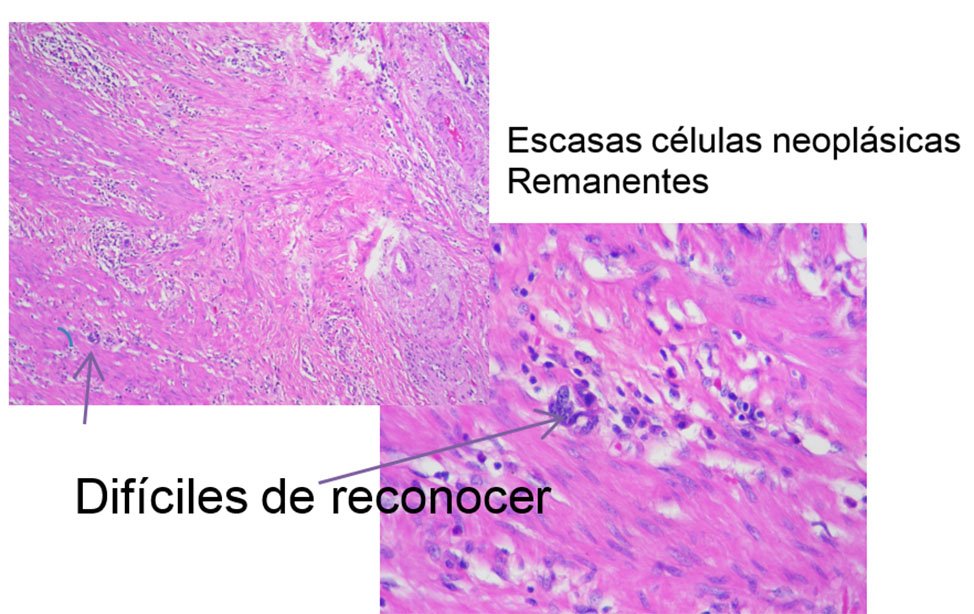
Figura 9: Grado 2
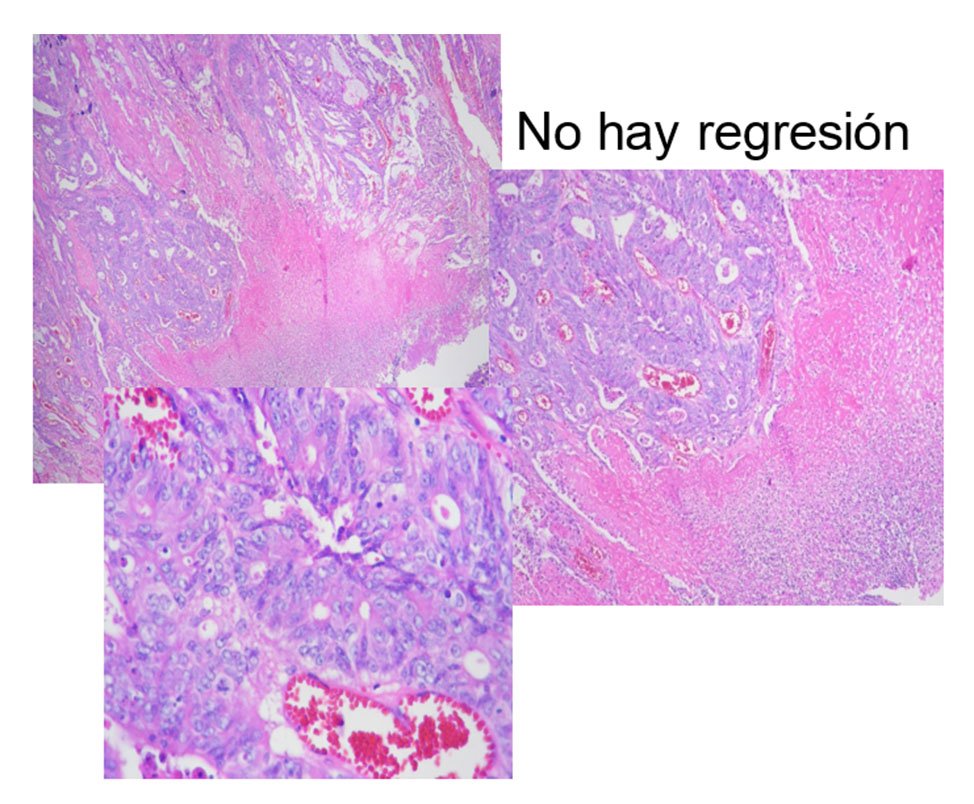
Figura 10: Grado 3
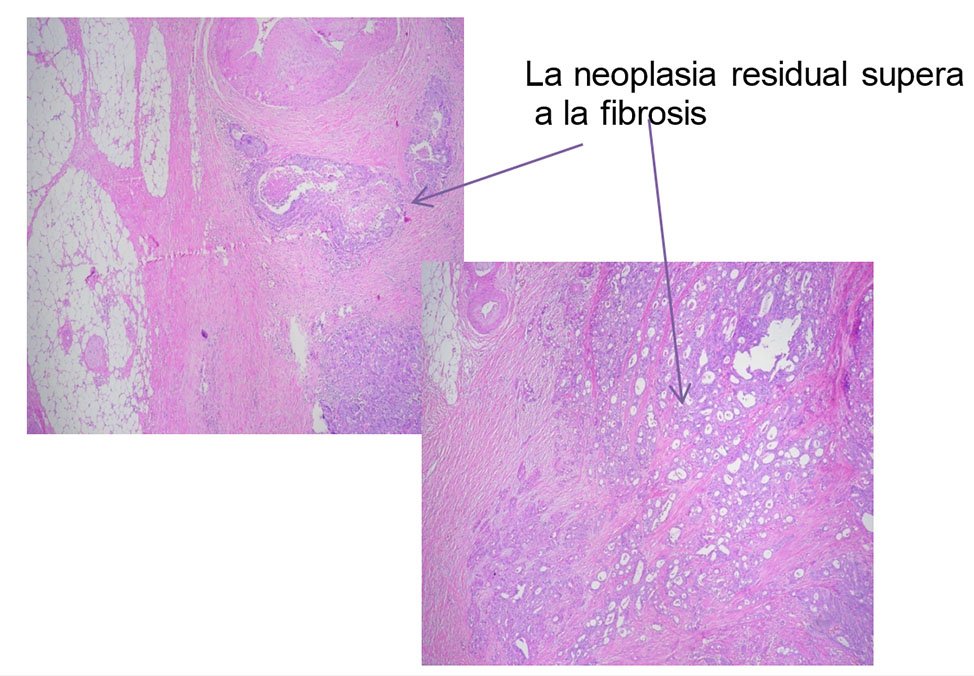
Figura 11: Grado 4

Figura 12: Grado 5
BIBLIOGRAFÍA
- Ruo L., Tickoo S., Klimstra DS. Y col. Long-term prognostic significance of extent of rectal response to preoperative radiation and chemotherapy. Ann Surg2002;236: 75-81
- Gavioli M., Luppi G., Losi L. y col. Incidence and clinical impact of sterelized disease and minimal residual disease after preoperative radiochemotherapy for rectal cancer. Dis Colon Rectum 2005;48: 1851-1857
- Leonard G., Brenner B. y Kemeny N. Neoadjuvant chemotherapy before liver resection for patients with unresectable liver metastases from colorectal carcionoma. J Clin Oncol 2005;23:2038-48
- Rubbria-Brandt L., Giostra E., Brezault C. y col. Importance of histological tumor response assessment in predicting the outcome in patients with colorectal liver metastases treated with neoadjuvant chemotherapy followed by liver surgery. Ann Oncol 2007;18:299-304
- Shia J., Guillem J., Moore H. y col. Patterns of morphologic alteration in residual rectal carcinoma following preoperative chemoradiation and their association with long-term outcome. Am J Surg Pathol 2004; 28:215-23
- Hiotis S., Weber S., Cohen A. y col. Assessing the predictive value of clínical complete response to neoadjuvant therapy for rectal cancer. An analysis of 488 patients. J Am Coll Surg 2002;194:131-5
- Mandard AM., Dalibard F., Mandard JC. Y col. Pathologic assessment of tumor regression of preoperative chemoradiotherapy of esophageal carcinoma. Clinicopathologic correlations. Cancer 1994;73 :2680-2686
- Dworak O., Keilholz L. y Hoffmann A. Pathological features of rectal cancer after preoperative radiochemotherapy. Int J Colorectal Dis 1997;12 :19-23
- Ryan R,Gibbons D., Hyland JMP. y col. Pathological response following long-course neoadjuvant chemoradiotherapy for locally advanced rectal cancer. Histopathology 2005;47: 141-146
Neoadyuvancia y conducta posterior
La neoadyuvancia en los pacientes con carcinomas del recto en estadíos avanzados, ha mostrado beneficios importantes.1-5 La remisión tumoral clínica completa, se ha observado entre el 20-30% de los pacientes, cuando se usa ésta táctica.6-12 En base a éstos hallazgos se ha preconizado, dentro de un contexto de seguimiento estricto y permanente, una conducta no activa, táctica denominada de “watch and wait”.13,14
El grupo de Angelita Habr-Gama (Fig. 13), ha mostrado en un trabajo reciente15 que extendiendo la quimioradiación, la respuesta clínica completa, se logró en el 50% de los pacientes.
En la figura 14 se muestran distintos aspectos endoscópicos de lesiones carcinomatosas del recto post-neoadyuvancia y las imágenes de respuesta clínica completa.
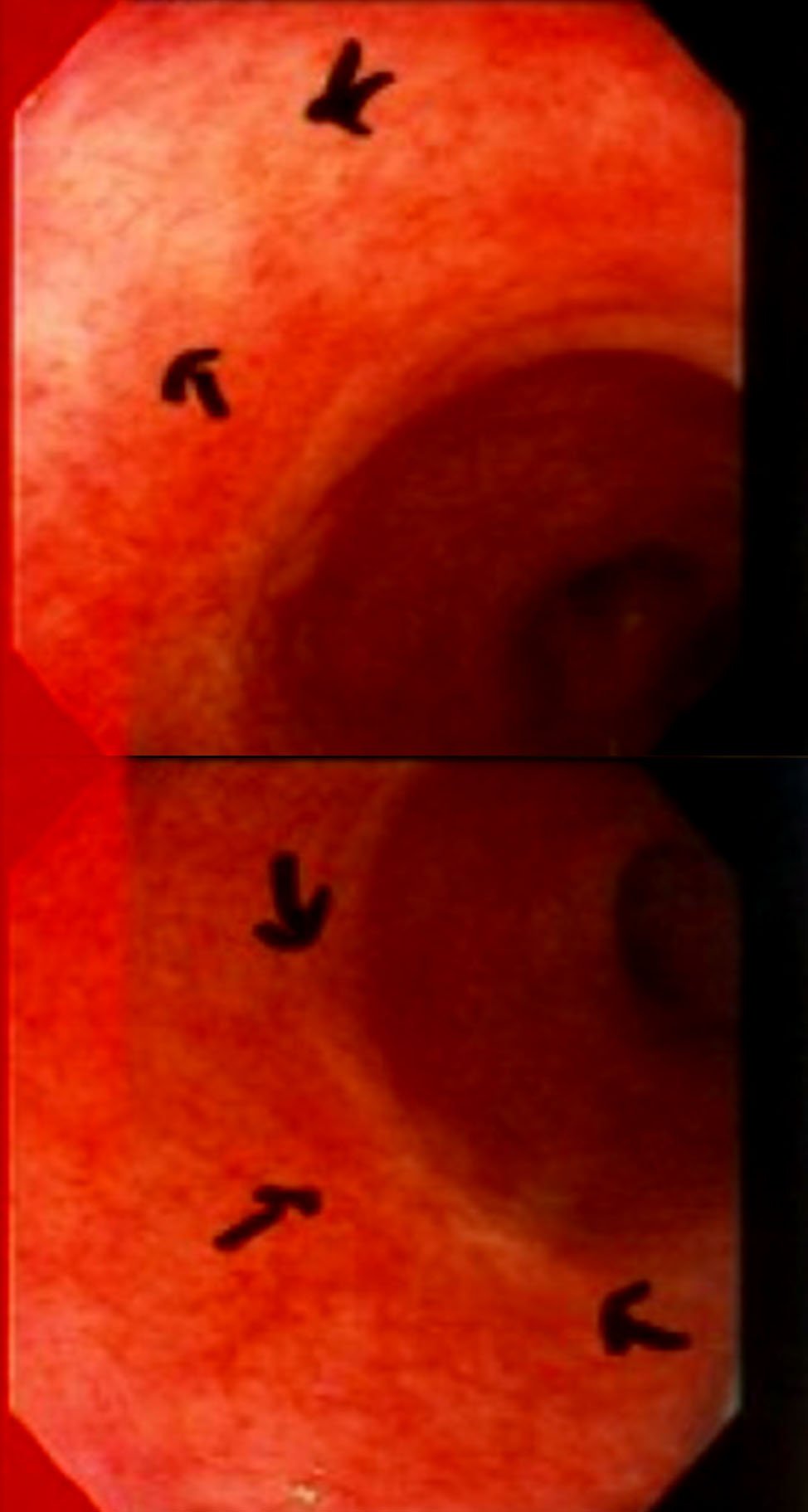
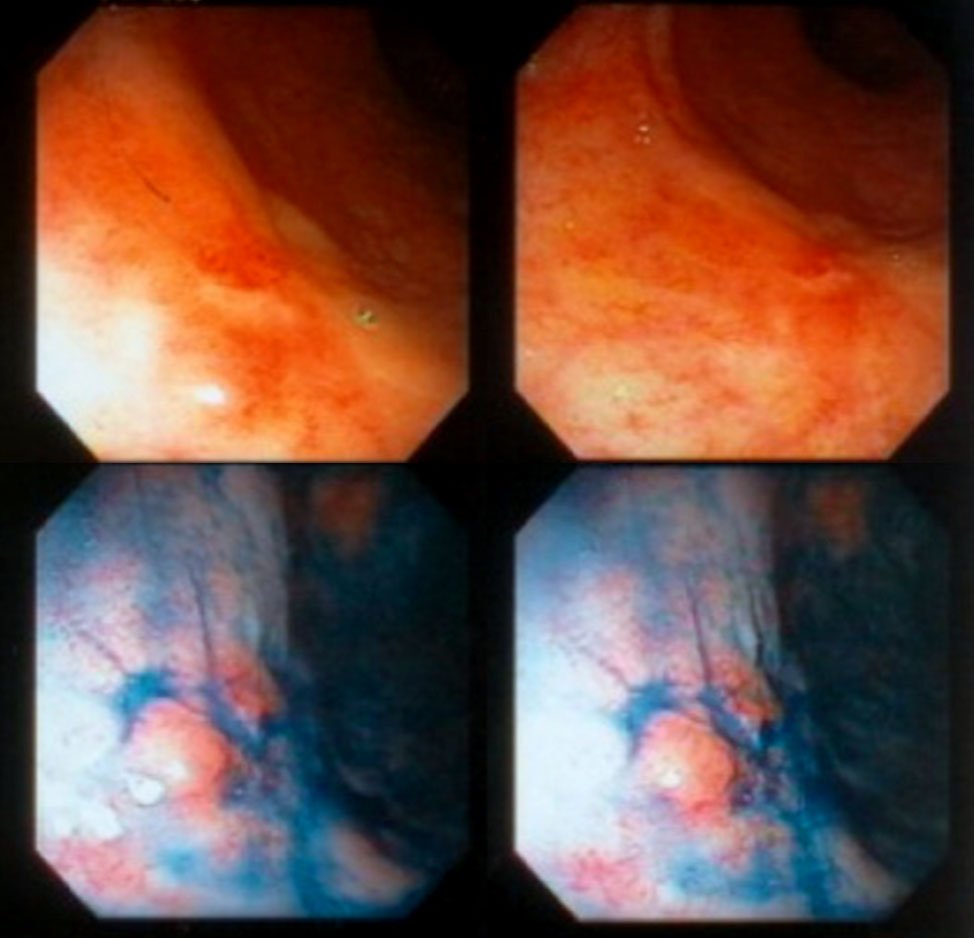
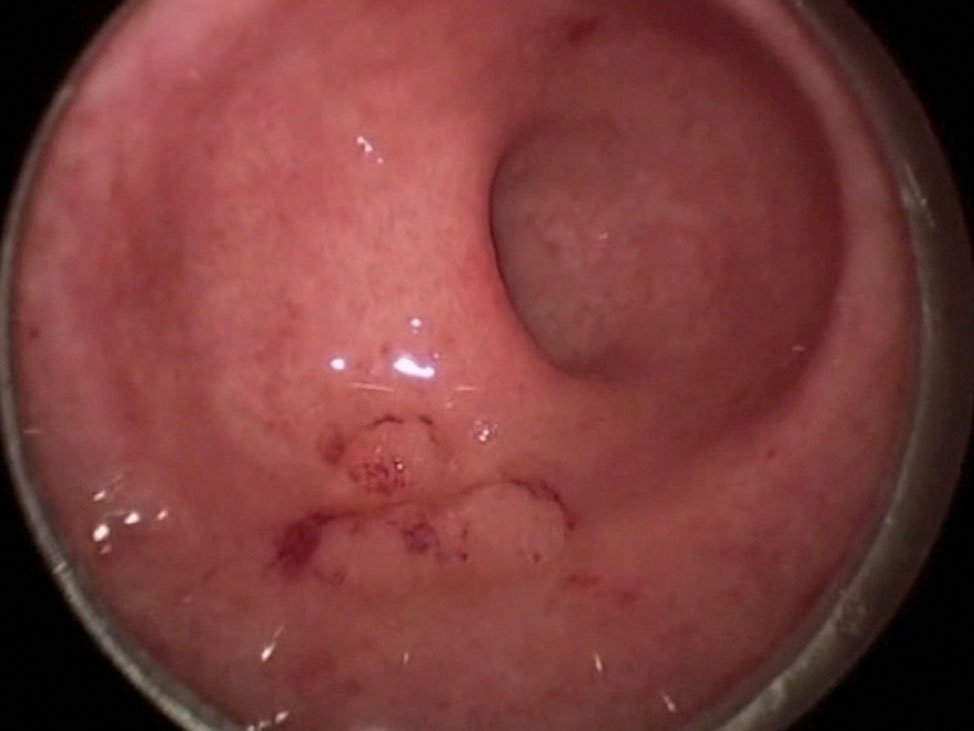
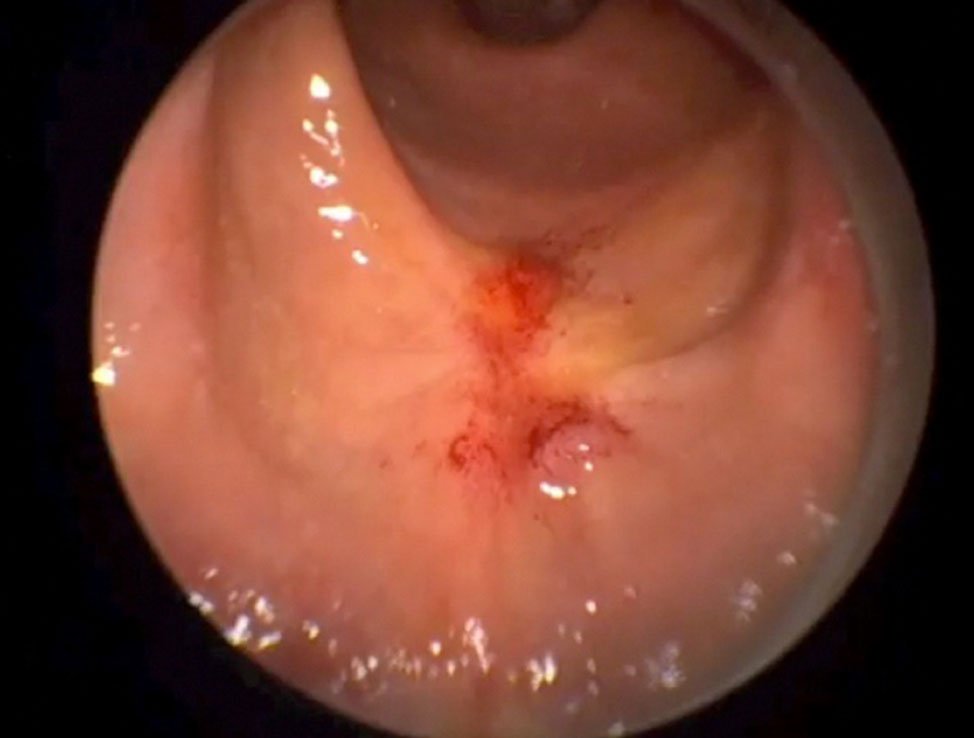
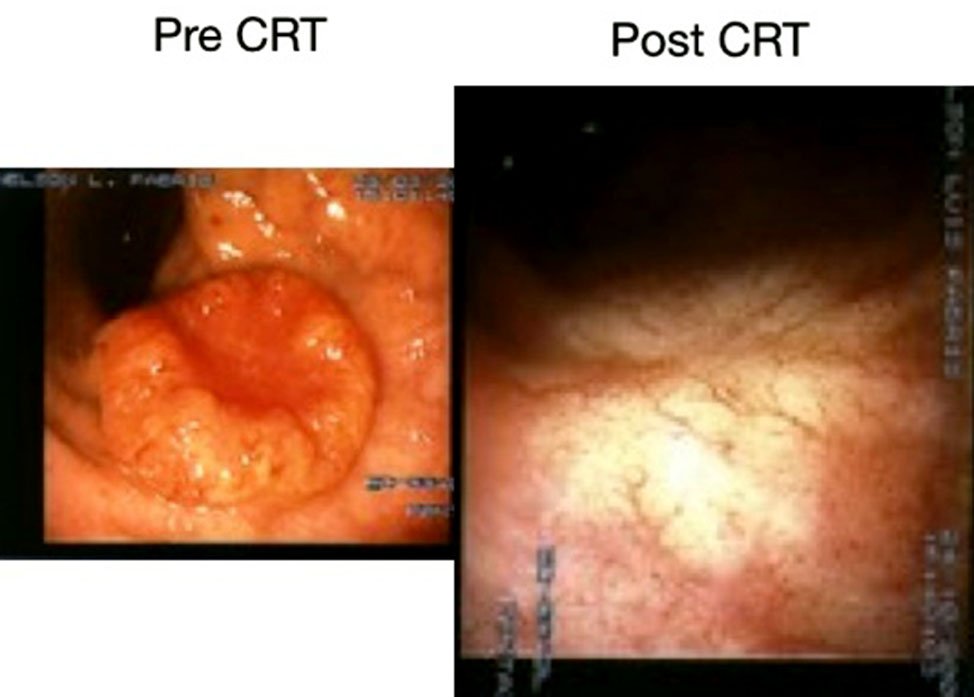
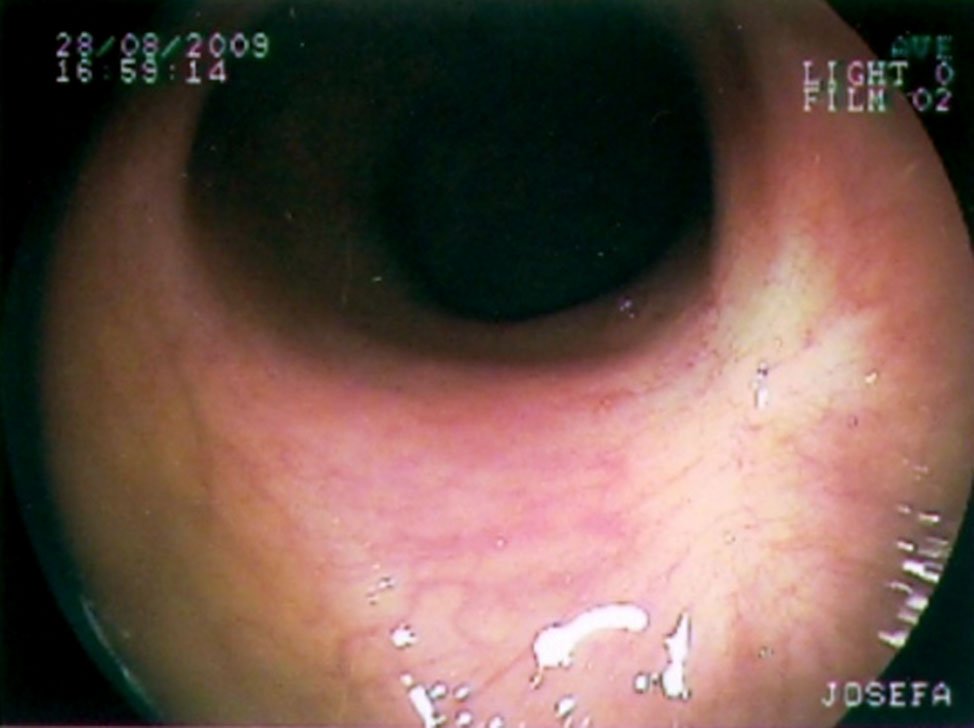
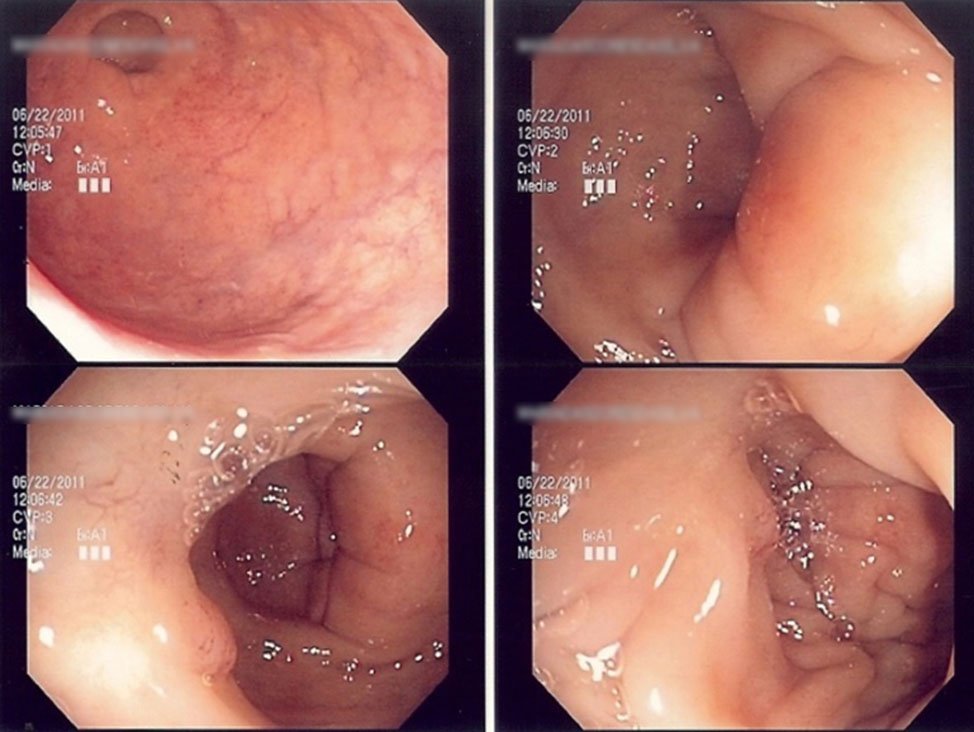
Figura 14: imágenes pre y post neoadyuvancia (gentileza Dra. Angelita Habr-Gama). Ver la descripción de la respuesta postneoadyuvancia al comienzo del capítulo.
BIBLIOGRAFÍA
- Gérard A., Buyse M., Nordlinger B. y col. Preoperative radiotherapy as adjuvant treatment in rectal cancer. Final results of a randomized study of the European Organization for Research and Treatment of Cancer (EORTC). Ann Surg 1998;208:606-614
- Improved survival with preoperative radiotherapy in resectable rectal cancer. Swedish Rectal Cancer Trial : N Engl J Med 1997;336:980-7
- Kapiteijn E., Marijnen C., Nagtegaal ID. y col. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med 2001;345:638-46
- Rullier A., Laurent C., Capdepont M. y col. Impact of tumor response on survival after radiochemotherapy in locally advanced rectal carcinoma. Am J Surg Pathol 2010;34:562-8
- de Campos-Lobato LF., Stocchi L., da Luz Moreira A. y col. Downstaging without complete pathologic response after neoadjuvant treatment improves cancer outcomes for cIII but not cII rectal cancers. Ann Surg Oncol 2010;17:1758-66
- Habr-Gama A., de Souza P., Ribeiro U. Jr y col. Low rectal cancer: impact of radiation and chemotherapy on surgical treatment. Dis Colon Rectum 1998;41:1087-1096
- Janjan NA., Abbruzzese J., Pazdur R. y col. Prognostic implications of response to preoperative infusional chemoradiation in locally advanced rectal cancer. Radiother Oncol 1999;51:153-60
- Grann A., Minsky B., Cohen AM. y col. Preliminary results of preoperative 5-Fluorouracil, low- dose leucovorin, and concurrent radiation therapy for clinically resectable T3 rectal-cancer. Dis Colon Rectum 1997;40:4515-22
- Luna-Perez P., Rodriguez-Ramirez S., Rodriguez-Coria DF., y col. Preoperative chemoradiation therapy and anal sphincter preservation with locally advanced rectal adenocarcinoma World J Surg 2001;25:1006-11
- Medich D., McGinty J., Parda D. y col. Preoperative chemoradiotherapy and radical surgery for locally advanced distal rectal adenocarcinoma: pathological findings and clinical implications. Dis Colon Rectum 2001;44:1123-8
- Habr-Gama A., Prerez RO., Sabbaga J. y col. Increasing the rates of complete response to neoadjuvant chemoradiotherapy for distal rectal cancer : results of a prospective study using additional chemotherapy during the resting period. Dis Colon Rectum 2009; 52:1927-34
- Zmora O., Dasilva G., Gurland F. y col. Does rectal wall tumor erradication with preoperative chemoradiation permit a change in the operative strategy? Dis Colon Rectum 2004;47:1607-12
- Habr-Gama A. Assessment and management of the complete clinical response of rectal cancer to chemoradiotherapy. Colorectal Dis 2006;8 :21-4
- Habr-Gama A., Perez R., Nadalin W. y col. Operative versus non-operative treatment for stage 0 distal rectal cancer following chemoradiation therapy: long- term results. Ann Surg 2004;240:711-7
- Habr-Gama A., Sabbaga J., Gama-Rodrigues J. y col. Watch and wait approach following extended neoadjuvant chemoradiation for distal rectal cancer: are we getting closer to anal cancer management? Dis Colon Rectum 2013;56:1109-111
