REV ARGENT COLOPROCT | 2014 | VOL. 25, Nº 3
RELATO ANUAL
CAPÍTULO 10
Factores pronósticos en el carcinoma del recto
Dr. Jorge A. Hequera
Es útil considerar los factores pronósticos y los factores predictivos.
Los factores pronósticos se refieren a los datos que suministran información sobre la evolución de la enfermedad y permiten definir con mayor precisión su historia natural.
Los factores predictivos son los datos que permiten seleccionar las mejores terapéuticas para cada paciente.
Hay factores asociados al paciente (como el sexo, la edad y los síntomas), otros asociados a la cirugía, otros inherentes al tumor y otros que se conocen como factores moleculares. La mayoría se han referido en otras secciones de éste Relato y los restantes se especificarán a continuación.
Hay una serie de factores que tienen importancia pronóstica en el carcinoma del recto y que no están incorporados en la estadificación TNM. Sin embargo, la AJCC en su última edición (2010), recomienda la recolección de sus datos, por su significancia clínica.
Ellos son los siguientes:
- Antígeno carcinoembrionario (CEA) preoperatorio o pretratamiento
- Depósitos Tumorales
- Margen de resección circunferencial
- Invasión perineural
- Evaluación del gen K-ras
- Grado de regresión tumoral postneoadyuvancia (se desarrolla en el capitulo 11)
- Inestabilidad microsatelital
Antígeno carcinoembrionario (CEA)
El antígeno carcinoembrionario fue descubierto en 1965 por Gold y Freedman1 y es una glucoproteina que recibe ese nombre porque es posible encontrarla en el endoderma primitivo y está ausente en la mucosa normal del adulto2. Es un antígeno que se utiliza como marcador tumoral del carcinoma colo-rectal, pero no es específico para éste carcinoma y se encuentra elevado en otros tumores y en afecciones no neoplásicas como cirrosis hepática y en los fumadores2,3,4,5. Aunque la determinación del CEA tiene poca utilidad para la detección precoz del carcinoma, por su baja sensibilidad (39 %) y especificidad6,7,8 es útil para la evaluación pronóstica y para la determinación de la respuesta al tratamiento9,10,11. Los niveles del CEA preoperatorio tienen valor pronóstico ya que los niveles elevados son indicadores de mal pronóstico. Además cuanto más altos sean mayor es la probabilidad que el cáncer sea localmente avanzado y generalmente se asocia a un mayor riesgo de recidiva12,13. Sin embargo, en el estudio holandés14,15 a pesar que los niveles preoperatorios fueron normales en la mayoría de los enfermos, se incrementaron en un 50% en pacientes con recurrencia. Por ello puede considerarse de utilidad, sobre todo para el seguimiento.
Los niveles preoperatorios altos deben normalizarse luego de la resección. La falta de normalización sugiere una resección incompleta o metástasis no detectadas . Por ello debe insistirse que la elevación luego de la normalización postoperatoria es una fuerte sugerencia de recurrencia y de ahí la utilidad en el seguimiento de controles seriados del marcador.16
Cabe destacar que la importancia del CEA preoperatorio como factor pronóstico independiente ha sido demostrado en numerosos trabajos.6,8,12,17,18
La incidencia y grado de elevación de un marcador tumoral puede ser un factor dependiente de la extensión tumoral, del tamaño tumoral y del grado de diferenciación.
Para el CEA esto es real en cuanto la extensión a través de la pared rectal eleva los índices en 30-40% de los casos poco avanzados (T1) mientras que los más avanzados alcanza el 70-80%.5 El tamaño tumoral y el grado de diferenciación no muestra una asociación clara con el CEA preoperatorio y podría considerarse que el tamaño dependería de la invasión tumoral más que del volumen tumoral.
El grado de diferenciación también es un aspecto controvertido y algunos trabajos sugieren que los carcinomas pobremente diferenciados tendrían menos capacidad de producir CEA12,19 y otros afirman lo contrario.6,8 Tal vez pueda vincularse a diferentes criterios anátomo-patológicos usados para estadificar la diferenciación.
Con respecto a la evaluación del CEA post-neoadyuvancia, se ha referido que un nivel bajo con respecto al nivel pretratamiento se corresponde como respuesta al tratamiento.20,21 Sin embargo, no debe considerarse como un único determinante y sí incluirse como uno de los factores pronósticos que recomienda el AJCC.22
Por otra parte, hay que destacar que los carcinomas pobremente diferenciados elevan poco el CEA y entonces un nivel normal del marcador en éste grado histológico no debe hacer presuponer un pronóstico favorable.23
BIBLIOGRAFÍA
- Gold P. y Freedman. Demostration of tumor specific antigen in human colonic carcinomata by inmunological tolerance and absorption techniques. J Exp Med 1965;121:434-462
- Pokorny RM., Hunt LE. Y Galandiuk S. What’s new with tumor markers for colorectal cancer. Dig Surg 2000;17:209-15
- Abel ME., Rosen L., Kodner IJ. y col. :Task Force, American Society of Colon and Rectal
-
Surgeons. Practice Parameters for the tratment of rectal carcinoma. Supporting documentation. Dis Colon Rectum 1993;36:991-1006
Slentz K., Senagore A., Hibbert J. y col. Can preoperative and postoperative CEA predict survival after colon cancer resection? Am Surg 1994;60:528-32 - Northover J. Carcinoembryonic antigen and recurrent colorectal cancer. Gut 1986;27:117-22
- Bannura G., Cumsille MA.,Contreras J. y col. Antígeno carcinoembrionario preoperatorio como factor pronóstico independiente en cáncer de colon y recto. Rev Med Chile 2004;132:691-700
- Carriquiry LA. y Piñeyro A. : Should carcinoembryonic antigen be use in the management of patients with colorectal cancer? Dis Colon Rectum 1999;42:921-9
- Wang I., Tang R. y Chiang JM. Value of carcinoembryonic antigen in the management of colorectal cancer. Dis Colon Rectum 1994;37:272-7
- Abir M., Alva S., Longo WE. y col: La vigilancia postoperatoria de los pacientes con cáncer del colon y cáncer rectal. Am J Surg 2006;1992:100-108
- Goldstein MI. y Mitchell EP. Antígeno carcinoembrionario en la estadificación y seguimiento de los pacientes con cáncer colorectal.Cancer Invest 2005;23:338-351
- Das P., Skribber JM., Rodriguez-Bigas MA. y col. Factores predictivos de respuesta tumoral y la reducción de grado en los pacientes que recibieron quimioradioterapia preoperatoria para el cáncer rectal. Cancer 2007;109:1750-1755
- Moertel CG., O’Fallon JR., Val L. y col. The preoperative carcinoembryonic antigen test in the diagnostic, staging and prognosis of colorectal cancer.Cancer 1986;58:603-610
- Fletcher RH. Carcinoembryonic antigen. Ann Intern Med 1986;104:66-73
- Kapiteijn E., Kranenberg EK., Steup WE. y col. Exéresis total del mesorecto (TME) con o sin radioterapia preoperatoria en el tratamiento del cáncer primario del recto. Ensayo aleatorio prospectivo con operativo estándar y técnicas histopatológicas. Grupo de cáncer colorectal holandés. Eur J Surg 1999;165:410-420
- Grossmann I., de Back GH., Meershack K. y col. Antígeno carcinoembrionario (CEA) con medición para el seguimiento del carcinoma rectal. Eur J Surg Oncol 2007;33:183-188
- Arnaud JP., Koehl C. y Adloff M. Carcinoembryonic antigen (CEA) in diagnosis and prognosis of colorectal carcinoma. Dis Colon Rectum 1980;23:141-144
- Herrera MA., Chu TM. y Holyoke ED. Carcinoembryonic antigen (CEA) as a prognostic and monitoring test in clinically complete resection of colorectal carcinoma. Ann Surg 1976;183:5-9
- Li Destri G., Greco S., Rinzivillo C. y col. Monitoring carcinoembryonic antigen in colorectal cancer: Is it still useful? Jpn J Surg 1998;28:1233-6
- Staab HJ., Anderer FA., Brummendorf T. y col. Prognostic value of preoperative serum CEA level compared to clinical staging. Br J Cancer 1981;44:652-662
- Jang NY., Kang SB., Kim DW. y col. The role of carcinoembryonic antigen after neoadjuvant chemoradiotherapy in patients with rectal cancer. Dis Colon Rectum 2011;54:245-252
- Perez RO., Sao Juliao GP., Habr-Gama A. y col. the role of carcinoembryonic antigen in predicting response and survival to neoadjuvant chemoradiotherapy for distal rectal cancer. Dis Colon Rectum 2009;52:1137-1143
- AJCC Cancer Staging Mnual (American Joint Committee on Cancer) 7º Edition 2010, Springer
- Steele G. y Zamcheck N. The use of carcinoembryonic antigen in the clinical management of patients with colorectal cancer. Cancer Detect Prev 1985;8:421-427
Depósitos tumorales:
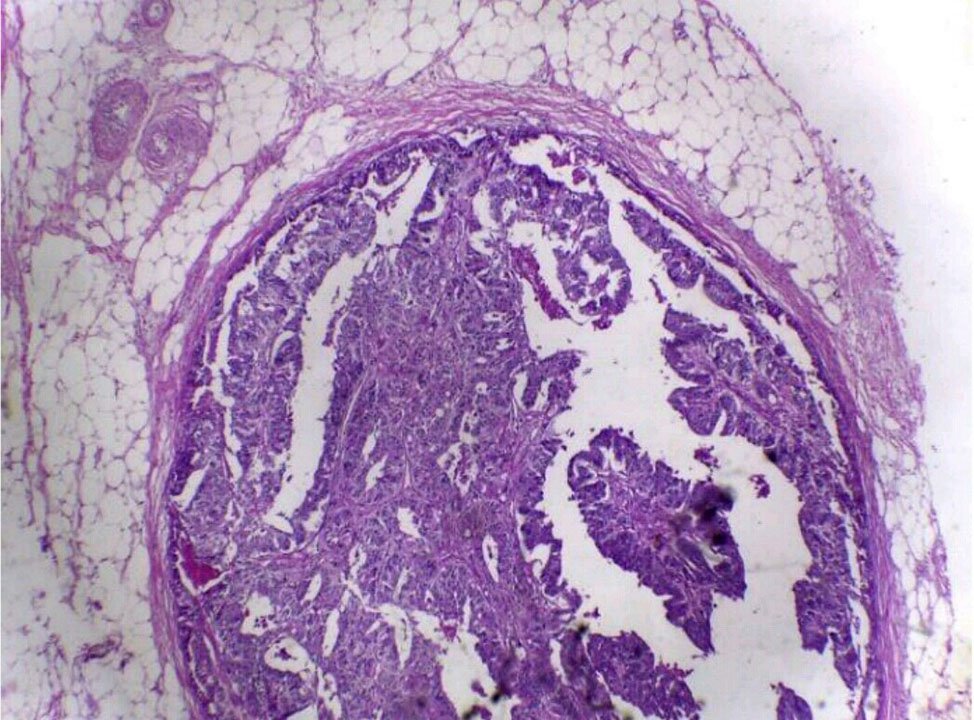
Los depósitos tumorales (Tumor deposit – TD por su versión en inglés) son focos de tumor separados (desunidos) encontrados en la grasa pericolónica o perirrectal o en el mesenterio contiguo (grasa mesocolónica) alejados del borde principal del tumor y sin evidencia de tejido ganglionar residual pero dentro del área linfática de drenaje del carcinoma primario (Figs. 1,2). Se producen por diseminación discontínua por vía venosa o perineural.
Su identificación puede ser macroscópica o microscópica, y el tamaño puede ser variable y la forma es redondeada. Pueden representar un ganglio linfático totalmente reemplazado.
No fueron reconocidos hasta 1997 con la 5a edición del T.N.M. pero el concepto fue cambiándose, tanto en la 6º como en la 7º edición.
En la 5º Edición (1997) fue introducida la “regla de los 3 mm” donde la clasificación se basaba exclusivamente en el tamaño, independientemente de la histología. Así, toda colección celular tumoral en la grasa perivisceral se consideraba como extensión del tumor primario si tenía 3 mm o menos de diámetro (categoría pT) y si era mayor de 3 mm se consideraba como metástasis ganglionar (categoría pN).
Esta subdivisión no tenía sustentos en trabajos publicados y se abandonó en la 6º edición
En la 6º Edición (2002) se desconsideró el tamaño como criterio de clasificación y se reemplazó por uno basado en la forma : “regla de la forma y el contorno”
Estas dos reglas se basan en criterios morfológicos y no tienen fundamentos biológicos.
Los nódulos tumorales en la grasa peri-rectal o pericolónica sin evidencias histológicas de tejido linfático residual son clasificados como metástasis (ganglio reemplazado por tumor), si el nódulo tiene la forma y el contorno liso de un ganglio linfático.
Si el depósito tumoral tiene contornos irregulares, sin evidencia de tejido linfático residual y se halla dentro del drenaje linfático del carcinoma primario se considera como extensión extramural discontínua, sino existen metástasis en ganglios linfáticos regionales. La mayoría de éstos son ejemplos de invasión linfovascular o más raramente invasión perineural.
En la 7a Edición (2009) se incorpora la “ regla de juicio del patólogo” (the pathologists discretion` rule”). Se crea una nueva categoría (N1c) que incluye todos los depósitos tumorales en pT1 y pT2 para ubicarlos en Estadío III (antes Estadío I). No hay evidencia de los efectos de éste cambio. La categoría N1c es para la presencia de TDs, pero aparentemente sólo en T1 y T2, ya que no se especifica como se clasificaría la presencia de TDs en T3 y T4.
La existencia de depósitos tumorales no cambia el estadío T y el concepto de la regla del contorno permanece en el estadío N. “Presumiblemente, ocurran discrepancias interobservador, cuando se deba decidir como considerar un contorno liso y sea difícil determinar si un nódulo redondeado es o no un ganglio totalmente reemplazado”.1
En la clasificación actual de T.N.M. (año 2009) se los designa como subestadío N: pN1c y en ésta categoría se excluye otra metástasis ganglionar. Tampoco es aplicable a los focos tumorales que pueden observarse en las piezas quirúrgicas post-neoadyuvancia, que en realidad son restos viables del tumor y su significación está en relación a la respuesta tumoral frente a ésta terapéutica.
La importancia de éstos DT está vinculada a los casos en que no se identifican metástasis en los ganglios linfáticos. Tienen valor pronóstico negativo pero no están suficientemente categorizados en la estadificación TNM porque un tumor con una sola metástasis ganglionar tiene la misma categoría que uno sin metástasis ganglionar pero con uno o más depósitos tumorales.
Se ha criticado2,3 la poca claridad conceptual de ésta subclasificación, porque la variabilidad interobservador puede hacer interpretar un ganglio supuestamente reemplazado por tumor como DT y en realidad el reemplazo no es total.
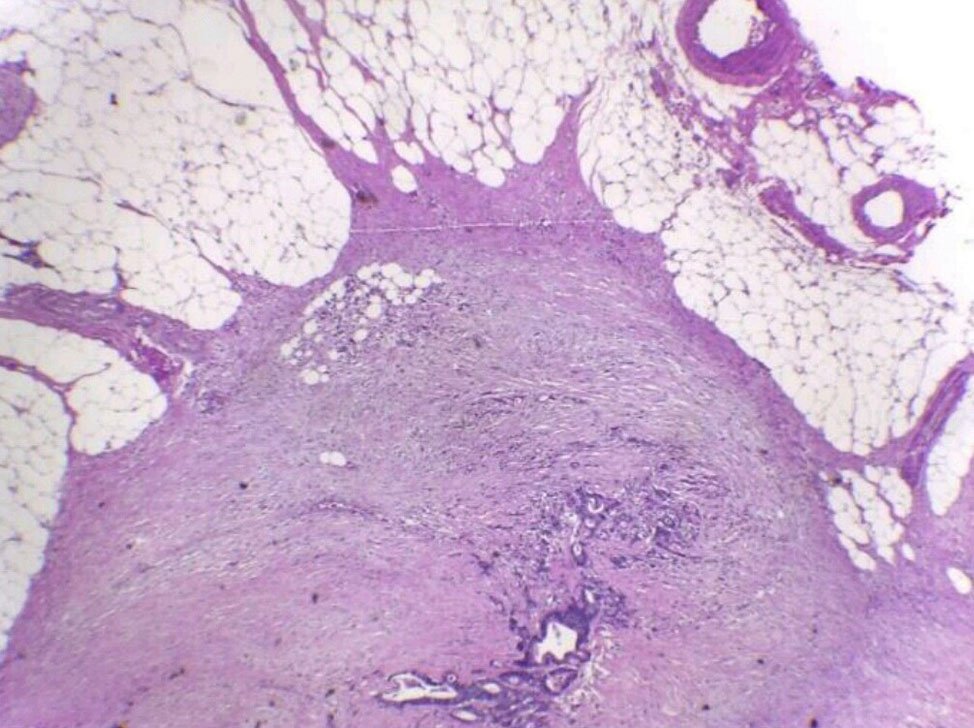
Figura 1: Depósitos tumorales. pN1c
BIBLIOGRAFÍA
- Ueno H., Mochizuki H., Shirouzu K. y col. Multicenter study for optimal categorization of extramural tumor deposits for colorectal cancer staging. Ann Surg 2012;255:739-746
- Ratto C. y Ricci R. : Potential pitfalls concerning colorectal cancer classification in the seventh edition of the AJCC Cancer Staging Manual. Dis Colon Rectum 2011;54:e32
- Chapuis PH., Chan CH. y Dent OF. Clinicopathological staging of colorectal cancer: Evolution and consensus- an Australian perspective.J Gastroenterol Hepatol 2011;26 Suppl. 1 .58-64
Estadificación anátomo-patológica de la grasa peri-rectal (Meso-recto)
La exéresis oncológica del recto requiere una adecuada disección peri-rectal. El plano de disección correcto, anatómicamente se halla entre la fascia rectal y la fascia pelviana (disección perimesorectal)
Una disección que involucre la grasa atravesándola (disección intramesorectal) o incluso que exponga a la muscular propia es inapropiada oncológicamente y condiciona recidivas locales y a distancia.
Con el objetivo de auditar la calidad de la resección quirúrgica de la grasa perirectal se diseñó un sistema de gradación en tres categorías7 aunque aún no ha sido ampliamente incorporado en los informes anatomopatológicos.
- Grado 3: meso-recto completo. Plano de disección con mesorecto intacto, con mínimas irregularidades en la superficie y defectos en la grasa peri-rectal que no superan los 5 mm de profundidad.
- Grado 2: meso-recto casi completo. Defectos en la grasa peri-rectal superiores a los 5 mm pero sin exposición de la muscular propia.
- Grado 1: meso-recto incompleto. El plano de disección quirúrgica expuso la muscular propia o hay un margen radial circunferencial muy irregular. Esta situación indica que parte de la grasa peri-rectal no ha sido resecada y permanece en la cavidad pelviana y que el pronóstico es pobre aún cuando el margen radial circunferencial sea negativo.7
En el estudio Mercury19 participaron 27 cirujanos con una experiencia quirúrgica entre 7 y 30 años. La técnica referida fue con resección total del meso-recto. Sin embargo, los resultados anátomo-patológicos mostraron una técnica inapropiada en el 24% de los pacientes.
De acuerdo a la clasificacíon referida más arriba las cifras fueron:
- Grado 3 266 pacientes (62%)
- Grado 2 81 pacientes (19%)
-
Grado 1 23 pacientes (5%)
58 pacientes (14%)
no fueron informados
Es importante en la cirugía del recto distal, evitar la disección del mesorecto en forma de cono (“ coning in”) porque ello incrementa el riesgo de recurrencia pelviana, posiblemente por dejar grasa perirectal in situ con inclusión de ganglios.
La indemnidad del meso-recto en la disección quirúrgica, posibilita el estudio de todos los ganglios contenidos en él, dependiendo la cantidad obtenida, de la meticulosidad del patólogo. La cantidad será obviamente menor si la resección es casi completa o incompleta, aún con una técnica de reclutamiento adecuada. También es menor en los rectos irradiados e incluso con negativización ganglios por efecto radioquimioterápico.
MARGEN DE RESECCIÓN CIRCUNFERENCIAL
Con respecto al margen de resección circunferencial, está ampliamente reconocido que un tumor histológicamente demostrado sobre la línea de resección o muy próximo a ella, en un cáncer del recto, tiene alta probabilidad de recurrencia y un pobre pronóstico de sobrevida.8,9,10
El compromiso del margen oscila entre el 1-33%11 y hay una estrecha correlación con los estadíos TNM, estableciéndose una mayor posibilidad de infiltración cuanto más alto sea el estadío.3,10,11,12,13,14,15,16
La patogenia de ese compromiso puede estar vinculada a varios factores:8,5
1º Diseminación tumoral en continuidad
2º Diseminación tumoral discontínua
3º Metástasis ganglionar linfática
4º Invasión venosa
5º Invasión linfática
6º Diseminación tumoral perineural
En el 30% de los casos el mecanismo fisiopatogénico es combinado.11
El riesgo de recurrencia local depende del nivel de compromiso del margen radial. Para Birbec5, la recurrencia cuando el margen de transección está comprometido es del 55%, cuando está entre 0.1 y 1.0 mm la misma es del 28 % y cuando el la infiltración está entre 1.1 y 2.0 mm , la recurrencia será del 5%. Para Nagtegaal y col.3 esos valores son 30.7%, 7.9% y 14.9% .
Tomar el MRC comprometido sólo como una medida de control de calidad quirúrgica es conflictivo y puede ser una fuente de sesgo importante.16
Hay varios factores de riesgo para la recurrencia, vinculados al paciente, a la técnica y a la histología.
1)Dependientes del paciente y de la técnica
- Tumor perforado
- Operación no restaurativa
- Tumor adherido a otros órganos
- Técnicas no estandarizadas
- Radioterapia preoperatoria
- Sexo masculino (pelvis estrecha y dificultad técnica)
2) Factores histológicos
- Estructuras adyacentes comprometidas
- Alto grado histológico
- Invasión venosa
Estos dos últimos ítems indican tumor biológicamente más agresivo.
También se deben considerar el tipo de series analizadas (prospectivas o retrospectivas), el tiempo de seguimiento, el diagnóstico histológico de recurrencia y el método de análisis estadístico.17
La RMN es indudablemente útil para el diagnóstico del MCR, aunque no lo valide histológicamente. Pero el paciente con margen positivo en la RMN, correctamente tratado, debería tener un margen negativo en la resección.18
Resumen y conceptos destacables
- Se define un margen positivo cuando la infiltración tumoral está al menos dentro de un mm de la fascia rectal
- Tambien puede ser definido por la presencia de depósitos tumorales, invasión vascular extramural y presencia de ganglios sospechosos
- En el plano anterior la grasa perirectal es escaso y el recto puede estar apoyado sobre el MCR. En ésta situación un tumor debe estar, al menos, en estadío T3 para correlacionarlo con un compromiso del margen. Por ello, son irrelevantes en estas circunstancias los tumores T1 y T2.
BIBLIOGRAFÍA
- Chan KW., Boey J. y Wong SKC. : A method of reporting radial invasión and surgical clearance of rectal carcinoma. Histopathology 1985; 9:1319-1327
- Quirke P. y Dixon MF.. The prediction of local recurrence in rectal adenocarcinoma by histopathological examination. Int J Colorectal Dis 1988;3:127-131
- Nagtegaal ID., Marijnen CAM., Klein Kranenbarg E. y col. Circumferencial margin is still an important predictor of local recurrence in rectal carcinoma : Not one milimeter but two milimeters is the limit. Am J Surg Pathol 2002;26: 350-357
- Brown G., Radcliffe AG., Newcombe RG. y col. Preoperative assessment of prognostic factors in rectal cancer using high-resolution magnetic resonance imaging .Br J Surg 2003;90:355-364
- Birbeck KF., Macklin CP., Tiffin NJ. y col. : Rates of circumferencial resection margin involvement vary between surgeons and predict outcomes in rectal cancer surgery. Ann Surg 2002;235: 449-457
- Maughan NJ. y Quirke P. Modern management of colorectal cancer. A pathologist’s view. Scand J Surg. 2003;92: 11-19
- Nagtegaal ID., van de Velde CJH., van der Wrop E. y col. Macroscopic evaluation of rectal cancer resection specimen : Clinical significance of the pathologist in quality control. J Clin Oncol 2002; 20:1729-1734
- Quirke P. Durdey P. Dixon MF. Y col. Local recurrence of rectal adenocarcinoma due to inadequate surgical resection: Histopathological study of lateral tumor spread and surgical excision. Lancet 1986;2 :996-999
- Wiggers T. y van de Velde CJ. The circunferencial margin in rectal cancer. Recommendations based
- Wibe A., Rendedal PR., Svensson E. y col. : Prognostic significance of the circunferencial resection margin following total mesorectal excision for rectal cancer. Br J Surg 2002;89:327-334
- Nagtegaal ID y Quirke P. : What is the role of circunferencial margin in the modern treatment of rectal cancer. J Clin Oncol 2008;26: 303
- Ng IOL., Luk ISC., Yuen ST. y col. :Surgical lateral clearance in resected rectal carcinomas. Cancer 1993; 71:1972-1976
- Macadam R., Yeomans N., Wilson J. y col. Factors affecting morbidity, mortality and survival in patients undergoing surgery for rectal cancer in a district general hospital. Ann R Coll Surg Engl 2005:87 :334-338
- de Hass-Kock DFM., Baeten CG., Jager JJ. y col. Prognostic significance of radial margin of clearance in rectal cancer. Br J Surg 1996;83:781-785
- Tekkis PP., Heriot AG., Smith J. y col. Comparison of circumferencial margin involvement between restorative and nonrestorative resection for rectal cancer. Colorectal Dis 2005;7:369-374
- Chapuis PH., Lin BP., Chan C. y col. Risk factors for tumor present in a circunferencial line of resection after excision of rectal cancer. Br J Surg 2006; 973:860-865
- Dent OF., Haboubi N., Chapuis PH. y col. Assessing the evidence for an association between circunferencial tumor clearance and local recurrence after resection of rectal cancer. Colorectal Dis 2007;9:112
- Dent OF., Chapuis PH., Haboubi N. y col. Magnetic resonance imaging cannot predict histological tumor involvement of a circunferencial margin in rectal cancer. Colorectal DIS 2011;13:97
- Mercury Study Group.Extramural depth of tumor invasion at thin-section MR in patients with rectal cancer: results of the Mercury Study. Radiology 2007;243:132-139
Otros detalles sobre el margen de resección radial o circunferencial (MRC)
La evaluación preoperatoria y postoperatoria del MRC tiene un doble fundamento. La estadificación preoperatoria es necesaria para establecer una táctica de tratamiento (neoadyuvancia como primera etapa o cirugía primaria). La estadificación, postoperatoria o postneoadyuvancia, es necesaria para indicar tratamientos complementarios (oncológicos o radioterápicos) y cumplimentar las pautas de seguimiento.
La RMN de alta resolución, posibilita (sola o asociada a la ultrasonografía) el diagnóstico en ambos períodos con una alta seguridad diagnóstica, como se detalla en la sección correspondiente.
El margen de resección radial o circunferencial es el límite anatómico que se establece siguiendo la línea de exéresis más externa de la grasa perirrectal, cuando se extirpa un carcinoma del recto. Corresponde solamente al segmento de la grasa no cubierta por peritoneo. Por ello la evaluación del margen de resección circunferencial se puede hacer solamente en los cánceres del recto medio y del recto inferior (ambos segmentos subperitoneales) y la localización perimetral es anterior, posterior y lateral izquierdo o derecho. El margen se mide entre la zona de infiltración más profunda del tumor y el borde más externo de la grasa perirrectal.
Hay discrepancias en el criterio del compromiso infiltrativo del margen, situación que se denomina “margen positivo” y las variantes son básicamente tres:
- Infiltración del propio borde marginal (transected tumour)1
- Infiltración tumoral hasta 1 mm del borde marginal2
- Infiltración tumoral hasta 2 mm del borde de resección3
Es necesario destacar que el criterio de margen positivo se aplica a cualquier forma de extensión tumoral (directa, vascular o a través de ganglios linfáticos) y Brown y col.4 mostraron 92% de concordancia entre la predicción por RMN y la histología del margen circunferencial resecado.
Estos conceptos están estrechamente vinculados a la técnica de resección total del mesorecto. Para lograr la indemnidad del mesorecto la disección debe ser cortante y dirigirse a través del llamado por Heald, el plano sagrado (“holy plane”) que anatómicamente está por fuera de la fascia rectal, que tapiza la grasa peri-rectal.
No respetar ese plano puede significar una técnica de resección inadecuada y la posibilidad de resecar sobre una zona infiltrada por tumor.5 La integridad anatómica del meso-recto se valora en patología macroscópicamente al observarse su superficie lisa y sin desgarros. La tinción con tinta china de esa superficie así como los cortes secuenciales y transversales permiten estudiar el margen circunferencial.
BIBLIOGRAFÍA
- Chan KW., Boey J. y Wong SK. A method of reporting radial invasion and surgical clearance of rectal carcinoma. Histopathology 1985;9:1319-1327
- Quirke P. y Dixon MF. The prediction of local recurrence in rectal adenocarcinoma by histopathological examination. Int J Colorectal Dis 1988;3:127-131
- Nagtegaal ID., Marijnen CAM., Kranenbarg EK. y col. Circumferencial margin involvement is still an important predictor of local recurrence in rectal carcinoma: not one millimeter but two millimeters is the limit. Am J Surg Pathol 2002; 26:350-7
- Brown G., Radcliffe AG., Newcombe RG. y col. Preoperative assessment of prognostic factors in rectal cancer using high-resolution magnetic resonance imaging. Br J Surg 2003;90:355-364
- Birbeck KF., Macklin CP., Tiffin NJ. y col. Rates of circumferencial resection margin Involvement vary between surgeons and predict outcomes in rectal cancer surgery. Ann Surg 2002;235:449-457
Invasión perineural
La invasión perineural es un factor de mal pronóstico de sobrevida. Ueno y col.1 establecieron un sistema de estadificación en grados, en base a la intensidad de la propagación y de la profundidad de la penetración tumoral en la pared rectal:
- Grado 0: sin invasión perineural
- Grado 1: menos de 5 focos y menos de 10 mm de penetración
- Grado 2: con 5 o más focos y más de 10 mm de penetración
La sobrevida a 5 años referida en correlación a la invasión perineural fue 74%, 50%, y 22% para los grados 0, 1 y 2 respectivamente. La recurrencia local fue 43 % en el grado 2 y 9% en el grado 0 y 1. Esa estadificación anátomo-patológica no solo refleja el pronóstico adverso de la invasión perineural, sino que en casos seleccionados sugiere realizar una adyuvancia postoperatoria intensa.
BIBLIOGRAFÍA
- Ueno H., Hase K. y Mochizuki H. Criteria for extramural perineural invasion as a prognostic factor in rectal cancer. Br J Surg 2001;88:994-10007
Evaluación del gen K-ras
La mutación del gen K-ras supone una importante alteración genética relacionada con la patogenia del CCR. Mas de 1/3 de los pacientes con CCR presentan mutaciones activadoras del gen K-ras. Los genes Ras codifican una proteína G, la cual está relacionada con el acoplamiento de señales de transducción de receptores de superficie1 como el receptor del factor de crecimiento epidérmico (EGFr) que está vinculado a procesos como angiogénesis, proliferación, migración y adhesión celular.2 El factor de crecimiento epidérmico se expresa en un alto porcentaje de casos (85% en las lesiones metastásicas y 65% en los tumores primarios) y su expresión se relaciona con la progresión de la enfermedad. El tratamiento del CCR se ha centralizado en el uso de anticuerpos monoclonales anti-EGFr, como el cetuximab y el panitumumab). Sin embargo, la mutación del gen K-ras supone un factor predictivo negativo de respuesta a esta terapéutica.
BIBLIOGRAFÍA
- Plesec T. y Hunt J. K-ras mutation testing in colorectal cancer. Adv Anat Pathol 2009; 16:196-203
- George B. y Kapetz S. Predictive and prognostic markers in colorectal cancer. Curr Oncol Rep 2011;13:206-215
Inestabilidad microsatelital (IMS)
Los microsatélites son repeticiones múltiples de 1 a 5 nucleótidos que están distribuidos en todo el genoma. Debido a su estructura repetitiva, los microsatélites son susceptibles a errores durante el proceso de replicación. La inestabilidad en microsatélites se origina como consecuencia de una deficiencia en el mecanismo post-replicativo de aparamientos erróneos.
Se conocen varios genes cuyos productos están involucrados en este mecanismo y que están mutados en el cáncer colo-rectal hereditario no polipoideo (sindromes de Lynch). Para determinar inestabilidad en microsatélites, en pacientes portadores, se emplean diversas técnicas principalmente inmuno-histoquímicas. La inestabilidad es por lo tanto un fenómeno complejo que ocurre por una función celular deficiente. La alteración de genes que han mutado constituyen una desregulación que conduce a la formación de cáncer. El análisis de la IMS facilita el diagnóstico clínico del CCHNP en familias potencialmente portadoras de defectos genéticos. Hay que considerar que sólo el 15% de los carcinomas esporádicos presentan IMS, mientras que en los pacientes con sindromes de Lynch ocurre en un 90% de los casos. Esto es importante para el asesoramiento genético de los familiares de riesgo. Existen tres formas principales de CCR de acuerdo al tipo de transmisión (esporádico, familiar y hereditario). La proporción de los casos hereditarios varía de 5-10%. Se dividen en dos sindromes: Poliposis multiple familiar y síndrome de Lynch1,2,3. Los microsatélites polimórficos son aquellos que muestran diferencias estables y heredables dentro de la población y son excelentes marcadores genéticos. La inestabilidad de microsatélites es una situación en que la longitud del microsatélite ha aumentado o disminuido en la línea germinal y lleva a un error en la replicación del ADN que conduce a la tumorogénesis.4
BIBLIOGRAFÍA
- Cruz-Bustillo,D. Genética molecular del cáncer colo-rectal. Rev Esp Enfer Dig 004;96 .48-590.
- Mecklin JP. Frecuency of hereditary colorectal cancer. Gastroenterology 1987;93:1021-5.
- Lynch HT., Lanspa S., Smyrk T. y col. Cancer (Lynch síndromes I and II), genetics, pathology, natural history and cancer control. Cancer Genet Cytogenet 1991;53:43-60.
-
Ionov Y., Peinado MA., Malkoshyan S. y col. Ubiquitsous somatic mutationsin simple repeated sequence reveal a new mechanism for colonic carcinogénesis.Nature 1993; 363: 558-61
