REV ARGENT COLOPROCT | 2014 | VOL. 25, Nº 3
RELATO ANUAL
CAPÍTULO 9
Otros Temas Anátomo-Patológicos
Dr. Jorge A. Hequera
Micrometástasis y células tumorales aisladas
Una micrometástasis es definida como tumor que mide entre 0.2 mm y 2.0 mm de dimensión máxima y es clasificada como N1 (mic) o M1 (mic) en ganglios linfáticos (Fig. 1) o en metástasis a distancia respectivamente.
Las células tumorales aisladas (Fig. 2) (conocidas como ITC, por su sigla en inglés), también denominadas “células en tránsito”, son células sueltas o en pequeños grupos que no miden más de 0.2 mm de dimensión máxima. No se ha demostrado que cambien el pronóstico. El hallazgo de ITC en ganglios linfáticos o en sitios distantes,ya sea por examen histológico, inmunohistoquímico o con técnicas no morfológicas (ej. Citometría de flujo, análisis de ADN, o amplificación de un marcador tumoral específico por PCR) debe ser clasificado como No y Mo respectivamente.
La subclasificación específica para la categoría No es sugerida sólo para los casos en los cuales ITC son la única evidencia de posible enfermedad metastásica.
Hay cuatro subestadíos:
- pNo: No hay evidencia histológica de metástasis en ganglios linfáticos regionales. No se realiza detección de ITC.
- pNo (i-): No hay evidencia histológica de metástasis en ganglios linfáticos regionales. Hallazgos morfológicos negativos para detección de ITC.
- pNo (i+): No hay evidencia histológica de metástasis en ganglios linfáticos regionales. Hallazgos morfológicos positivos (hematoxilina-eosina o inmunohistoquímica para detección de ITC.
- pNo (mol -): No hay evidencia histológica de metástasis en ganglios linfáticos regionales. Hallazgos no morfológicos (moleculares) negativos para detección de ITC.
- pNo (mol+): No hay evidencia histológica de metástasis en ganglios linfáticos regionales. Hallazgos no morfológicos (moleculares) positivos para detección de ITC.
Hay que destacar que como el compromiso ganglionar linfático se agrupa en una categoríaseparada no es necesario asumir la necesidad de penetración de toda la pared para que se metastatisen los ganglios como ocurre con otras clasificaciones1
Actualmente, los datos disponibles son insuficientes para recomendar técnicas especiales para su identificación, que además son costosas y a veces puede ser difícil realizar un control de calidad adecuado.
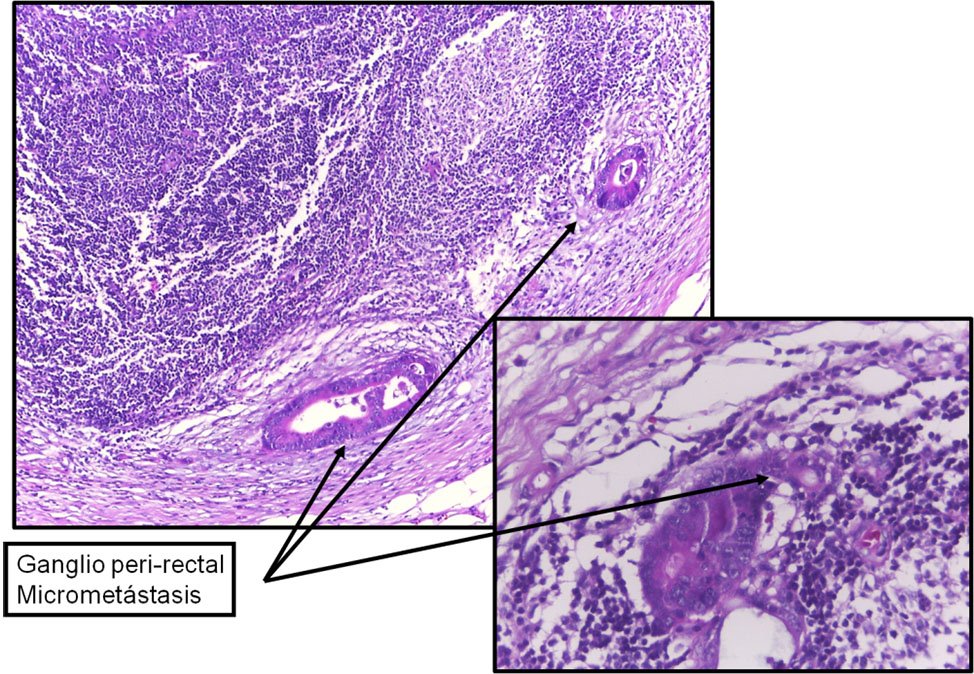
Figura 1:ganglio con micrometástasis
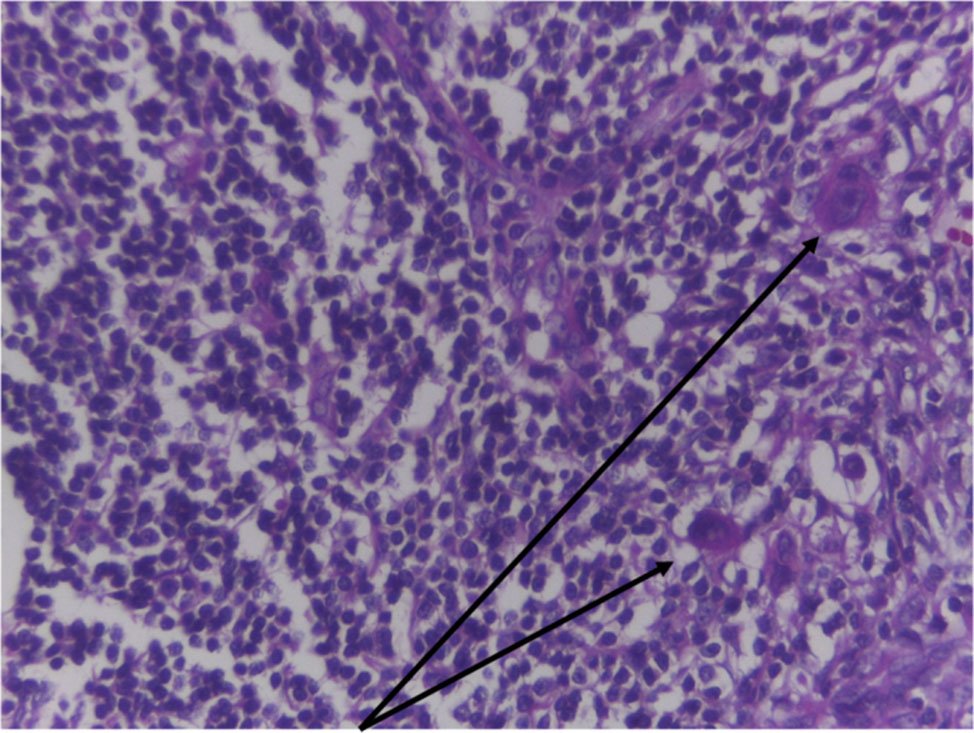
Figura 2: Ganglio linfático peri-rectal. Células tumorales aisladas. ITC pN0
BIBLIOGRAFÍA
- Fielding LP.: Staging system for colorectal cancer. En W..P.Mazier y col. Surgery of the colon, rectum and anus. Pag.383-388. Saunders, USA 1995
Invasión venosa extramural
UEL CCR utiliza el drenaje linfático y venoso de la pared intestinal para diseminarse a los ganglios linfáticos y a órganos distantes.
La invasión venosa extramural - IVE- (EMVI por su sigla en inglés) se caracteriza por la presencia de células neoplásicas en vasos sanguíneos peritumorales, más allá de la muscular propia. El vaso tiene que penetrar en la pared del recto en la zona de infiltración tumoral.1
Es un factor independiente de pobre pronóstico para el cáncer del recto2 y está asociado a un riesgo aumentado a recurrencia local y metástasis a distancia con 50% de posibilidades con IVE positiva y sólo 12% con IVE negativa.3
Se ve en el 50% de los tumores T3 yT4 y podría ser la progresión natural de un diseminación vascular intramural.4
Hay una amplia dispersión en los porcentajes del diagnóstico con cifras que oscilan entre el 10 y el 89%5 probablemente por los diferentes criterios para la identificación o debido a una selección de pacientes. Otros factores a considerar están vinculados a la cantidad de cortes histológicos que se realicen y a la experiencia del patólogo. Todos estos diferentes conceptos pueden llevar a un subregistro de la invasión venosa y determinar una estadificación incorrecta.
La literatura es confusa, y así hay trabajos que no separan invasión de los vasos linfáticos de los venosos 6,7 o no refieren si la invasión es intramural o extramural o si el tumor primario es del colon o del recto.8
El uso de técnicas de tinción especiales (además de la clásica hematoxilina – eosina) o marcadores inmunohistoquímicos, de las células endoteliales, facilitan considerablemente la detección de invasión vascular .5,9,10,11
El ultrasonido no puede diagnosticar vasos normales de los que están infiltrados por tumor; en cambio la RMN muestra la extensión tumoral en los vasos de la grasa perirrectal, con una característica imagen de contorno irregular, o dilatación nodular. La IVE se puede observar cuando hay una intensidad de señal intravascular intermedia, similar al tumor, asociada a mínima expansión del vaso. Con una dilatación vascular y el contorno nodular, la sensibilidad y especificidad diagnóstica de la RMN para una IVE es del 62 y 88% respectivamente.12
El grupo de Brown4 elaboró una estadificación de IVE en base al diagnóstico por RMN (Cuadro 1).
A diferencia de lo que ocurre con los vasos venosos extramurales, los intramurales son de paredes más finas, de menor calibre y con menos fibras de elastina. También son más frecuentemente obliterados por el tumor y por ello se hace más dificultosa su identificación histológica, sobre todo en los preparados estándar con hematoxilina-eosina.
La detección de la invasión venosa es dos veces mayor cuando se utilizan tinciones especiales para la elastina y el diagnóstico también es mayor cuando la evaluación la realizan patólogos especializados gastrointestinales.12
En una comunicación reciente, el College of American Pathologists (CAP) incluyen en el listado de verificación, como ítem único la “invasión linfovascular” a pesar de reconocer la importancia pronóstica superior de la EMVI.13
Resumen y conceptos destacables
- Por definición la IVE debe estar asociaciada con tumores al menos de estadío T3. Los tumores T1 y T2, potencialmente no pueden invadir los vasos extramurales
- Cuando un tumor se visualiza estrechadamente cercano a un vaso, se debe considerar la posibilidad del compromiso por IVE.
- Los signos sugestivos de IVE son: a) presencia de señal de intensidad tumoral dentro de una estructura vascular, b) vasos dilatados y c)expansión tumoral a través y más allá de la pared tumoral con alteración del borde vascular.
- Si hay sospecha de IVE se debe evaluar la posibilidad de compromiso de MCR.

BIBLIOGRAFÍA
- Chand M. y Brown G. : Pre-operative staging of rectal cancer: MRI or ultrasound? Seminars in Colon and Rectal Surgery 2013;24:114-118
- Dressen RC. Local recurrence in rectal cancer can be predicted by histopathological Factors. Eur J Surg Oncol 2009;35:1071-1077
- Talbot IC., Ritchie S., Leighton MH., y col. : The clinical significance of invasión of veins by rectal cancer. Br J Surg 1980;67: 439-442
- Smith NJ., Barbochano Y., Norman AR. Y col.:Prognostic significance of magnetic esonance imaging- detected extramural vascular invasión in rectal cancer Br J Surg 2008;95:229-236
- Stemberg A., AmarM., Alfici R. y col.: Conclusions from a study of venous invasión in Stage IV colorectal adenocarcinoma . J Clin Pathol 2002;55:17-21
-
Compton CC. y Greene FL. : The staging of colorectal cancer: 2004 and beyond. CA Cancer J Clin 2004;54: 295:308
Compton CC.: Colorectal carcinoma:diagnostic, prognostic and molecular features. Mod. Pathol. 2003;16: 376-388 - Minsky BD. y Cohen AM.: Blood veesel invasion in colorectal cancer- an alternative to TNM staging? Ann Surg Oncol 1999;6:129-130
- Kingston FF., Goulding H. y Bateman AC.: Vascular invasion is under-recognized in colorectal cancer using conventional hematoxylin and eosin staining. Dis Colon Rectum 2007;50: 1867-1872
- Inoue T.,Mori M.,Shimono R. y col. Vascular invasion of colorectal carcinoma readly visible with certain stains. Dis Colon Rectum 1992;35: 34-39
- Kirsch R., Messenger DE., Riddell RH. y col.: Venous invasion in colorectal cancer. Impact of an elastin stain on detection and interobserver agreement among Gastrointestinal and nongastrointestinal pathologists.Am J Surg Pathol 2013;37:200-210
- Smith NJ., Shihab O., Arnaout A. y col. : MRI for detection of extramural vascular Invasion in rectal cancer. Am J Roentgenol. 2008;191: 1517-1522
- Washington KBK., Branton P., Burgart L. y col.: Protocol for the examination of specimens from patients with primary carcinoma of the colon and rectum. February 1, 2011. Available at: http:// www.cap.org/apps/docs/committees/cancer/cancer_protocols/2011/Colon_11protocol.pdf.Accessed March 5,2012
Brotes tumorales (Tumour budding)
Se denomina así a la presencia de células tumorales libres o agrupadas (no más de cinco células) en el frente invasivo del tumor (Fig. 3). También se denomina “desdiferenciación focal”.1 Se visualiza con alta magnificación y debe hacerse el diagnóstico diferencial con la configuración del borde tumoral (infiltrativo o de empuje) que se ve con baja magnificación2
El concepto es que el brote tumoral ingresa al tejido conectivo peritumoral, evadiendo las defensas del huésped y finalmente invade los vasos linfáticos y sanguíneos con la consecuente posibilidad de metástasis local y a distancia.
Actualmente se lo considera un factor de pobre pronóstico independiente del estadío patológico.3
Recientemente se han descripto en forma similar la presencia de células tumorales libres dentro del cuerpo tumoral principal, y se ha sugerido denominarla brotes intratumorales (“intratumoural budding”, ITB por su sigla en inglés) para diferenciarlas de los clásicos brotes peritumorales, (“peritumoural budding”, PTB).4 También es un factor de pobre pronóstico. Una ventaja del ITB es que la muestra la provee la biopsia colonoscópica y se puede anticipar el pronóstico a la cirugía. De todos modos, aún no hay consenso entre los patólogos para estandarizar un sistema de clasificación.
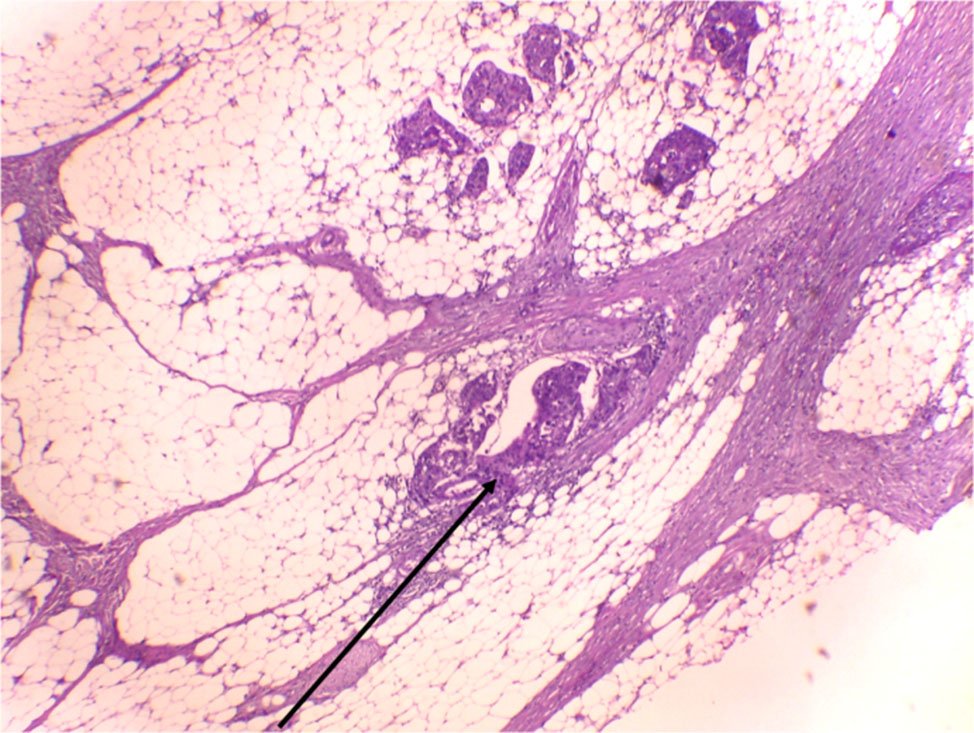
Figura 3: Brotes Tumorales
BIBLIOGRAFÍA
- Ueno H.., Murphy J., Jass JR. Y col.: Tumor “budding” as an index to estímate the potential of aggressiveness in rectal cancer. Histopathology 2002;40:127-132
- Lugli A., Karamitopoulou E. y Zlobec I. : Tumour budding: a promisin parameter in colorectal cancer Br J Cancer 2012;106: 1713-1717
- Compton CC., Tanabe KK. y Savarese DMF. : Pathology and prognostic determinants of colorectal cancer. www.uptodate.com
- Lugli A., Vlajnik T., Giger O. y col. : Intratumoral budding as a potential parameter oftumor progression in mismatch repair-proficient and mismatch repair-deficient colorectal cancer patients. Hum Pathol 2011;42:1833-1840
Importancia de la estadificación del ganglio apical
Dukes1 en 1932 introdujo el concepto de estadificación del cáncer del recto y sosteniendo que el ganglio apical centinela (GLC) al estar metastatizado es un factor de mal pronóstico y de pobre sobrevida.
Ang y col.2 reenfatizan esos criterios en 2011, y mostraron una evolución similar en los pacientes estadificados como Dukes C con metástasis en el GLA y en los Dukes D. Además reafirmaron que el pronóstico es más pobre cuando el ganglio linfático apical es positivo. También los enfermos con GLA positivo tienen más probabilidad de tener el margen de resección comprometido e invasión vascular extramural.
En un análisis multivariado3 se mostró que después de las metástasis a distancia, las metástasis ganglionares son la segunda causa de mal pronóstico.
Por ello, la ligadura alta de la arteria mesentérica inferior es aconsejable, porque permite colectar mayor cantidad de ganglios y en consecuencia posibilita una mejor estadificacióntumoral. Además es un indicador de buena calidad quirúrgica.
Newland y col. a través de varios trabajos sostienen que más que el número, la localización de los ganglios positivos es el factor pronóstico de más importancia. Por ello, si el hallazgo de un ganglio apical positivo es un indicador de enfermedad avanzada, se deberían implementar terapias más agresivas y seguimientos más estrechos para detectar recurrencias más tempranas.4,5,6
Por el contrario, Suzuky y col.7 reportaron que el número de ganglios positivos y no la localización tiene valor pronóstico positivo.
En base a trabajos de la literatura, el panel de expertos de la NCCN (J Natl Compr Netqw 2012;10 :1524-1564) recomienda que actualmente, el uso del ganglio centinela, así como la detección de células neoplásicas por inmunohistoquímica, sólo debería considerarse para estudios de investigación y los resultados deberían ser usados con precaución en la toma de decisiones clínicas.
En un trabajo reciente Vaccaro y col.8 demostraron que tiene mayor importancia pronóstica la proporción de ganglios positivos que el número absoluto de los mismos
BIBLIOGRAFÍA
- Dukes CE.: The classification of cancer of the rectum. J Pathol Bacteriol 1932;32:323
- Ang CW., Tweedle EM., Campbell F. y col.: Apical node metástasis independently predicts poor survival in Dukes C colorectal cancer. Colorectal Disease 2011;13:526-531
- Chapuis PH., Dent OF., Fisher R. y col.: A multivariate analysis of clinical and pathological variables in prognosis after resection of large bowel cancer. Br J Surg 1985;72:698-702
- Newland RC., Chapuis PH. y Pheils MT.:The relationship of survival to staging and grading of colorectal carcinoma: a prospective study of 503 cases. Cancer 1981;47:1424-9
- Newland RC., Chapuis PH. y Smith EJ.: The prognostic value of substaging colorectal carcinoma. A prospective study of 1117 cases with standarized pathology. Cancer 1987;60:852-7
- Newland RC., Dent OF., Lyttle MN. Y col.: Pathologic deterinants of survival associated with colorectal cancer with lymph node metastases, A multivariated analysis of 579 patients. Cancer 1994;73:2076-82
- Suzuki O., Sekishita Y., Shiono T. y col.: Number of lymph node metastases is better predictor of prognosis that level lymph node metastases in patients with node-positive colon cancer. J Am Coll Surg 2006;202:732-736
- Vaccaro CA., Im V., Rossi GL. y col.: Lymph node ratio as prognosis factor for colon cancer treated by colorectal surgeons. Dis Colon Rectum 2009;52:1244-50
Resumen y conceptos destacables
- La progresión metastásica ganglionar es un factor de mal pronóstico y el compromiso del ganglio apical influye negativamente en la sobrevida.
- La ligadura alta de la arteria mesentérica superior posibilita una recolección mayor de ganglios (incluído el apical) y en consecuencia una mejor estadificación.
- Son motivo de controversias como factores predictivos de pronóstico el número de ganglios positivos, su localización y la proporción de positivos con respecto al total recolectado
Tumor residual. Clasificación “R” :
Por definición, la estadificación TNM, describe la extensión anatómica del carcinoma del recto, no tratado previamente. El valor predictivo se basa en los datos obtenidos de los resultados del tratamiento de los mismos.
Esto no ocurre con el tumor residual que usa los mismos parámetros para la estadificación.
Se denomina así al tumor que persiste luego de la resección quirúrgica, por compromiso de los márgenes proximal, distal y/o circunferencial.1 Desde 1977 la AJCC recomendó la utilización de una clasificación auxiliar (clasificación R) porque tiene un valor pronóstico de importancia y actualmente sigue sostenida en la 7º edición del TNM.2
Se agrupa en 4 grados:
- Rx: No puede ser evaluada la presencia de un tumor residual.
- R0: La resección es completa, los márgenes histológicamente son negativos y no hay tumor residual (ni tumor primario ni ganglios linfáticos metastásicos).
- R1: La resección es incompleta, los márgenes histológicos están comprometidos, hay presencia de tumor microscópico (como tumor primario o como ganglios metastásico).
-
R2: La resección es incompleta, los márgenes están macroscópicamente comprometidos o hay enfermedad macroscópica después de la resección (por ej. tumor primario, ganglios regionales o metástasis hepáticas).
Esta estadificación auxiliar evalúa la eficacia del tratamiento primario, influye en el tratamiento a seguir y se correlaciona con el pronóstico.3
Recientemente, algunos patólogos propusieron que la clasificación detallara el compromiso específico del margen circunferencial y crearon subgrupos. El resultado fue complejizar el tema y además no tuvo mayor difusión.4
El tumor residual es un fuerte predictor de los resultados post-tratamientos y los estadíos R1 Y R2 son factores pronósticos adversos.
Por todo ello, para el patólogo es de suma relevancia, la evaluación histológica de los márgenes de resección radial circunferencial, distal y proximal, porque posibilitan ésta estadificación.
Es necesario destacar, como dice Compton5 “que está ampliamente aceptado por convención, que cuando el margen de resección en la pieza anatómica, está afectado por tumor, es probable que haya infiltración tumoral en el sitio opuesto del margen, es decir, dentro del tejido correspondiente al sitio de resección en el paciente”. Sin embargo, se debe señalar que el estadío R0, evaluado en los márgenes locales, no debe indicar ausencia absoluta de tumor en cualquier tejido del organismo, que debe descartarse si se presupone con otras metodologías de evaluación.6
BIBLIOGRAFÍA
- Hermanek P. Colorectal carcinoma: Histopathological diagnosis and staging. Baillieres Clin Gastroenterol 1989;3 :511-529.
- AJCC Cancer Staging Manual-American Joint Committee on Cancer 7º Edition 2010, Springer.
- Wittekind C., Compton CC., Greene F. y col. TNM residual tumor classification reviseted Cancer 2002; 94: 2511-2516
- Wittekind C., Comptonn CC., Quirke P. y col. A uniform residual tumor (R) classification. Integration of the R classification and the circunferential margin status. Cancer 2009; 115: 3483-3488
- Compton CC. Key issues in reporting common cancer specimens. Arch Pathol Lab Med2006;130: 318-324
- Wittekind C.,Comptonn CC. y Sobin LH. Residual tumor classification revisited. Cancer 2002;94: 2511-2516
Estadificación de los carcinomas múltiples
Para la estadificación de los cánceres múltiples sincrónicos se consideran el colon y recto como un solo órgano. El carcinoma primario es el que tiene la estadificación T más alta y la cantidad se indica con el número o la letra m colocados entre paréntesis después del pTdel tumor dominante (por ej. pT32 o pT3 (m)).
Los tumores sincrónicos pueden incluir:
- Cánceres múltiples no invasivos.
- Cánceres múltiples invasivos.
- Combinación de ambos.
Si un cáncer nuevo se diagnostica dentro de los dos primeros meses del primer diagnóstico, éste nuevo carcinoma se considera sincrónico bajo el criterio sustentado por el programa SEER (Survillance, Epidemiology and Results Program of the National Cancer Institute).1
BIBLIOGRAFÍA
- SEER Program: Code Manual. NIH Publication Nº92-1999 Bethesda,Md: National Cancer Institute,1992
Tumor recurrente
PSe designa así al que reaparece luego de un tiempo ( intervalo libre de enfermedad), durante el cual no pudo detectarse. Ese tiempo por consenso es 6 meses después de la resección. Puede reaparecer en el sitio del tumor primario (recaida local) o en otro sitio del organismo. La recidiva es la recaída en el mismo sitio. Es decir es una modalidad de recurrencia, pero no todas las recurrencias son una recidiva. La variedad histológica de la recurrencia debe ser la misma del tumor primario. En caso contrario sería un nuevo tumor.
Migración de estadío
Se describe así a un cambio en la distribución del estadío en una población con un cáncer en particular, inducido por un cambio en el sistema de estadificación mismo o un cambio en la tecnología que permite una detección de la diseminación tumoral con mayor sensibilidad y especificidad.
Esto se conoce como fenómeno de Will Rogers, comediante estadounidense (1879-1935) que dijo “Cuando un ciudadano de Oklahoma se va a California, la inteligencia media de ambos estados aumenta”. El fenómeno es una paradoja aparente que ocurre cuando se desplaza un elemento de un conjunto (elemento que está por debajo de la media en ese conjunto) a otro conjunto, donde ese elemento desplazado tenga un valor por encima de la media. De ésta manera crece la media de ambos conjuntos, tras el cambio.
