REV ARGENT COLOPROCT | 2014 | VOL. 25, Nº 3
RELATO ANUAL
CAPÍTULO 8
Estadificación por Anatomía Patológica
Dr. Jorge A. Hequera
GENERALIDADES
La estadificación anátomo-patológica requiere una evaluación detallada de la pieza de resección quirúrgica. El reconocimiento de factores pronósticos vinculables a los estudios de patología, hace recomendable establecer protocolos estadarizados que incluyan todo esos elementos. Tales protocolos, a veces son solamente una “aide memoir” que mejora el rendimiento.1
La información que debería incluir el estudio anátomo-patológico, para evaluar un carcinoma rectal se detalla a continuación2 y cada uno de los ítems se discute en distintos apartados de éste Relato.
- Descripción macroscópica del tumor y del órgano.
- Gradación histológica del cáncer.
- Profundidad de la penetración y extensión a estructuras adyacentes (estadío T).
- Número de ganglios linfáticos regionales evaluados.
- Número de ganglios positivos evaluados (estadío N).
- Presencia de metástasis a distancia en otros órganos ó regiones, incluyendo ganglios linfáticos no regionales (estadío M).
- Compromiso oncológico o no, de los márgenes proximal, distal y circunferencial (radial).2-8
- Efectos del tratamiento neoadyuvante.2,3,9,10
- Invasión linfovascular.2,3,11
- Invasión perineural.12-14
- Número de depósitos tumorales.15-19
BIBLIOGRAFÍA
- Rigby K, Brown SR, Lkin G y col. The use of a proforma improves colorectal cancer pathology reporting. Ann R Coll Surg Engl 1999;81: 401-403.
- Washington MK, Berlin J, Branton P y col. Protocol for the examination of specimens from patients with primary carcinoma of the colon and rectum. Arch Pathol Lab Med 2009;133 :1539-1551.
- Edge SB, Byrd D, Compton C, y col. Eds. AJCC Cancer Staging Manual 7º Edition, New York: Springer; 2010.
- Compton CC, Fielding LP, Burgart LJ y col. Prognostic factors in colorectal cancer. College of American Pathologists Concensus Statement 1999. Arch Pathol Lab Med 2000;124:979-994.
- Compton CC y Greene FL: The staging of colorectal cancer: 2004 and beyond. CA Cancer J CLIN 2004;54 :295:308.
- Nagtegaal ID, Marijnen CA, Kranenbarg EK y col. Circumferencial margin involvement is still an important predictor of local recurrence in rectal carcinoma: not one millimeter but two millimeter is the limit. Am J Surg Pathol. 2002; 26:350-7.
- Nagtegaal ID y Quirke P. What is the role for the circunferencial margin in the modern treatment of rectal cancer? J Clin Oncol 2008;26:303-312.
- Wibe A, Rendedal PR, Svensson E y col. Prognostic significance of the circunferencial resection margin following total mesorectal excision for rectal cancer. Br J Surg 2002;89 :327-334.
- Gavioli M, Lupp G, Losi L y col. Incidence and clinical impact of sterelized disease and minimal residual disease after preoperative rasiochemotherapy for rectal cancer Dis Col Rectum 2005;48:1851-1857.
- Rodel C, Martus P, Papadoupolos T y col. Prognostic significance of tumor regression after preoperative chemoradiotherapy for rectal cancer. J Clin Oncol 2005;23:8388-8696.
- Nissan A, Stojadinovic A, Shia A y col. Predictors of recurrence in patients with T2 an early T3, NO adenocarcinoma of the rectum treated by surgery alone. J Clin Oncol 2006;24:4078-4084.
- Fujita S, Shimoda T, Yoshimura K y col. Prospective evaluation of prognostic factors in patients with colorectal cancer undergoing curative resection. J Surg Oncol 2003;84 :127-131.
- Liebig C, Ayala G, Wilks J y col. Perineural invasion is an independent predictor of outcome in colorectal cancer. J Clin Oncol 2009;27:5131-5137.
- Quah HM, Chou JF, Gonen M y col. Identification of patients with high-risk stage II colon cancer for adjuvant therapy. Dis Colon Rectum 2008;51: 503-507.
- Lo DS, Pollett A, Siu LL y col. Prognostic significance of mesenteric tumor nodules in patients with stage III colorectal cancer. Cancer 2008; 112:50-54.
- Nagtegaal ID y Quirke P. Colorectal tumor deposits in the mesorectum and pericolon; a critical review. Histopathology 2007; 51 :141-149.
- Puppa G, Misonneuve P, Sonzogni A y col. Pathological assessment of pericolonic tumor deposits in advanced colonic carcinoma: relevance to prognosis and tumor staging. Mod Pathol 2007; 20: 843-855.
- Ueno H y Mochizuki H. Clinical significance of extrabowel skipped cancer infiltration in rectal cancer. Surg Today 1997;27:617-622.
- Ueno H, Mochizuki H y Hasshiguchi Y y col. Extramural cancer deposits without nodal structure in colorectal cancer: optimal categorization for prognostic staging. Am J Clinic Pathol 2007;127:287-294.
Historia de las clasificaciones Anátomo-Patológica
La primera estadificación referida para el carcinoma del recto se debe a Lockhart-Mummery1 cirujano del St. Mark’s Hospital de Londres, en 1927. La fundamentó en el estudio de 200 pacientes tratados por escisión perineal y utilizó para la clasificación un sistema alfabético de tres letras: A, B y C, basado en la profundidad de la penetración tumoral en la pared rectal. En 1932 Dukes,2 patólogo de la misma institución, estableció una clasificación similar pero incluyendo el estadío ganglionar. Esta clasificación fue clásica durante casi medio siglo, con algunas modificaciones que el mismo Dukes introdujo. Otros investigadores propusieron modificaciones posteriores y tuvieron diversos grados de aceptación.3-5 En 1954, Denoix6 presentó un sistema de estadificación basado en tres características, que refieren la descripción tumoral, linfática regional y metastásica, utilizando la sigla TNM. Sustentada por la Unión Internacional Contra el Cáncer (UICC) y el American Joint Committee on Cancer (AJCC) primero por separado y por consenso unificado a partir de 1977, actualmente es de uso universal.
Resumen y conceptos destacables
- El fundamento principal de una clasificación es poder agrupar los pacientes de acuerdo a los resultados y dictar pautas pronósticas.
- Las clasificaciones anátomo-patológicas fueron la primera forma de estadificar el carcinoma del recto, pues no existían las imágenes.
- La mayoría de las clasificaciones ideadas el siglo pasado usaban criterios parciales que las hacían poco comparables entre sí.
BIBLIOGRAFÍA
- Lockhart-Mummery JP. Two hundred cases of cancer of the rectum treated by perineal excision. Br J Surg 1927;14 :110-124.
- Dukes CE. The classification of cancer of the rectum. J Pathol 1932;35 :323-332.
- Kirklin JW, Dockerty MB y Waugh JM. The role of peritoneal reflection in the prognosis of carcinoma of the rectum and sigmoid colon. Surg Gynecol Obstet 1949;88:326-331.
- Astler VB y Coller FA. The prognostic significance of direct extension of carcinoma of the colon and rectum. Ann Surg 1954;139 :846-851.
- Turnbull RB, Kyle K, Watson FR y col. Cancer of the colon: The influence of the Non-touch isolation tecnique on survival rates. Ann Surg 1967;166 :420-427
- Zinkin LD. A critical review of the classification and staging of colorectal cancer. Dis Colon Rectum 1983;26:37-43.
Clasificaciones anátomo-patológicas
Una preocupación constante del equipo médico multidisciplinario es poder correlacionar con la mayor aproximación la exéresis tumoral y el pronóstico. El resultado oncológico permite adecuar modificaciones terapéuticas que mejoren los índices de supervivencia. Esta necesidad se concreta en el diseño de clasificaciones oncológicas. La variedad es amplia y cada una contempla algunos aspectos. Por ello muchas veces no son comparables y por ende las conclusiones son dispares.
De todos modos y aunque no sea una indicación sustentarlas, es conveniente describirlas someramente para clarificar conceptos erróneos y facilitar la comparación de estadíos.
Ya fue referido el inicio de las principales clasificaciones1,2,3 en las primeras décadas del siglo pasado y se detallan a continuación.
Evolución de las distintas clasificaciones
Dukes; Kirklin, Dockerty y Waugh; Astler y Coller; Turnbull, Kyle, Watson y Spratt; Gunderson-Sosin; GITSG; Australiana; Jass-Love-Northover; Post- neoadyuvancia, T.N.M.
Clasificación de Dukes
Tal vez la clasificación que alcanzó más difusión (y aún hoy hay centros que la utilizan) es la referida por Dukes (Figs. 1 y 2) en 1932.2 Originalmente fue descripta para los carcinomas rectales y está basada en la extensión de la diseminación directa y en la aparición de metástasis linfáticas. Los tumores se dividen en tres categorías principales: A, B y C. En el grado A el tumor está limitado a la pared rectal, sin que exista una propagación a los tejidos peri-rectales ni compromiso ganglionar linfático. En el grado B la extensión tumoral llega a los tejidos peri-rectales, pero tampoco hay invasión ganglionar. En el grado C hay metástasis ganglionares. Hay que destacar que habitualmente el compromiso ganglionar se establece cuando el tumor se propagó a los tejidos peri-rectales. Por ende el grado C de hecho es un grado B con metástasis linfáticas. Posteriormente el propio Dukes modificó el grado C,4 subdividiéndolo de acuerdo al nivel de la ligadura vascular. Cuando los ganglios metastásicos son próximos al tumor, quedando algunos de la cadena indemnes por debajo de la ligadura principal, en los vasos hemorroidales (rectales) superiores o mesentéricos inferiores, el grado se denomina C1. Cuando la cadena ganglionar está infiltrada hasta la propia ligadura, el grado se denomina C2.
En todos sus trabajos, Dukes sostuvo que su clasificación es una medida de diseminación y que no hay relación entre el tamaño del tumor y la penetración.
La principal ventaja de ésta clasificación es su sencillez al utilizar sólo tres letras, lo que facilita recordarla. Sin embargo, resulta inconveniente la necesidad de evaluar las piezas de resección (excluye la posibilidad de clasificación clínica), no contemplar las metástasis y haber sido diseñada sólo para los carcinomas del recto. Ello generó una serie de modificaciones (algunas hechas por el mismo Dukes) con la intención de superar éstos defectos. Para ello se utilizaron las mismas letras pero dividiéndolas en subgrupos de acuerdo a la penetración parietal o al grado de afectación ganglionar según niveles de localización anatómica o agregando una letra para tabular las metástasis y extrapolándola al colon. El resultado final es una confusión por errores semánticos o de interpretación.5 Sin embargo, el impacto de la clasificación de Dukes o sus modificaciones posteriores ha sido tan grande que en muchos trabajos de descripción se señala su equivalencia a la clasificación T.N.M. (de uso actual y de difusión universal).

Figura 1: Cuthbert E. Dukes (1890-1977).
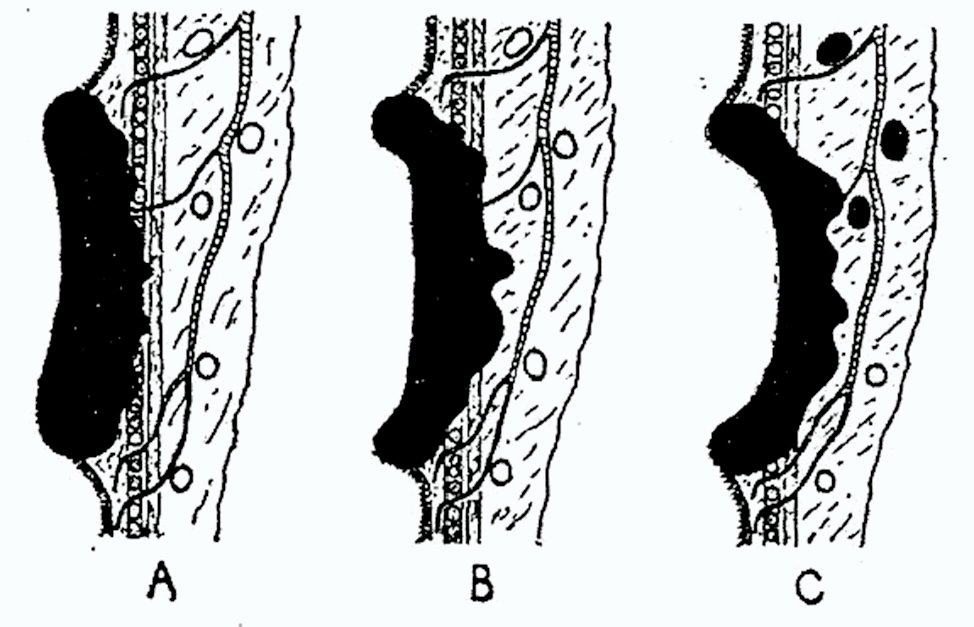
Figura 2: Esquema original de la clasificación de Dukes (1932).
Clasificación de Kirklin, Dockerty y Waugh:
En 1949, Kirklin, Dockerty y Waugh6 de la Clínica Mayo, propusieron una clasificación que modificaba “ligeramente” la de Dukes. Sin embargo, de su análisis se deducen importantes diferencias. El grado A son tumores limitados a la mucosa y establecen dos subgrupos B: el B1, invade la muscular propia sin atravesarla y el B2 con penetración completa de la misma. El grado C no fue subdividido y significa presencia de metástasis linfáticas sin especificar regionalidad. Puede haber entonces tumores de grado C con invasión incompleta (B1) o completa (B2) de la capa muscular.
Además en ésta clasificación se incluyeron únicamente tumores operados con intención “curativa”, (a diferencia de Dukes que incluyó operaciones “paliativas” y por ello no pueden ser comparables. También se tabularon carcinomas del sigmoides distal.
Clasificación de Astler y Coller:
En 1954, Astler y Coller7 propusieron una modificación a la clasificación de Kirklin, Dockerty y Waugh, incluyendo también los tumores resecados con criterio paliativo. La única modificación es en el grado C que dividieron en C1 y C2. Ambos indican metástasis linfáticas pero C1 es cuando el tumor tiene penetración incompleta de la pared y C2 cuando es completa. Se deduce que no hay diferencia conceptual entre ambas clasificaciones, con respecto a la penetración, pero difieren en la inclusión de tumores avanzados y en la subdivisión del grado C.
En ésta clasificación se pone énfasis en el “efecto de protección” de la serosa en cuanto a la diseminación, ya que los pacientes con grado C1 (sin invasión de la serosa) tienen una sobrevida mayor que los del grado C2.
Clasificación de Turnbull, Kyle, Watson y Spratt:
El estudio anatomopatológico del colon o recto resecados y sus mesos pueden ser insuficiente para describir la extensión completa de la neoplasia. Así es que puede haber penetración parietal con o sin ganglios metastásicos tanto en las resecciones paliativas como en las curativas. Para estadificar la diseminación a distancia Turnbull y col.8 y Turnbull en 19759 de la Cleveland Clinic, introdujeron para el cáncer del colon un grado D, que incluye las metástasis alejadas y la invasión a órganos adyacentes. Fue también aplicado al cáncer del recto y la detección del estadío D se basa en hallazgos clínicos o quirúrgicos, laparoscópicos o de imágenes y puede ser confirmado por citología o por biopsias.
Clasificación de Gunderson-Sosin
Esta clasificación10 no tuvo mayor difusión. Modifica el sistema de Astler y Coller, y sudivide los estadíos con invasión microscópica de aquellos con invasión macroscópica. Como Astler y Coller demuestran que si el tumor penetra toda la capa muscular el pronóstico es menos favorable y que la presencia del carcinoma en la serosa es un factor de riesgo para la recurrencia local.
A: limitado a la mucosa.
B1: invade hasta la muscular propia.
B2: atraviesa la serosa (m: microscópica y g: macroscópica).
B3: adherencia o invasión a estructuras adyacentes.
C1: igual a B1 más metástasis en ganglios regionales.
C2: igual a B2 más metástasis en ganglios regionales.
C3: igual a B3 más metástasis en ganglios regionales.
Clasificación GITSG:
En 1984, el Gastrointestinal Tumor Study Group11 propone un sistema basado en la clasificación de Dukes considerando por primera vez el número de ganglios linfáticos metastásicos como parámetro pronóstico. Estudios posteriores demostraron el valor de dividir los ganglios en dos grupos (de uno a tres y cuatro o más).12
Clasificación Australiana:
Es también un método alfabetizado que usa las letras A, B, C, y D. Pero incluye una categoría “0” para los carcinomas confinados a la mucosa y una categoría “X” para aquellos carcinomas resecados localmente sin linfadenectomía.13
Esta clasificación ha tenido poca difusión pero hay que destacar que una vez separadas las resecciones “curativas” éste sistema ha mostrado un gran poder predictivo.14
Clasificación de Jass y col.:
Jass y col.15 propusieron una clasificación basada en el pronóstico:
I Pronóstico excelente.
II Pronóstico bueno.
III Pronóstico regular.
IV Pronóstico pobre.
Los autores fundamentan su clasificación en la de Dukes, pero realizando análisis multivariados de variables seleccionadas de valor pronóstico independiente que parecen tener influencia en la sobrevida. Se incluyen el compromiso ganglionar y la diseminación a través de la pared colónica pero agregando la calidad del frente de invasión tumoral, la infiltración linfocitaria peritumoral y la diseminación local.
En realidad éste sistema no es estrictamente una clasificación por estadíos ya que reune parámetros de clasificación con factores biológicos. Deans y col.16 en una revisión de ésta clasificación refieren que la mayoría de los autores piensa que la clasificación de Dukes tiene mayor valor pronóstico y es más reproducible que la de Jass y col.
Clasificación post-tratamiento neoadyuvante:
Este tema es tratado in extenso en otro apartado del relato.
La evaluación patológica de resecciones rectales posteriores a tratamiento oncológico se basa en el hallazgo de tumor residual y metástasis en ganglios linfáticos.
La terapia neoadyuvante (quimioterapia y/o radioterapia) en el carcinoma del recto, esta asociada a una significativa respuesta tumoral que permite reclasificar el tumor con un estadío menor (“downstaging”). En un 10 a 30% de los casos la repuesta es completa ausencia de tumor residual en el examen patológico17 lo cual lleva a la necesidad de un replanteo táctico.
Por otra parte, la enfermedad residual mínima ha demostrado tener mejor pronóstico que la enfermedad macroscópica residual.
También es necesario considerar que la regresión tumoral debe ser evaluada sólo en el tumor primario y las metástasis no deben ser incluídas.
Los depósitos de mucina acelulares no son tomadas en cuenta para la estadificacion, sólo se consideran las células epiteliales viables para la asignación del estadío pT.
La estadificación patológica post quimio y/o radioterapia es indicada con el prefijo “y” para designar que la evaluación es post-tratamiento.
BIBLIOGRAFÍA
- Lockart-Mummery JP. Two hundred cases of cancer of the rectum treated by perineal excision. Br J Surg 1927; 14:110-124.
- DukesCE. The classification of cancer of the rectum.J Pathol Bacteriol 1932;32:323.
- Zinkin LJ. A critical review of the classification and staging of colorectal cancer. Dis Colon Rectum 1983;26:37-43.
- Gabriel WB, Dukes CE y Bussey HJR. Lymphatic spread in cancer of the rectum. Br J Surg 1935;23:395.
- Hequera JA, Gutiérrez VP, Grecco CA. y col. Clasificaciones para el cáncer del recto. Prensa Med Argent 1985;72: 142-146.
- Kirklin JW, Dockerty MB y Waugh IM. The role of the perotoneal reflection in the prognosis of carcinoma of the rectum and sigmoid colon. Surg Gynecol Obstet 1949;88:326.
- Astler VB y Coller FA. The prognosis significance of direct extension of carcinoma of the colon and rectum.Ann Surg 1954;139:846.
- Turnbull RB, Kyle K, Watson FR y col. Cancer of the colon: the influence of the non touch technique on survival rates. Ann Surg 1967;420:166.
- Turnbull RB: The no touch isolation technique of resection. JAMA 1975;231:1181.
- Gunderson LL y Sosin H.: Areas of failure found at operation (second or symptomatic look) following “curative surgery” for adenocarcinoma of the rectum. Cancer 1974;34 :1278-1292.
- Gastrointestinal Tumor Study Group. Adjuvant therapy of colon cancer. Results of a prospectively randomized trial. N Engl J Med 1984;310:737-743.
- Nathanson SD, Schultz L, Tilley B y col. Carcinomas of the colon and rectum. A comparison of staging classification. Am J Surg 1986;52 :428-433.
- Davis NC y Newland RC: The reporting of colorectal cancer: The Australian clinic-pathological staging system. Aust NZ J Surg 1982;52: 395-99.
- Chapuis PH, Fisher R, Dent OF y col. The relationship between staging methods and survival in colorectal carcinoma. Dis Col Rect 1985;28:158-161.
- Jass JR, Love SB y Northover JAM. A new prognostic classification of rectal cancer. Lancet 1987;1: 1303-1306.
- Deans GT, Heatley M, Anderson N y col. Jass’ classification revisited. J Am Coll Surg 1994;179:11.
- Hiotis SP, Weber SM, Cohen AM y col. Assessing the predictive value of clinical complete response to neoadjuvant therapy for rectal cancer. An analysis of 488 patients. J Am Coll Surg 2002;194: 131.
Comentarios sobre la clasificación de Dukes
John C. Goligher1 escribió en 1976 que la existencia de varias clasificaciones anátomo-patológicas sólo podía crear confusión y errores de interpretación en la lectura de trabajos publicados por las distintas instituciones. El refería que “es un derecho inalienable de cada patólogo y cirujano, de desarrollar su propio sistema de clasificación de la extensión de la diseminación del cáncer del colon y recto… (pero) yo sugiero que sería más útil restringir el impulso de clasificación y aceptar la clasificación de Dukes exactamente como fuera propuesta por él.”
A pesar de ésta sugerencia, desde 1991 el Council of the American Society of Colon and Rectal Surgeons refrendó la clasificación TNM.
Corman2 piensa que la clasificación de Dukes llena todos los criterios razonables de pronóstico y varios trabajos coinciden con ésta conclusión.3-9
Maughan y Quirke10 coinciden que la clasificación de Dukes tiene varios inconvenientes:
- No estadifica el compromiso peritoneal ni del mesorecto.
- Es de poco uso desde el advenimiento de los métodos imagenológicos.
- No posibilita por ser postoperatoria, la indicación de terapias neoadyuvantes.
Sin embargo tiene la ventaja, para usarla como clasificación secundaria, de ser fácil de recordar y entender.
BIBLIOGRAFÍA
- Goligher JC. The Dukes’ A, B and C categorization of the extent of spread of carcinomas of the rectum. Surg Gynecol Obstet 1976;143:793.
- Corman ML. En Corman’s Colon and Rectal Surgery. Lippincott,Williams and Williams, Philadelphia, 6º ed. 2013 pag.771.
- Chapuis PH, Dent OF, Newland RC y col. An evaluation of the American Joint Committee (pTNM) staging method for cancer of the colon and rectum.Dis Colon Rectum 1986;29:6.
- Deans GT, Heatley M, Anderson N y col. Jass’ classification revisited. J Am Coll Surg 1994;179:11.
- Fisher ER, Robinsky B, Sass R y col. Relative prognostic value of the Dukes and Jass systems in rectal cancer: findings from the National Surgical Adjuvant Breast and Bowel Projects (Protocol R-01). Dis Colon Rectum 1989;32:944.
- Fisher ER, Sass R, Palekar A y col. Dukes’ classification revisited findings for the National Surgical Adjuvant Breast and Bowel Projects (Protocol R-01) Cancer 1989;64:2354.
- Lindmark G, Gerdin B, Pahlman L y col. Prognostic predictors in colorectal cancer. Dis Colon Rectum 1994;37:1219.
- Nathanson SD, Schultz L, Tilley B y col. Carcinomas of the colon and rectum: a comparison of staging classification. Am Surg 1986;52:428.
- Haboubi N. The TNM: a very good staging system that needs continuous appraisal. Colorectal Dis 2011;13:477.
- Maughan NJ y Quirke P. Modern management of colorectal cancer-A pathologists’ view. Scandinavian J Surg 2003;92:11-19.
Clasificación T.N.M.
Breve revisión histórica
Uno de los grandes avances en el tratamiento del cáncer colo-rectal en el siglo XX fue la estadificación postoperatoria del tumor y la división por grupos de los pacientes según el pronóstico. En la actualidad, la estadificación que comenzó con Lockhart-Mummery en 1927 y Dukes en 1932, es una realidad aceptada y sustentada universalmente. Desde un comienzo y a través del tiempo hubo modificaciones para mejorar la estadificación con el objetivo de satisfacer las necesidades y requerimientos de todos los vinculados al cuidado del paciente.
El debate continúa y la pregunta es: ¿cúal es el sistema de estadificación más apropiado?
La respuesta es difícil porque el enfoque multidisciplinario para el cuidado del paciente depende de una estadificación exacta y actualmente no la hay.
¿Qué parámetros deben considerarse en una estadificación?
En 19781 la Union Internacionale contre le Cáncer (UICC) definió los requerimientos esenciales para establecer un sistema de estadificación:
- Debe ser claramente definido.
- Debe ser universalmente aceptado.
- Debe ser simple de aplicar.
- Debe reflejar el pronóstico de una manera lógica que exprese las etapas de progresión del carcinoma.
- Debe permitir, en base a los resultados, sugerir el tratamiento más apropiado.
El cumplimiento de estas premisas posibilita:
- Informar al paciente y a sus familiares del pronóstico.
- Aconsejar la necesidad de una vigilancia contínua.
- Seleccionar adecuadamente los pacientes que puedan beneficiarse de las terapéuticas adyuvantes o neoadyuvantes.
- Comparar resultados del tratamiento.
- Facilitar el intercambio de información entre colegas y centros de tratamiento.
Las primeras estadificaciones se fundamentaron en los hallazgos anátomo-patológicos porque el carcinoma es primariamente una enfermedad quirúrgica. El tumor resecado es imprescindible para una correcta evaluación histológica. Sin embargo, con ésta metodología no se puede evaluar enfermedad residual, por ello se incorporaron las estadificaciones clínico-patológicas.
Un resumen de ésta modalidad fue dado en un simposio moderado por Jass en 19872 que sugiere que “cualquier clasificación debería basarse en un pequeño número de variables clínicas, que tengan influencia importante e independiente. También la necesidad de clasificación por estadíos, de factores pronósticos para el manejo del paciente”.
En 1990 se trató éste tema en el Congreso Mundial de Gastroenterología, endoscopía digestiva y coloproctología3 en Sidney, Australia. Se consideró el cambio de estadificación anátomo-patológica por clínico-patológica, recomendándose establecer una terminología estándar para unificar los distintos sistemas de estadificación.
A pesar del tiempo transcurrido persisten las deficiencias y los desafíos en la versión 7º del TNM, como la necesidad de subestadificar los heterogéneos prupos de pacientes con ganglios positivos pero sin conocimiento de metástasis a distancia y la posibilidad de correlacionar las imágenes como las de RMN con los resultados del tratamiento neoadyuvante sin estadificación.
Chapuis y col.4 se preguntan si no es tiempo de reveer los métodos de estadificación y la terminología en un Forum Internacional, con el objetivo de evaluar que métodos se usan y cómo, quien debería ser responsable de la información para los estadíos y considerarando las necesidades de médicos y pacientes.
BIBLIOGRAFÍA
- UICC (1978 2nd edition) Clinical Oncology: A manual for students and doctors pp 67-8 Springer-Verlag. Berlin, Heidelberg.
- Jass JR, Chapuis PH, Dixon MF y col. Simposium om staging of colorectal cancer. Int J Colorect Dis 1987;2:123-38.
- Fielding LP, Arsenault PA, Chapuis PH y col. Working party report to the World Congress of Gastroenterology, Sidney, 1990. Clinicopathology staging for colorectal cancer: an International Documentation System (IDS) and an International Comprehensive Anatomical Terminology (ICAT). JGastroenterol Hepatol 1991;6:325-44.
- Chapuis PH, Bokey L, Chant C y col. Colorectal cancer staging revisited: time for critical evaluation? Colorectal Dis 2012;14:1043-1044.
Secuencia de publicaciones de la clasificación T.N.M.
1º edición publicada en 1977. Entró en vigor en 1978.
2º edición publicada en 1983. Entró en vigor en 1984.
3º edición publicada en 1988. Entró en vigor en 1989.
4º edición publicada en 1992. Entró en vigor en 1993.
5º edición publicada en 1997. Entró en vigor en 1998.
6º edición publicada en 2002. Entró en vigor en 2003.
7º edición publicada en 2009. Entro en vigor en 2010.
8º edición será publicada en el otoño de 2016 y entrará en vigor enero 2017 (Greene F. comunicación personal).
La estadificación TNM fue preconizada por Pierre Denoix (Fig. 3), entre 1943 y 1952, usando el tamaño y la extensión del tumor primario, el compromiso linfático y la presencia de metástasis para clasificar la progresión del cáncer.1
Posteriormente el TNM fue desarrollado y mantenido por la International Union Against Cancer (UICC) para lograr un consenso sobre una norma reconocida globalmente como estándar para clasificar la extensión de la diseminación del cáncer. La TNM también fue usada por la American Joint Comittee on Cancer (AJCC). En 1987 la UICC y la AJCC unificaron los sistemas de estadificación.
T (tumor): refiere el tumor primario que no ha sido previamente tratado y en el colon y en el recto significa diseminación tumoral a través de la pared visceral.
N (node, ganglio): refiere el compromiso ganglionar regional.
M (metástasis): indica presencia o ausencia de metástasis a distancia.
La moderna cirugía y el tratamiento multimodal del carcinoma rectal está orientado a minimizar la recurrencia local y a distancia. La probabilidad de que ocurran ambas dependerá fuertemente de una estadificación adecuada y abarcativa, donde se consideren los parámetros que puedan tener una mayor incidencia en la diseminación.
El sistema TNM, incorpora factores pronósticos (clínicamente relevantes y características específicas tumorales que afectan el resultado) y factores predictivos (características pronósticas de probabilidad de respuesta a un tratamiento determinado). Ambos constituyen la base de los tratamientos estándares dirigidos por la estadificación.
A pesar de ser un sistema dinámico que se actualiza cada pocos años hay limitaciones, ya que la estadificación se renueva sobre ítems fijos y formalmente no se incorpora la respuesta a los tratamientos como factores pronósticos.
En un comienzo la estadificación del colon y del recto podía asimilarse como clasificación común porque el pilar del tratamiento era la cirugía.
Actualmente la estadificación del carcinoma del recto es más precisa y de hecho las imágenes permiten una caracterización diagnóstica (local y a distancia) de suma importancia para el o los tipos de tratamiento y el pronóstico de los mismos.
Por otra parte, se necesitan agregar factores de pronóstico para poder identificar pacientes de alto riesgo, que requerirán terapéuticas más agresivas.

Figura 3: Pierre Denoix (1912-1990).
BIBLIOGRAFÍA
-
Denoix PF. Enquete permanent dans les Centres Anticancereaux. Bull Inst Nat Hyg 1946;1:70-75.
Especificaciones sobre el estadío “T”
La invasión tumoral a través de las capas de la pared rectal constituye uno de los pilares de la clasificación TNM. La penetración tumoral es referida a cada una de las capas y se detalla a continuación (Figs. 4 a 12):
pTx: El tumor primario no puede ser evaluado.
pT0: No hay evidencia del tumor primario.
pTis: Carcinoma in situ intraepitelial (o no invasor).
pTis: Carcinoma in situ intramucoso (o con invasión de la lámina propia).
pT1: Tumor que invade la capa submucosa.
pT2: Tumor que invade la capa muscular propia.
pT3: Tumor que atraviesa la capa muscular propia comprometiendo la subserosa o el tejido pericólico o perirrectal no peritonizado.
pT4a: Tumor que penetra superficie del peritoneo visceral.
pT4b: Tumor que invade directamente o está adherido a otros órganos o estructuras.
El riesgo de recurrencia para el estadío T se incrementa con la progresión del estadío, independientemente del compromiso ganglionar1 con los siguientes porcentajes:
- T1 5%.
- T2 10%.
- T3 25%.
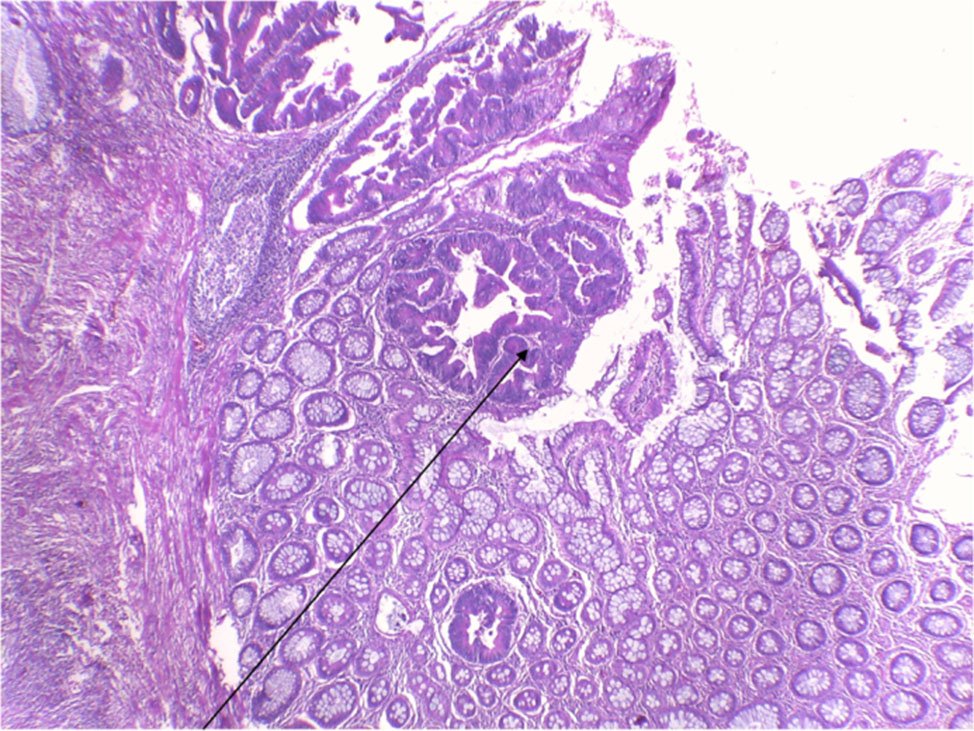
Figura 4: pTis Adenocarcinoma In situ. Imágenes cribiformes en Adenoma túbulo papilar Categoria 5.1 de Viena.
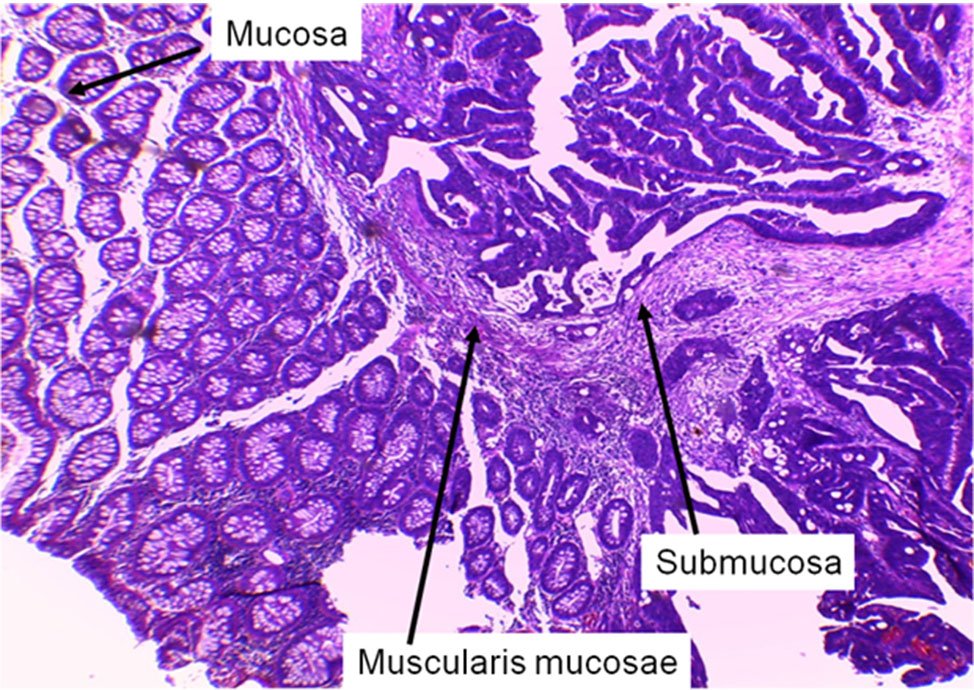
Figura 4: pTis Adenocarcinoma In situ. Imágenes cribiformes en Adenoma túbulo papilar Categoria 5.1 de Viena.

Figura 5: Estadio pT1 Invasión de la submucosa.
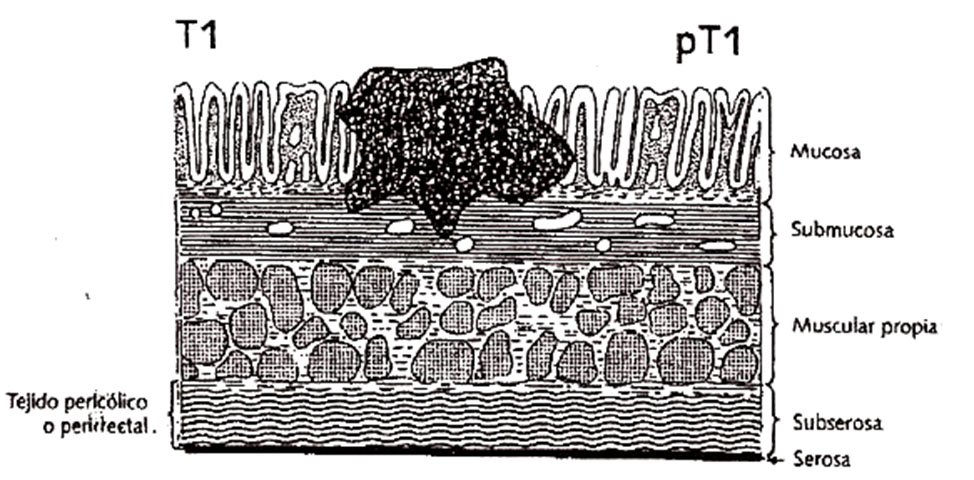
Figura 6: esquema del estadío pt1.

Figura 7: Estadio pT2. Invasión de muscular propia.
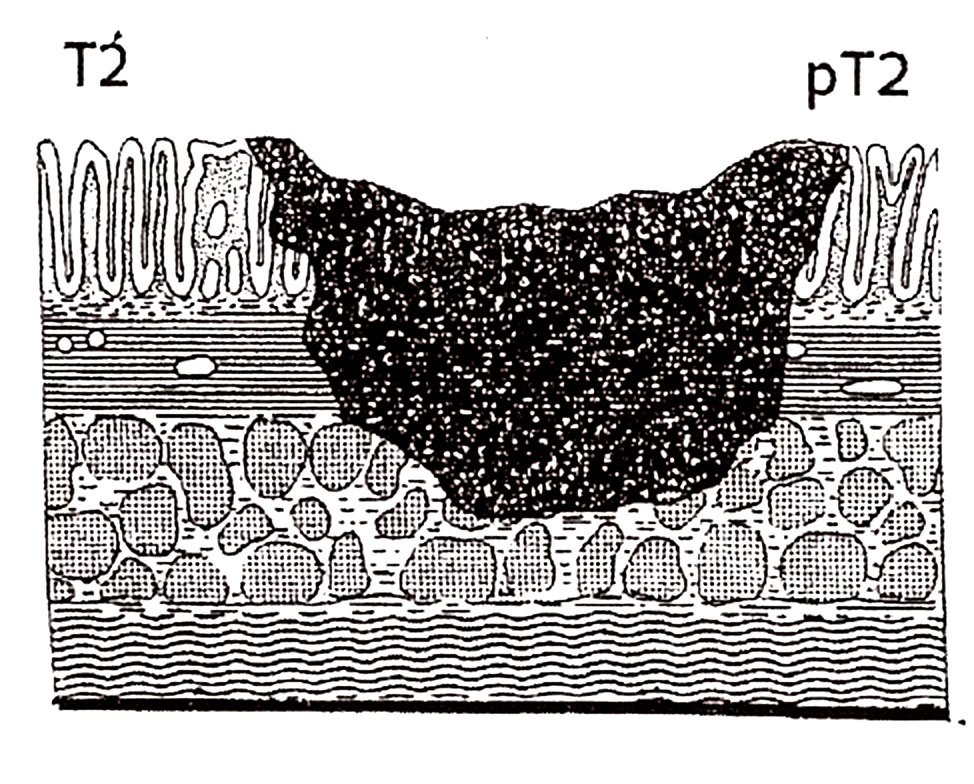
Figura 8: esquema del estadío pt2

Figura 9: Estadio pT3. Invasión del tejido adiposo peri-rectal.
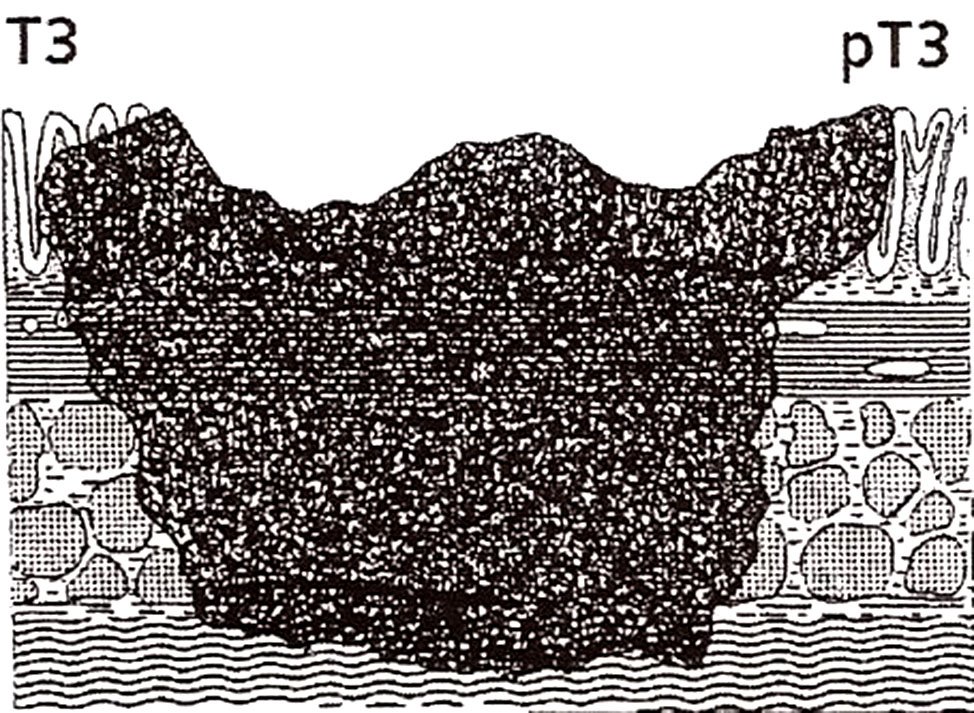
Figura 10: esquema del estadío pt3.

Figura 11: Estadio pT4a. Penetra el peritoneo ó adventicia.
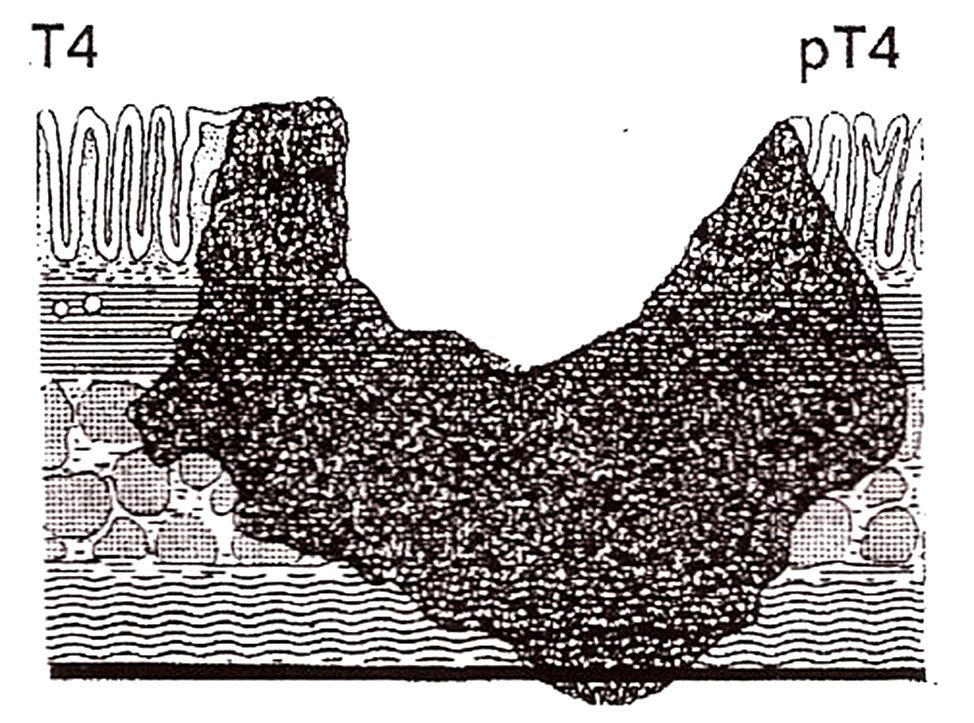
Figura 12: esquema del estadío pt4.
Temas de controversia
pTis
Este estadío se refiere como “carcinoma in situ” y comprende dos variedades carcinoma intraepitelial, que la caracteriza la presencia de células malignas encima de la membrana basal y carcinoma intramucoso, cuando la diseminación está confinada a la lámina propia y no más allá de la muscularis mucosae.
Ni el carcinoma intraepitelial ni el intramucoso están asociados a riesgo de metástasis, porque no hay vasos linfáticos en la mucosa colónica por encima de la muscularis mucosae.2
Los términos “alto grado de displasia” y “displasia severa” pueden ser usados como sinónimos de adenocarcinoma in situ o carcinoma sin situ (AJCC Cancer Staging Manual 7ª ed. 2010, Springer).
pT3:
Este estadío refiere el tumor que atraviesa la capa muscular propia comprometiendo la subserosa o el tejido pericolónico o perirrectal no peritonizado, sin compromiso de la superficie serosa ni infiltración de estructuras adyacentes.
La invasión de la grasa perivisceral provoca cambios epiteliales y mesenquimáticos y en la forma de las células neoplásicas determinando un crecimiento del estroma y de los vasos (angiogénesis). Ese crecimiento tumoral en la grasa posibilita por proximidad anatómica la invasión de vasos linfáticos, venas extramurales y haces neuronales, favoreciendo así una diseminación a distancia.
Se ha referido que la penetración tumoral en profundidad más allá de la capa muscular, es un factor de peor pronóstico3-6 y la complejidad de la diseminación ha hecho que se subdivida el estadío pT3 en 4 grados.7 Esta subclasificación no fue incluída en la 7º Edición del TNM.
La extensión tumoral en la grasa se la considera midiéndola en mm desde el borde de la muscular propia hacia la subserosa o tejidos perirrectales o pericolónicos no peritonizados:
pT3a invasión menor de 1 mm.
pT3b invasión de 1 a 5 mm.
pT3c invasión de 5 a 15 mm.
pT3d invasión de más de 15 mm.
La invasión de un carcinoma del recto en el esfínter anal externo es clasificada como T3.
A la invasión de la grasa peri-rectal se la considera un factor pronóstico de sobrevida de acuerdo al grado de penetración. Cuando la invasión es menor a 5 mm el pronóstico es 85% y cuando es mayor a 5 mm desciende a 54%.8-10 Esto tiene especial relevancia porque llevaría a indicar neoadyuvancia solamente en el segundo grupo de pacientes. Sin embargo, en el primer grupo la posibilidad de compromiso ganglionar es del 38-43%10 lo cual sería también indicación de neoadyuvancia. De lo antedicho se deduce lo importante de una estadificación con adecuada precisión diagnóstica.
pT4:
Este estadío implica que el tumor ha penetrado la superficie serosa por diseminación directa, así como al tumor que invade directamente o es histológicamente adherente a otros órganos o estructuras pelvianas.
La adherencia a otros órganos o estructuras es clasificada como T4, pero si no hay evidencia microscópica la clasificación debería ser T3.
La invasión del músculo elevador del ano es clasificada como T4.
A pesar de haber subdivisión T4a y T4b, es de buena práctica que los tumores adheridos a otras estructuras sean extirpados en bloque.
Hay características histopatológicas que ayudan al patólogo a estadificar el compromiso peritoneal (pT4a):
- Reacción fibrosa fibroinflamatoria.
- Proliferación vascular.
- Células mesoteliales reactivas.
- Hemorragia en la serosa.
- Depósitos de fibrina en la serosa.
BIBLIOGRAFÍA
- Sobin LH y Compton CC. TNM seventh edition: what’s new, what’s changed: communication from the International Union Against Cancer and the American Joint Committee on Cancer. Cancer 2010;116: 5336-5339.
- Fenoglio CM, Kaye GI y Lane N. Distribution of human colonic lymphatics in normal hyperplastic and adenomatous tissue. Its relationship to metástasis from small carcinomas in pedunculated adenomas. Gastroenterology 1973;64-51.
- Merkel S, Mansmann U, Siassi M y col. The prognostic inhomogeneity in pT3 rectal carcinomas.Int J Colorectal Dis 2001;16: 298-304.
- Bori R, Sejben I, Svébis M y col. Heterogeneity of pT3 colorectal carcinomas according to the deph of invasion (published online ahead of print January 27,2009) Pathol Oncol Res doi:10.1007/s 12253-009-9149-x.
- Miyoshi M, Ueno H, Hashiguchi H y col. Extent of mesorectal tumor invasion as a prognostic factor after curative surgery for T3 rectal cancer patients. Ann Surg 2006;243 :492-498.
- Compton CC. Key issues in reporting common cancer specimens: problems in pathologic staging of colon cancer. Arch Pathol Lab Med 2006;130:318-324.
- Wittekind C, Henson DE, Hutter RV y col. TNM Supplement: A commentary on uniform use 3º ed. Hoboken, New Jersey: John Wiley and Sons:2003.
- Dukes CE y Bussey HJ. The spread of rectal cancer and its effects on prognosis. Br J Cancer 1958;12:309-320.
- Cawthorn SJ, Parums DV, Gibbs NM y col. Extent of mesorectal spread and involvement of lateral resection margin as prognostic factors after surgery for rectal cancer. Lancet 1990;335:1055-1059.
-
Merkel S, Mansmann U, Papadopoulos T y col. The prognostic inhomogeneity of colorectal carcinomas Stage III: a proposal for subdivisión of Stage III. Cancer 2001;92:2754-2759.
Resumen y conceptos destacables
- La estadificación anátomo-patológica debe incluir básicamente el compromiso loco-regional, la afectación ganglionar y la diseminación a distancia.
- La clasificación actual de aceptación generalizada es la T.N.M.
- Otras clasificaciones no reúnen las características diagnósticas y pronósticas de la T.N.M. y han perdido vigencia.
- La clasificación de Dukes como secundaria, puede ser útil en la práctica diaria, por su sencillez y fácil memorización.
- El uso de una clasificación aceptada internacionalmente, facilita no sólo el diálogo entre colegas, sino la realización prospectiva de trabajos con una evaluación de resultados fácilmente comparables.
Especificaciones sobre el estadío “N”
Los ganglios linfáticos regionales del recto son los hemorroidales o rectales (superior, medio e inferior), mesentéricos inferiores, ilíacos internos, mesorectales, sacros laterales, presacros, sacro de Gerota.
El compromiso metastásico ganglionar habitualmente es escalonado (ganglios pericólicos, intermedios y principales). Pero puede, raramente, ocurrir metástasis discontínuas o saltatorias (“skip metástasis”) o diseminación linfática retrógrada por bloqueo de linfáticos.
En base a estas consideraciones anatómicas la diseminación metastásica de un carcinoma del recto puede seguir dos vías:
- Diseminación ascendente, la más frecuente, hacia la arteria rectal superior y Mesentérica inferior
-
Diseminación lateral, hacia las arterias rectales medias, obturatriz, ilíaca externa e ilíaca interna.
El estadío N de node (ganglio) en inglés es la segunda variable de la clasificación T.N.M.
En la 7º Edición (2009) vigente en la actualidad se la dividió en dos subgrupos de acuerdo a la cantidad de ganglios regionales.
El detalle se consigna a continuación:
Nx los ganglios no pueden ser evaluados.
No ganglios regionales sin metástasis (Fig. 13).
N1 metástasis en 1-3 ganglios regionales (Fig. 14 y 15).
N1a metástasis en 1 ganglio regional.
N1b metástasis en 2-3 ganglios regionales.
N1c depósito(s) tumorales en la subserosa, mesenterio o tejidos pericólicos o perirectales no peritonizados sin ganglios regionales metastásicos (Figs. 16 y 17).
N2 metástasis en 4 o más ganglios regionales.
N2a metástasis en 4-6 ganglios regionales.
N2b metástasis en 7 o más ganglios regionales.

Figura 13: Ganglio linfático peri-rectal. Ausencia de metástasis.

Figura 14: Ganglio peri-rectal con metástasis masiva de Adenocarcinoma.
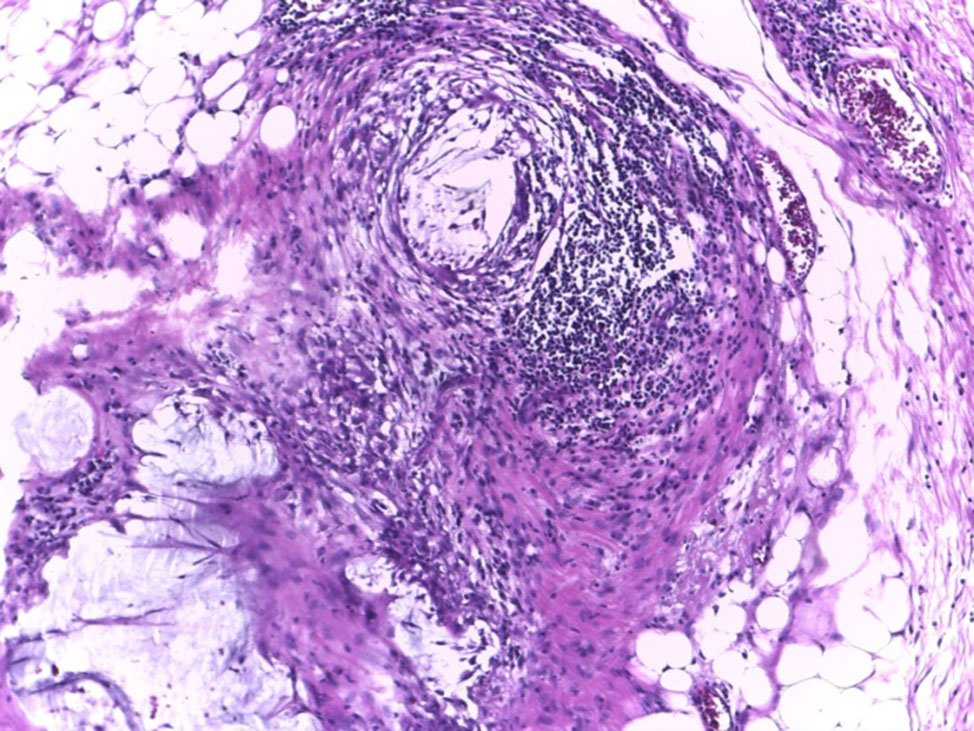
Figura 15: En la serosa/adventicia.
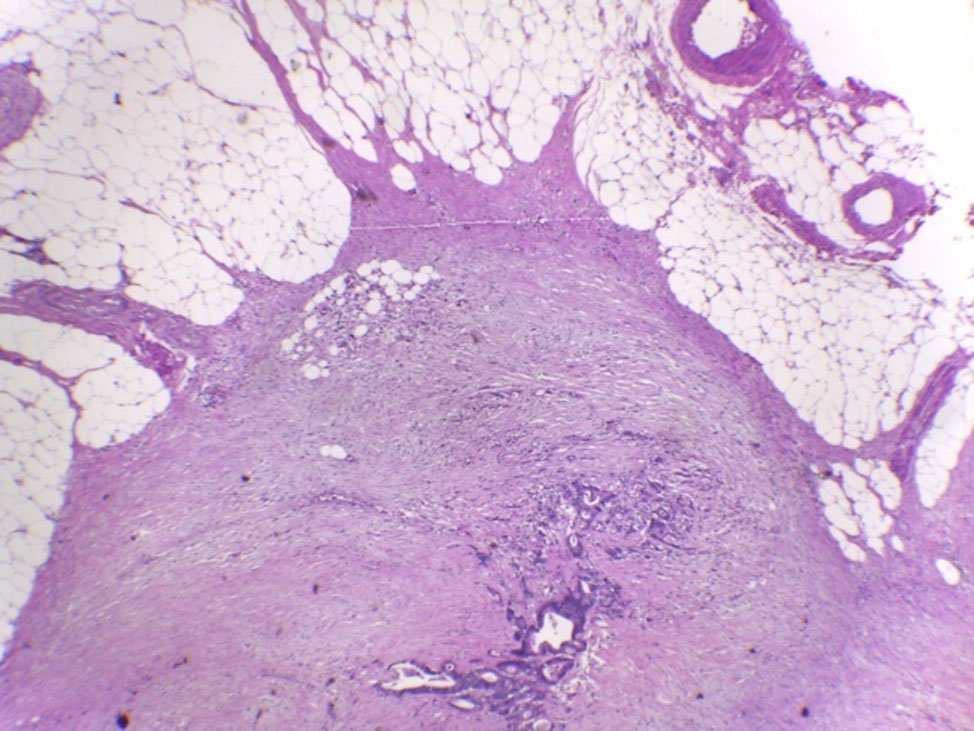
Figura 16: Depósitos tumorales, pN1c.
Necesidad de una alta precisión diagnóstica en el estadío “N”. Factores no modificables y factores modificables
La evaluación de la metástasis ganglionar es necesaria en la etapa clínica por varias razones:
1º La afectación ganglionar es un factor pronóstico adverso independiente.
2º De acuerdo al estadío N los pacientes deberán o no recibir tratamiento neoadyuvante:
Una subestadificación llevará a un tratamiento inadecuado.
Una sobreestadificación condicionará un exceso terapéutico.
3º En la resección local, donde no se extirpan ganglios, la estadificación debe excluir la metástasis ganglionar.
4º El riesgo de afectación ganglionar aumenta con el incremento del estadío T.1-4
T1 riesgo de 10.5%.
T2 riesgo de 15-20%.
T3 riesgo mayor al 30%.
T4 riesgo mayor al 50%.
En la etapa anátomo-patológica el análisis del compromiso ganglionar tiene varias facetas a considerar. Los detalles técnicos anátomo-patológicos a discutir son vinculables a:
- Variabilidad interobservador.
- Inadecuada visualización ganglionar en la microscopía óptica, por el número cortes.
- Presencia de micrometástasis no detectadas.
El primer punto dependerá fundamentalmente de la experiencia y del empeño puesto por el patólogo. El corte estándar puede no incluir tejido metastásico si éste es muy escaso y ante la duda se debería considerar la posibilidad de ampliar el número de cortes. Además técnicamente deben realizarse cortes siguiendo el eje longitudinal, hecho que posibilita una mayor evaluación tisular. Por otra parte, cuando son macroscópicamente negativos, debe incluirse todo el ganglio en el estudio histipatológico. La presencia de micrometástasis puede efectivizarse, en casos seleccionados, con técnicas de inmunohistoquímica. Pero por ser un procedimiento costoso y laborioso, no se lo recomienda en foma rutinaria.
Por otra parte si el patólogo no recoge un mínimo de 12 ganglios el National Comprehensive Cancer Network5 recomienda:
1º Volver a chequear la pieza de resección.
2º Si no se obtiene más ganglios, informar como comentario, que se hizo una búsqueda más intensiva.
Otros puntos estudiados y planteados se refieren a:
- La importancia directa de las metástasis ganglionares como factor predictivo de sobrevida. Hay una estrecha correlación entre el número de ganglios examinados y la sobrevida.6-10 También el número de ganglios analizados es una variable de pronóstico significativa en pacientes con ganglios positivos como negativos y la sobrevida esta asociada al incremento de ganglios analizados.8
- El número de ganglios necesarios para que el informe del anátomo-patólogo sea oncológicamente adecuado. Una recolección inadecuada de ganglios puede subestimar la presencia de ganglios metastásicos y posibilitar un tratamiento en menos. Tales pacientes insuficientemente estadificados tendrán un riesgo incrementado para la recurrencia local.
- La necesidad o no de técnicas de aclaramiento de la grasa, con el objetivo de identificar la mayoría
- El uso de la cadena de polimerasa (PCR).
- La proporción de ganglios positivos de todos los recolectados.
- La importancia del ganglio apical.
- Técnicas de inmunohistoquímica para identificar metástasis “ocultas”.
En 199011,12 se estableció la necesidad de reclutar un número de 12 ganglios para asegurar una estadificación precisa de los ganglios negativos.
En 200013 la misma cantidad fue recomendada por el National Cancer Institute fundamentándola en dos motivos:
- Aparentemente no había diferencias en el porcentaje de ganglios positivos en las piezas de resección con obtención de 12-20 ganglios y en aquellas con 20 o más.
- Con la recuperación de 12 ganglios se podía determinar exactamente la presencia o ausencia de metástasis ganglionares en el 90% de las piezas resecadas14,15 lo cual permite establecer con seguridad el diagnóstico de estadío II.16
Sin embargo, aunque la mayoría de los trabajos insisten en la necesidad de reclutar 12 o más ganglios17-19 un trabajo holandés admite un mínimo de 1020 y uno francés 8 ganglios.21
En 2007 la National Quality fórum aprobó como indicador de calidad para la resección del CCR la recolección de 12 o mas ganglios (htpp://www.qualityforum.org/pdf/ cáncer).
Sin embargo, hay correlación entre el número de ganglios recuperados y la detección de ganglios metastásicos y Goldstein y col.17 mostraron que esa probabilidad es del 25% para 12 ganglios, 46% para 18 ganglios, 48% para 24 ganglios y 85% cuando se examinan 30 ganglios.
En general e independientemente de la cantidad de ganglios examinados, los positivos son más fáciles de detectar porque tienden a ser más visibles, palpables o localizados a lo largo del pedículo vascular que irriga el tumor. Una disección estándar de la grasa visualiza ganglios hasta de 5 mm con metástasis. Herrera y col.22 encontraron en 345 piezas de resección 72 ganglios positivos. De ellos 56 (78%) los ganglios medían 5 mm o menos. Brown y col.23 indican que los ganglios positivos no son siempre más grandes que los negativos. Con técnicas de aclaramiento de la grasa encontraron que 75% de ganglios positivos eran menores de 2 mm, pero es necesario considerar que ésta técnica no es estándar en los laboratorios de patología y en realidad se usa en casos especiales o en protocolos de investigación.
El número de ganglios examinados es un factor pronóstico mayor ya que una subestadificación podría implicar no hacer quimioterapia cuando correspondiere. Además el número de ganglios positivos y negativos, y el porcentaje de positivos/negativos es un factor pronóstico independiente.24
Se ha considerado que no obtener un mínimo de 12 ganglios, si la resección quirúrgica es adecuada, puede ser una evaluación anátomo-patológica deficiente.25
En 1991, Cohen y col.26 mostraron que la sobrevida a 5 años era mejor para los pacientes con 3 o menos ganglios positivos (66%) que aquellos que tenían 4 o más (37%). Suzuki y col.27 15 años después mostraron resultados similares.
Hay diversos factores que afectan la recolección de ganglios, algunos no modificables y otros modificables. Ellos están vinculados al paciente, a la cirugía y a la anatomía patológica.28
Factores no modificables29-32
- Edad: podría especularse que con el envejecimiento se produce por atrofia senil una disminución de ganglios. Baxter y col.29 correlacionaron la edad con el número de ganglios en pacientes con cáncer colorrectal y hallaron un promedio de 9 ganglios en mayores de 70 años y de 12 ganglios en menores de 50 años (p=0.01).
- Localización del tumor: hay mayor cantidad de ganglios en tumores del colon derecho simplemente porque hay mayor extensión del meso.
-
Grado histológico: hay más ganglios en los pobremente diferenciados.
Tamaño del tumor: Los tumores más grandes causan una respuesta inmune antigénica mayor en los ganglios regionales haciéndolos más visibles para la obtención técnica del patólogo y favoreciendo una recolección mayor.33 - Obesidad: puede dificultar una apropiada resección quirúrgica.
Factores modificables15,23,34-36
- Pericia del cirujano: la calidad técnica para una resección adecuada, está vinculada a la curva de aprendizaje y a la experiencia sostenida.
- Extensión de la resección: una resección suficiente facilita una mayor recolección ganglionar.
- Pericia del patólogo.
- Pericia del asistente técnico/a del patólogo: tanto la diligencia del patólogo y sus asistentes influyen en la obtención ganglionar final.
- Técnicas de detección: ya se refirió en otro apartado los motivos y necesidades para realizar técnicas de aclaramiento.
- Evolución a través del tiempo del diagnóstico: se ha observado que a través del transcurso del tiempo se van recolectando más ganglios.17
Las causas más probables son:
- La introducción en 1979 de la Resección Total del Mesorecto.37
- La educación médica explicando la necesidad de reclutar más ganglios manejar mejor el tratamiento.
- La presión para mantener estándares de calidad para el tratamiento.
BIBLIOGRAFÍA
- Dresen R y Beets-Tan R. Estadificación preoperatoria del cáncer de recto. En Vaccaro CA. Enfoque multidisciplinario del cáncer colorrectal. Ed.Journal, Buenos Aires pag. 36-45,2014.
- Blumberg D, Paty PB, Guillem JG y col. All patients with small intramural rectal cancers are at risk for lymph node metástasis. Dis Colon Rectum 1999;42:881-885.
- Fang WL, Chang SC, Link JK y col. Metastatic potential in T1 and T2 colorectal cancer. Hepatogastroenterology 2005;52:1688-1691.
- Derwinger K, Kodeda K, Bexe-Lindskag E. y col. Tumor differentation grade is associated with TNM staging and the risk of node metástasis in colorectal cancer. Acta Oncológica 2010;49:57-62.
- National Comprehensive Network (NCCN) NCCN Clinical Practice Guidelines in Oncology. Principles of Pathologic Review for colon and rectal cancer. www.ncn.org/professionals/physician gls/PDF/Colon. Accessed June 23,2008
- Chang GJ, Rodriguez-Bigas MA, Skibber JM y col. Lymph node evaluation and survival after curative resection of colon cancer: systematic review. J Natl Cancer Inst 2007;99:433-441.
- Goldstein NS. Lymph recovery from 2427 pT3 colorectal resection specimens spanning 45 years. Am J Surg Pathol 2002;26:179-189.
- Le Voyer TE, Sigurson ER, Hanlon AL y col. Colon cancer survival is associated with increasing number of lymph nodes analized: a secundary survey of Intergroup Trial INT-0089. JClin Oncol 2003;21:2912-2919.
- Swanson RS, Compton CC, Stewart AK y col. The prognosis of T3NO colon cancar is dependen ton the numbre of lymph nodes examinated. Ann Surg Oncol 2003;10:65-71.
- Wong J, Bowles B, Bueno R y col. Impact of the number of negative nodes on disease-free survival in colorectal cancer patients. Dis Colon Rectum 2002;45:1341-1348.
- Fielding LP, Aresnault PA, Chapuis PH y col. Working party report to the World Congress of Gastroenterology. Sidney 1990. J Gastroenterol Hepatol 1991;6:325-44.
- Chen SL y Bilchik AJ. More extensive nodal dissection improves survival for stages I to III of colon cancer. A population-based study. Ann Surg 2006;244:602-610.
- Nelson H, Petrelli N, Carlin A y col. Guidelines 2000 for colon and rectal surgery. J Natl Cancer Inst 2001;93:583-596.
- Hermaneck P. Oncologic Surgery/Pathologic-Anatomic point. Langenbecks. Arch Chir suppl Kongressbd 1991:277-281.
- Scott KW y Grace RH. Detection of lymph nodes metástasis in colorectal carcinoma before and after fat clearance. Br J Surg 1989;76:1165-1167.
- Compton CC y Greene F. The staging of colorectal cancer:2004 and beyond. CA Cancer J Clin 2004;54:295-308.
- Goldstein NS, Sandford W, Coffey M y col. Lymph node recovery for colorectal resections specimens removed for adenocarcinoma: trends over time and a recommendation for a minimun number of lymph nodes to be recovered. Am J Clin Pathol 1996;106:209-216.
- Compton CC, Fielding NP, Bugart L y col. Prognostic factors in colorectal cancer: College of American Pathologists Concensus Statements 1999. Arch Pathol Lab Med 2000;124:979-94.
- Hammond ME, Fitzgibbons PL, Compton CC y col. College of American Pathologists Conference XXXV: Solid tumor prognostic factors- Which, how and so what? Summary document and recommendations for implementation. Cancer Committee and Conference Participans. Arch Pathol Lab Med 2000;124:958-65.
- National Guidelines on Colon and Rectal Cancer. National Working Group on Gastrointestinal Cancers, versión 2.0 http:/oncoline.nl (accesed april 2010).
- Maurel J, Launoy G, Grosclaude P y col. Lymph node harvest reporting in patients with carcinoma of the large bowel: A french population-based study. Cancer 1998;82:1482-6.
- Herrera L y Villareal JL: Incidence of metastases from rectal adenocarcinoma in small lymph nodes by a clearing technique. Dis Colon Rectum 1992;35:783-788.
- Brown HG, Luckasevic TM, Medich DS y col. Efficacy of manual dissection of lymph nodes in colon cancer resections. Mod Pathol 2004;17:402-6.
- Berger AC, Sigurdson ER, Le Voyer T y col. Colon cancer survival is associated with decreasing ratio of metastatic to examined lymph nodes. J Clin Oncol 2005;23:8706-12.
- Jestin P, Pahlman L, Glimelius B y col. Cancer staging and survival in colon cancer is dependen ton the quality of the pathologists specimen examination. Eur J Cancer2005;41:2071-78.
- Cohen AM, Tremiterra S, Candela F y col. Prognosis of node-positive colon cancer. Cancer 1991;67:1859-61.
- Suzuki O, Sekishita Y, Shiono T y col. Number of lymph node metástasis is better predictor of prognosis than level of lymph node metástasis in patients with node-positive colon cancer. J Am Coll Surg 2006;202:732-736.
- Valsecchi ME, Leighton J y Tester W. Modifiable factors that influence colon cancer lymph node sampling and examination. Clin Colorectal Cancer 2010;9:162-167.
- Baxter NN, Virnig DJ y Rothemberg DA. Lymph node evaluation in colorectal cancer patients: a population-based study. J Natl Cancer Inst 2005;97:219-225.
- Caplin S, Cerottini J, Bosman F y col. For patients with Dukes’ B (TNM Stage II) colorectal carcinoma, examination of six or fewer lymph nodes is related to for prognosis. Cancer1998;83:666-72.
- Thorn CC, Woodcock NP, Scott N y col. What factors affect lymph node yield in surgery for rectal cancer? Colorectal Dis 2004;6:356-61.
- Görög D, Nagy P, Peter A y col. Influence of obesity on lymph node recovery from rectal resection specimens. Pathol Oncol Res 2003;9:18.
- Wright F, Law C, Last I y col. Lymph node retrieval and assessment in stage II colorectal cancer: a population-based study. Ann Surg Oncol 2003;10:903-909.
- Morris EJ, Maughan MJ, Forman D y col. Identifying stage III colorectal cancer patients: the influence of the patients, surgeons and pathologist. J Clin Oncol 2007;25:2573-9.
- Lemmens VE, van Lijnschoten I, Jansen-Heijnen MI y col. Pathology practice patterns affect lymph node evaluation and outcome of colon cancer: a population –based study. Ann Oncol 2006;17:1803-9.
- Ostadi MA, Harnish JL, Stegienko S y col. Factors affecting the numbers of lymph nodes retrieved in colorectal cancer specimens. Surg Endosc 2007;21:2142-6.
-
Heald RA. A new approach to rectal cancer. Br J Hosp Med 1979;22:277-281.
Utilización de técnicas inmuno-histoquímicas
Como se se expresara en las consideraciones anteriores, al modificarse el estadío tumoral de acuerdo al número de ganglios afectados se establece una correlación directa con el pronóstico. Por eso se ha puesto siempre empeño en lograr la estadificación más precisa.
En 1995 Burchill1 propuso el uso de una citoqueratina (CK 20) como marcador para detectar células tumorales gastrointestinales circulantes, mediante una reacción histoquímica denominada transcripción reversa, acoplada a la reacción en cadena de la polimerasa (RT-PCR). Con ella se logra identificar células tumorales aisladas (micrometástasis) no sólo en sangre periférica sino también en ganglios y médula ósea.
Puede obtenerse una identificación de una célula tumoral en 10 a la 9 células mononucleares2 y eventualmente detectar esas células neoplásicas en ganglios clasificados como negativos.
Pero, como se refiriera más arriba, no es un método estandarizado universalmente, es caro, laborioso y se justificaría en casos seleccionados o en trabajos de investigación.
BIBLIOGRAFÍA
- Burchill SA, Bradbury NF., Pittman K. y col.: Detection of epithelial cancer cells in peripheral blood by reverse transcriptase-polymerase chain reaction. Br J Cancer 1995;71:78-81.
- Johnson PW, Burchill SA y Selby PJ. The molecular detection of circulating tumor cells. Br J Cancer 1995;72:268-76.
Metástasis.Especificaciones sobre la categoría “M”
Etimologicamente metástasis proviene del gr. meta: más allá, en otro lugar y stasis: acción de estar.
La metástasis es la diseminación de un tumor primario en órganos distantes a ese tumor que ocurre por vía sanguínea o linfática. Es distinto a invasión que es la migración y penetración directa a los tejidos vecinos.
En ésta categoría se incluyen adenopatías no regionales, implantes peritoneales, cualquier órgano o tejido alejado del tumor primario. Un líquido peritoneal positivo, debe considerarse pM1.
Las metástasis más frecuentes del cáncer rectal se localizan en hígado (Fig. 18) pulmón y cerebro.
Se consideran las siguientes categorías:
pM 0: sin metástasis a distancia.
pM 1: metástasis a distancia.
pM1 a: metástasis a un solo sitio ú órgano (ej. hígado, pulmón, ovario, ganglio linfático no regional).
pM1 b: metástasis a más de un órgano o sitio o al peritoneo.

Figura 18: Metástasis hepática, corte macroscópico.
La categoría pMx fue eliminada de la 7º edición del TNM.
La categoría pM0, no debería ser utilizada por el patólogo, en referencia a la pieza de resección. En realidad, si M0 significa ausencia de metástasis a distancia en cualquier parte del organismo, el patólogo sólo podría informarla en piezas de necropsias y anotarla como aTNM.
En Australia, se ha considerado insuficiente la clasificación del estadío M en el sistema TNM y se propuso un sistema alternativo (ver clasificación australiana en otro sector de éste Relato) que subdivide el estadío D en cuatro subgrupos:
- Estadío D1 cuando hay solamente tumor en el nivel de resección.
- Estadío D2 cuando sólo hay metástasis a distancia.
- Estadío D3 incluye ambos subestadíos D1 y D2
- Estadío D0 indica aquellos pacientes con metástasis sincrónicas (habitualmente en el hígado) extirpadas quirúrgicamente y y otras conocidas dentro de los 3 meses de resección del tumor primario.
Esta clasificación no ha tenido difusión pero es interesante porque subestadifica las distintas variables de diseminación a distancia.
Resumen de los cambios efectuados en la 7° Edicion T.N.M. (2009)
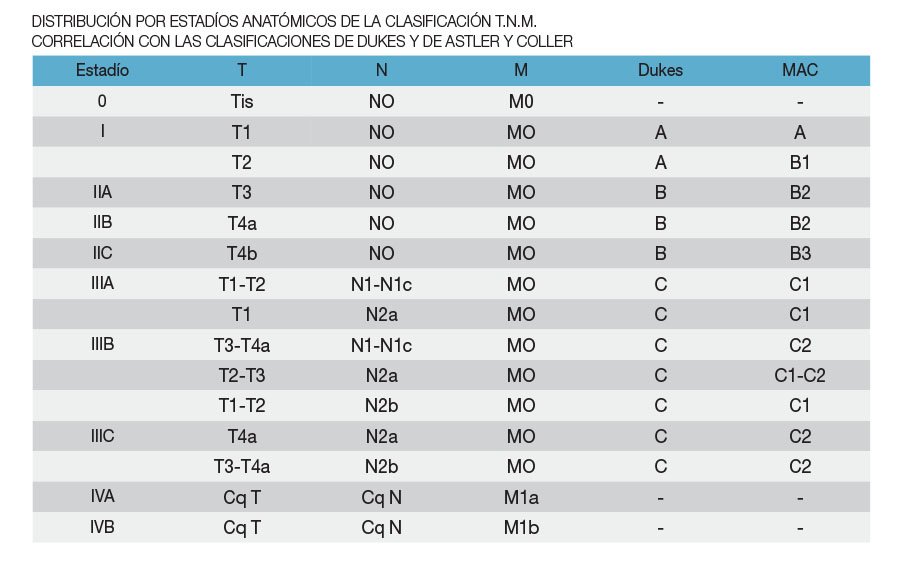
- En la sexta edición (2002), el estadío II era subdividido en IIA y IIB de acuerdo a que el tumor primario fuera T3NO o T4N0, respectivamente, y el estadío III era subdividido en IIIA (T1-2 N1M0), IIIB (T3-4 N1MO) o IIIC (cualquier TN2M0). En la séptima edición, fueron realizados cambios, subestadificando los estadios II y III, basados en datos de sobrevida y recaída, que no estaban disponibles cuando se actualizó la edición anterior.
- Con esos datos se mostró un pronóstico diferente dentro de las lesions T4, basado en la extension de la enfermedad. En consecuencia las lesions T4 se subdividieron en T4a (Tumor que penetra la superficie visceral del peritoneo) y en T4b (Tumor que invade directamente o es histologicamente adherente a otros órganos o estructuras).
- Por su importancia potencial, los depósitos tumorales satélites se han definido como un nuevo factor sitio-específico (Depósito Tumoral –TD) con descripción de su textura y número. Las lesions T1-2 que no tienen metastasis ganglionares regionales pero tienen depósitos tumorales, se clasifican como N1c.
- El número de ganglios comprometidos con metastasis, dentro de los grupos N1 y N2, tienen influencia en el pronóstico. En consecuencia el subestadío N1 fue subdividido en N1a (metastasis en un ganglio regional) y N1b (metastasis en 2-3 ganglios) y el subestadío N2 fue subdividido en N2a (metastasis en 2-4 ganglios) y N2b (metastasis en 7 o más ganglios).
- El estadío II se subdivide en IIA (T3N0), IIB (T4a NO) y IIC (T4b NO).
-
En el estadio III:
-Con lesiones N1, el estadío T4b N1, anteriormente clasificado como IIIB, mostró reultados más parecidos al grupo IIIC y por ello fueron reclasificados como IIIB IIIC.
-En forma similar, varias categorías de lesiones N2 antes clasificadas como IIIC, tienen resultados parecidos a otros grupos. Entonces T1N2a ha sido reclasificado como IIIA y T2N2a-b y T3N2a han sido reclasificados como IIIB. - M1 ha sido subdividida en M1a cuando la metastasis afecta un solo sitio y M1b para metástasis multiples (AJCC Cancer Staging Manual (American Joint Committee on Cancer) 7º edition 2010 Springer).
Utilidad de un protocolo pre-establecido (“Proforma”) de evaluación anátomo-patológica
El pedido de estudios anátomo-patológico hecho por el cirujano debería contar con una serie de datos de referencia para el patólogo, propuestos por éste.
Ello facilitaría un estudio de alta calidad y el diálogo entre cirujano y patólogo (ambos integrantes del equipo de atención médica multidisciplinario). Esta auditoría no significa evaluar la técnica quirúrgica ni la técnica anátomo-patológica, sino mejorar los resultados como demostraron Rigby y col.1 Además esa estandarización permite obtener resultados más completos al no obviar datos aparentemente de poca relevancia.2
Los informes anátomo-patológicos de cáncer colo-rectal, con ítems previamente solicitados, han mostrado resultados más detallados cuando fueron informados por patólogos especializados en gastroenterología.3 También se demostró que con un protocolo estandarizado la evaluación es mejor, que cuando no se estandariza.4
Una opción aconsejada recientemente, es el uso de protocolos preestablecidos en forma electrónica, que facilita la realización de los informes histopatológicos.5
BIBLIOGRAFÍA
- Rigby K., Brown SR., Lakin G. y col.: The use of a proform improves colorectal cancer pathology reporting. Ann R Coll Surg Engl 1999;81:401-403.
- Cross SS., Feeley KM. y Angel CA. The effects of four interventions on the informational content of histopathology reports of resected colorectal carcinomas. J Clin Pathol 1998;51:481-482.
- Messenger DE, McLeod RS y Kirsch R. What impact has the introduction of a synoptic report for rectal cancer had on reporting outcomes for specialist gastrointestinal and nongastrointestinal pathologists? .Arch Pathol Lab Med 2011;135:1471-1475.
- Chan NG, Duggal A, Weir MM y col. Pathological reporting of colorectal cancer specimens: a retrospective survey in an academic Canadian pathology departamento. J Can Chir 2008;51:284-288.
- Casati B y Bjugn R. Structured electronic template for histopathology reporting on colorectal carcinoma. Arch Pathol Lab Med 2012;136:652-656.
Resumen y conceptos destacables
- El tratamiento multimodal actual condiciona una comunicación directa, fundamentalmente entre el patólogo, el oncólogo y el cirujano.
- La buena calidad de la cirugía y de la evaluación anátomo-patológica requiere de un protocolo pre-establecido con pautas a consignar de cada ítem a evaluar.
- El cumplimiento de un protocolo estandarizado de anatomía patológica, al permitir una recolección completa de datos, posibilita establecer pautas pronósticas con mayor certeza.
- La mejor calidad diagnóstica anátomo-patológica puede vincularse al grado de subespecialización del patólogo.
Aspectos macroscópicos del carcinoma
La morfología del carcinoma colo-rectal tiene correlación con su extensión anatómica parietal. Basicamente los tumores pueden clasificarse en tres grupos:
- Lesiones in situ: pueden se polipoideas o planas.
- Carcinomas tempranos: estos tumores, invaden la submucosa sin sobrepasarla. Son mayoritaramente polipoideos, pedunculados, semipedunculados o sésiles. Pero, a veces la lesión puede ser plana, con una mínima elevación o sin ella y también puede tener una depresión central.
- Carcinomas avanzados: estos tumores sobrepasan la submucosa. Comprenden cuatro variedades que son las polipoideas, las ulceradas con bordes bien delimitados, las ulceradas sin bordes definidos o las difusamente infiltrantes. Las dos primeras son las variedades más frecuentes.
En la estadificación, éstos aspectos anatómicos son importantes y pueden facilitar el diagnóstico digital, endoscópico y por imágenes, que luego serán ratificados por la anatomía patológica.
Conceptos básicos en la propagación del carcinoma
Los mecanismos de diseminación del carcinoma del recto son:
- Por propagación directa.
- Por propagacional transperitoneal.
- Por implante.
- Por diseminación linfática.
- Por diseminación venosa.
El carcinoma se origina en la mucosa y crece generalmente atravesando transversalmente las capas de la pared rectal y también, en menor proporción, en sentido longitudinal.
En la historia natural, de no mediar tratamiento, el crecimiento involucra toda la pared, posibilitando así la invasion de tejidos ú órganos perirectales.
Podrían considerarse tres etapas de la invasion tumoral parietal y correlacionarla con el pronóstico.
- La primera etapa (Tis) es un carcinoma localizado que no metastatiza porque histologicamente no hay vasos linfáticos en la mucosa rectal.
- La segunda etapa (carcinoma invasor T 1-2-3) el tumor tiene capacidad de diseminarse localmente y a distancia.
- La tercera etapa ( T4 a y b ) es cuando el carcinoma atravesó los límites parietales y es máxima la posibilidad metastásica.
Tipos histopatologicos
La clasificación de los tipos histopatológicos sustentada por el AJCC1 es aplicable solamente a carcinomas que se desarrollan en el colon y recto. Se excluyen los sarcomas, linfomas, los tumores carcinoides del colon o del apéndice cecal. Los tipos histológicos incluyen:
- Adenocarcinoma in situ (“alto grado de displasia o displasia severa”).
- Adenocarcinoma.
- Carcinoma medular.
- Carcinoma mucinoso (tipo coloide).
- Carcinoma de células en anillo de sello.
- Carcinoma de células espinosas (epidermoide).
- Carcinoma adenoescamoso.
- Carcinoma de células pequeñas.
- Carcinoma indiferenciado.
- Carcinoma, NOS.
BIBLIOGRAFÍA
AJCC Cancer Staging Manual (American Joint Committe om Cancer) 7º Edition 2010 Springer.
GRADACIÓN HISTOLÓGICA
El diagnóstico de cáncer implica entre otras cosas establecer el grado histológico. Esta es una de las formas de evaluar la agresividad tumoral. Cada tumor tiene diferentes grados de diferenciación histológica, y en general los tumores de bajo grado están constituidos por estructuras parecidas al tejido que le da origen. En cambio, los tumores de alto grado o poco diferenciados, son los que más se alejan de su contrapartida normal, y en la mayoría de los casos están constituidos por elementos celulares con marcada atipía y alto índice de proliferación.
El tejido tumoral en el carcinoma colo-rectal puede estar constituído en forma variable por glándulas, nidos o cordones celulares. La gradación se fundamenta en la proporción del componente glandular hallado en relación al total de la neoplasia.
En 1893 von Hansemann1 clasificó los tumores según su diferenciación histológica. Posteriormente se propusieron métodos similares2-8 destacándose el valor de la diferenciación en el pronóstico. Broders9 en 1925 dividió los carcinomas en 4 grados, de acuerdo a la proporción de células diferenciadas. Rankin y Broders6 y Rankin y Olson10 los correlacionaron con la presencia de metástasis, concluyendo que existe una relación directa entre indiferenciación y diseminación, mientras que la sobrevida está en relación inversa.
Steward y Spies7 presentaron resultados similares y en 1939 Grinnell11 introdujo una ligera simplificación al sistema de Broders, estableciendo 3 grados en lugar de 4.
En 1940 Dukes12 basado en 985 carcinomas del recto, propuso 4 grados, agrupando por separado los carcinomas coloides. Posteriormente para que correspondiese mejor con la de Grinnell11 los redujo a grados bajo, medio y alto de malignidad y carcinomas coloides. Todos los trabajos coinciden en que la gradación histopatológica es útil para estimar el pronóstico de sobrevida. Sin embargo, Dukes2 sostuvo que la distribución y diferenciación de las células no son uniformes a través de un carcinoma y que en general son menos diferenciadas en el plano invasor que en el superficial. Por eso, la biopsia preoperatoria puede variar según el sitio de donde se la obtenga y la pieza operatoria debe estudiarse en múltiples secciones, agregando que esencialmente la gradación histopatológica es una estimación de la velocidad de crecimiento tumoral. De ahí el valor pronóstico sobre todo si se la asocia con otros parámetros que incluyan las vías de diseminación. Por otra parte, el grado histológico ha mostrado a través de análisis multivariados ser un factor pronóstico independiente. De hecho, se ha documentado el pronóstico adverso de los tumores de alto grado. La OMS13 ha recomendado una clasificación basada en etapas de diferenciación. Cada etapa incluye diversos parámetros histológicos que deben estar siempre presentes.
Cada grado se designa con la letra G. Si el grado no puede ser evaluado se denomina Gx
Hay 4 grados:
Grado 1: bien diferenciado (Fig. 19).
Grado 2: moderadamente diferenciado (Fig. 20).
Grado 3: pobremente diferenciado (Fig. 21).
Grado 4: indiferenciado (Fig. 22).
Los criterios de inclusión son:
Grado 1: el tumor está constituído en más del 95% por glándulas. La mayoría de éstas (más del 75%) tiene contornos lisos y regulares. No existe componente nuclear de alto grado (ej.: núcleos bizarros).
Grado 2: la proporción de glándulas varía entre un 50% y un 95%.
Grado 3: menos de 50% de estructuras glandulares.
Grado 4: está restringido a aquellos tumores que tienen evidencia de diferenciación epitelial, pero sin formación glandular o ésta es mínima (menos del 5%). Se lo considera un tipo histológico distinto que representaría el límite extremo de los carcinomas pobremente diferenciados y probablemente asociados a inestabilidad microsatelital.
Por convención dentro de éste grupo se incluyen el carcinoma de células en anillo de sello y el carcinoma de células pequeñas.
Las amplias variaciones concernientes a la gradación se hallan con los tumores bien y moderadamente diferenciados, siendo la variabilidad interobservador en los carcinomas de alto grado relativamente menor. Por lo tanto, y en virtud del valor pronóstico que proveen, la relativa simplicidad y reproducibilidad es que se ha propuesto un sistema binario para la gradación del carcinoma colorrectal.14

Figura 19: Adenocarcinoma Diferenciado (G1)
 .
.
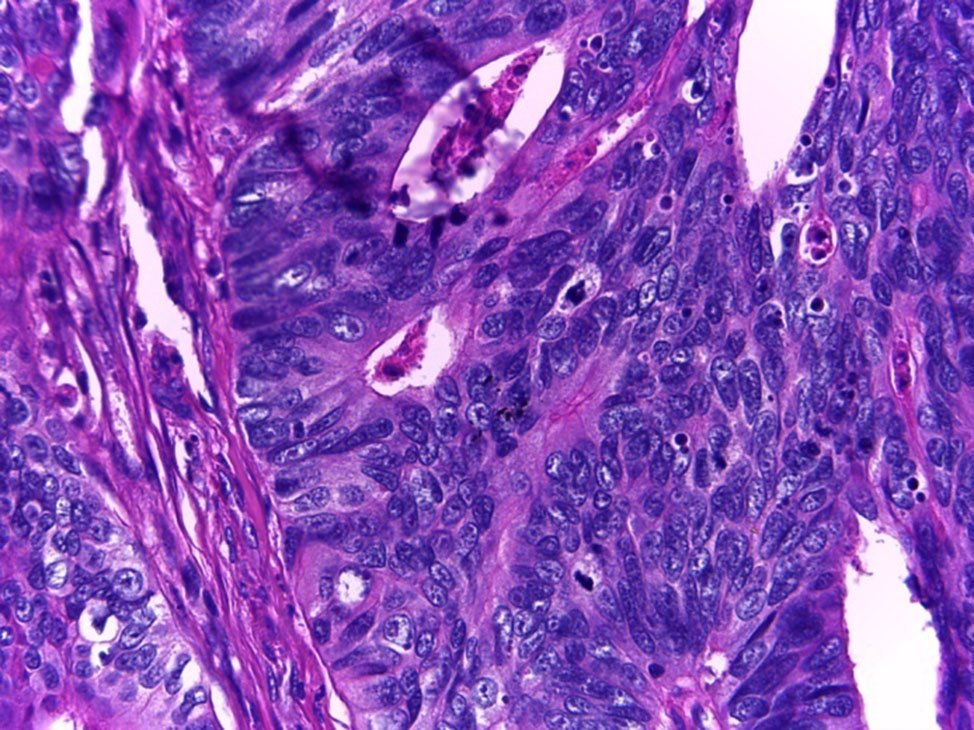
Figura 20: Adenocarcinoma Moderadamente diferenciado (G2).
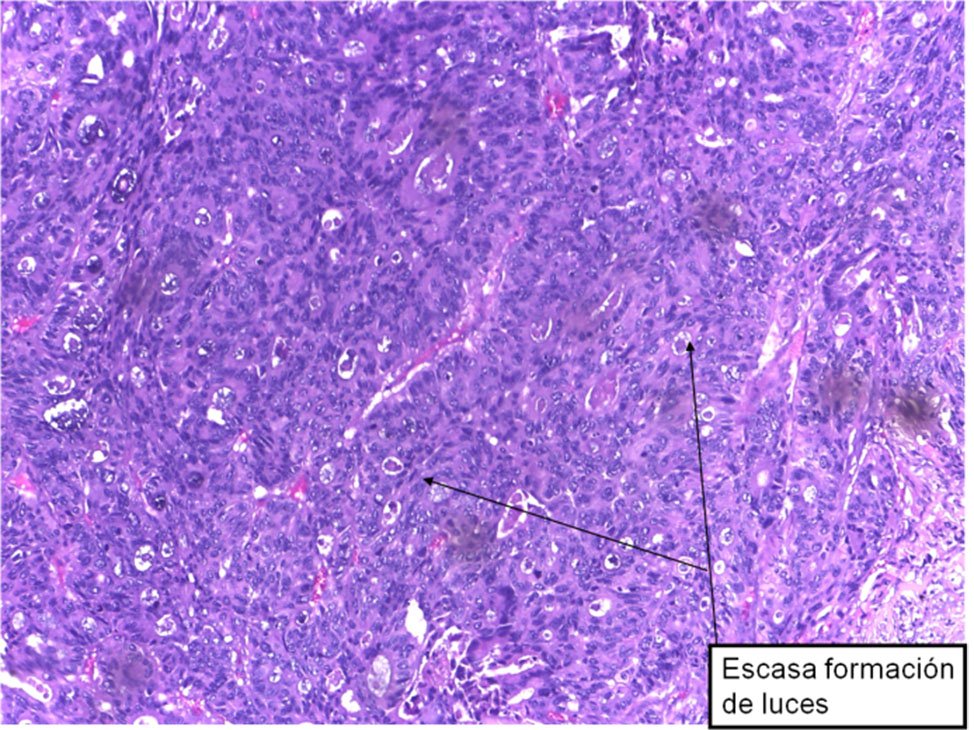
Figura 21: Adenocarcinoma Moderadamente diferenciado (G2).
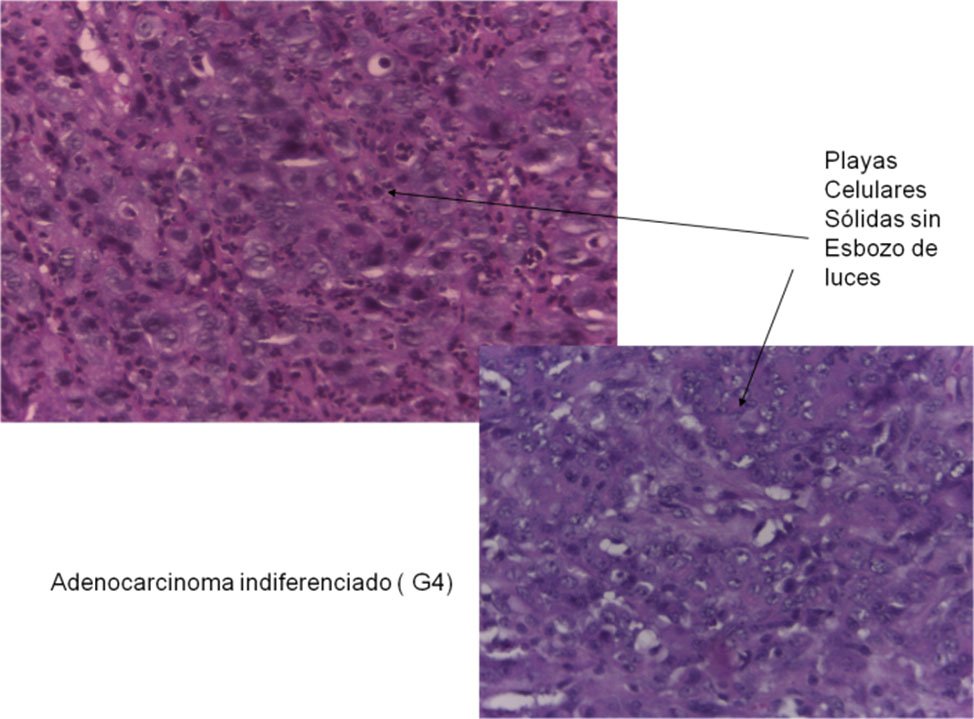
Figura 22: Adenocarcinoma Moderadamente diferenciado (G2).
Bajo grado: igual o mayor al 50% de formación glandular (Grados 1 y 2).
Alto grado: menor del 50% de formación glandular (Grados 3 y 4).
Ésta gradación se aplica al adenocarcinoma de tipo usual, que representa el 85% de los carcinomas. Cuando un adenocarcinoma tiene una diferenciación heterogénea, el diagnóstico del grado se hace en base al componente menos diferenciado, pero hay que considerar que por esa heterogeneidad una biopsia simple puede no ser representativa.
Hay que destacar que la parte superficial del tumor es histológicamente distinta al frente de invasión tumoral donde el tumor es generalmente menos diferenciado.15
El grado de diferenciación histológica se asocia con la estadificación TNM y con el riesgo de metástasis ganglionares en el cáncer colo-rectal y es un factor pronóstico independiente, siendo el alto grado un pronóstico adverso.16,17
Por ello cuando el grado de diferenciación es bajo (G1 y G2) en tumores T1 o en casos seleccionados T2 la indicación de tratamiento es resección local. Pero, cuando el grado de diferenciación es alto, al haber riesgo aumentado de metástasis ganglionares, aún en estadío T2 no es aconsejable la resección local.
BIBLIOGRAFÍA
- Von Hansemann DP. Studien uber spezificitat den altruismos un die Anaplasie der Zellen HIRSCH-WALD A. Berlin pah. 93, 1983.
- Dukes CE. The classification of cancer of the rectum. J Pathol Bacteriol 1932;32,323.
- Dukes CE. Histologic grading of rectal cancer. Proc R S Med 1937; 30:371.
- Raidford TS. Carcinomas of the large bowel. Ann Surg 1935;101: 863.
- Rankin FW. The curability of cancer of the colon, rectosigmoid and rectum. J.A.M.A.1933;101: 491.
- Rankin FW y Broders AC. Factors influencing prognosis in carcinoma of the rectum Surg Gynecol Obstet 1928;28:66.
- Stewart FN y Spies JW. Biopsy histology in the grading of rectal carcinoma Am J Path 1929;5:109.
- Wood W0 y Wilkie DP. Carcinoma of the rectum. An anatomic-pathologic study Edinburgh Med J 1933;40:321.
- Broders AC. The grading of carcinoma. Minnesota Med 1925;8:726.
- Rankin FW y Olson PF. The hopeful prognosis in cases of carcinoma of the colon Surg Gynecol Obstet 1933;41:366.
- Grinnell RS. The grading and prognosis of carcinoma of the colon and rectum Ann Surg 1939;109:500.
- Dukes CE. Cancer of the rectum: an analysis of 1000 cases. J Pathol Bacteriol 1940;50:527.
- Hamilton SR, Vogelstein B, Kudo S y col. Carcinoma of the colon and rectum. World Health Organization Classification of Tumors: Pathology and genetics of Tumors of the digestive system. Lyon, France: Iarc Press 2000;103:143.
- Comptonn CC, Fielding LP, Burgart LJ y col. Prognostic factors in colorectal Cancer. College of American Pathologist Consensus Statement 1999. Arch Pathol Lab Med 2000;124:979-994.
- Rosai J y Sobin LH. Eds. Ephitelial neoplasias of the intestines. In Tumors of the Intestines.Washington DC. Armed Forces Institute of Pathology; 2003 Atlas of Tumors Pathology 3º serie.
- Derwinger K, Kodeda K, Bexe-Lindskog E y col. Tumor differentiation grade is associated with TNM staging and the risk of node metástasis in colorectal cancer Acta Oncológica 2010; 49:57-62.
-
Choi PW, Yu CS, Jang SJ y col. Risk factors for lymph node metástasis in submucosal Invasive colorectal cancer. World J Surg 2008;32:2089-2094.
