REV ARGENT COLOPROCT | 2014 | VOL. 25, Nº 3
RELATO ANUAL
CAPÍTULO 4
Resonancia Magnética Nuclear
Dr. Jorge A. Hequera
Agradezco a la Dra. Patricia E. Zeballos por sus aportes en éste capítulo
GENERALIDADES
La RMN es una técnica que produce imágenes tomográficas multiplanares para lo cual utiliza campos magnéticos y ondas de radiofrecuencia. Asimismo, analiza características múltiples de los tejidos que incluye la densidad del protón hidrógeno, los tiempos de relajación T1 y T2 y el flujo sanguíneo dentro de los tejidos. El contraste que proporciona la RMN es muy superior a las otras modalidades de diagnóstico y permite diferenciar los tejidos entre sí. Los distintos tejidos absorben y liberan ondas de radiofrecuencia de manera diferente, capaces de ser detectadas y a frecuencias características.
Aunque hace tres décadas la evaluación de los factores de riesgo se basaba en el estudio histopatológico de las piezas de resección, en la actualidad, las imágenes han demostrado que pueden dar información adecuada preoperatoria de los principales factores de riesgo que son fundamentalmente el estadío T, el estadío N y el margen de resección circunferencial.1-3
Con ésta metodología de imagen se pueden evaluar, no sólo el compromiso parietal por la invasión tumoral y las adenopatías sino, y fundamentalmente, también la grasa perirectal, el margen radial y la invasión a órganos vecinos.
Con los resultados de la estadificación de esos elementos, se pueden cumplir dos objetivos básicos:
- Categorizar los factores determinantes de pronóstico.
- Establecer la táctica quirúrgica oncológica más adecuada.
BIBLIOGRAFÍA
- Nagtegaal ID. y Quirke P. What is the role of the circumferencial margin in the modern treatment of rectal cancer? J Clin Oncol 2008;26:303-312.
- Kapiteijn E., Marijnen CA., Nagtegaal ID. y col. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer.N J Engl Med 2001;345:638-646.
- Gosens MJ., van Krieken JH., Marijnen CA. y col. Improvement of staging by combining tumor and treatment parameters: the value for prognostication in rectal cancer. Clin Gastroenterol Hepatol 2007;5:997-1003.
Referencias históricas
Los primeros trabajos sobre la estadificación del carcinoma del recto con Resonancia Magnética Nuclear (RMN), se presentaron en 1986.1,2
La evolución tecnológica de la RMN pasó por tres etapas, de acuerdo al tipo de bobina utilizada:
1º etapa: Bobina de cuerpo (no permite diferenciar las capas de la pared rectal).
2º etapa: Bobina endo-rectal.
3º etapa: Bobina phased-array (bobinas externas dedicadas).
En la primera etapa la precisión diagnóstica era similar a la de TC y oscilaba entre 59% y 88%.1-7
En la segunda etapa, con la adquisición de la bobina endorectal, la precisión diagnóstica en la estadificación de T, llegó al 65-86%.8-13
Los estudios comparativos entre MRI con bobina endorectal y Eco endorectal muestran una eficacia diagnóstica similar para la estadificación T,13-15 pero con éste equipo hay inconvenientes que limitaron su uso. Ellos son el alto costo, la escasa disponibilidad y un campo visual disminuido por la atenuación de la señal y la corta distancia desde la bobina, que evita la evaluación completa de la fascia meso-rectal y de los tejidos circundantes.16 Otro inconveniente es que cuando el carcinoma es muy voluminoso o casi obstructivo es difícil colocar la bobina endorectal y se ha referido imposibilidad hasta en 40% de pacientes.17
En la tercera etapa, se subsanaron los inconvenientes referidos, al incorporarse la bobina phased-array o bobina pélvica (bobina abdominopelviana) (Figs. 1 y 2). Esta bobina externa ha permitido una alta resolución espacial y asi la obtención de imágenes mejorada.
Con ésta técnica la exactitud diagnóstica para el estadío T es referida en un trabajo de revisión reciente18 con un promedio del 76%, siendo para el T1 56%, para el T2 52%, para el T3 85% y para el T4 83%. Los porcentajes levemente menores al uso de bobinas endorectales, han sido atribuídos a la variabilidad interobservador.9,16
Figura 1: Equipo de Resonancia de alto campo (1.5 T).
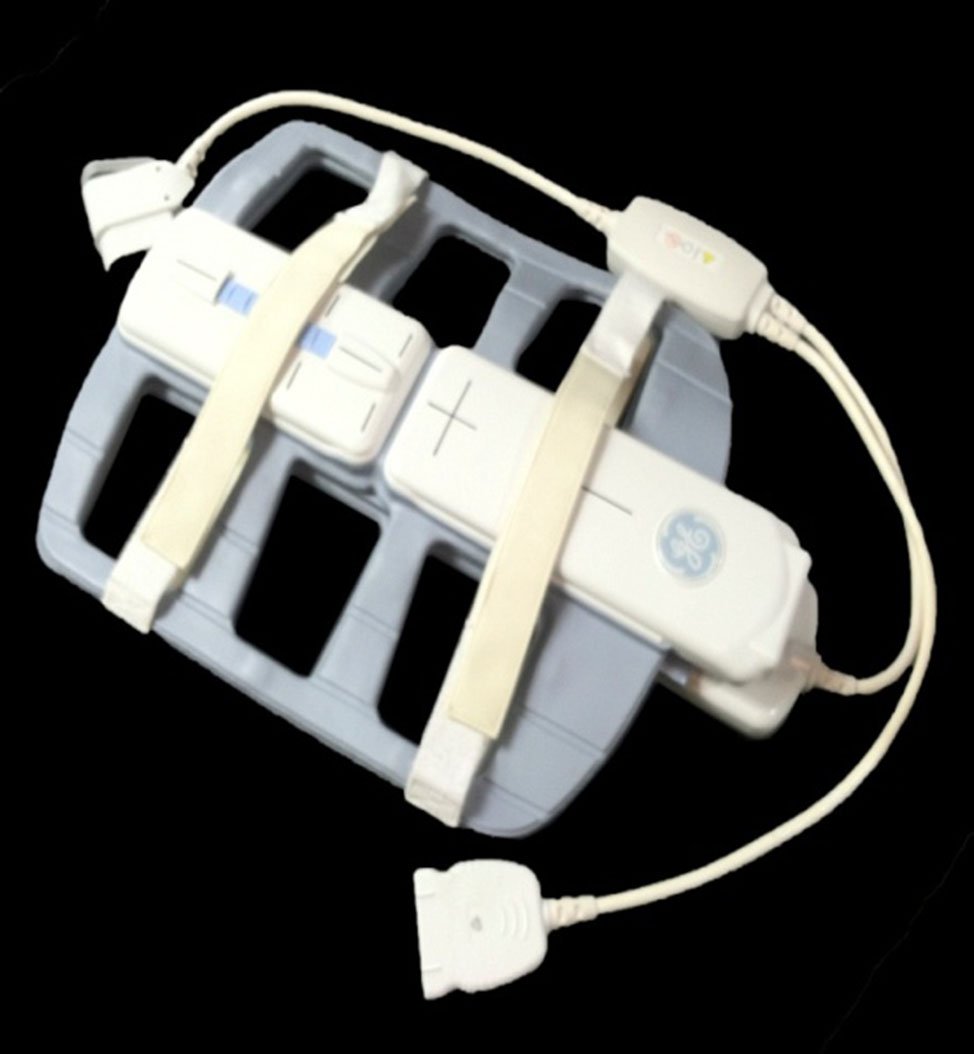
Figura 2: bobina phased-array.
BIBLIOGRAFÍA
- Hodgman CG., MacCarty RL., Wolf BG. y col. Preoperative staging of rectal carcinoma by computed tomography and 0.15T magnetic resonance imaging. Preliminary report. Dis Colon Rectum 1986;29:446-50.
- Butch RJ., Stark DD., Wittenberg J. y col. Staging rectal cancer by MR and CT. Am J Roentgenol 1986;146:1155-60.
- Cova M., Frezza P., Pozzi-Mucelli RS. y col. Computed tomography and magnetic resonance in the preoperative staging of the spread of rectal cancer. A correlation with the anatomicopathological aspects. Radiol Med (Torino) 1994;87:82-9.
- Zerhouni EA., Rutter C., Hamilton SR. y col. CT and MR imaging in the staging of colorectal carcinoma: Report of the Radiology Diagnostic Oncology Group II. Radiology 1996;200:443-51.
- Guinet C., Buy JN., Ghossain MA. y col. Comparison of magnetic resonance imaging and computed tomography in the preoperative staging of rectal cancer. Arch Surg 1990;125:385-8.
- Okizuka H., Sugimura K. y Ishida T. Preoperative local staging of rectal carcinoma with MR imaging and rectal balloon. J Magn Reson Imaging 1993;3:329-35.
- Stark M., Bohe M., Fork FT. y col. Endoluminal ultrasound and low-field magnetic resonance imaging are superior to clinical examination in the preoperative staging of rectal cancer.Eur J Surg 1995;161:841-845.
- Chann TW., Kressel HY., Milestone B. y col. Rectal carcinoma: staging at MR with endorectal surface coil. Work in progress. Radiology 1991;181:461-7.
- Schnall MD., Furth EE., Rosato EF. y col. Rectal tumor stage: correlation of endorectal MR imaging and pathologic findings. Radiology 1994;190:709-14.
- Indinnimeo M., Grasso RF., Cicchini C. y col. Endorectal magnetic resonance imaging in the preoperative staging of rectal tumors. Int Surg1996;81:419-22.
- Pegios W., Vogl J., Mack MG. y col. MRI diagnosis and staging of rectal carcinoma. Abdom Imaging 1996;21:211-8.
- Vogl J., Pegios W., Hunerbein M. y col. Use and applications of MRI techniques in the diagnosis and staging of rectal lesions. Recent results. Cancer Res 1998;146:35.
- Gualdi GF., Casciani E., Guadalaxara A. y col: Local staging of rectal cancer with transrectal ultrasound and endorectal magnetic resonance imaging: comparison with histologic findings. Dis Colon Rectum 2000;43:338-45.
- Zagoria RJ., Schlarb C. y Ott DJ. Assessment of rectal tumor infiltration utilizing endorectal MR imaging and comparison with endoscopic rectal sonography. S Surg Oncol 1997;64:312-17.
- Maldjian C., Smith R., Kilger A. y col. Endorectal surface coil MR imaging as a staging technique for rectal carcinoma: a comparison study to rectal endosonography. Abdom Imaging 2000;25:75-80.
- Beets-Tan RG. y Beets GL.: Rectal cancer: review with emphasis on MRI imaging. Radiology 2004;232:335-346.
- Hunerbein M., Pegios W., Rau B. y col. Prospective comparison of endorectal ultrasound, three-dimensional endorectal ultrasound and endorectal MRI in the preoperative evaluation of rectal tumors. Preliminary results. Surg Endosc 2000;14:1005-9.
-
Skandarajah AR. Y Tjandra JJ.: Preoperative loco-regional imaging in rectal cancer. ANZ J Surg 2006;76:497-504.
Detalles técnicos
El protocolo de estadificación del cáncer del recto consta de imágenes ponderadas en T2, en los 3 planos (Figs. 3, 4, 5 y 6) sagital (siguiendo el eje del recto inferior y conducto anal), axial (perpendicular al recto en el sitio del tumor) y en tumores del recto inferior se completa con el plano coronal (paralelo al conducto anal). El estudio de la pelvis, se completa con la evaluación del retroperitoneo (por la diseminación linfática ascendente y lateral) y del hígado, para determinar la presencia de metástasis y las posibilidades de resección.
Ventajas de la R.M.N.
- Es un método no invasivo.
- No utiliza radiaciones ionizantes.
- Obtiene imágenes en todos los planos del espacio (multiplanares).
- Por el gran contraste entre los tejidos permite caracterizar las lesiones o determinar con precisión su extensión.
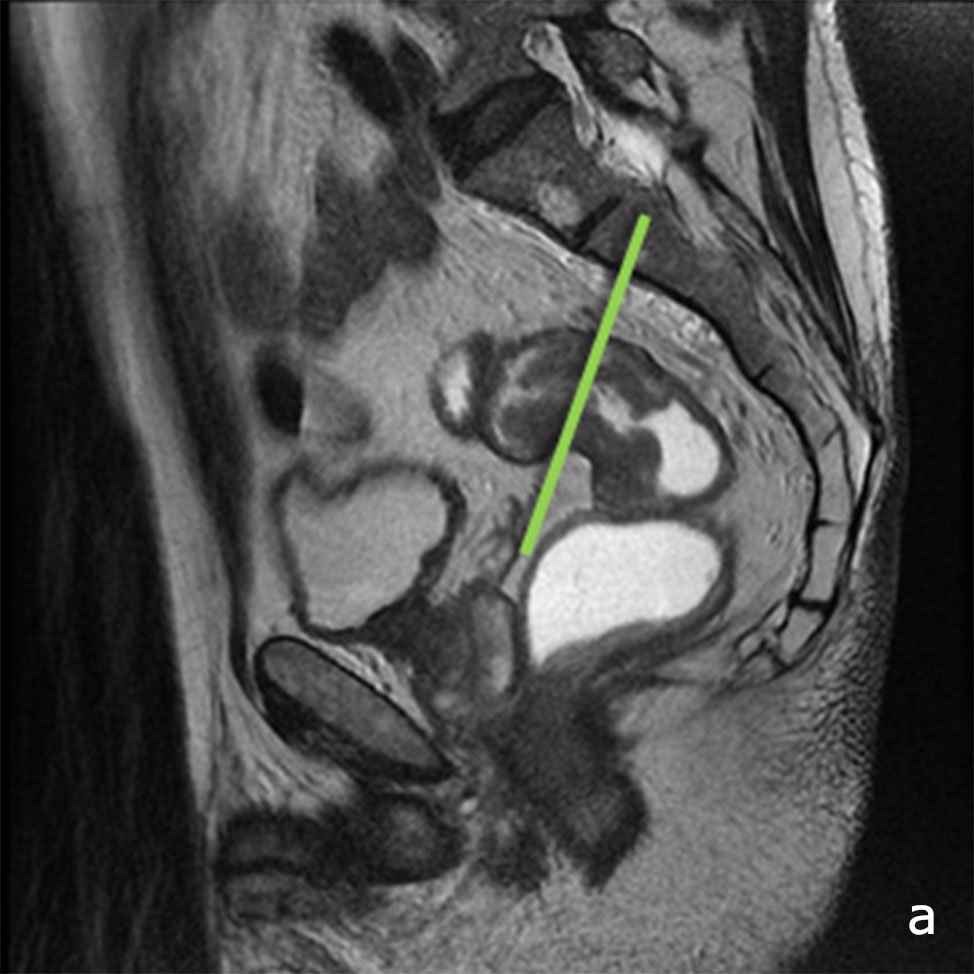
Figura 3: RM AR, secuencia T2, plano sagital, se programa aquí el plano axial.

Figura 4: perpendicular al tumor rectal
Desventajas de la R.M.N.
- Elevado costo.
- Tiempo de estudio prolongado. No se puede utilizar en pacientes con claustrofobia.
- No sirve en portadores de marcapasos, prótesis y clips quirúrgicos magnéticos no compatibles con RMN. En éstos pacientes, ésta metodología está contraindicada.
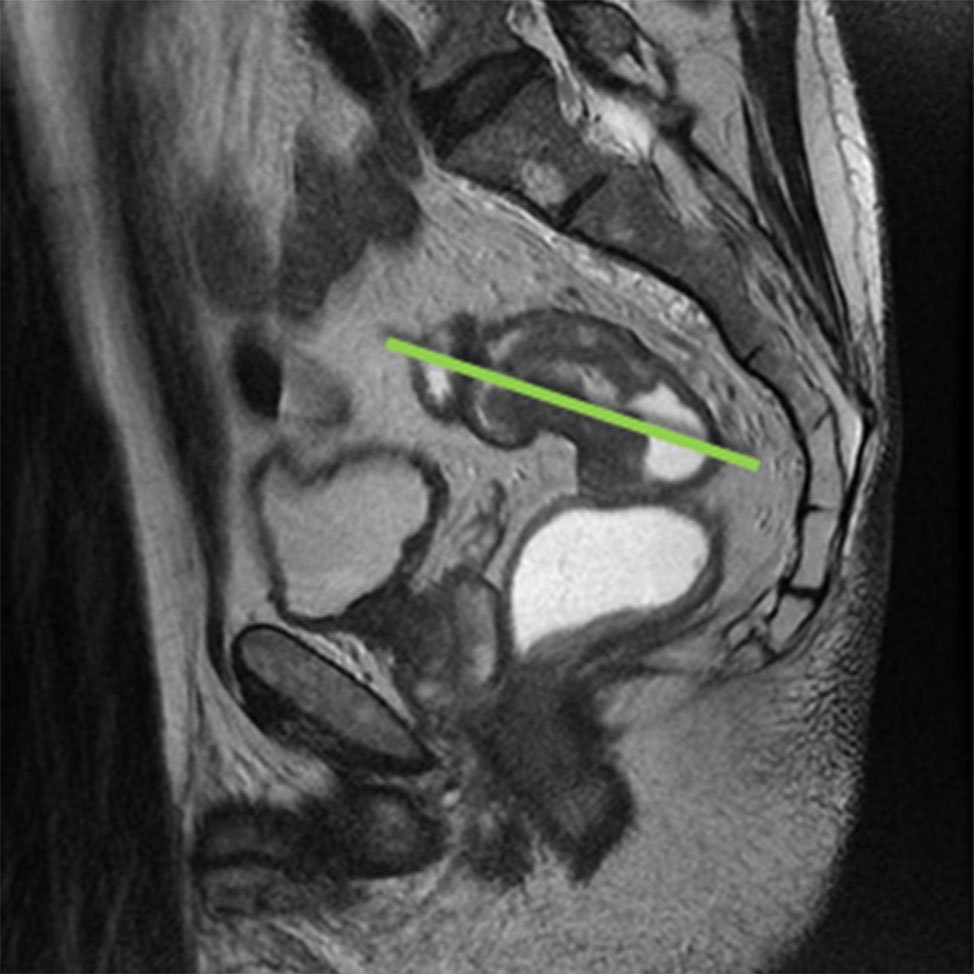
Figura 5: RM AR, secuencia T2, se programa aquí el plano coronal.
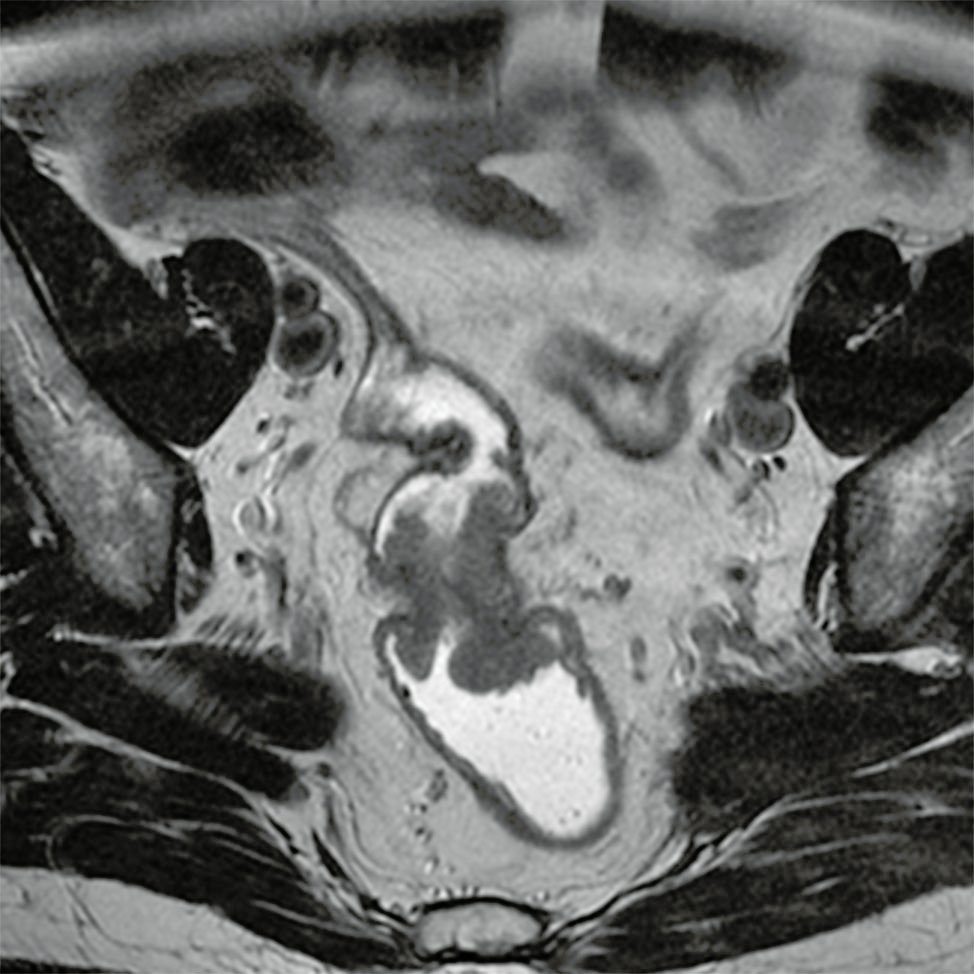
Figura 6: paralelo al tumor rectal.
Preparación del paciente
El peristaltismo intestinal degrada la calidad de las imágenes de alta resolución, impidiendo una adecuada interpretación. Por ello se indican una serie de medidas médico-dietéticas para evitar los artefactos de movimiento. Dieguez y su equipo utilizan un esquema que transcribimos a continuación:1
- Dos días antes del examen, se ingieren 2 comprimidos de Simeticona 200 mg.
- Durante esos dos días previos al examen, deben evitarse comidas que contengan harina y vegetales de hoja verde.
- El día del examen, se ingieren 2 comprimidos de Simeticona 200 mg, 2 horas antes de la realización del examen.
- Se deben cumplir 8 horas de ayuno antes del estudio.
- El día del examen, inmediatamente antes del estudio, se administra por vía intramuscular –salvo contraindicaciones específicas- de 20 a 40 mg de hioscina N-butilbromuro.
BIBLIOGRAFÍA
- Virginillo JM. y Dieguez A. Resonancia magnética de alta resolución en la estadificación del cáncer del recto. Coloproct Latinoamer 2014;2:2-19.
Anatomía normal por R.M.N.
Las capas de la pared rectal que visualiza la RNM son cinco (Fig. 7).1
1º capa: mucosa, fina, con señal de baja intensidad (hipointensa).
2º capa: submucosa, más gruesa y con señal de mayor intensidad (hiperintensa).
3º capa: muscular propia, con señal de baja intensidad. Ocasionalmente se diferencian la camada longitudinal de la circular.(hipointensa).
4º capa: grasa peri-rectal. Es una capa de alta señal (altamente hiperintensa).
5º capa: fascia meso-rectal fina, de baja señal (hipointensa) rodeando la grasa perirectal y el recto. Este plano no es visible por ecografía endorectal.
Se ha sugerido la necesidad, para el mejor manejo en un equipo multidisciplinario, de implementar el uso de protocolos de anatomía patológica (ver capítulo 8).
En un trabajo reciente2 se propuso un protocolo para evaluación pretratamiento, con RMN, sugiriendo como regla memotécnica la palabra “Distance” expresada en inglés y cuya significado se detalla a continuación:
DIS: distancia desde el borde inferior del tumor al margen anal.
T: por T staging (estadificación del T).
A: anal complex (evaluación del complejo esfinteriano anal).
N: node (ganglios).
C: margen de resección circunferencial.
E: extramural vascular invasion (invasión vascular extramural).

Figura 7: RM AR, secuencias axial T2. Capas de la pared rectal (Muscular Propia: línea azul; Submucosa: línea amarilla; Mucosa: línea roja). Mesorecto (M) y fascia mesorectal (línea verde de puntos).
BIBLIOGRAFÍA
- Bartram C. y Brown G. Endorectal ultrasound and magnetic resonance imaging in rectal cancer staging. Gastroenterol.Clin North Am 2002;31:827:39.
- Nougaret S., Reinhold C., Mikhael HW. y col. The use of MR imaging in treatment planning for patients with rectal carcinoma: Have you checked the “distance”? Radiology 2013; 268:330-344.
Especificaciones sobre la categoría “T”
El estadío T se define por RMN por la penetración en las capas de la pared rectal y su correlación con la fascia meso-rectal. El diagnóstico se basa en las diferencias de intensidad de la señal en fase T2, entre el tumor, la submucosa, la capa muscular propia y el mesorrecto (Figs. 8, 9, 10, 11 y 12).
Las imágenes del tumor son típicamente visualizadas con señal intermedia entre la grasa perirrectal, que es brillante, y la muscular propia, que se ve negro intenso. La señal se incrementa si el tumor contiene mucina pero una baja señal, similar a la de la muscular, indica una marcada reacción desmoplástica del tumor.
El principal problema es diferenciar el estadío T2 (invasión de la capa muscular) del estadío T3 (invasión tumoral mesorectal verdadera incipiente o reacción desmoplástica adyacente al tumor).1,2 Por ello si la inflamación observada en la grasa perirectal se la considera no como inflamación pura, sino como una combinación de invasión tumoral y fibrosis, puede sobrestadificarse el estadío T2 y ser referido erradamente como T3.3
Hay que considerar al respecto, que la espiculación de la grasa perirectal en continuidad con un tumor intramural, se la debe señalar como una característica de estadío T3.4

Figura 8: RM AR, secuencia axial T2. Estadificación T1: Tumor rectal que compromete la submucosa en hora 5 (flecha) con estenosis moderada a severa de la luz rectal (estrella).

Figura 9: RM AR, secuencia axial T2. Estadificación T2: Tumor rectal de cara anterior con invasión de la muscular propia (línea curva verde) y estenosis leve de su luz (estrella).
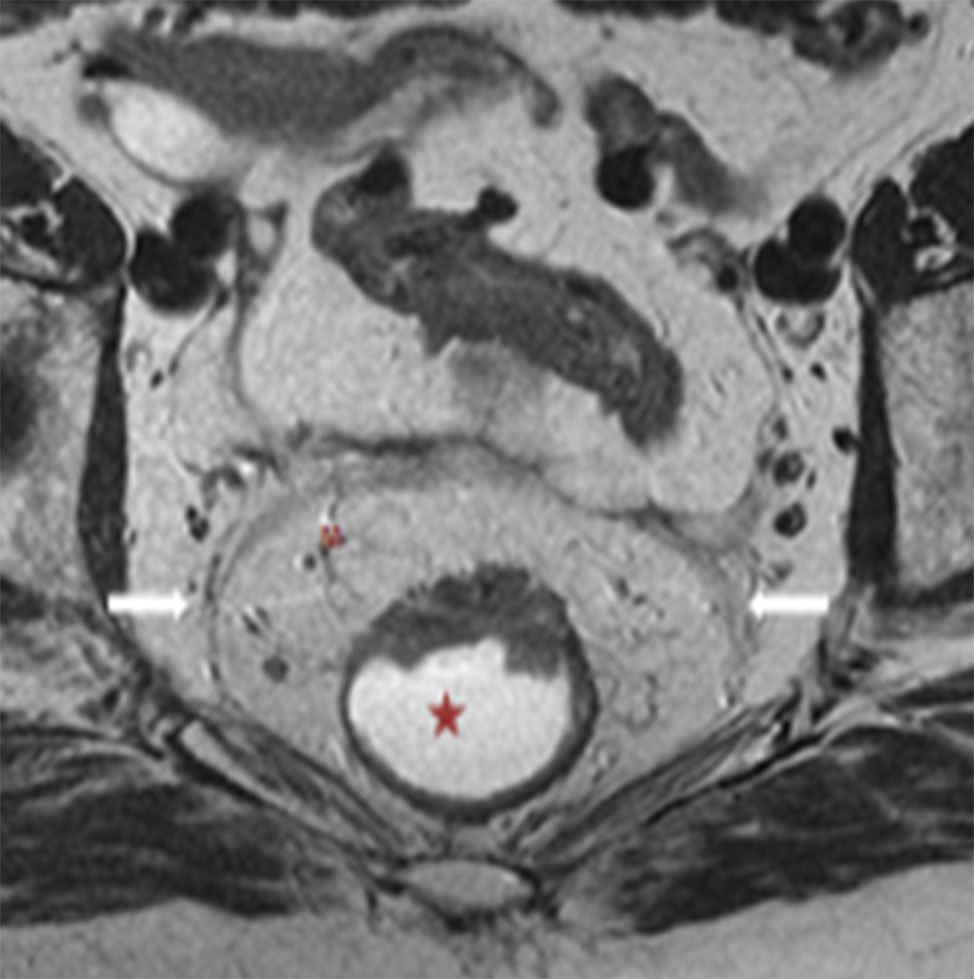
Figura 10: RM AR, secuencia axial T2. Estadificación T3a: Tumor rectal de cara anterior, con invasión a través de la muscular propia y un crecimiento extramural menor a 3 mm.
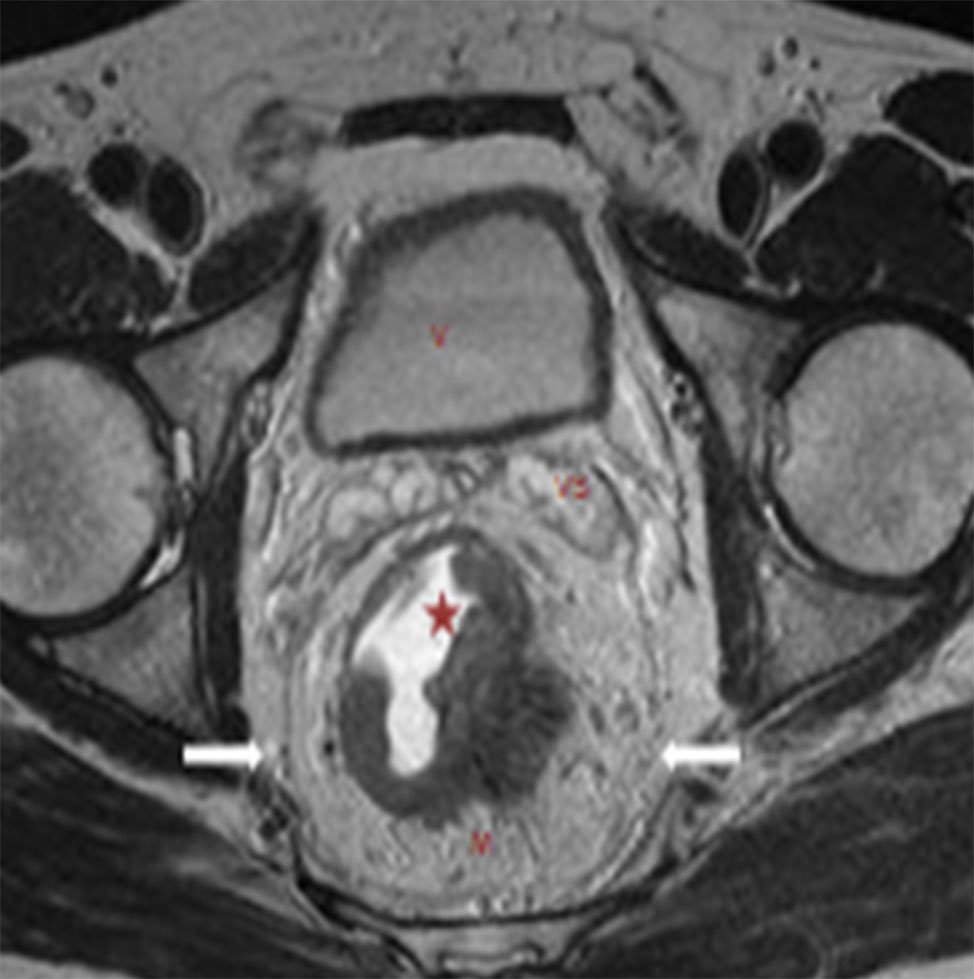
Figura 11: RM AR, secuencia axial T2. Estadificación T3c: tumor rectal posterior y lateral izquierdo, con invasión a través de la muscular propia y un crecimiento extramural desde hora 3 a hora 5, mayor a 5 mm.
Los fracasos diagnósticos habitualmente son por problemas técnicos o por interpretaciones observador-dependientes. Lo más común es el uso de secciones de corte más grandes, técnicas de más baja resolución o la poca comprensión entre reacción desmoplástica comparada con el tumor.
Desde un punto de vista clínico y terapéutico, es más importante medir la profundidad de la invasión extramural en mm que diagnosticar el estadío T, dado que un tumor T2 tiene el mismo pronóstico que un tumor T3 con menos de 1 mm de invasión. Por eso la importancia del diagnóstico por imágenes de la grasa peri-rectal. Un paciente con un tumor estadío T3 con más de 5 mm de invasión mesorectal tiene una sobrevida cáncer-específica a 5 años del 54%, mientras que cuando la invasión es menor a 5 mm, la sobrevida excede el 85%.5-7
La profundidad de invasión tumoral evaluada por la RMN tiene una excelente correlación con los resultados histopatológicos, como lo demostró el grupo Mercury.8
Aunque la precisión diagnóstica con la RMN, para los estadíos T es en el promedio similar a los obtenidos con ultrasonografía, las cifras son mayores con la RMN cuando se evalúan los estadíos T3 y T4 y menores que la ecografía endorrectal para los estadíos T1 y T2.9-11
La sensibilidad diagnóstica de la R.M.N. para el estadío T es 87%81-92 y la especificidad es 75%.12,68-80
La diseminación tumoral extramural, es la medida de la penetración tumoral en los tejidos peri-rectales más allá de la capa muscular. La RMN la evalúa, pero tiene una limitación técnica cuando el tumor es circunferencial o hay poca grasa perirectal como en el recto inferior, cara anterior.1,13
Esta evaluación por RMN es importante porque con el incremento de la profundidad en la diseminación, hay un incremento del compromiso ganglionar y de la invasión vascular extramural.14,15

BIBLIOGRAFÍA
- Brown G., Richards CJ., Newcombe RG. y col. Rectal carcinoma: thin-section MR imaging for staging in 28 patients. Radiology 1999;211:215-222.
- Beets-Tan RG., Beets GL., Vilegen RF. Y col. Accuracy of magnetic resonance imaging in prediction of tumor-free resection margin in rectal cancer surgery. Lancet 2001;357:497-504.
- Beets-Tan RG. y Beets GL..: Rectal cancer:review with emphasis on MRI imaging. Radiology 2004;232:335-346.
- Bartram C. y Brown G. Endorectal ultrasound and magnetic resonance imaging in rectal cancer staging. Gastroenterol Clin North Am 2002;31:827-39.
- Merkel S., Mansmann U., Papadopoulos T. y col. The prognostic inhomogeneity of colorectal carcinomas stage III: a prpousal for subdivisión of stage III. Cancer 2001;92:2754-2759.
- Merkel S., Mansmann U., Siassi M. y col. The prognostic inhomogeneity in pT3 carcinomas. Int J Colorectal Dis 2001;16:298-304.
- Bellows CF., Jaffe B., Bacigalupo L. y col. Clinical significance of magnetic resonance imaging findings in rectal cancer. World J Radiol 2011;3:92-104.
- Mercury study group. Extramural depth of tumor invasion at thin-section MR in patients with rectal cancer: results of the Mercury study. Radiology 2007;243:132-139.
- Rotondano G., Esposito P., Pellecchia L. y col. Early detection of locally recurren rectal cancer by endosonography. Br J Radiol 1997;70:567-71.
- Mathur P., Smith JJ., Ramsey C. y col. Comparison of CT and RMN in the pre-operative staging of rectal adenocarcinoma and prediction of circunferencial resection margin involvement by MRI. Colorectal Dis 2003;5:396-401.
- Beets-Tan RG. MRI in rectal cancer: the T stage and circunferencial resection margin. Colorectal Dis 2003;5:392-395.
- Al-Sukni E., Milot L., Fruitman M. y col. Diagnostic accuraccy of MRI assessment of T category lymph node metastases, and circunferencial resection margin imvolvement in patients with rectal cancer: a systematic review and meta-analysis. Ann Surg Oncol 2012;19:2212-2223.
- Kim YW., Cha SW., Kim NK. y col. Factors related to preoperative assessment of the circunferencial resection margin and the extent of mesorectal invasion by magnetic resonance imaging in rectal cancer: a prospective comparison study. World J Surg 2009;33:1952-1960.
- Dukes CE. Y Bussey HJ. The spread of rectal cancer and its effect on prognosis. Br J Cancer 1958;12:309-320.
- Cawthorn SJ., Parums DV., Gibbs NM. Y col. Extent of mesorectal spread and involvement of lateral resection margin as prognostics factors after surgery for rectal cancer. Lancet 1990;335:1055-1059.
Resumen y conceptos destacables
- La RMN debe evaluar el carcinoma del recto (para estadificar los estadios T) en planos estrictamente perpendiculares al tumor porque sino se desdibuja la capa muscular y puede sobreestadificarse la neoplasia.
- En el diagnóstico diferencial entre estadíos T2 y T3, el criterio fundamental es la evaluación de la grasa perirectal. En un estadío T3, la capa muscular está completamente alterada por el tumor y no puede dellimitarse de la grasa. El tumor la penetra como una formación de base ancha o conformando un aspecto nodular.
- La parte más externa de la capa longitudinal puede estar localmente alterada por vasos pequeños que la penetran. Esto no necesariamente indica invasión tumoral.
- Es fundamental como factor pronóstico y terapéutico, medir la diseminación en la grasa perirectal, tabulando en mm la invasión.
- En el recto superior, la reflexión peritoneal debe evaluarse en cortes sagitales y axiales. Se ve como una imagen de baja intensidad de señal, en forma de estructura lineal entre el domo de la vejiga y la cara anterior del recto (corte sagital) o como una estructura en forma de “V” (corte axial). La alteración de esa línea implica compromiso tumoral.
- El compromiso peritoneal (T4a) no es quivalente a compromiso del MCR.
Especificaciones sobre la categoría “N”
La sensibilidad diagnóstica de la R.M.N. para los ganglios ha sido referida como del 77%69-84 y la especificidad de 71%.1,59-81
La evaluación ganglionar con RMN posibilita diagnosticar:
- La presencia, cantidad, características morfológicas y el tamaño de los mismos.
- Su localización en la grasa peri-rectal y la distancia hasta la FMR.
- La localización extrarectal.
Para caracterizar éste estadío según el compromiso tumoral se usan tres criterios: el tamaño, la forma y las características de la señal de los ganglios.
El diagnóstico imagenológico implica visualizar los ganglios normales y diferenciarlos de los patológicos (Figs. 13 y 14). Estos se caracterizan fundamentalmente por tener los márgenes alterados (irregulares) y focos tumorales intranodulares que causan señales de intensidad mixta.2
El tamaño ganglionar también es un problema porque las micrometástasis pueden ocurrir en ganglios de tamaño normal.3-6
En realidad por imágenes se pueden detectar ganglios de 2-3 mm, pero el criterio morfológico considerado aisladamente es un predictor pobre para determinar si el ganglio es reactivo o metastásico. Por ello la variabilidad diagnóstica es grande y oscila de 39-95%.7-13
Brown y col.14 describen que el tamaño de los ganglios benignos oscilan entre 2 y 10 mm, mientras que los metastásicos tienen entre 3 y 15 mm. y en esa serie el 58% de los ganglios positivos eran menores de 5 mm corroborando que el tamaño como criterio único tiene poca precisión para el diagnóstico.
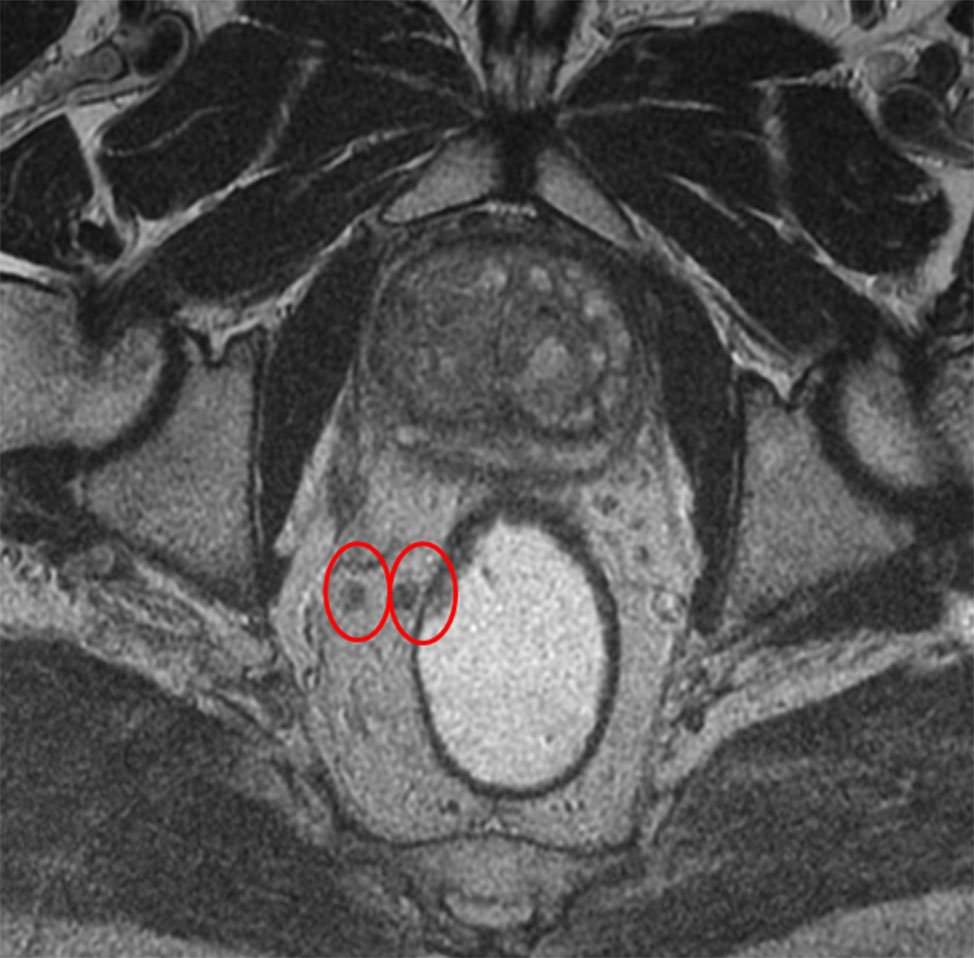
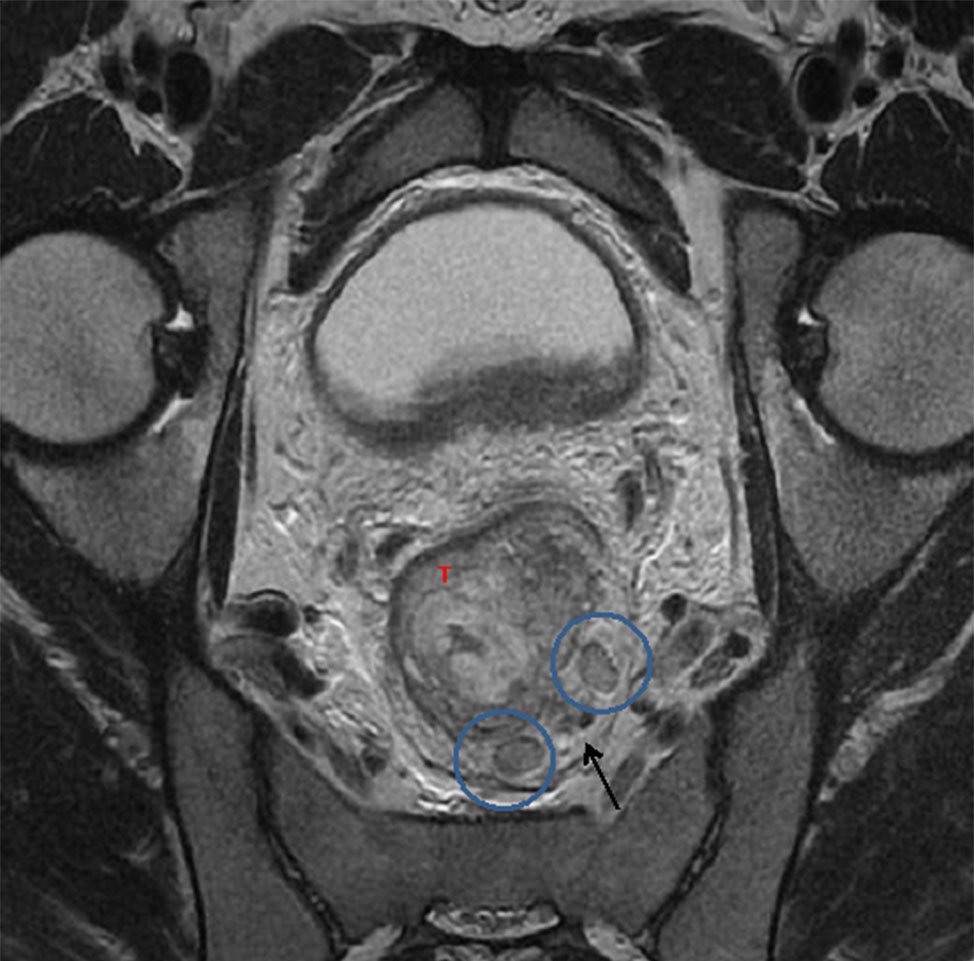
Figura 13 y 14: RM AR, secuencias T2, planos axiales (a) Imágenes ganglionares sin criterio de sospecha, de forma, tamaño e intensidad de señal conservada (círculos rojos), (b) Imágenes ganglionares aumentadas de tamaño y alteración de su señal (círculos celestes). T (tumor primario), flecha (IVEM).
Un avance reciente para mejorar el diagnóstico de la RMN es utilizar medios de contraste. Estas sustancias tienen propiedades magnéticas que hacen modificar las señales de resonancia en las estructuras que las rodean, al ser sometidas a los fenómenos de los campos magnéticos. Con ello, se logra aumentar la sensibilidad y la especificidad en la detección de patología y diferenciar zonas anatómicas normales que pudietran simular patología. Uno de los primeros fue un agente de contraste denominado USPIO.15 Lamentablemente no está muy difundido y no se ha utilizado aún en nuestro país. El no estar aprobado por la FDA es una limitación suficiente.
USPIO es una sigla en inglés que significa Ultra Small SuperParamagnetic (Particles) Iron Oxide. Las partículas, una vez inyectadas en la circulación, son transportadas desde los capilares al espacio intersticial y a través de los capilares linfáticos, hacia los ganglios. La fagocitosis de estas partículas por macrófagos de los ganglios provoca un acortamiento del tiempo de relajación T2 y una pérdida de intensidad de la señal en los ganglios normales, descripta como efectos de suceptibilidad.
En los ganglios con metástasis, el sistema retículo endotelial es reemplazado por células tumorales, lo cual imposibilita o disminuye la captación de las partículas (fagocitosis incompleta), lo que causa un aumento de la intensidad de la señal.16-18
Estos contrastes específicos pueden ser utilizados como predictores del compromiso ganglionar empleando criterios además de la intensidad y heterogeneidad de la señal, como la irregularidad y el espiculado de los bordes ganglionares.19,20
En el estudio de Koh y col.15 se evaluó el uso del USPIO, con precontraste y postcontraste y se pudo determinar tres patrones de señales ganglionares definidas como normales, reactivas y malignas. En éste trabajo se refieren limitaciones debidas a intolerancia del paciente por el tiempo prolongado del examen, la inhabilidad para distinguir pequeñas metástasis ganglionares de menos de 1 mm y el sesgo que ocasiona el estudio de pacientes con tumores operables.
La RMN tiene la ventaja en el estudio de la afectación ganglionar de tener mejor precisión diagnóstica que otros métodos, porque evalua la totalidad de la grasa peri-rectal, la fascia rectal y el territorio ilíaco.
Un agente de contraste alternativo comenzado a usar recientemente es el Gadolinio (gadofosveset trisódico) conocido en Europa como Vasovist y en EEUU como Ablavar. Aprobado por la FDA, una característica importante, en forma similar al Uspio, es que tiene un alto valor predictivo negativo (mayor al 90%).
El gadolínio es un medio de contraste metálico (elemento nº64 de la tabla periódica), que tiene propiedades paramagnéticas y por lo tanto altera el magnetismo de los protones del agua, y así aumenta la intensidad de las señales en las lesiones que tienen vascularidad alterada.
Las metástasis pueden aparecer isointensas antes de la administración del contraste. Cuando éste se administra, se mejora la definición, pudiendo valorarse los márgenes de la lesión y la invasión a estructuras adyacentes. También con el realce se puede definir la zona de la biopsia y es útil en el diagnóstico de las recurrencias tumorales.
El godofosveset es un compuesto que se une fuertemente a la albúmina y no tiene difusión extravascular. El mecanismo exacto no es conocido, pero es claro que los ganglios normales o reactivos, incorporan el contraste elevando con un fuerte incremento la señal en forma comparable a la que se observa en los vasos adyacentes. El incremento de la señal destaca una imagen hiperintensa en forma de anillo que circunscribe el ganglio denominada “efecto o signo de relieve” (“relief sign”). Cuando un ganglio está totalmente metastatizado ese signo no se observa.
Un ganglio metastatizado se ve en la RMN con áreas oscuras, que indican depósito tumoral y esto es porque el tejido tumoral evita la absorción del gadolinio.
En síntesis la mejor perfomance de las imágenes con gadolinio se dan por la mejor detención y caracterización dado por la mejor resolución de los pixeles.
BIBLIOGRAFÍA
- Al-Sukhni E., Milot L., Fruitman M. y col. Diagnostic accuracy of MRI assessment of T category, lymph node metastases, and circunferencial resection margin involvement in patients with rectal cancer: a systematic review and meta-analysis. Ann Surg Oncol 2012; 19:2212-2223.
- Bartram C. y Brown G. Endorectal ultrasound and magnetic resonance imaging in rectal cancer staging. Gastroenterol Clin North Am 2002;31:827-39.
- Dworak O. Number and size of lymph nodes and node metastases in rectal carcinomas. Surg Endosc 1989;3:96-99.
- Andreola S., Leo E., Belli F. y col. Manual dissection of adenocarcinoma of the lower third of the rectum specimens for detection of lymph node metastases smaller than 5 mm. Cancer 1996;77:607-12.
- Bielovic M., Kalezic V., Petrovic M. y col. Correlation of macroscopic and histological characteristics in the regional lymph nodes of patients with rectal and sigmoidal adenocarcinoma. Hepatogastroenterology 1998;45:433-438.
- Monig SP., Baldus SE., Zirbes TK. y col. Lymph node size and metastatic infiltration in colon cancer. Ann Surg Oncol 1999; 6:579-581.
- Hodgman CG., MacCarty RL., Wolf BG. y col. Preoperative staging of rectal carcinoma by computed tomography and 0.15T magnetic resonance imaging.Preliminary report. Dis Colon Rectum 1986;29:446-50.
- Butch RJ., Stark DD., Wittenberg J. y col. Staging rectal cancer by MR and CT. Am J Roentgenol 1986;146:1155-60.
- Chann TW., Kressel HY., Milestone B. y col. Rectal carcinoma: staging at MR with endorectal surface coil. Work in progress. Radiology 1991;181:461-7.
- Schnall MD., Furth EE., Rosato EF. y col. Rectal tumor stage: correlation of endorectal MR imaging and pathological findings. Radiology 1994;190:709-14.
- Indinnimeo M., Grasso RF., Cicchini C. y col. Endorectal magnetic resonance imaging in the preoperative staging of rectal tumors. Int Surg 1996;81: 419-22.
- Zagoria RJ., Schlarb C. y Ott DJ. Assessment of rectal tumor infiltration utilizing Endorectal MR imaging and comparison with endoscopic rectal sonography. Surg Oncol 1997;64:312-317.
- Kwok H., Bissett IP. Hill GL. Preoperative staging of rectal cancer. Int J Colorectal Dis 2000;15:9-20.
- Brown G., Radcliffe AG., Newcombre RG. y col. Preoperative assessment of Prognostic factors in rectal cancer using high-resolution magnetic resonance imaging. Br J Surg 2003;90:355-364.
- Koh DM., Brown G., Temple L. y col. Rectal cancer: mesorectal lymph nodes at MR Imaging with USPIO versus histopathologic findings. Initial observations. Radiology 2004;231:91-9.
- Weissleder R., Elizondo G., Wittenberg J. y col. Ultrasmall superparamagnetic Iron Oxide: characterization of a new class of contrast agents of MR imaging. Radiology 1990;175:489-93.
- Bellin MF., Ray C., Kinkal K. y col. Lymph node metastases: safety and effectiveness of MR imaging with ultrasmall superparamagnetic iron oxide particles.Inicial experience. Radiology 1988;207:799-808.
- Bellin MF., Bigelman C. y Precetti-Morel S. : Iron oxide enhanced MR lymphography: Initial experience. Eur J Radiol 2000;34: 257-264.
- Kim JH., Beets GR., Kim MJ. Y col. High resolution MR imaging in rectal cancer: are there any criteria in addition to the size? Eur J Radiol 2004;52:78-83.
- Brown G., Richards CJ., Bourne MA. y col. Morphologic predictors of lymph node status in rectal cancer with use of high-spatial-resolution MR imaging with histopathologic comparison. Radiology 2003;227:371-377.
Resumen y conceptos destacables
- Los ganglios de aspecto uniforme y de un tamaño menor a 10 mm con intensidad de señal homogénea no son sospechosos de ser metastásicos.
- Se consideran ganglios sospechosos aquellos con bordes irregulares, intensidad de señal mixta o con ambas manifestaciones.
- La presencia en las imágenes, de uno a tres ganglios sospechosos se considera estadío N1 y de cuatro ó más, estadío N2.
- Cualquier ganglio a 1 mm del MRC considerará al margen como altamente sospechoso de compromismo neoplásico.
- El registro de la localización y tamaño de ganglios en las paredes pelvianas es crítico pues conlleva la necesidad de tratamiento radiante o linfadenectomía pelviana.
El margen circunferencial radial y la invasión vascular extramural se discuten en otro sector de este Relato.
Estadificación de factores de riesgo por R.M.N.
Las imágenes de la RMN se usan para estadificar y para identificar los pacientes con riesgo de recurrencia que se pueden beneficiar con neoadyuvancia, una cirugía más extensa o con la adopción de ambas conductas.
El compromiso loco-regional, de acuerdo al grado de invasión, tendrá correlación con el desarrollo de metástasis sincrónicas. Hunter y col.1 en base a los hallazgos de las imágenes, dividen a los pacientes en dos grupos, de alto y de bajo riesgo (Cuadros 1 y 2), y señalan que los primeros tienen una probabilidad de metástasis sincrónicas de 20,7%, mientras que para los pacientes de bajo riesgo la probabilidad es de 4.2%.
Por ello una evaluación más intensa (que incluya PET-FDG) posibilitaría una estadificación más segura y una terapéutica más adecuada.
Por todo ello, la identificación de factores pronósticos en la estadificación preoperatoria, tienen una influencia significativa en la estrategia terapéutica, porque ayudan a determinar:
- Tipo de resección.
- Posibilidad de resecabilidad tumoral.
- Elegibilidad de pacientes para neoadyuvancia.
Imágenes de buen pronóstico (Fig. 15 A, B, C)
- Margen circunferencial sin infiltración.2,3
- Ausencia de invasión venosa extramural.4
- Estadios precoces (T1 - T2 - T3a - T3b) independientemente del estadío ganglionar.5,6
- Tumores del recto bajo, estadíos 1 ó 2, sin invasión del plano interesfintérico o del elevador.7
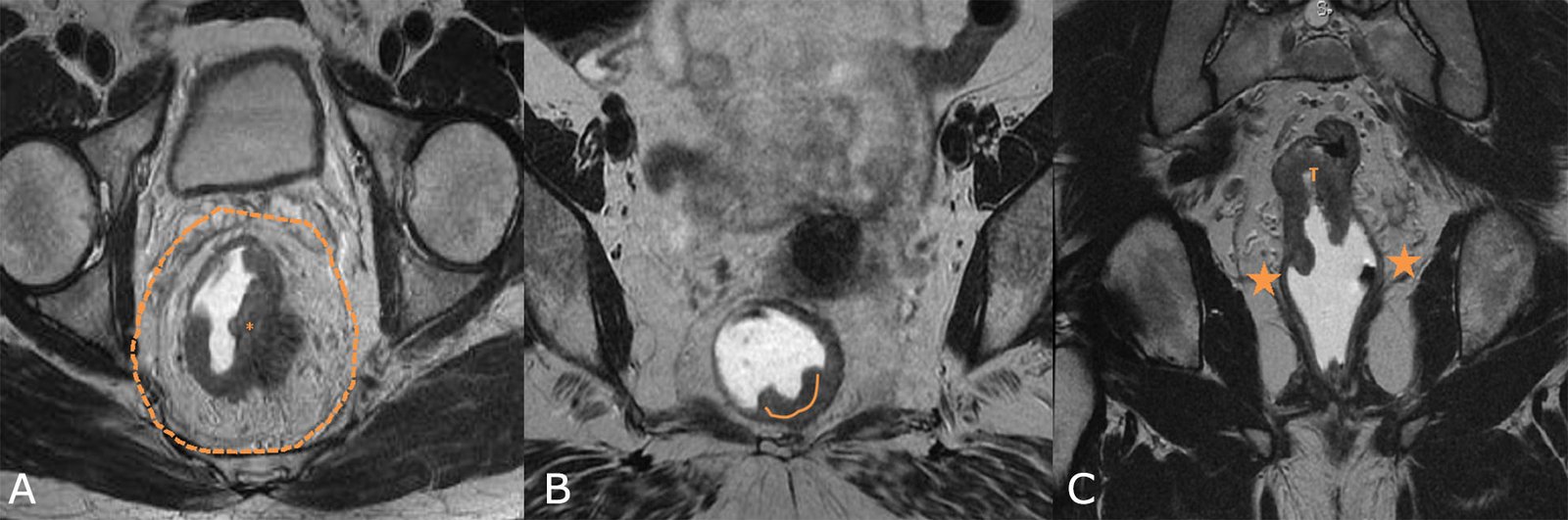
Figura 15: RM AR, secuencias T2, planos axiales y coronal. Imágenes de buen pronóstico. A. MCR libre (línea de puntos), B. Estadio precoz (t2: línea naranja), C. tumor de recto medio e inferior con preservación del plano esfinteriano y músculos elevadores (estrellas).
Cuadro 1. Pacientes de bajo riesgo
Imágenes de mal pronóstico (Fig. 16 A, B y C)
- Invasión venosa extramural.
- Invasión extramural mayor a 5 mm.
- Compromiso del margen circunferencial.
- Invasión tumoral del plano interesfintérico en tumores rectales bajos.
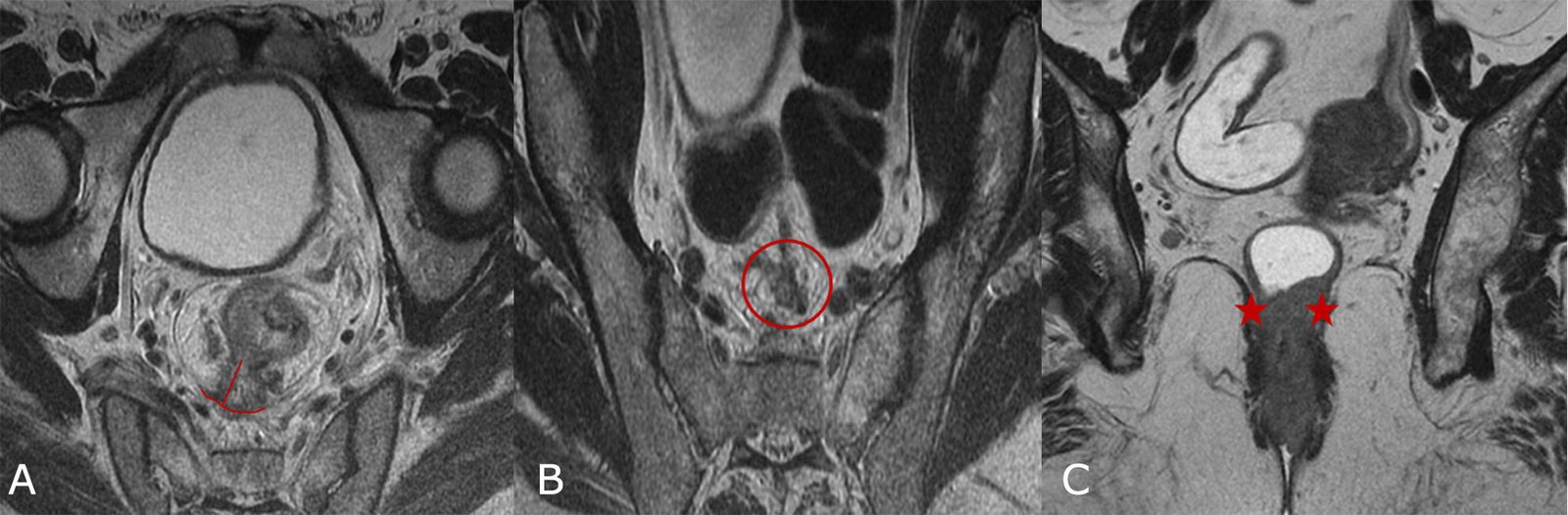
Figura 16: RM AR, secuencias T2, planos axiales y coronal. Imágenes de mal pronóstico. A. Compromiso del margen circunferencial e invasión extramural mayor a 5 mm (líneas rojas), B. Invasión venosa extramural (círculo rojo), C. invasión tumoral del plano interesfintérico en tumores rectales bajos (estrellas rojas).
Cuadro 2: Pacientes de alto riesgo1
BIBLIOGRAFÍA
- Hunter CJ., Garant A., Vuong T. y col. Adverse features on rectal MRI identify a high-risk group that may benefit from more intensive preoperative staging and treatment. Ann Surg Oncol 2012;19:1199-1205.
- MERCURY Study Group. Diagnostic accuracy of preoperative magnetic resonance imaging in predicting curative resection of rectal cancer: prospective observational study. BMJ 2006;333(7572):779.
- MERCURY Study Group. Extramural depth of tumor invasion at thin-section MR in patients with rectal cancer: results of the MERCURY study. Radiology 2007;243:132-9.
- Smith NJ., Barbachano Y., Norman AR. y col: Prognostic significance of magnetic resonance imaging detected extramural vascular invasion in rectal cancer. Br J Surg 2008;95:229-236.
- Taylor FG., Quirke P., Heald RJ. y col. Preoperative high-resolution magnetic resonance imaging can identify good prognosis stage I, II and III rectal cancer best managed by surgery alone a prospective, multicenter, European study that recruited consecutive patients with rectal cancer. Ann Surg 2011;253:711-9.
- Merkel S., Mansmann U., Siassi M. y col. The prognosis inhomogeneity in pT3 rectal carcinomas. Int J Colorectal Dis 2001;16:298-304.
-
Salerno GV., Daniels IR., Moran BJ. y col. Magnetic resonance imaging prediction of an involved surgical resection margin in low rectal cancer. Dis Colon Rectum 2009;52:632-9.
Resumen y conceptos destacables
En la elección de una metodología diagnóstica se priorizan los beneficios como la sensibilidad y la especificidad. Sin embargo deben considerarse los costos, la disponibilidad de equipos y los tiempos de realización de las imágenes.
En nuestro país, un resonador cuesta un promedio de U$S 1.000.000 y una RMN pelviana con aranceles de pre-paga tiene un valor entre $2000 y $2500. Por otra parte un equipo de Ecografía 3D cuesta en promedio U$S 80.000 y una ecografía endo-rectal a nivel pre-paga tiene un costo promedio de $500.
En los EEUU esos valores son U$S 2475 y U$S 450. Como se puede observar la proporción es similar.
El tiempo de realización de cada procedimiento insume un costo adicional. Mientras una RMN para estadificación pelviana requiere 30-60 minutos para una Ecografía es en promedio 15 minutos.
En base a estas consideraciones se puede presuponer que un equipo de Ecografía tenga más posibilidad de disponibilidad, sobre todo en zonas rurales o de bajos recursos.
Sin embargo, debe considerarse que ante la necesidad de estadificación de un carcinoma avanzado, hay que contemplar la posibilidad de un centro que posea un equipo de resonancia. En nuestro país hay alrededor de 70 equipos, la mayoría en áreas de alta concentración poblacional, pero las distancias no son una gran limitación y las posibilidades de transporte son factibles.
