REV ARGENT COLOPROCT | 2014 | VOL. 25, Nº 3
RELATO ANUAL
CAPÍTULO 3
Estadificación por imágenes
Dr. Jorge A. Hequera
GENERALIDADES
Los objetivos básicos para el tratamiento curativo del carcinoma del recto son:
- Lograr el control local.
- Disminuir el promedio de recurrencias.
Con la tendencia actual de brindar una atención individualizada, la estadificación debe jerarquizar el riesgo de fracaso local y a distancia, y se han considerado que las imágenes tienen la misma importancia que el tipo de tumor y la susceptibilidad genética.1
Actualmente, hay varios métodos de imágenes para estadificar el carcinoma del recto. Ellos incluyen la Tomografía Computada (TC), la Resonancia Magnética Nuclear de Alta Resolución (RMN), la Ecografía Endo-rectal (ECO), la Tomografía por Emisión de Positrones (PET) y la asociación de PET con TC (PET/TC).
La eficacia diagnóstica en algunos aspectos es superponible, a veces, entre estos métodos.
En general los resultados dependen de varios factores, siendo los más destacados la calidad del equipo, el entrenamiento del operador ó cambios producidos en la pared rectal por la radioterapia, las biopsias o las resecciones locales previas. Estos últimos elementos distorsionan la anatomía de la pared rectal y dificultan o impiden una lectura real. Por otra parte, la eficacia diagnóstica es de fundamental importancia pues la estadificación por imágenes puede influir en la elección del tipo y oportunidad de la cirugía y en la indicación de la neoadyuvancia. Por ello, una condición básica del diagnóstico por imágenes es posibilitar la diferenciación entre lesiones tempranas y lesiones localmente invasivas.
Es frecuente que para obtener una información más completa se combinen algunos de éstos métodos. Sin embargo, hay que destacar que la metodología a elegir, muchas veces depende de la experiencia personal y la disponibilidad del equipo de imágenes.
De todos modos, en todos los sistemas de imágenes, la obtención de la seguridad diagnóstica en la estadificación debe ser prioritaria. Vale la pena insistir que una infraestadificación puede significar perder la opción de realizar quimio y radioterapia o una cirugía más amplia, y como consecuencia generar un mayor riesgo de recurrencia. Por contrapartida, una sobreestadificación expone al paciente a una terapia innecesaria y a una morbilidad asociada.
BIBLIOGRAFÍA
- Nougaret S., Reinhold C., Mikhael HW y col. The use of MR imaging in treatment planning for patients with rectal carcinoma: Have you checked the “Distance”? Radiology 2013;268:330-344.
Ecografía Endorrectal (EER)
Agradezco al Dr. Jorge H. Arias por sus aportes en éste capítulo
También es conocida como ultrasonografía ó ecografía transrectal (ERUS por su sigla en inglés) o USER.
Fue introducida a mediados de la década de 1980.1,2 Su uso se generalizó en las dos últimas décadas con mejoras en los equipos (Fig. 1) y estandarización de la técnica.3-6
Consideraciones generales
La ecografía endo-rectal es una técnica de diagnóstico no invasiva que emplea ultrasonidos para obtener imágenes del ano, del recto y de los órganos pelvianos. Se realiza mediante la introducción de una sonda ecográfica por el ano. Esta es un pequeño capuchón cilíndrico de 7 mm de diámetro que lleva en su interior un transductor ecográfico (Fig. 2). Con el transductor se ven las estructuras anatómicas del recto y del ano con una excelente resolución, en tiempo real y con una presentación de 360º.
El transductor emite ultrasonidos que son reflejados por los tejidos explorados y recoge sus ecos (de ahí el nombre de la técnica). Los ultrasonidos son producidos por la vibración rapidísima de un cristal especial contenido en el transductor. Esas ondas acústicas que utiliza la ultrasonografía son de una frecuencia alta entre 2 y 20 o más megahercios (Mhz). Un megahercio equivale a un millón de hercios y cada hercio es un ciclo por segundo. Los ecos recogidos en el transductor, son enviados a una unidad que los convierte en imágenes que se ven en el monitor y se pueden imprimir en papel.
La intensidad de la frecuencia determinará la profundidad de la penetración de la onda acústica. A mayor frecuencia menor penetración y mayor definición de los elementos cercanos al transductor (Figs. 1 y 2).
Las imágenes hipoecoicas o anecoicas son de color negro, porque el sonido no rebota (ej.: el balón lleno de agua). Las imágenes ecogénicas o hiperecoicas se ven blancas porque el sonido rebota (ej.: grasa, tejidos blandos).
Con un equipo transductor 3D mecánico, de alta resolución con frecuencias que van de 5 a 20 Mhz, se pueden ver imágenes de hasta 0.3 mm.
Preparación del paciente
Es un procedimiento ambulatorio y se puede hacer en Consultorio.
No causa dolor, no se necesita sedación y la tolerancia es buena.
Si el paciente es hombre puede ser examinado de decúbito lateral (Posición de Sims), pero si es mujer algunos aconsejan el decúbito prono ya que en decúbito lateral las estructuras anteriores pueden deformarse y dificultar el estudio.7
Si hay contenido fecal en el recto puede indicarse una microenema o supositorio.
Anatomía sonográfica
Una descripción detallada de la anatomía rectal se presenta en una sección previa.
Desde el punto de vista sonográfico, la pared rectal se representa en cinco capas, rodeadas de tejido adiposo y seroso, como resultado de la diferente impedancia acústica.
Ecograficamente la pared rectal mide 2-3 mm de espesor y no siempre las capas son visibles en todos los niveles, como se explica en detalles técnicos.
Las capas son (Fig. 3):
1º capa hiperecoica: interfase dada por el balón con agua y la mucosa.
2º capa hipoecoica: dada por la mucosa (lámina propia y muscular de la mucosa).
3º capa hiperecoica: dada por la submucosa.
4º capa hipoecoica: dada por la muscular propia.
5º capa hiperecoica: interfase entre la muscular propia y la grasa o serosa.
Detalles técnicos
Una adecuada visualización de las capas sonográficas de la pared rectal depende del posicionamiento centrado del transductor, de la distensión del recto por acción del balón y de un adecuado contacto del mismo con la pared rectal.
Por ello pueden disminuir la eficacia diagnóstica los siguientes ítems:
- Angulación del transductor con respecto al eje tumoral.
- Inadecuada preparación intestinal. Las heces o la presencia de burbujas de aire en el recto o en el balón, pueden dar falsas imágenes.
- Un tumor estenótico que no permita el paso del transductor, impide un estudio adecuado de la región proximal del tumor.
Figura 1: Equipo utilizado B&K modelo flex focus, de 6 a 20 MHz. 3D.

Figura 2: Transductor 3D (B&K 2052).
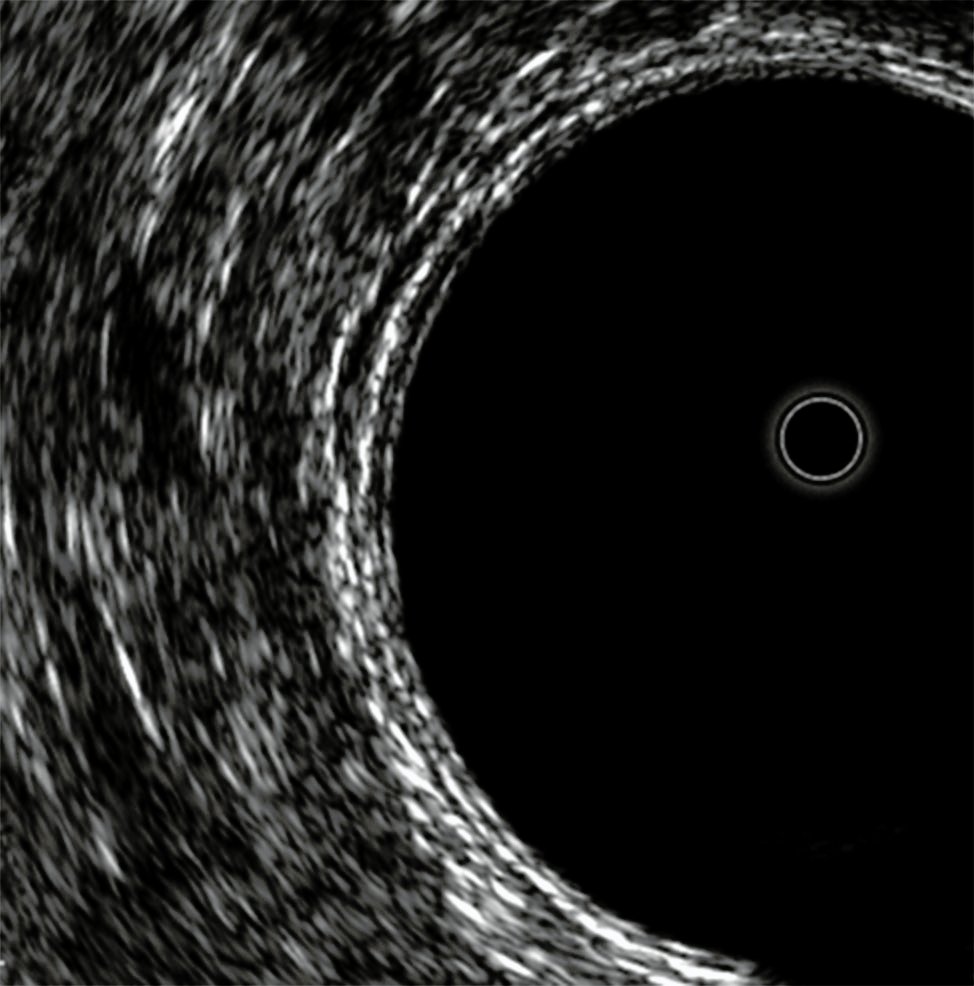
Figura 3: Pared rectal normal. Se observa balón hipoecoico y las cinco capas de la pared rectal.
Estadificación sonográfica
El nivel de penetración tumoral en la pared rectal y la presencia de adenopatías se estadifica siguiendo la clasificación TNM con el agregado de el prefijo “u”.10
El tumor es predominantemente hipoecoico y puede estar rodeado de tejido fibroso o edema, también hipoeoico.11 Ese tumor generalmente aparece como una lesión que invade o altera las capas de la pared rectal.
Especificaciones sobre la categoría “T”
La eficacia diagnóstica para la evaluación ecográfica de la profundidad tumoral varía del 63 al 96% con un promedio de 81.8%, cifras halladas en el estudio de 2718 pacientes.5,6,12,13 Pero si se analiza cada estadío “T” por separado, se observa que la variabilidad en la eficacia oscila entre el 25 y el 100%.

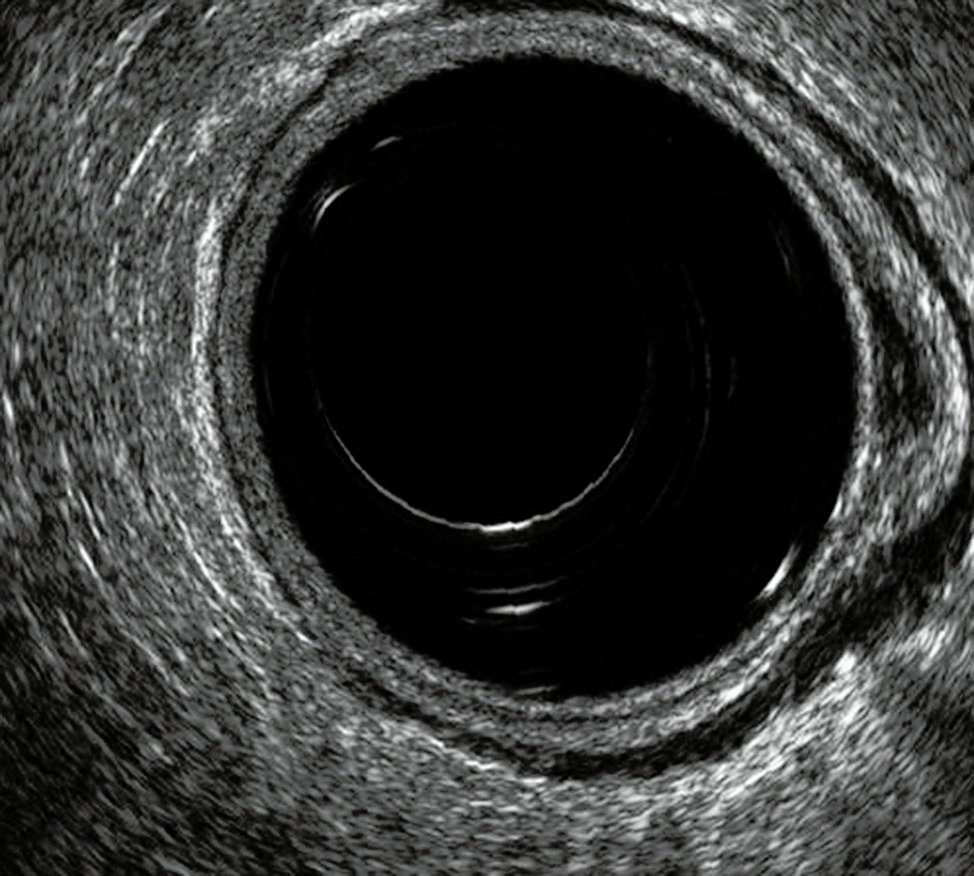
Figura 4: T1N0, se observa a la derecha lesión hipoecoica con invasión de la capa submucosa y respetando la capa muscular.
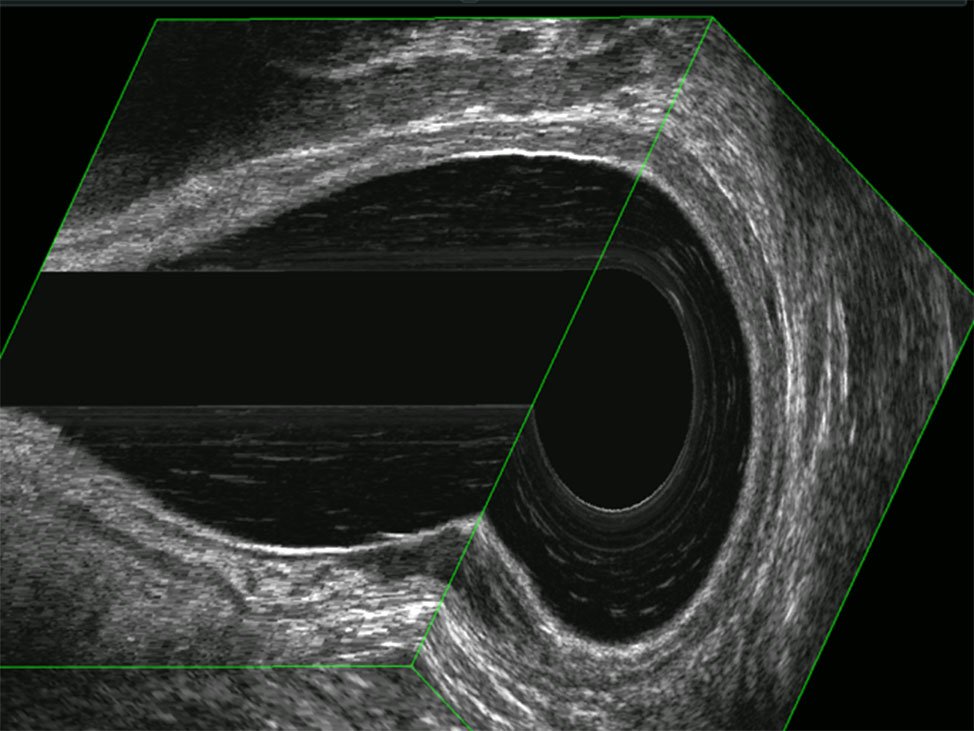
Figura 5: T1N0, se puede ver la lesión de la figura anterior en dos cortes.
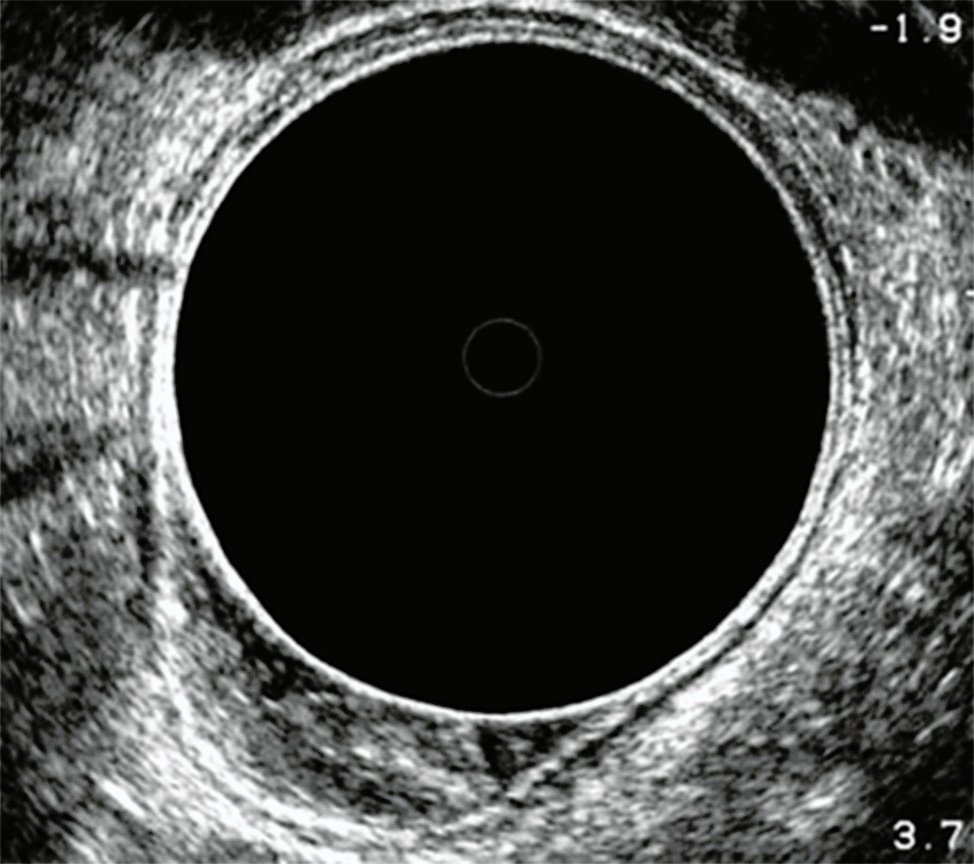
Figura 6: T1N0 posterolateral derecha con invasión de la capa submucosa y respetando la capa muscular.
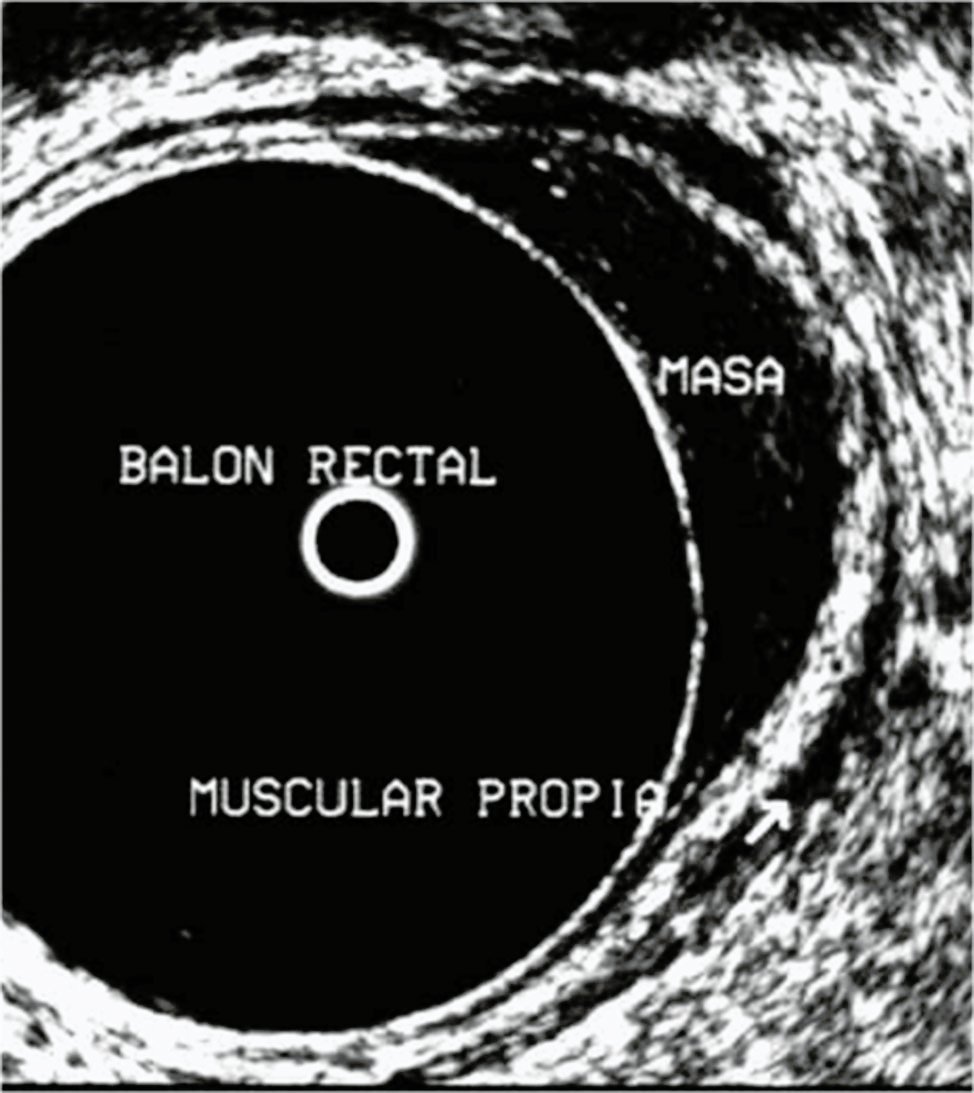
Figura 7: T1N0 en lateral izquierdo observandose a la derecha de la imagen.
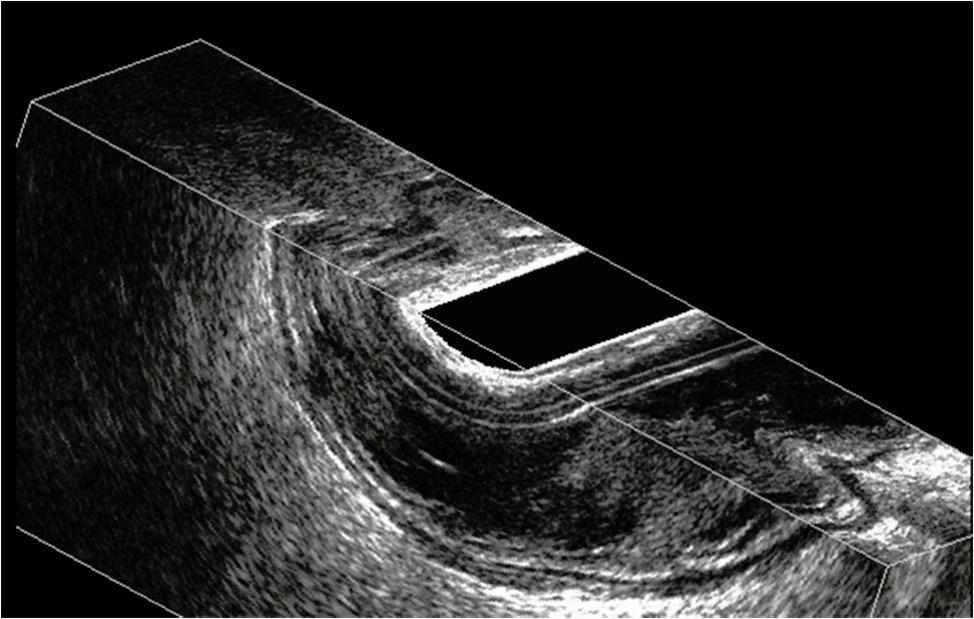
Figura 8: T2N0 superficial, imagen 3D, pequeña invasión de la capa muscular en sector central.
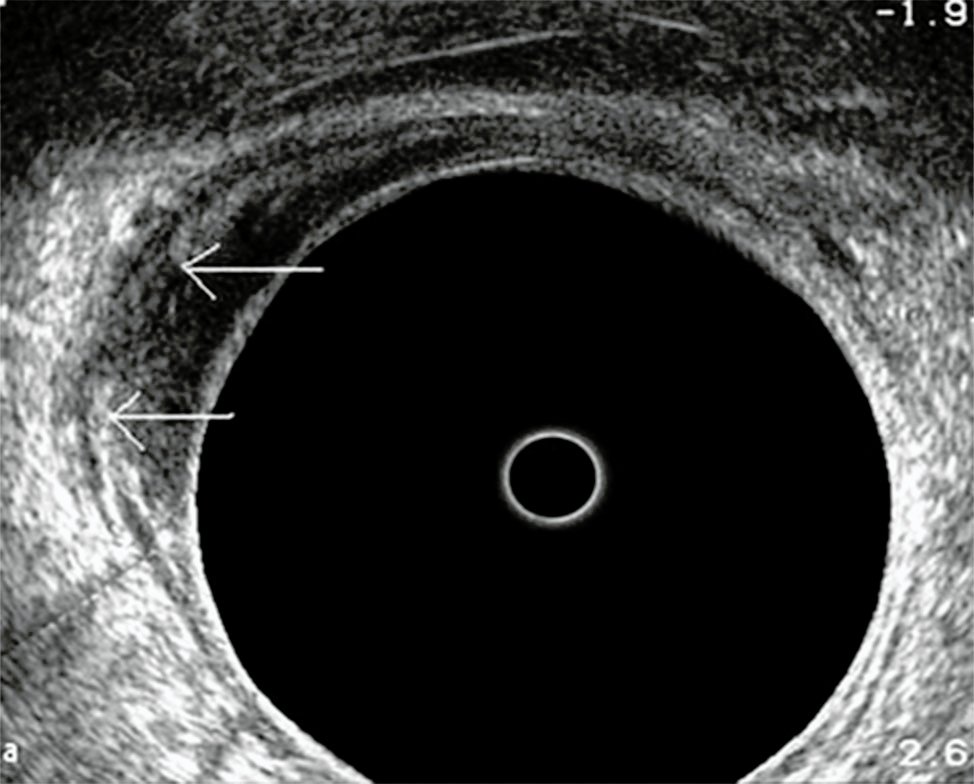
Figura 9: T2N0 profundo. La invasión de la capa muscular es marcada (flechas).
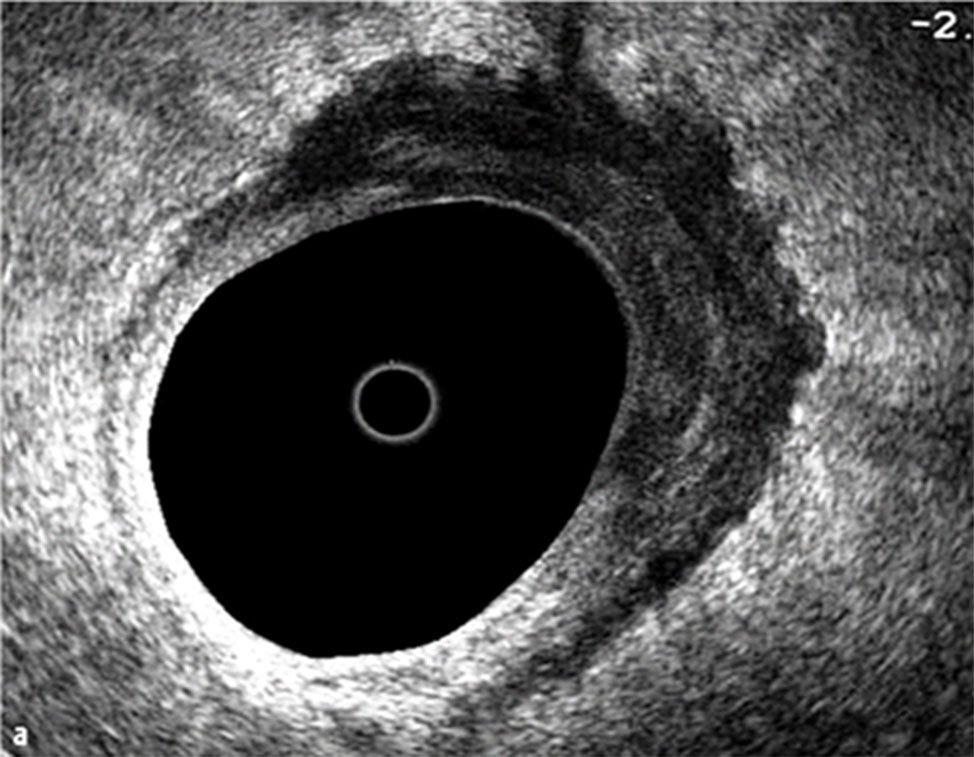
Figura 10: T3N0 la lesión sobrepasa la capa muscular en varios sectores.
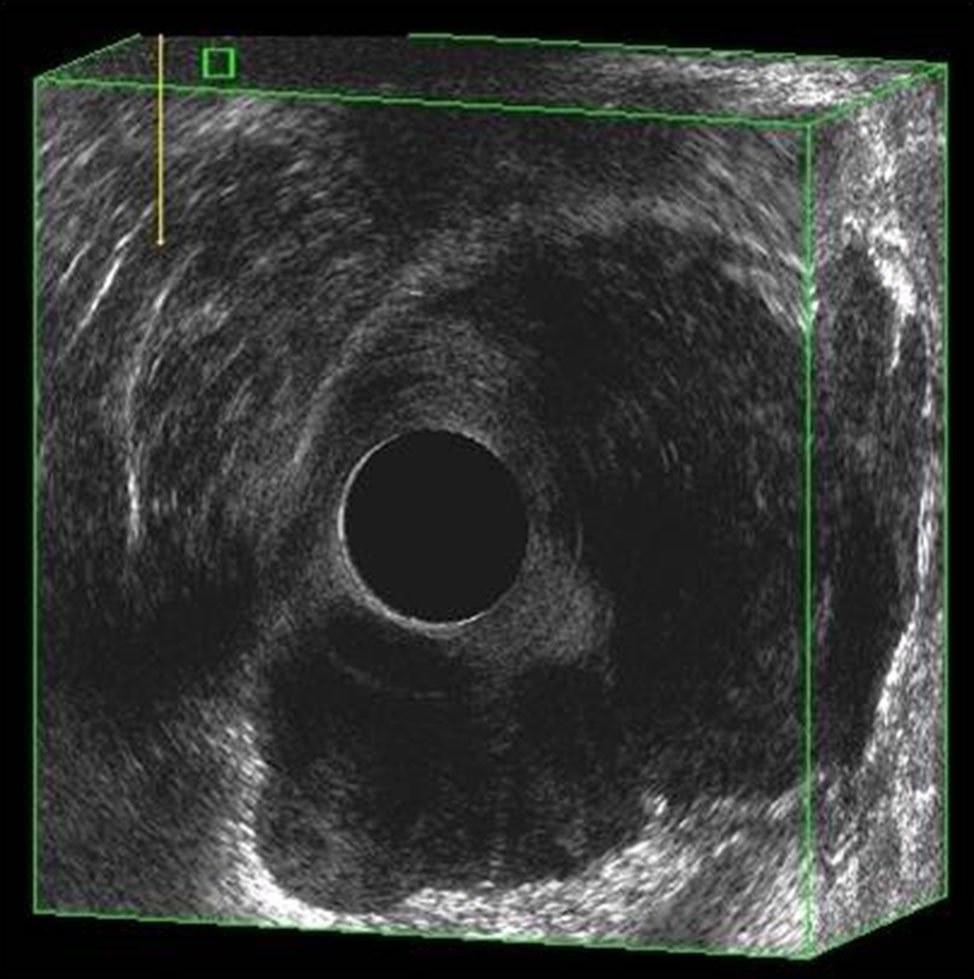
Figura 11: T3N0 imagen 3D, se ve la invasión en diversos cortes.
Factores a considerar
Esta amplia dispersión se puede explicar por tres factores:
1) Experiencia del operador.
En base a esa experiencia y a la capacidad de interpretación de las imágenes, se pueden ofrecer diferentes tácticas para el tratamiento del cáncer del recto. Wong y col.44 sugirieron un sistema de estadificación sonográfica vinculándola al tratamiento:

2) Alteraciones anatómicas de la pared rectal producidas por radioterapia previa o biopsias, éstas pueden causar hemorragias y obliteración consecuente de las capas sonográficas12 o alteraciones provocadas por la inflamación post-resección local.14
3) Tipo de carcinomas incluídos (ej.: un carcinoma obstructivo no permite una evaluación completa por la rigidez del transductor que no puede sobrepasar el tumor). Esta eventualidad ocurre hasta en el 17% de los casos.15
Es muy importante la exacitud diagnóstica del estadío uT1, porque en algunos casos seleccionados el tratamiento puede ser la resección local. Más aún, en éstos casos es necesario hacer una estadificación de la invasión submucosa, diferenciando las lesiones Sm1 (tercio interior de la submucosa) de las Sm2 (tercio medio) y de las Sm3 (tercio externo).36
Esta evaluación es trascendente, debido a los diversos riesgos de afectación ganglionar, que van del 1 al 3% en las lesiones Sm1, 8% en las lesiones Sm2 y 23% en las lesiones Sm3.37
Aunque no es el objetivo de éste Relato, es útil considerar las indicaciones en uT1 para la resección local.38
- Tamaño tumoral menor a 3-4 cm.
- Compromiso de menos de un tercio de la circunferencia rectal.
- Localización a menos de 6 a 8 cm del margen anal.
- Histología bien diferenciada o con diferenciación moderada.
- Ausencia de invasión venosa y linfática.
- Movilidad tumoral.
- Sin sospecha de presencia de ganglios perirectales o presacros.
Por otra parte una causa importante de inexactitud resulta de sobreestadificar las lesiones T2, porque la ecografía, en algunos casos, no puede distinguir entre una imagen irregular en la pared más externa del recto como debida a inflamación peritumoral o a extensión transmural del tumor.12,14
A veces es dificultoso o imposible distinguir entre una penetración profunda de la capa muscular (T2) o una invasión microscópica de la grasa (T3).
Sin embargo, en centros experimentados la sensibilidad, usando Ecografía 3D, ronda el 95% para la categoría T y en centros de ecografía general disminuye al 79%.16,17 Con esta metodología 3D se puede medir con exactitud el tamaño y volumen tumoral, la distancia a diferentes puntos anatómicos (margen anal, unión ano-rectal) y además evaluar el aparato esfinteriano. La ultrasonografia tridimensional, al posibilitar realizar cortes en diferentes planos, es especialmente útil para determinar la invasión longitudinal y circunferencial.
En un trabajo reciente, Krajewski y Kane18 analizan dos metaanálisis recientes y los índices de sensibilidad y especificidad en la estadificación del carcinoma del recto inferior, comparando la ECO, la TC y la RMN. Para el estadío T2 la sensibilidad de la ECO y de la RMN fueron similares (94%) pero la especificidad fue mayor para la ECO (86% vs. 69%).
Especificaciones sobre la categoría “N”
La eficacia del diagnóstico ecográfico de las adenopatías oscila en algunos trabajos entre el 70-75%,19-21 y en otros entre 63-86% con promedio de 73%.13 Esta variación en la eficacia diagnóstica es por la variabilidad en el criterio para definir al ganglio metastásico. Ese criterio para Beynon22 es la forma y la hipoecogenicidad. En cambio para Hildebrandt23 el criterio es el grado de ecogenecidad. Tampoco hay unanimidad de criterio cuando se considera sólo el diámetro.12,24
Una alternativa para el diagnóstico, principalmente en adenopatías distantes, es la punción aspiración con aguja fina guiada por Erus. Es una técnica para confirmar ganglios sospechosos y para tomar decisiones terapéuticas más agresivas, pero no tiene mucha difusión. En un trabajo con 457 pacientes, 32 (7%) tenían adenopatías ilíacas y 47% de los nódulos (15 de 32), fueron confirmados por éste método.25
Características morfológicas de los ganglios que sugieren metástasis
Según Brown26 y otros6,12,24 las características más destacables para diagnosticar un ganglio como metastásico son:
- Apariencia hipoecoica.
- Contorno más circular que oval.
- Márgenes irregulares.
- Localización peritumoral.
- Tamaño mayor a 5 mm.
- Ausencia de reflexión hiliar.
En general, los ganglios normales o reactivos del mesorecto son ovalados y ecogénicos, mientras que los ganglios metastásicos son redondeados, con márgenes irregulares, hipoecoicos y heterogéneos27 (Figs. 12, 13 y 14).
Para Herzog28 a un mayor tamaño en la imagen hipoecoica hay mayor sensibilidad en la detección de adenopatías patológicas:
- De 0 a 5 mm sensibilidad 79%
- De 6 a 10 mm sensibilidad 92%
- Mayor de 10 mm sensibilidad 100%
La ecografía puede visualizar ganglios tan pequeños como de 3 mm, pero no se pueden diagnosticar micrometástasis en ganglios si la arquitectura no está suficientemente alterada; así también como es difícil el diagnóstico diferencial entre metástasis y proceso inflamatorio.29,30
Por otra parte, en adenopatías menores a 3 mm la sensibilidad ecográfica disminuye al 43%.31
Para Hildebrandt y col.20 las metástasis ganglionares pueden visualizarse con una precisión del 72% mientras los ganglios inflamatorios se ven con una especificidad del 83%. Otros trabajos32,33 cuestionan estos porcentajes y sostienen que hay menos especificidad para diferenciar los ganglios benignos de los malignos. La connotación más importante es que con ganglios negativos, puede indicarse un procedimiento quirúrgico local. Es necesario destacar que el riesgo promedio de tener ganglios no detectados o no tratados es 15%.34
Los ganglios en la periferia del mesorecto no se pueden ver porque están fuera del rango del transductor.
El tamaño ganglionar es un predictor pobre de metástasis linfáticas, ya que el diagnóstico positivo se hace en el 53% de los ganglios de más de 5 mm, pero también en el 18% de los menores a 5 mm.35
Curva de aprendizaje
Los mejores diagnósticos dependen del equipamiento técnico y de la capacitación del operador. Se ha referido que la precisión diagnóstica mejora con la experiencia y que se requeriría un mínimo de 50 procedimientos para optimizar los resultados.8,9
Algunos sugieren39 que la experiencia no afecta la seguridad diagnóstica para los estadíos T y N, por lo cual no habría curva de aprendizaje. Otros trabajos40 sostienen que la necesidad de la experiencia y un entrenamiento apropiado, deberían ser criterios básicos, para evaluar un estadío con seguridad.
Es evidente que la curva de aprendizaje es necesaria41 y se ha considerado a la inexperiencia como factor de inexactitud en la evaluación de la profundidad de la infiltración tumoral.13
Orrom y col.8 demostraron un incremento de la seguridad diagnóstica desde el 59,3% al 95%, cuando el estudio lo realiza un experto, con respecto a un evaluador con experiencia breve.
Varios trabajos preconizan la necesidad de mayores tiempos de entrenamiento y la meticulosidad del mismo, y demuestran una exactitud progresiva con ello con cifras mayores al 90%.8,42-44
Marusch y col.16 sostienen que se necesita una curva de aprendizaje de más de 50 procedimiento para evaluar con exactitud la penetración tumoral, y más de 75 para asegurar la evaluación del status ganglionar. Se ha considerado que la precisión diagnóstica en la estadificación ganglionar mejora del 50 al 77% después de realizar 30 procedimientos.18
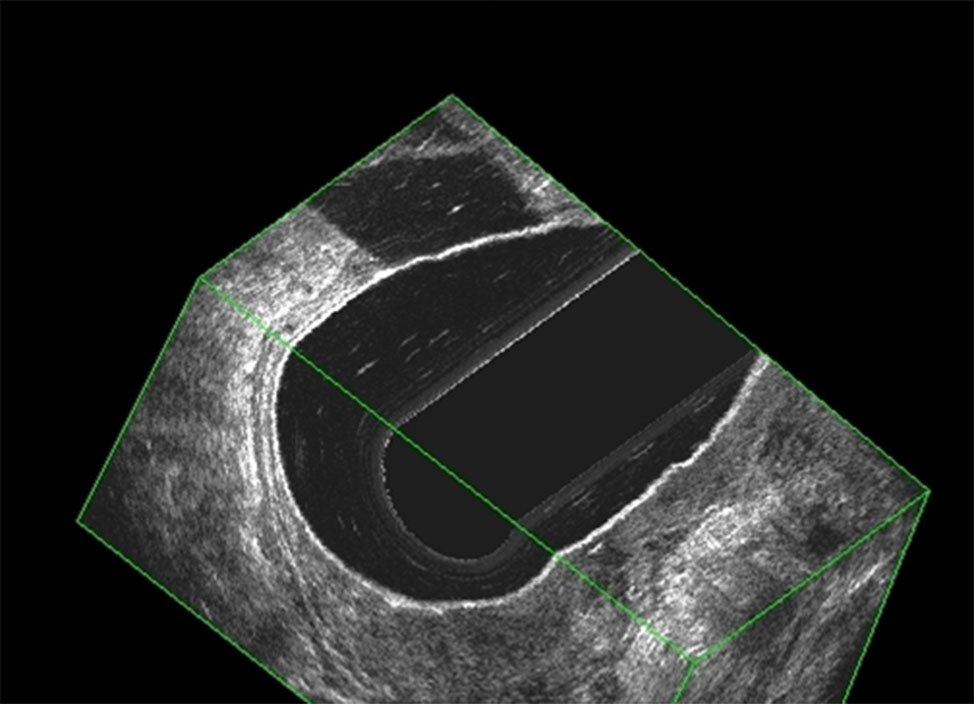
Figura 12: T3N1 imagen 3D, dos imágenes de adenopatías a la derecha que se observan en los dos cortes.
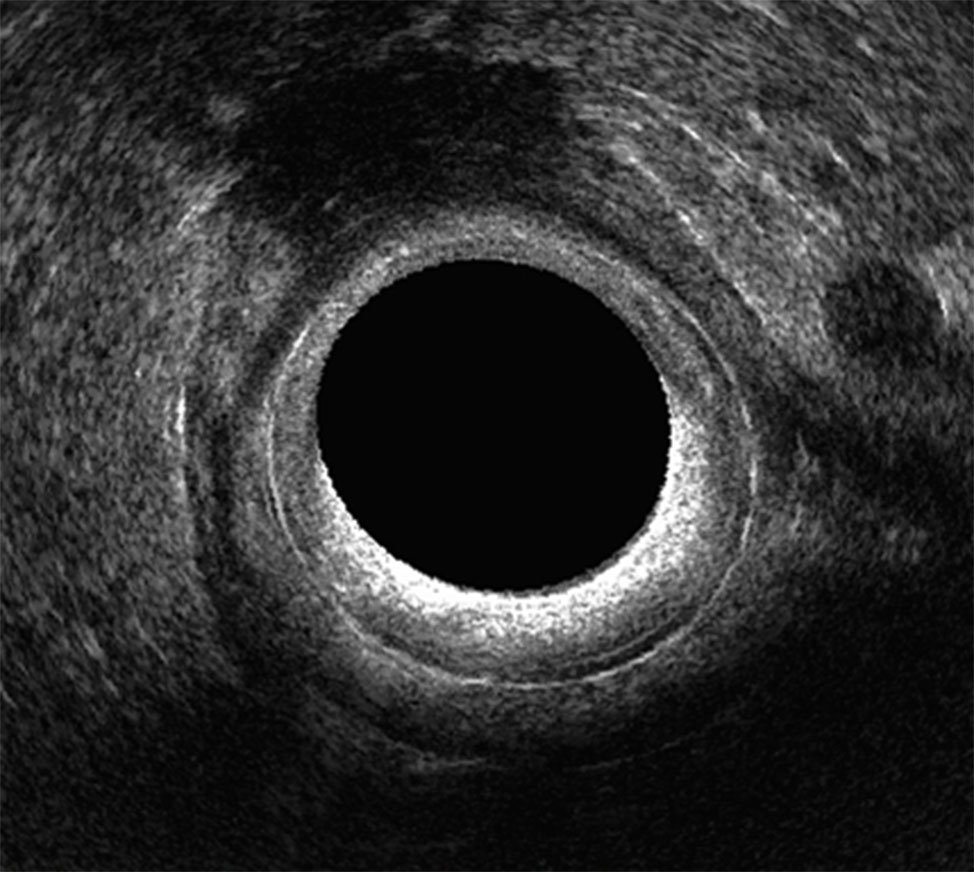
Figura 13: adenopatía redondeada de más de 2 cm de diámetro.
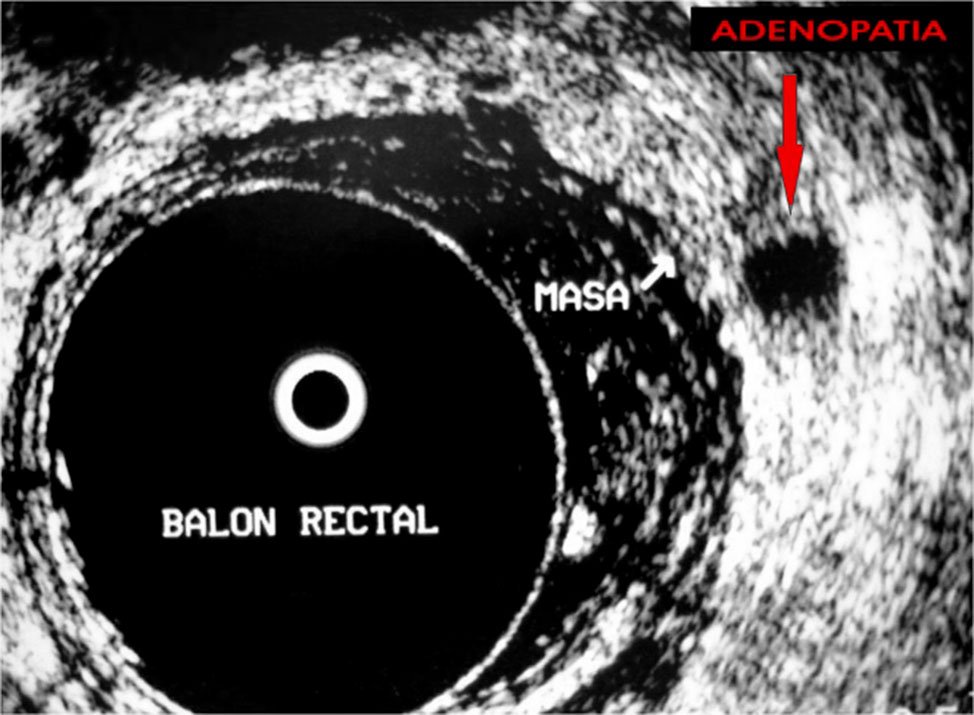
Figura 14: adenopatía de bordes irregulares.
Resumen y conceptos destacables
- La precisión diagnóstica es alta para los estadíos tempranos (T1 y T2) y mejor que los de RMN.
- Para la estadificación ganglionar no hay diferencias con la RMN.
- Tiene como ventajas ser un procedimiento fácil de realizar y no necesita preparación. No es costoso y se puede hacer en forma ambulatoria.
- Tiene como desventaja no visualizar el meso-recto ni la fascia rectal, por estar éstos elementos fuera del rango del transductor.
- Es un procedimiento operador y equipo dependiente.
BIBLIOGRAFÍA
- Hildebrandt U. y Feifel G. Preoperative staging of rectal cancer by intrarectal ultrasound. Dis Colon Rectum 1985;28:42-46.
- Beynon J., Fay D., Roe A. y col. Endoluminal ultrasound in the assessment of local invasion rectal cancer. Br J Surg 1986;73:474.
- Beets GL. y Beets-Tan RG. Pretherapy imaging of rectal cancer: ERUS or MRI?. Surg Oncol Clin N Am 2010;19:733.
- Torricelli P.: Rectal cancer staging. Surg Oncol 2007;16 (suppl1): S 49.
- García-Aguilar J., Pollack J., Lee SH. Y col. Accuracy of endorectal ultrasonography in preoperative staging of rectal tumors. Dis Colon Rectum 2002;45:10-15.
- Kumar A. y Scholefield JH. Endosonography of the anal canal and rectum. World J Surg 2000;24:208-215.
- Saranovic D., Barisec G. y Krivokapic Z. Endoanal ultrasound evaluation of anorectal disease and disorders: Technique, indications, results and limitations. Eur J Radiology 2007;61:489.
- Orrom WJ., Wong WD., Rothenberg DA. y col.:Endorectal ultrasound in the preoperative staging of rectal tumors. Dis Colon Rectum 1990;33:654.
- MacKay SG., Pager CK., Joseph D. y col. Assessment of the accuracy of transrectal ultrasonography in anorectal neoplasia. Br J Surg 2003;90:346
- Akbari RP, Wong WD. Endorectal ultrasound and the preoperative staging of rectal cancer. Scand J Surg 2003;92:25-33.
- Maier AG., Barton PP., Neuhold NR. y col. Peritumoral tissue reaction of transrectal US as a posible cause of overstaging in rectal cancer. Histopathologic correlation. Radiology 1997;203:785-789 .
- Massari M., De Simone M., Cioffi U. y col. Value and limits of endorectal ultrasonography for preoperative staging of rectal carcinoma. Surg Laparosc Endosc 1998;8:438-444.
- Skandarajah A. y Tjandra J. Preoperative loco-regional imaging in rectal cancer. Anz J Surg 2006;76:497-504.
- Starck M., Bohe M., Simanaitis M. y col.: Rectal endosonography can distinguish bening rectal lesions from invasive early rectal cancers. Colorectal Dis.2003;5:246-250.
- Harewood GC. Assessment of publication bias in the reporting of EUS performance in staging rectal cancer.Am J Gastroenterol 2005;100:808-816.
- Marusch F., Koch A., Schmidt U. y col. Routine use of transrectal ultrasound in rectal cancer carcinoma: results of a prospective multicenter study. Endoscopy 2002;34:385-390.
- Ptok H., Marusch F., Meyer F. y col. Feasibility and accuracy of TRUS in the pretreatment staging for rectal carcinoma in general practice. Eur J Surg Oncol 2006;32:420-425.
- Krajewski KM. y Kane RA. Ultrasound staging of rectal cancer. Semin Ultrasound CT MRI 2008;29:427-432.
- Thaler W., Watzka S., Martin F. y col. Preoperative staging of rectal cancer by endoluminal ultrasound vs. Magnetic resonance imaging. Preliminary results of a prospective, comparative study. Dis Colon Rectum 1994;37:1189-93.
- Hildebrandt U., Klein T., Feifel G. y col. Endosonography of pararectal lymph nodes. In vitro and in vivo evaluation. Dis Colon Rectum 1990;33:863-8.
- Tio TL., Coene PP., Van Delden OM. Y col. Colorectal carcinoma: preoperative TNM classification with endosonography. Radiology 1991;179:165-70.
- Beynon J. An evaluation of the role of rectal endosonography in rectal cancer. Ann R Coll Surg Engl 1989;71:131-9.
- Hildebrandt U., Feifel G., Schwarz HP. y col. Endorectal ultrasound: instrumentation and clinical aspects. Int J. Colorectal Dis 1986;1:203-7.
- Kim NK., Kim MJ., Yun SH. y col. Comparative study of transrectal ultrasonography, pelvic computarized tomography and magnetic resonance imaging in preoperative staging of rectal cancer. Dis Colon Rectum 1999;42:770-5.
- Levy M., Alberts SR., Clain JE. y col. Endoscopic ultrasound guided fine needle aspiration (EUS-FNA) detection of malignant iliac nodes in rectal cancer. Gastrointest Endosc 2006;63:AB97.
- Brown G., Kirkham A., Williams GT. y col. High-resolution MRI of the anatomy important in toootal mesorectal excision of the rectum. AJR 2004;182:431-9.
- Goh V., Halligan S. y Bartram C. Local radiological staging of rectal cancer. Clin Radiol 2004;59:215-226.
- Herzog U., von Flue M., Tondelli P. y col. How accurate is endorectal ultrasound in the preoperative staging of rectal cancer? Dis Colon Rectum 1993:36:127-34.
- Kim HJ. y Wong WD. Role of endorectal ultrasound in the conservative management of rectal cancers. Semin Surg Oncol 2000;19:358-66.
- Bartram C. y Brown G. Endorectal ultrasound and magnetic resonance imaging in rectal cancer staging. Gastroenterol Clin N Am 2002;31:827-39.
- Landmann RG., Wong WD., Hoepfl J. y col. Limitations of early rectal cancer nodal staging may explain failure after local excision. Dis Colon Rectum 2007;50:1520-25.
- Jachem RJ., Reading CC., Dozois RR. y col. Endorectal ultrasonography staging of rectal carcinoma. Mayo Clin Proc 1990;65:1571.
- Roubein LD., David C., Du Brow R. y col. Endoscopic ultrasonography in staging rectal cancer, Am J Gastroenterol 1990;85:1391.
- Blumberg D., Paty PB., Guillem JG. y col. All patients with small intramural rectal cancers are at risk for lymph node metástasis. Dis Col Rectum 1999;42:881.
- Le Blanc JK. Imaging and management of rectal cancer. Nat Clin Proct Gastroenterol Hepatol 2007;4:665-676.
- Kitajima,K., Fujimori T., Fujii S. y col. Management of early invasive colorectal Cancer. Risk of recurrence and clinical guidelines. Dis Colon Rectum 1995;38:1286.
- Tytherleigh MC., Warren BF. y Mortensen NJ. Management of early rectal cancer. Br J Surg 2008;95:409-423.
- Benick PE. y Wong WD. Surgical treatment of rectal cancer. En Eldelstein P (Ed). Protocols in general surgery :colon cancer, New York, Wiley-Liss, 1999.
- Badger SA., Devlin PB., Neilly PJ. y col. Preoperative staging of rectal carcinoma y endorectal ultrasound: is there a learning curve? Int JColorectal Dis 2007;22:1261-1268.
- Rafaelsen SR., Sorensen T., Jakobsen, A. y col.: Transrectal ultrasonography and magnetic resonance imaging in the staging of rectal cancer.Effect of experience. Scand J Gastroennterol 2008;43:440-446.
- Muthusamy VR. Y Chang KJ.: Optimal methods for staging rectal cancer. Clin Cancer Res 2007;13:6877 s- 6884 s.
- Carmody BJ. y Otchy DP.: Learning curve of transrectal ultrasound. Dis Colon Rectum 2000;43:193-197.
- Mackay SG., Pager CK., Joseph D. y col: Assessment of the accuracy of transrectal Ultrasonography in anorectal neoplasia. Br J Surg 2003;90:346-350.
-
Arias J. y Farina P.: Ecografía endorectal en la estadificación del cáncer del recto. En Hequera JA y Nally C. eds. Estadificaciones para el carcinoma del colon recto y ano. Edit.Akadia, Buenos Aires, 2012 pag 59-74.
